Трансхиатальная лапароскопическая энуклеация лейомиомы нижнегрудного отдела пищевода
Автор: Камалов А.К., Рябов А.Б., Хомяков В.М., Волченко Н.Н., Колобаев И.В., Кострыгин А.К., Соболев Д.Д., Уткина А.Б., Аксенов С.А., Макурина М.П.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Случай из клинической практики
Статья в выпуске: 6 т.21, 2022 года.
Бесплатный доступ
Актуальность. Мезенхимальные опухоли составляют 2 % от всех новообразований пищевода, из них на долю лейомиом приходится до 80 %, которые преимущественно локализуются в нижней трети пищевода. Хирургический метод является основным в лечении данной нозологии. Из-за низкой встречаемости отсутствуют единые подходы к выбору хирургического объема и доступа. Малоинвазивные методики имеют преимущества перед открытыми доступами. Однако целый ряд факторов влияет на принятие решения: размер, локализация и расположение опухоли по окружности пищевода. При небольших новообразованиях с интрамуральной формой роста возможно выполнение эндоскопической резекции. При больших и протяженных лейомиомах показана операция Льюиса. В остальных случаях энуклеация опухоли является золотым стандартом лечения. Вопрос малоинвазивного хирургического доступа является актуальным. При опухолях, расположенных в нижнегрудном отделе пищевода ближе к пищеводно-желудочному переходу, торакоскопический доступ имеет ограничения. В этой связи лапароскопический доступ с возможностью трансхиатальной мобилизации пищевода обеспечивает адекватную возможность для энуклеации опухоли. Описание клинического случая. Нами выполнена лапароскопическая трансхиатальная энуклеация опухоли пищевода у пациентки 47 лет, с лейомиомой нижнегрудного отдела пищевода. Операция выполнена в объеме R0. Период наблюдения составил 12 мес, без признаков рецидива заболевания. Заключение. Данная методика, на наш взгляд, полностью оправдана, при тщательном отборе пациентов и соблюдении всех правил онкохирургии. Лапароскопический доступ с трансхиатальной мобилизацией пищевода обеспечивает хорошую возможность для выполнения энуклеации мезенхимальных опухолей, локализованных в нижней трети грудного отдела, на уровне наддиафрагмального и абдоминального сегмента
Лапароскопическая трансхиатальная энуклеация, лейомиома пищевода, хирургическое лечение
Короткий адрес: https://sciup.org/140296690
IDR: 140296690 | УДК: 616.329-006.363.03-089 | DOI: 10.21294/1814-4861-2022-21-6-170-176
Текст научной статьи Трансхиатальная лапароскопическая энуклеация лейомиомы нижнегрудного отдела пищевода
Мезенхимальные опухоли составляют 2 % от всех новообразований пищевода [1], из них на долю лейомиом приходится до 80 % [2], которые преимущественно локализуются в нижней трети пищевода (до 81 %) [3, 4]. Хирургический метод является основным в лечении данной нозологии. Как правило, мезенхимальные новообразования протекают бессимптомно, а клинические симптомы появляются, когда опухоль достигает больших размеров. Одни из первых жалоб, которые предъявляют пациенты, – это чувство инородного тела за грудинной, затруднение глотания пищи, а также, при наличии изъязвления слизистой оболочки пищевода, возможны желудочно-кишечные кровотечения (ЖКК) [3–5].
Основными методами диагностики являются компьютерная томография и эндосонография, позволяющие определить до операции локализацию опухоли в пищеводе, размер, характер роста и строение. Анализ данных с достаточно высокой степенью информативности позволяет сформулировать диагноз [6].
При планировании органосохраняющего лечения морфологическая верификация не обязательна, так как по малым образцам сложно дифференцировать лейомиому от гастроинтестинальной стромальной опухоли [7, 8]. Кроме того, вследствие воспаления в месте биопсии развивается фиброз, который затрудняет энуклеацию опухоли без вскрытия просвета пищевода. Однако при планировании неадъювантного противоопухолевого лечения морфологическая верификация обязательна.
В связи с низкой частотой встречаемости данной категории опухолей отсутствуют единые подходы к выбору хирургического доступа. Малоинвазивные методики имеют преимущества перед открытыми доступами. Однако целый ряд факторов влияет на принятие решения: локализация опухоли в нижнегрудном отделе пищевода, расположение опухоли по окружности пищевода, а также размер лейомиомы.
При небольших новообразованиях (до 4 см) с интрамуральной формой роста возможно выполнение эндоскопической туннельной резекции
[3, 6]. При больших и протяженных лейомиомах показана операция Льюиса. В остальных случаях эндохирургическая энуклеация опухоли является золотым стандартом лечения [9]. Вопрос выбора малоинвазивного хирургического доступа является актуальным. При опухолях, расположенных в нижнегрудном отделе пищевода ближе к пищеводножелудочному переходу, торакоскопический доступ имеет ограничения. В этой связи лапароскопический доступ с возможностью трансхиатальной мобилизации пищевода обеспечивает адекватную возможность для энуклеации опухоли. В подтверждение этого приводим клиническое наблюдение.
Описание клинического случая
Пациентка С., 47 лет, обратилась в МНИОИ им. П.А. Герцена с жалобами на боли в эпигастрии, дискомфорт за грудиной при приеме твердой пищи. По данным ЭГДС с эндосонографией на уровне 35,5 см от резцов, по задней полуокружности визуализирована проксимальная граница субэпителиального образования пищевода, занимающая на этом уровне половину окружности. Дистальнее опухоль переходила на левую и переднюю стенки (до уровня 37 см от резцов), занимая 3/4 окружности, нависая над кардиоэзофагеальным переходом. При инструментальной пальпации опухоль имела мягкую консистенцию. Просвет пищевода сужен не более чем на 1/4. При эндосонографии с датчиком 20 МГц и эхоэндоскопом 6 МГц подтверждено, что образование являлось единым, охватывало циркулярно просвет пищевода на 3/4, анэхогенно, имело гиперэхогенные септы, располагалось в подслизистом слое (рис. 1). По данным СКТ с внутривенным контрастированием – в заднем средостении определялось образование округлой формы с относительно четкими контурами, поперечными размерами 38×36 мм, вертикальным – 52 мм, накапливавшее контрастный препарат в пределах 15HU, на фоне которого прослеживалась слизистая оболочка пищевода и его просвет с газом, без признаков инвазивного роста (рис. 2). Учитывая данные исследования, клинически был выставлен диагноз мезенхимальная опухоль.
29.06.2021 пациентке выполнена лапароскопическая трансхиатальная энуклеация опухоли пищевода. Положение пациентки на операционном столе на спине с разведенными ногами. Под камеру в области пупочного кольца установлен 11-мм троакар. По параректальной линии на уровне пупка установлено 2 5-мм порта справа и слева. Дополнительно было установлено 2 10-мм порта на уровне реберной дуги соответственно (рис. 3). После ревизии была мобилизована левая доля печени рассечением венечной и треугольной связок. Затем была рассечена желудочно-диафрагмальная связка и выполнена сагиттальная диафрагмото-мия. Рассечена правая ножка диафрагмы. Далее произведена мобилизация кардиального отдела
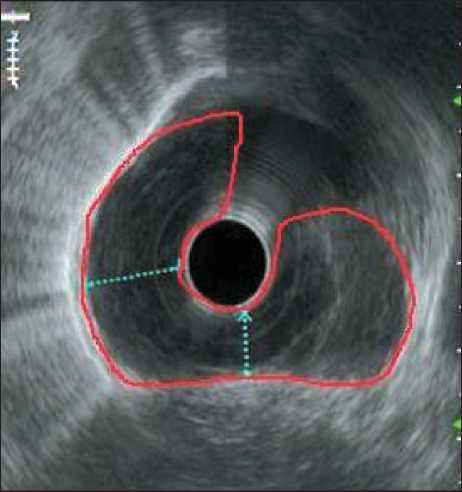
Рис. 1. Эндосонография. Границы опухоли отмечены красной линией
Fig. 1. Endosonography. The borders of the tumor are marked with a red line
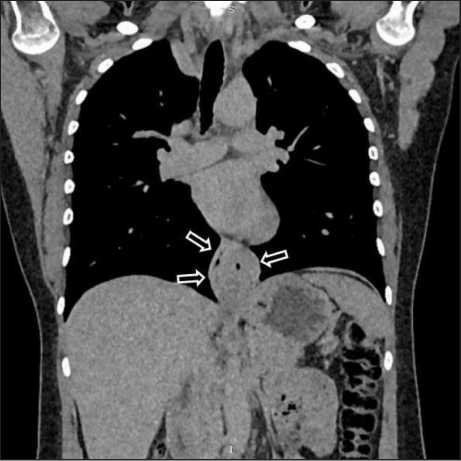
Рис. 2. КТ органов грудной клетки. Опухоль пищевода отмечена стрелками
Fig. 2. CT-scan of the chest. Tumor of the esophagus is marked with arrows
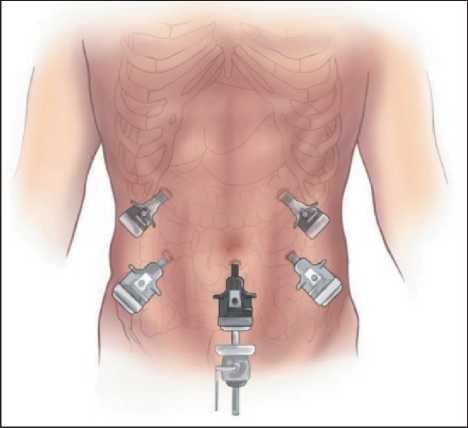
Рис. 3. Схематичное расположение портов
Fig. 3. Schematic diagram of ports
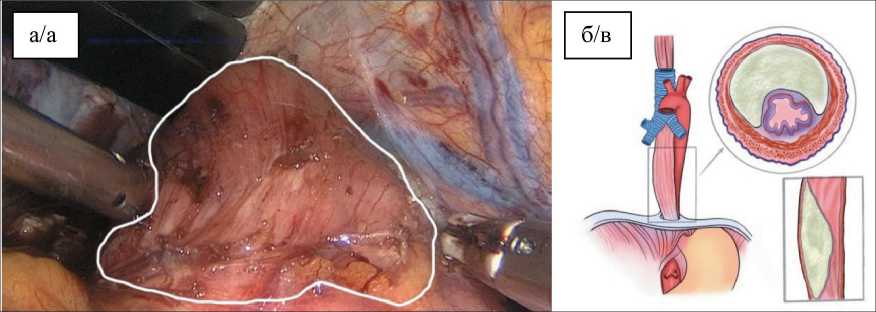
Рис. 4. Мобилизована н/3 пищевода и зона КЭП с опухолью:
а – интраоперационная фотография (выделена белой линией); б – схематичное изображение Fig. 4. Low third of the esophagus and zone of cardioesophageal junction (CEJ) with tumor were mobilized: a – intraoperative photograph (white line), b – schematic image
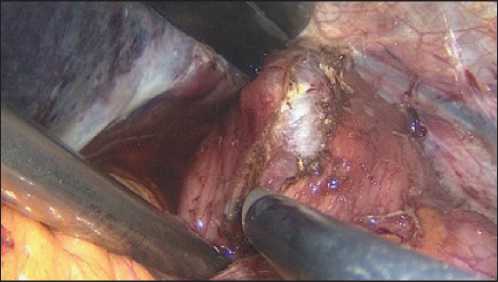
Рис. 5. Рассечение мышечного слоя пищевода
Fig. 5. Dissection of the muscular layer of the esophagus
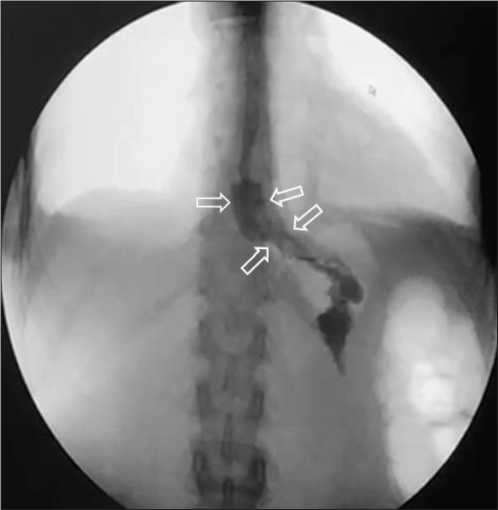
Рис. 6. Рентгеноскопия с пероральным контрастированием н/3 пищевода и КЭП после операции
Fig. 6. Radioscopy with oral contrast of the low third of the esophagus and CEJ after surgery
При морфологическом исследовании – опухоль построена из разнонаправленных пучков, образованных веретеновидными клетками, с эозинофильной цитоплазмой, сигароподобными вытянутыми ядрами. Опухоль четко ограничена от окружающей жировой клетчатки. Митотическая активность в опухоли не выражена. По результатам иммуногистохимического (ИГХ) исследования – положительная экспрессия в опухолевых клетках: SMA, Desmin. Отрицательная экспрессия: CD117, CD34, DOG1. ИГХ картина соответствует лейомиоме пищевода.
С учетом радикальности хирургического вмешательства и морфологии опухоли дополнительное противоопухолевое лечение не показано, рекомендовано динамическое наблюдение. Срок наблюдения – 12 мес. По результатам контрольного обследования данных за рецидив заболевания не выявлено. Жалоб пациентка не предъявляет.
Обсуждение
При лейомиомах пищевода хирургическое лечение в объеме энуклеации опухоли показано в случае симптомного течения заболевания, быстром темпе роста или при размерах опухоли более 3 см [6, 10]. Если не планируется неоадъювантная терапия, то морфологическая верификация не обязательна, поскольку это не меняет тактику лечения [11]. Обязательными требованиями к органосохраняющему хирургическому лечению являются радикальное удаление опухоли без повреждения ее капсулы, блуждающих нервов и попытка сохранения слизистой оболочки пищевода.
В настоящее время имеется большой арсенал хирургических доступов и методик при мезен-хиамальных опухолях пищевода. С развитием малоинвазивной хирургии в последнее время все реже и реже стал применяться открытый доступ. В основном открытая хирургия используется при местнораспространенных опухолях, когда выполняется операция Льюиса. Применение эндоскопических методов удаления опухоли имеет ряд ограничений, это небольшие опухоли до 3–4 см в диаметре, с четкими ровными контурами, которые располагаются в подслизистом слое. В данном клиническом примере применение метода туннельной резекции было невозможно из-за того, что опухоль циркулярно охватывала весь пищевод.
В классических случаях опухоли верхне- и среднегрудного отделов пищевода удаляются торакоскопическим доступом справа. При нижнегрудной локализации выбор доступа определен
Список литературы Трансхиатальная лапароскопическая энуклеация лейомиомы нижнегрудного отдела пищевода
- Sanchez-Garcia Ramos E., Cortes R., de Leon A.R., ContrerasJimenez E., Rodríguez-Quintero J.H., Morales-Maza J., Aguilar-Frasco J., Irigoyen A., Reyes F., Alfaro-Goldaracena A. Esophageal schwannomas: A rarity beneath benign esophageal tumors a case report. Int J Surg Case Rep. 2019; 58: 220-3. https://doi.org/10.1016/j.ijscr.2019.03.038.
- Kitada M., Matsuda Y., Hayashi S., Ishibashi K., Oikawa K., Miyokawa N. Esophageal schwannoma: a case report. World J Surg Oncol. 2013; 11: 253. https://doi.org/10.1186/1477-7819-11-253.
- Pence K., Correa A.M., Chan E., Khaitan P., Hofstetter W., Kim M.P. Management of esophageal gastrointestinal stromal tumor: review of one hundred seven patients. Dis Esophagus. 2017; 30(12): 1-5. https://doi.org/10.1093/dote/dox064.
- Jesić R., Randjelović T., Gerzić Z., Zdravković Dj., Krstić M., Milinić N., Pavlović A., Svejić T., Bulajić M. [Leiomyoma of the esophagus. Case report]. Srp Arh Celok Lek. 1997; 125(3-4): 113-5.
- Kobayashi N., Kikuchi S., Shimao H., Hiki Y., Kakita A., Mitomi H., Ohbu M. Benign esophageal schwannoma: report of a case. Surg Today. 2000; 30(6): 526-9. https://doi.org/10.1007/s005950070120.
- Wang G.X., Yu G., Xiang Y.L., Miu Y.D., Wang H.G., Xu M.D. Submucosal tunneling endoscopic resection for large symptomatic submucosal tumors of the esophagus: A clinical analysis of 24 cases. Turk J Gastroenterol. 2020; 31(1): 42-8. https://doi.org/10.5152/tjg.2020.19062.
- Rösch T., Kapfer B., Will U., Baronius W., Strobel M., Lorenz R., Ulm K.; German EUS Club. Endoscopic ultrasonography. Accuracy of endoscopic ultrasonography in upper gastrointestinal submucosal lesions: a prospective multicenter study. Scand J Gastroenterol. 2002; 37(7): 856-62.
- Dumonceau J.M., Deprez P.H., Jenssen C., Iglesias-Garcia J., Larghi A., Vanbiervliet G., Aithal G.P., Arcidiacono P.G., Bastos P., Car-rara S., Czakó L., Fernández-Esparrach G., Fockens P., Ginès À., Havre R.F., Hassan C., Vilmann P., van Hooft J.E., Polkowski M. Indications, results, and clinical impact of endoscopic ultrasound (EUS)-guided sampling in gastroenterology: European Society of Gastrointestinal Endoscopy (ESGE) Clinical Guideline - Updated January 2017. Endoscopy. 2017; 49(7): 695-714. https://doi.org/10.1055/s-0043-109021.
- Mujawar P., Pawar T., Chavan R.N. Video Assisted Thoracoscopic Surgical Enucleation of a Giant Esophageal Leiomyoma Presenting with Persistent Cough. Case Rep Surg. 2016. https://doi.org/10.1155/2016/7453259.
- Milito P., Asti E., Aiolf A., Zanghi S., Siboni S., Bonavina L. Clinical Outcomes of Minimally Invasive Enucleation of Leiomyoma of the Esophagus and Esophagogastric Junction. J Gastrointest Surg. 2020; 24(3): 499-504. https://doi.org/10.1007/s11605-019-04210-3.
- Andrási L., Szepes Z., Tiszlavicz L., Lázár G., Paszt A. Complete laparoscopic-transhiatal removal of duplex benign oesophageal tumour: case report and review of literature. BMC Gastroenterol. 2021; 21(1): 47. https://doi.org/10.1186/s12876-021-01625-8.
- Asti E., Siboni S., Sironi A., Barbieri L., Bonavina L. Minimally invasive surgery for submucosal benign esophageal tumors: indications, preoperative investigations, patient selection, and clinical outcomes. Ann Laparosc Endosc Surg. 2019; 4. https://doi.org/10.21037/ales.2019.06.13.
- Thakut G., Murchite S.A., Kulkarni R.M., Gaikwad V.V. Leiomyoma of esophagus-A case report. Int J Surg Case Rep. 2020; 76: 285-287. https://doi.org/10.1016/j.ijscr.2020.09.142.


