Транскатетерная имплантация аортального клапана у 80-летней пациентки с критическим аортальным стенозом
Автор: Чупин Андрей Валерьевич, Пузенко Дмитрий Владимирович, Лебедев Дмитрий Петрович, Звездкина Елена Александровна, Алексеева Юлия Михайловна, Сафронов Сергей Николаевич
Журнал: Клиническая практика @clinpractice
Рубрика: Случай из практики
Статья в выпуске: 4 (16), 2013 года.
Бесплатный доступ
В статье представлено описание клинического случая транскатетерной имплантации аортального клапана у 80-летней пациентки с критическим аортальным стенозом и высоким риском открытой хирургической коррекции.
Транскатетерная имплантация аортального клапана (tavi), критический стеноз аортального клапана
Короткий адрес: https://sciup.org/14338470
IDR: 14338470
Текст научной статьи Транскатетерная имплантация аортального клапана у 80-летней пациентки с критическим аортальным стенозом
Больные пороками клапанов сердца – это большая группа пациентов, у которых развитие сердечной недостаточности наиболее предсказуемо [1, 2]. Внезапная смерть у больных с клапанной патологией встречается довольно часто, даже в отсутствие дополнительных факторов риска, поэтому все эти пациенты имеют высокий риск летального исхода, особенно при длительном консервативном лечении [3, 4]. По последним данным, опубликованным Американской Ассоциацией Сердца, смертность от клапанных пороков в США составляет около 20.000 человек ежегодно или 7 человек на 100.000 в популяции [5].
Среди всех клапанных пороков сердца, аортальный стеноз наиболее часто приводит к серьезным гемодинамическим последствиям. Частота и степень поражения аортального клапана увеличивается с возрастом [2, 6, 7]. По данным самого крупного популяционного исследования, проведенного в США у 5201 лиц старше 65 лет, каждый четвертый из обследо- ванных имел структурные изменения в виде утолщения створок, кальцификации, или их комбинации. Гемодинамически значимый аортальный стеноз (легкий или умеренный), наблюдался у 1,5% женщин и 2% мужчин, увеличиваясь с возрастом [1, 8, 9]. В качестве других факторов риска аортального стеноза (или склероза) в этой популяции отмечены мужской пол, повышение уровня липопротеинов низкой плотности, избыточная масса тела, артериальная гипертензия и курение. Результаты исследования подтверждают, что гемодинамически выраженный аортальный стеноз встречается, по меньшей мере, у 2% лиц старше 70 лет [1, 2].
В последнее время отмечается тенденция к увеличению продолжительности жизни, в связи с чем значительно возросло число пациентов пожилого и старческого возраста, а также больных, страдающих серьезной сопутствующей патологией, относящихся к группам высокого риска открытой хирургической коррекции [1, 10, 11]. Выполнение больших реконструктивных операций на аортальном клапане с использованием расширенных хирургических доступов и подходов у таких больных по вполне объяснимым причинам не представляется возможным. В этом случае единственным шансом для продления жизни и улучшения ее качества становится использование новейших эндоваскулярных технологий протезирования аортального клапана [11-14]. В нашей статье описан клинический случай использования технологии транскатетерной имплантации аортального клапана (TAVI) – как безальтернативный метод коррекции критического аортального стеноза у пациентки 80-ти лет с наличием тяжелой сопутствующей патологии.
Описание клинического случая.
В центр сердечно-сосудистой хирургии ФГБУ ФНКЦ ФМБА России поступила пациентка Ц., 80 лет, с жалобами на боли сжимающего и давящего характера за грудиной при незначительной физической нагрузке – ходьбе до 100 м и в покое, перебои в работе сердца, общую слабость. Из анамнеза известно, что в течение 20 лет повышается АД максимально до 210/100 мм рт. ст, обычное АД – 140/80 мм рт. ст., гипотензивную терапию принимает регулярно.
При общем осмотре: положение больной – вынужденное. Телосложение правильное, нормостеническое – рост 164 см, вес 68 кг. Из особенностей – тоны сердца приглушены, грубый пансистолический шум во всех точках аускультации, проводящийся на сосуды шеи.
Данные лабораторных и инструментальных методов исследований:
В предоперационном периоде пациентке выполнен полный объем лабораторных, инструментальных и инвазивных методов обследования по кардиохирургическому протоколу с целью верификации клинического диагноза, определения показаний к хирургической коррекции и предоперационной подготовке: По данным общего анализа крови, мочи, коагулограммы – существенных отклонений не выявлено, биохимический анализ крови выявил умеренное повышение цифр креатинина крови – до 140 мкмоль/л.
Проведенная ЭХО-КГ выявила наличие критического стеноза аортального клапана, (макс. скорость – 5,5 м/с; макс. градиент – 122 мм рт.ст.; средн. градиент – 68 мм рт. ст.) (рис. 1, 2), массивного кальциноза кольца аотального клапана, наличие легкой аортальной недостаточности (аортальная регургитация 1-й степени). Также определялась концентрическая гипертрофия миокарда левого желудочка с утолщением межжелудочковой перегородки (до 1,6 - 1,8 см). Отсутствовали зоны снижения локальной сократимости с ОФВ 55 %.
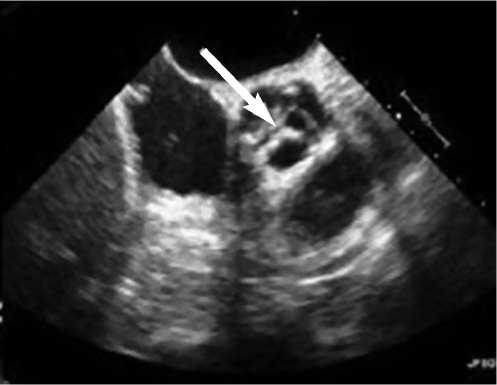
Рис. 1. ЭХО-КГ: Критический стеноз аортального клапана (стрелкой указан критически стенозированный аортальный клапан)
По данным селективной коронарографии и ангиографии корня аорты диагностирован правый тип кровоснабжения миокарда. Левая коронарная артерия, ствол левой коронарной артерии – без признаков стенозирования, стентированные сегменты ОВ-ВТК проходимы. Правая коронарная артерия – стентированный сегмент ПКА проходим, без признаков рестенозирования. Аортография восходящего отдела выявила выраженный кальциноз в проекции аортального клапана; отсутствие расширения вос-
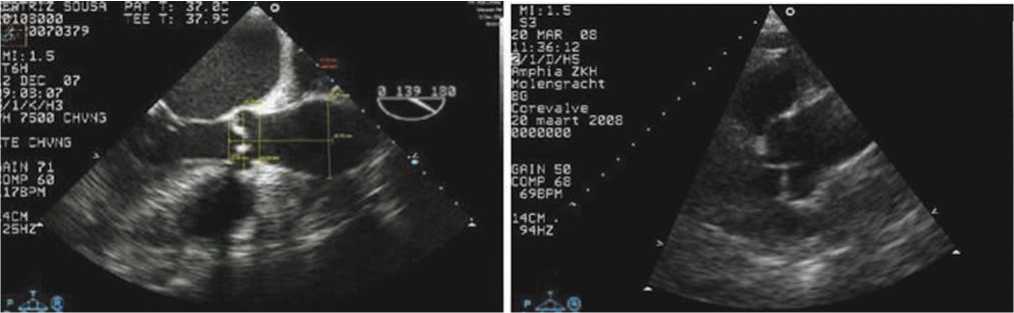
Рис. 2. ЭХО-КГ оценка корня с измерением фиброзного кольца аортального клапана, сино-тубулярного соединения, диаметра аорты на уровне синусов Вальсальвы.
ходящей аорты. Диаметр аорты на уровне синусов Вальсальвы – 24 мм, диаметр на уровне си-но-тубулярной зоны – 25 мм, в месте наибольшего расширения аорты – 39 мм, расстояние до этой области – 45 мм, расстояние от кольца АК до уровня ствола ЛКА – 6 мм (рис. 3). Диаметр восходящей аорты проксимальнее отхождения брахиоцефального ствола – 30 мм. Дуга аорты не расширена, не извита. Брахиоцефальные артерии отходят 3-мя стволами.
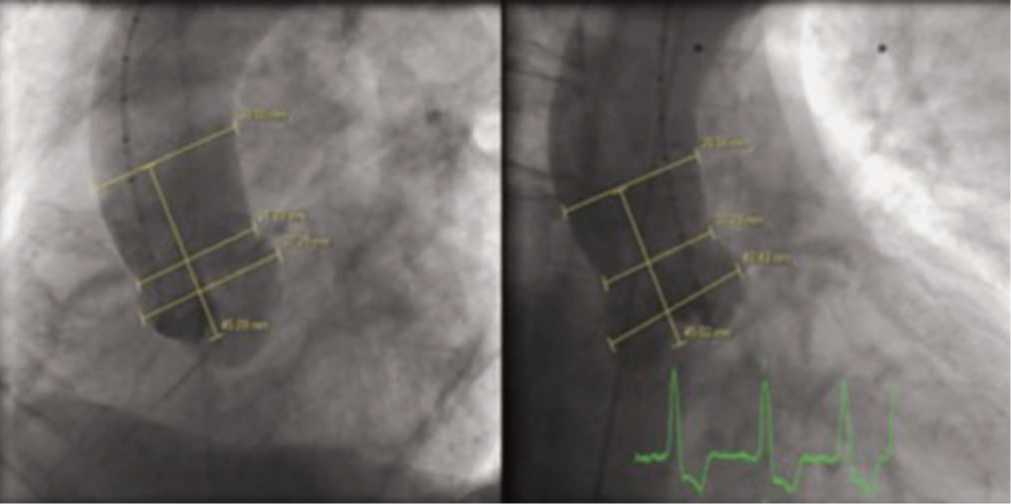
Рис. 3. АГ оценка параметров корня фиброзного кольца аортального клапана, сино-тубулярного соединения, диаметра аорты на уровне синусов Вальсальвы.
При мультиспиральном компьютерном исследовании восходящего отдела аорты, брюшного отдела аорты с контрастированием верифицированы атеросклеротическое поражение брюшной аорты и её магистральных ветвей, без гемодинамически значимых стенозов, атеросклеротическое поражение грудной аорты, тотальный кальциноз аортального клапана.
Диаметр аорты на уровне аортального кольца – 26,5 мм, на уровне синуса – 32,8 мм, высо- та синуса – 15,6 мм. Диаметр восходящей аорты – 38 мм.
Дуга аорты до отхождения магистральных артерий – 28 мм, после отхождения магистральных артерий – 21 мм, в нисходящем отделе – 22 мм. (рис. 4).
В стенке дуги и нисходящей аорты – кальцинированные включения.
Брахиоцефальный ствол диаметром 13,2 мм, отходит в типичном месте, не изменен. Правая подключичная артерия – диаметром 6,8 мм, в проксимальном сегменте имеет С-образный фиксированный изгиб.
Левая общая сонная артерия – диаметром 7,2 мм, левая подключичная артерия – диаметром 8 мм, отходят в типичном месте, гемодинамически не изменены.
Диаметр брюшного отдела аорты на супра-ренальном уровне составляет 22 мм, на инфра-ренальном уровне – 18 мм, стенка её атеросклеротически изменена. Общие подвздошные артерии диаметром справа 8,3 мм, слева – 9 мм, стенки атеросклеротически изменены, без гемодинамически значимых стенозов. Наружные подвздошные артерии справа и слева диаметром 7 мм, стенки атеросклеротически измене-
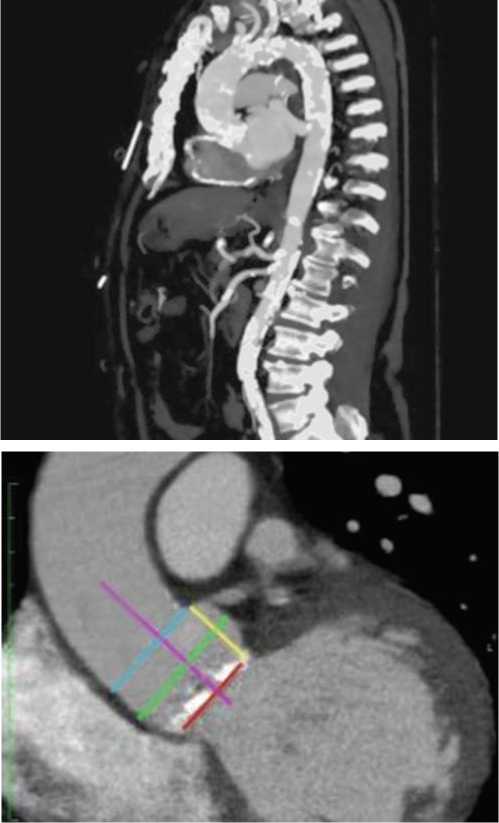
Рис. 4. МС-КТ оценка корня аорты с измерением:
I - диаметра кольца аортального клапана,
I - синоно-тубулярного соединения,
I - диаметра аорты на уровне синусов Вальсальвы,
- высоты от устья коронарной артерии до створки аортального клапана ны, без гемодинамически значимых стенозов. Почечные артерии без гемодинамически значимых изменений.
По данным ЭКГ – синусовый ритм, брадикардия, отклонение ЭОС влево, ГЛЖ с признаками снижения кровоснабжения и перегрузкой.
По данным ультразвукового дуплексного сканирования сонных и брахиоцефальных артерий выявлена гемодинамически незначимая S-образная извитость правой и левой внутренних сонных артерий. S-образная извитость правой позвоночной артерии между поперечными отростками C4-C3. Эктазия внутренней яремной вены справа.
При исследовании ФВД выявлено нарушение вентиляционной функции легких по обструктивному типу средней степени тяжести. Кроме того, установлено ограничение воздушного потока генерализованного характера.
При ультразвуковом исследовании почек, надпочечников, внутренних органов, органов малого таза – признаки диффузных изменений паренхимы почек, уплотнение синусов, экстра-ренальная киста левой почки 7,2 см (хронич. пиелонефрит, ХПН), УЗ-признаки дифф. изменений паренхимы печени и поджелудочной железы. Стенки желчного пузыря уплотнены, холедох – 0,8 см. Состояние после экстирпации матки с придатками. Вероятнее всего (учитывая данные биохимического анализа крови) у больной имеет место нефроангиосклероз с явлениями начальной ХПН.
На основании вышеперечисленного пациентке выставлен диагноз:
Основное заболевание:
I20.8 Ишемическая болезнь сердца. Стенокардия напряжения III ФК. Атеросклероз коронарных артерий. Коронарная ангиопластика со стентированием ОВ, ВТК, ПКА в 20102011 гг. Критический аортальный стеноз склеродегенеративного генеза. Гипертоническая болезнь III ст, риск 4.
Осложнения:
Пароксизмальная форма фибрилляции предсердий. ХСН III ФК.
Сопутствующие заболевания:
Протокол хирургического лечения пациентки:
Учитывая наличие сопутствующей патологии, перенесенные вмешательства на органах брюшной полости, органах малого таза, эндоваскулярные вмешательства на коронарных артериях, наличие начальной стадии ХПН, изменений по данным исследований ФВД, высокий риск открытой хирургической коррекции с риском по EuroScore 23%, наличия у пациентки симптомного критического аортального стеноза с градиентом до 120 мм рт. ст., нами принято решение о транскатетерной имплантации аортального клапана CoreValve, предварительный размер имплантируемого устройства по данным инструментальных методов исследования составил 26 мм. (рис. 5)

Рис. 5. Внешний вид имплантируемого устройства CoreValve
Пациентка дообcледована, подготовлена к оперативному вмешательству. 25.06.2013 года проведена хирургическая коррекция критического аортального стеноза методом транскатетерной имплантации (TAVI) устройства CoreValve размером 26 мм, содержащего биологический аортальный клапан из свиного перикарда на саморасширяющемся нитиноловом каркасе с памятью формы.
Описание операции:
В асептических условиях, после обработки операционного поля по Филончикову, с использованием пленки Iobahn, доступом в верхней трети правого бедра выделена общая бедренная артерия, диаметром 9 мм, с мягкими стенками и отчетливой пульсацией, по передней стенке пунктирована иглой, на проводнике установлен интродьюсер RCFW 18.0-P-38-30-RB. Иглой пунктирована левая бедренная артерия в ретроградном направлении. По Селдингеру установлен интродьюсер Avanti+ 6F. Гепаринизация 5 000 ЕД внутриартериально. На проводнике Emerald через интродьюсер левой ОБА в некоронарный синус установлен диагностический катетер Pigtail. На проводнике Emerald через интродью-сер правой ОБА путем смены катетеров и проводников из-за выраженного стеноза и кальциноза аортального клапана диагностический катетер 534-553S заведен в полость левого желудочка, проводник заменен на Super Stiff 260 см, по которому в проекцию клапана аорты позиционирован баллонный катетер Nucleus 20.0 х 4.0. Выполнена аортография корня аорты (рис. 6).
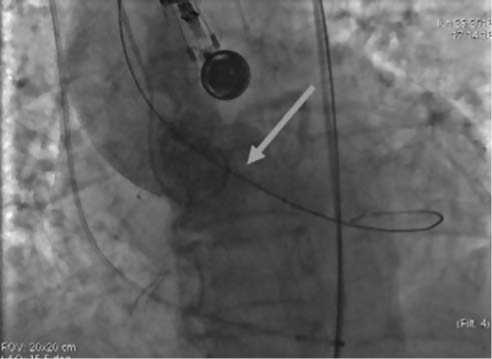
Рис. 6. Ангиография корня аорты (стрелкой указан критический стенозированный аортальный клапан)
Выполнено прямое измерение градиента давления Ао и ЛЖ, максимальный градиент – 121 мм рт. ст. Проведена баллонная дилатация аортального клапана на фоне навязанного сердечного ритма 200 в минуту (рис. 7). После удаления баллонного катетера гемодинамика стабильная. Приспособлением для сжатия и загрузки клапана аортальный клапан диаметром 26 мм смонтирован в систему доставки. По проводнику Super Stiff система доставки позиционирована в зону имплантации. Выполнена аортография корня аорты.
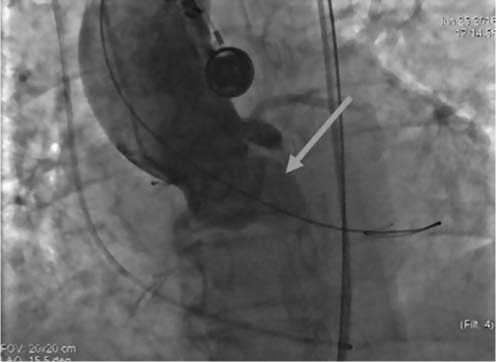
Рис. 7. Балонная дилятация АК (стрелкой указан баллон 20 мм, дилятирующий аортальный клапан)
Проведена имплантация клапана (рис. 8). Гемодинамика стабильная. По проводнику Super
Stiff диагностический катетер Pigtail установлен в полость левого желудочка, второй диагностический катетер Pigtail установлен над клапаном аорты. Контрольная аортография (рис. 9) – результат хороший, клапан имплантирован в желаемую позицию, коронарные артерии визуализируются, кровоток по ним не скомпрометирован. Инвазивное измерение давления – градиент на клапане отсутствует. Инструменты удалены. Послойное ушивание раны правого бедра с оставлением активного дренажа. Гемостаз левой ОБА с применением сшивающего устройства. Йод. Давящая асептическая повязка слева.
По данным интраоперационной ЧП ЭХО-КГ корень аорты: 3,7 см. Выходной тракт левого желудочка: 2,2 см. Восходящий отдел аорты: 4,0 см на расстоянии 6,2 см от ВТЛЖ. Сино-тубуляр-ное соединение: 3,1 см. Расстояние от сино-ту-булярного соединения до ВТЛЖ: 1,9 см.
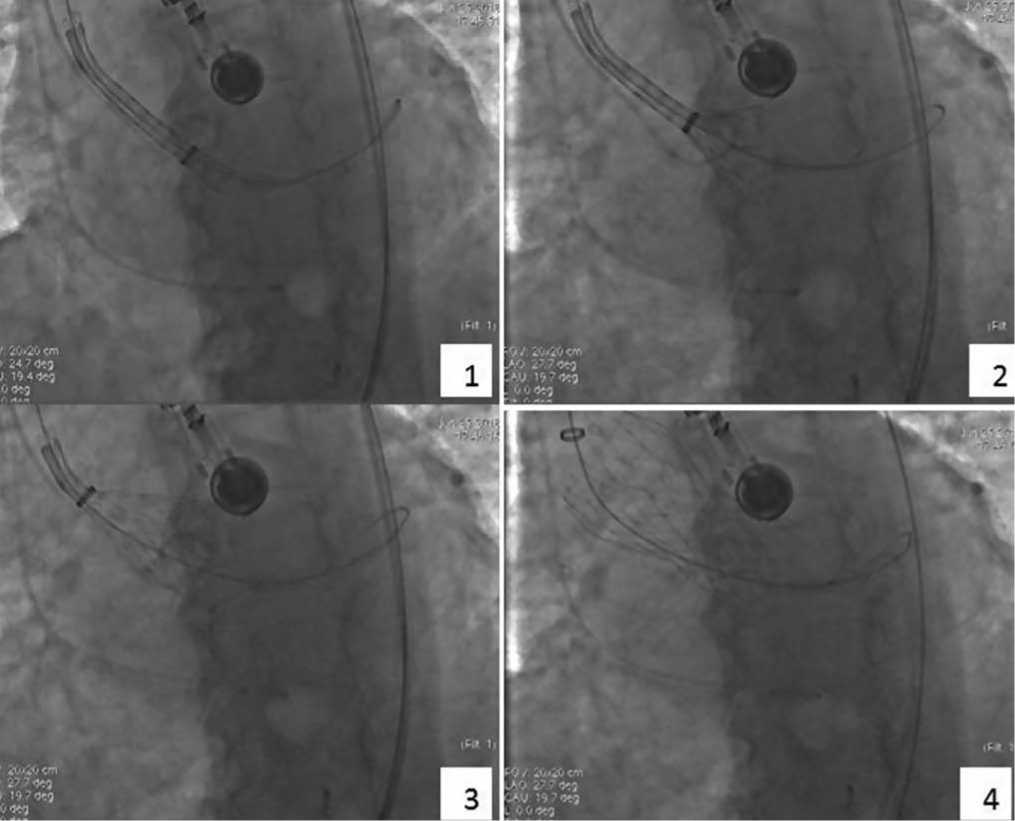
Рис. 8. Этапы имплантация устройства.
1– проведение устройства, 2 – начало открытия устройства, 3 – открытие 2/3 устройства, 4 – полное раскрытие устройства
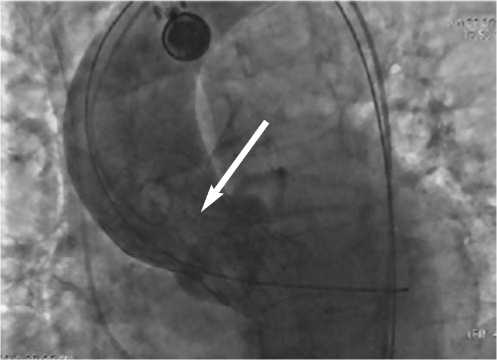
Рис. 9. Контрольная ангиография корня аорты (стрелкой указано имплантированное устройство, содержащее аортальный клапан) видно отсутствие регургитации крови в полость левого желудочка
Раскрытие аортального клапана: 0,5 см. Выраженный кальциноз стенок аорты и створок аортального клапана с частичным переходом на аортально-митральный контакт и развитием критического стеноза устья аорты (V max = 5,3 м/сек; PG max = 124 мм рт. ст; PG mean = 65 мм рт. ст). Аортальная регургитация 0 - 1-й степени.
После имплантации устройства – в проекции аортального клапана лоцируются линейные тени от протеза АК – убедительных данных за наличие парапротезных фистул не получено. В режиме ЦДК визуализируются две транспротезные струи аортальной регургитации: первая эксцентричная 1-й степени и вторая центральная 1-й степени. Убедительных данных за наличие зон нарушения локальной сократимости не получено. Фракция выброса в пределах 54 - 56 %.
Проводившееся лечение в послеоперационном периоде:
Антибактериальная терапия амоксиклавом 1,2 г х 2 раза в сутки, 5 суток. Гастропротекция, седация, клексан 40 мг х 2 р, варфарин.
Послеоперационное ЭХО-КГ на 5-е сутки после транскатетерной имплантации АК выявило отсутствие патологического градиента на АК, (V max = 2,1 м/сек; PG max = 12 мм рт. ст; PG mean = 7 мм рт.ст.). Аортальная регургитация 1 - 2-й степени (в два потока центральный и эксцентричный). Общая фракция выброса – 55%.
Послеоперационный период:
У пациентки в раннем послеоперационном периоде (вторые сутки) после проведения транскатетерной имплантации аортального клапана отмечалось развитие полной поперечной блокады с ЧСС 30 в минуту, потребовавшее проведения временной эндокардиальной стимуляции. Необходимо учитывать тот факт, что после процедуры TAVI наличие полной АВ-блокады 3 степени может носить временный характер и часто восстанавливается после уменьшения отека зоны проводящих путей в сроки до 2-х недель от даты оперативного вмешательства [15-17]. У нашей пациентки в течение 2-х недель сохранялись явления АВ блокады, диагностирована стойкая АВ-блокада 3 степени. Через две недели после проведения транскатетерной имплантации АК по абсолютным показаниям произведена операция имплантации однокамерного ЭКС-554 VVI-60 без особенностей и осложнений.
После имплантации ЭКС – гладкое течение послеоперационного периода. Заживление п/о раны на правой нижней конечности первичным натяжением. Дыхательная, сердечно-сосудистая недостаточность компенсированы. Пациентка адаптирована к повседневным физическим нагрузкам, активна. На 20 сутки после операции пациентка выписана из стационара в удовлетворительном состоянии,с хорошей толерантностью к физической активности, отсутствием жалоб.
Контрольное обследование, выполненное через 3 месяца, не выявило патологического градиента на аортальном клапане. (V max = 1,9 м/сек; PG max = 14 мм рт. ст; PG mean = 8 мм рт. ст). Транспротезная аортальная регургитация 1-й степени). Глобальная сократимость миокарда в норме. Фракция выброса – 55 %. Свободной жидкости в полости перикада не выявлено.
Обсуждение:
Стенотическое поражение аортального клапана различного генеза – жизнеугрожающее состояние, сопровождающееся высокими рисками развития внезапной сердечной смерти, требующее хирургической коррекции при возникновении первых проявлений болезни. Около 32% пациентов не подвергаются хирургическому лечению из-за наличия сопутствующих заболеваний [1]. TAVI – метод выбора у соматически тяжелых больных высоких групп риска для открытой хирургической операции (PARTNER Trial Criteria: EuroScore >20; STS >8): пациентов с полиморбидной патологией, имеющих симтоматически тяжелый аортальный сте- ноз, подходящую анатомию сосудов, корня аорты, предшествующую открытую коронарную хирургию, тотальный кальциноз аорты, лучевую терапию с ожидаемой продолжительностью жизни более 12 месяцев – когда риск отрытого протезирования аортального клапана превышает потенциальную пользу [11].
В нашем случае пациентка имела сопутствующую экстракардиальную патологию, вмешательства на органах брюшной полости, органах малого таза и эндоваскулярные вмешательства на коронарных артериях в анамнезе, начальную стадию ХПН, изменения ФВД и высокий риск открытой хирургической коррекции по EuroScore – 23%, симптомный критический аортальный стеноз с градиентом до 120 мм рт. ст., тотальный кальциноз створок и фиброзного кольца аортального клапана, в связи с чем и было принято решение о транскатетерной имплантации аортального клапана.
Предоперационное дообследование, включавшее в себя ЭХО-КГ с оценкой кольца аортального клапана, МСКТ корня аорты, восходящей аорты, БЦА, подвздошных, бедренных артерий, ультразвуковое дуплексное сканирование подвздошных артерий, артерий нижних конечностей, коронарографию, ангиографию корня аорты, восходящей аорты, БЦА, артерий нижних конечностей не выявило противопоказаний к проведению транскатетерной имплантации, определило наличие подходящей анатомии корня аорты (рис. 3, 6) достаточного диаметра и отсутствие извитости подвздошных артерий для транскатетерной имплантации аортального клапана CoreValve диаметром 26 мм из перикарда свиньи, на основе саморасширя-ющегося нитинолового стента с памятью формы, обработанного для повышения тромборе-зистентности, высокой резистентности к инфекционным агентам и обладающего пониженными антигенными свойствами с использованием системы доставки клапана размерами 18 FR доступом через правую общую бедренную артерию. Процедура имплантации аортального клапана прошла без особенностей, имплантировано устройство CoreValve 26 мм.
По данным Haworth P и соавт., в имплантации системы постоянной ЭКС пациентам, перенесшим операцию TAVI, нуждается 28,5% больных, особенно – пациенты с кальцинозом фиброзного кольца аортального клапана [15].
У нашей пациентки в раннем послеоперационном периоде после проведения транскате- терной имплантации аортального клапана отмечалось развитие стойкой полной поперечной А-В блокады, потребовавшей имплантации постоянного однокамерного электрокардиостимулятора.
Контрольное обследование, выполненное через 3 месяца, не выявило патологического градиента на аортальном клапане, при удовлетворительной толерантности к физическим нагрузкам, отсутствии жалоб, предъявляемых при поступлении. Таким образом, на наш взгляд, в данном клиническом случае технология транскатетерного протезирования АК явилась безальтернативной процедурой, позволившей с минимальной инвазией получить хорошие результаты лечения.
По мнению ряда авторов, выполнение открытого протезирования аортального клапана показано даже асимптомным пациентам, у которых клинические признаки аортального стеноза выявляются лишь при проведении стресс тестов, а процедура TAVI должна рассматриваться исключительно как альтернативный подход у пациентов высоких групп риска открытой кардиохирургической коррекции с ожидаемой продолжительностью жизни более 1 года [3, 16, 17]. К сожалению, в настоящее время в России, учитывая большое количество населения отдаленных регионов с низкой частотой диспансеризации и проведения скрининговой ЭХО-КГ, выявляемость ранних стадий поражения аортального клапана не достигает уровня США и Европы.
Учитывая большое число пациентов пожилого возраста с наличием одного или более сопутствующих заболеваний, выполнение которым открытой хирургической коррекции не представляется возможным, необходимо внедрение в повседневную кардиохирургическую практику федеральных центров специализированной медицинской помощи процедуры TAVI, имеющей безальтернативный характер, как в описанном выше случае.
Использование эндоваскулярных пособий и отказ от искусственного кровообращения с ми-нимализацией наносимой интраоперационной травмы у больных высоких групп риска поможет начать выполнять протезирование аортального клапана у больных, которым выполнение реконструктивных операций на клапанном аппарате ранее считалось невозможным, что позволит продлевать жизнь и улучшать ее качество тысячам пациентов.
Список литературы Транскатетерная имплантация аортального клапана у 80-летней пациентки с критическим аортальным стенозом
- D'Agostino RB, Grundy S, Sullivan L.M., Willson P.W., For the CHD Risk Prediction Group of the Framingham risk prediction scores. Results of a multiple ethnic group investigation. JAMA 2001; 286:180-7.
- Selzer A. Changing aspects of the natural history of valvular aortic stenosis. N Engl J Med. 1987;317:91-8.
- Buellesfeld L, Gerckens U, Schuler G, et al. 2-year follow-up of patients undergoing transcatheter aortic valve implantation using a self-expanding valve prosthesis. J Am Coll Cardiol. 2011;57:1650-7.
- Kannel WB, Wilson PW. Comparison of risk profiles for cardiovascular events: implications for prevention. Adv Intern Med; 1997 42:39-66.
- Thom T, et al. Circulation. Executive summary: heart disease and stroke statistics -2010 update: a report from the American Heart Association. 2010 Feb 23;121(7):948-54 DOI: 10.1161/CIRCULATION-AHA.109.192666
- Carabello BA. How does the heart respond to aortic stenosis: let me count the ways. Circ Cardiovasc Imaging. 2013 Nov 1;6(6):858-60 DOI: 10.1161/CIRCIMAGING.113.001242
- Cribier A, Eltchaninoff H, Bash A, et al. Percutaneous transcatheter implantation of an aortic valve prosthesis for calcific aortic stenosis: first human case description. Circulation. 2002;106:3006-8.
- Baumgartner H, Hung J, Bermejo J, et al. Echocardiographic assessment of valve stenosis: EAE/ASE recommendations for clinical practice. J Am Soc Echocardiogr. 2009;22:1-23.
- Jeffrey S., Ed. Borer. Pathophysiology, Evaluation and Management of Valvular Heart Diseases. 2004. Vol. 2. 190 p.
- Bardissi AW, Shekar P, Couper GS, et al. Minimally invasive aortic valve replacement in octogenarian, high-risk, transcatheter aortic valve implantation candidates. J Thorac Cardiovasc Surg. 2011; 141:328-35.
- Leon MB, Smith CR, Mack M, et al. Transcatheter aortic-valve implantation for aortic stenosis in patients who cannot undergo surgery. N Engl J Med. 2010;363:1597-607.
- J Thorac Cardiovasc Surg. 2012 Sep;144(3): e29-84. 2012 ACCF/AATS/SCAI/STS expert consensus document on transcatheter aortic valve replacement: developed in collabration with the AHA,ASE, Eur Assoc for Cardio-Thoracic Surgery, Heart Failure Society of America, Mended Hearts, Society of Cardiovascular Anesthesiologists, Society of Cardio-vascular Computed Tomography, and Society for Cardiovascular Magnetic Resonance DOI: 10.1016/j.jtcvs.2012.03.001
- Leon MB, Piazza N, Nikolsky E, et al. Standardized endpoint definitions for Transcatheter Aortic Valve Implantation clinical trials: a consensus report from the Valve Academic Research Consortium. J Am Coll Cardiol. 2011;57:253-69.
- Smith CR, Leon MB, Mack MJ, et al. Transcatheter versus surgical aortic-valve replacement in high-risk patients. N Engl J Med. 2011;364:2187-98.
- Haworth P, Behan M, Khawaja M. Predictors for permanent pacing after transcatheter aortic valve implantation. Catheter Cardiovasc Interv 2010; 76: 751-6.
- Reynolds MR, Magnuson EA, Lei Y, et al. Health-related quality of life after transcatheter aortic valve replacement in inoperable patients with severe aortic stenosis. Circulation. 2011;124:1964-72.
- Ussia GP, Capodanno D, Barbanti M, et al. Balloon aortic valvuloplasty for severe aortic stenosis as a bridge to high-risk transcatheter aortic valve implantation. J Invasive Cardiol. 2010;22:161-6.


