Трансплантация почки при гипергомоцистеинемии: клиническое наблюдение
Автор: Загородникова Н.В., Дмитриев И.В., Балкаров А.Г., Анисимов Ю.А., Буланов А.Ю., Костин А.И., Шмарина Н.В.
Журнал: Вестник медицинского института "РЕАВИЗ": реабилитация, врач и здоровье @vestnik-reaviz
Рубрика: Клинический случай
Статья в выпуске: 2 т.14, 2024 года.
Бесплатный доступ
Введение. Во всем мире наблюдается ежегодный прирост трансплантаций почки. Увеличивается и число реципиетов с гипергомоцистеинемией до и после трансплантации почки, что повышает риск сердечно-сосудистых осложнений, потери нефротрансплантата и смерти пациентов.Материалы и методы. Пациентке 28 лет с терминальной хронической почечной недостаточностью в исходе хронического гломерулонефрита выполнили аллогенную трансплантацию почки, от донора 52 лет, с констатированной смертью головного мозга в исходе острого нарушения мозгового кровообращения по геморрагическому типу.Результаты. Ранний послеоперационный период осложнился тромбозом.Заключение. Исследование гомоцистеина крови обязательно, при обследовании пациентов на трансплантацию почки.
Трансплантация почки, гипергомоцистеинемия, тромбоз, утрата трансплантата
Короткий адрес: https://sciup.org/143182585
IDR: 143182585 | УДК: 616-089.819.843:616.153.478.6 | DOI: 10.20340/vmi-rvz.2024.2.CASE.3
Текст научной статьи Трансплантация почки при гипергомоцистеинемии: клиническое наблюдение
Гипергомоцистеинемия (ГГЦ) представляет собой биохимическое изменение уровня гомоцистеина в плазме крови выше 15 мкмоль/л, связанное с повышенной склонностью к тромбообразованию и рассматривающееся как фактор риска развития ишемической болезни сердца, атеросклероза, венозного тромбоза и инсульта [1–3]. ГГЦ сопровождается формированием выраженного гиперкоагуляционного синдрома и угнетением активности естественных антикоагулянтов [2]. При отсутствии патогенетической терапии риск повторного тром-бообразования увеличивается в 4,7 раза. Патогенетические механизмы влияния гомоцистеина на сосудистую стенку включают: нарушение эндотелий-зависимой вазодилатации, окислительный стресс, способствующий перекисному окислению белков и липидов, усиление тромбогенеза и коагуляции (рис. 1) [4, 5].
Повышению уровня гомоцистеина в крови могут способствовать различные факторы. ГГЦ может быть обусловлена генетическими дефектами ферментов, дефицитом фолиевой кислоты, витаминов В12 и В6, вредными привычками (курение, чрезмерное употребление алкоголя и кофе), некоторыми заболеваниями (гипотиреоз, лейкоз, системная красная волчанка, раковые опухоли, болезнь Крона и др.), применением ряда лекарственных препаратов (метотрексат, метформин, карбамазепин) [6]. Поскольку почки являются основным органом выделения гомоцистеина, то в случае хронической болезни почек (ХБП) его уровень возрастает [7]. Достоверной разницы уровня гомоцистеина в зависимости от причин, приведших к терминальной хронической почечной недостаточности не выявлено. Наиболее выражена ГГЦ у больных, находящихся на гемодиализе.
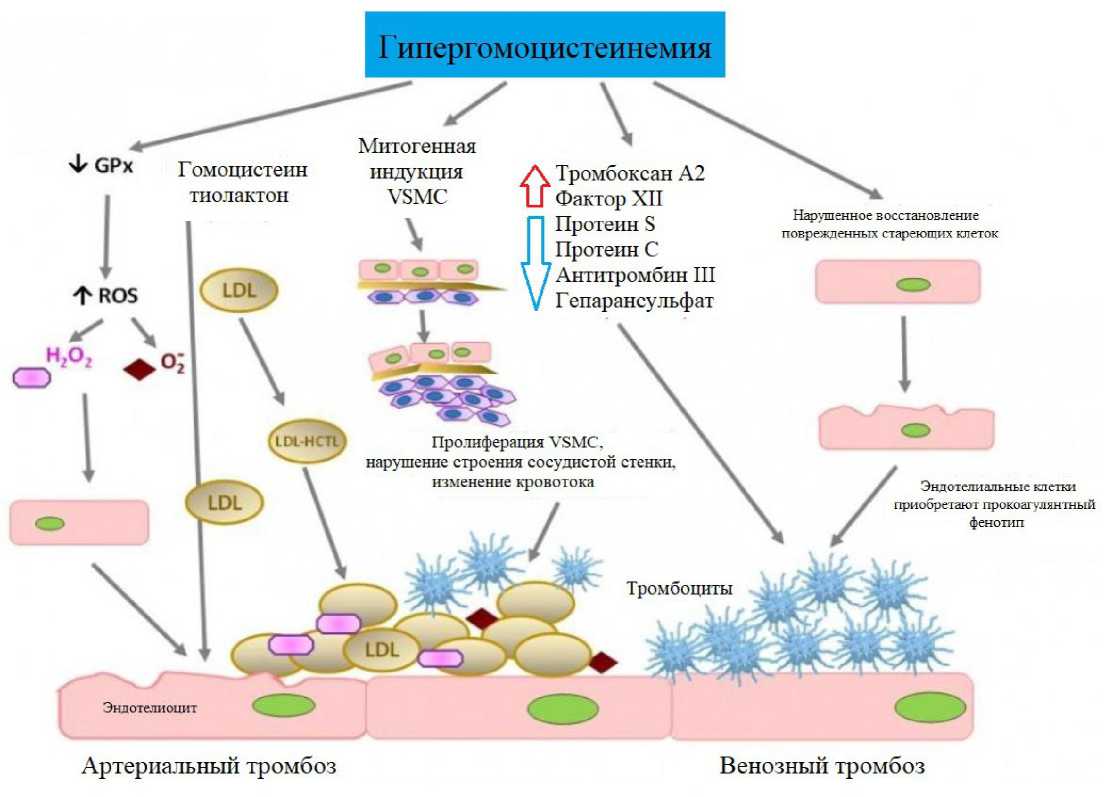
Рисунок 1. Патогенетические механизмы влияния гомоцистеина на сосудистую стенку [4, 5]
Figure 1. Pathogenetic mechanisms of the effect of homocysteine on the vascular wall [4, 5]
Клиническое наблюдение
Пациентка К., 28 лет, поступила в отделение трансплантации почки и поджелудочной железы ГБУЗ НИИ СП им. Н.В. Склифосовского ДЗМ 20.02.2022 года для проведения операции трансплантации почки. Диагноз при поступлении: хронический гломерулонефрит (морфологически фокально-сегментарный гломерулосклероз + тромботическая микроангиопатия), нефротический вариант. Хроническая болезнь почек С5Д (заместительная почечная терапия программным гемодиализом с февраля 2019 г.). Вторичная компенсированная нефрогенная анемия. Вторичный гиперпаратиреоз. Комбинированная тромбофилия (первичный анти-фосфолипидный синдром + мультигенная форма тромбофилии).
Из анамнеза известно, что пациентка была больна с 2012 года, когда после перенесённой пневмонии отметила появление отёков нижних конечностей и массивной протеинурии, однако за медицинской помощью не обращалась. В 2013 г. выполнили нефробиопсию, диагностировали фокальносегментарный гломерулосклероз в сочетании с тромботической микроангиопатией. Дважды в год пациентка получала стационарное лечение в клинике, где проводили массивную патогенетическую терапию глюкокортикостероидами, цитостатиками, ритуксимабом с незначительным клиническим эффектом. Несмотря на проводимую терапию, постепенно прогрессировала хроническая почечная недостаточность. В феврале 2019 г. диагностировали терминальную стадию почечной недостаточности и начали проведение заместительной почечной терапии программным гемодиализом (ПГД) через центральный венозный катетер. Позже, на левом предплечье была сформирована артерио-венозная фистула (АВФ). По амбулаторным данным от 04.11.2021 г. выявили тяжёлую гипергомоцистеине-мию, уровень гомоцистеина плазмы крови составлял 55,6 мкмоль/л., по поводу чего назначили терапию фолиевой кислотой в дозе 5 мг 1 раз в сутки. Также в анамнезе имелись указания на отёк Квинке на нефракционированный гепарин, пациентка постоянно принимала сулодексид в дозе 250 ЛЕ 2 раза в сутки.
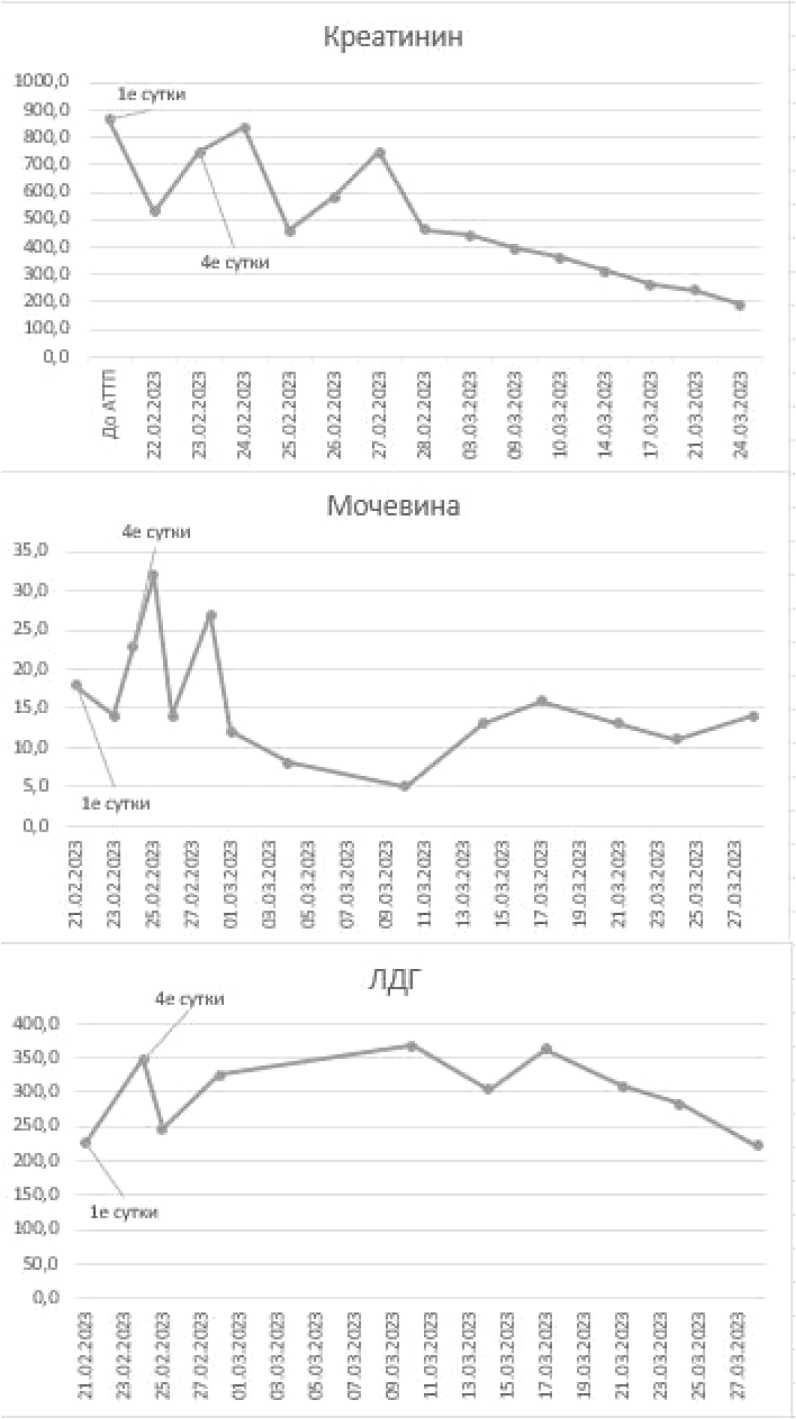
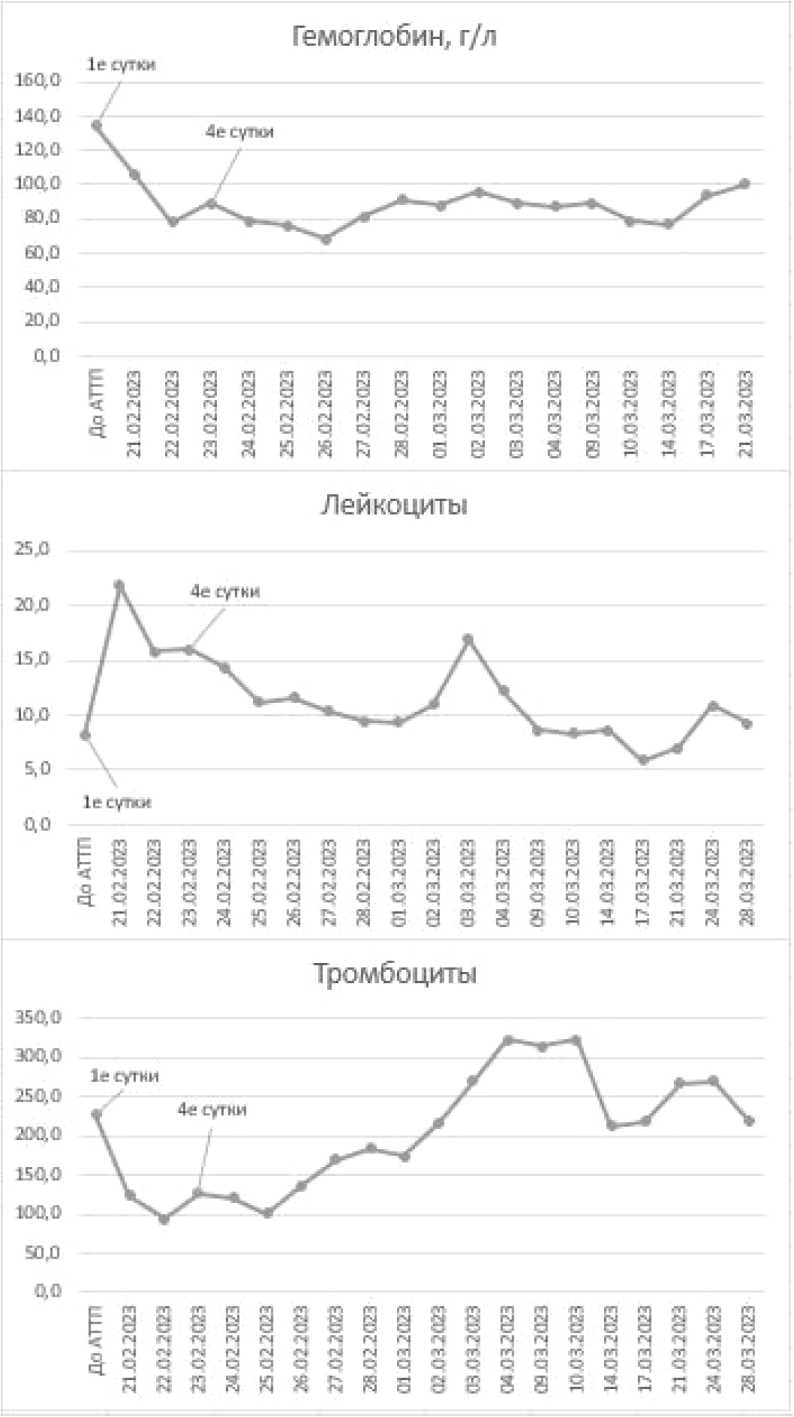
20.02.2022 г. пациентке выполнили аллотрансплантацию почки от посмертного донора мужского пола европеоидной расы возрастом 52 года с констатированной смертью головного мозга в исходе острого нарушения мозгового кровообращения по геморрагическому типу. К моменту эксплантации креатинин сыворотки крови составлял 78 мкмоль/л, мочевина крови – 12 ммоль/л, гемоглобин – 131 г/л, артериальное давление – 140/90 мм рт. ст. Продолжительность пребывания донора в реанимации со- ставляла трое суток. Типаж донора – А 2,3; В 35, 17(58); Dr 1,6(13).
Иммунологическая совместимость по антигенам I класса HLA составила 1 антиген (25 %), несовместимость – 3 антигена (75 %), совместимость по антигенам II класса HLA – 1 антиген (50 %), несовместимость – 1 антиген (50 %).
Пациентка получала трехкомпонентную имуносу-прессивную терапию (ИСТ) с индукцией метилпреднизолоном в суммарной дозе 1000 мг в течении трёх дней. Поддерживающая ИСТ включала ингибиторы кальцинейрина (циклоспорин в дозе 125 мг 2 раза в сутки), антиметаболиты (микофеноловая кислота в дозе 720 мг 2 раза в сутки) и глюкокортикостероиды (метилпреднизолон в дозе 24 мг в сутки, начиная с третьих послеоперационных суток). Отметили отсроченную функцию нефротрансплан-тата. Учитывая отягощённый анамнез на нефракци-онированный гепарин в виде отёка Квинке и высокий риск развития кровотечения на фоне применения других препаратов данной группы, антикоагулянтную терапию не назначали.
Ранний послеоперационный период (первые послеоперационные сутки) осложнился развитием венозного тромбоза почечного аллотрансплантата (ПАТ), тромбоза АВФ и внутренней яремной вены справа, потребовавшим выполнения ревизии ПАТ в экстренном порядке. Интраоперационно отметили наличие плотных тромботических масс в вене ПАТ, провели венотомию и тромбэктомию, венозный отток полностью восстановили. Учитывая тяжелую ГГЦ в сочетании с антифосфолипидным синдромом, тромбозом вены почечного трансплантата, пациентка была консультирована гематологом. Коллегиально согласовали коррекцию терапии, выполнили введение антитромбина III в дозе 1000 МЕ внутривенно капельно в течение двух дней, провели сеанс плазмафереза с замещением свежезамороженной плазмой в объеме 1,5 л, назначили высокие дозы фолиевой кислоты (кальция фолинат) в дозе 50 мг в сутки в течение трёх дней с дальнейшим переводом на пероральные формы фолиевой кислоты в дозе 5–10 мг в сутки, а также сулодексид в дозе 250 ЛЕ 2 раза в сутки, эноксапарин в дозе 4000 анти-Xa МЕ 2 раза в сутки. Коррекцию терапии выполняли под контролем гемограммы, развернутой коагулограммы (с уровнем антитромбина) и тромбоэластограммы.
На фоне проводимой терапии на третьи послеоперационные сутки выявили ультразвуковые признаки гематомы ложа ПАТ, в экстренном порядке выполнили ревизию послеоперационной раны, выявили наличие гематомы ложа ПАТ объёмом 1000 мл, при этом артерия и вена нефротрансплантата проходимы, признаков тромбоза не отмечено. Явного источника кровотечения не обнаружено, выполнили гемостатическую терапию, переливание аутологич- ной крови реципиента с использованием аппарата «cell saver».
На четвёртые послеоперационные сутки по данным ультразвукового исследования были выявлены эхографические признаки неокклюзионного тромбоза вены трансплантата почки, а также гематомы ложа почечного трансплантата. В экстренном порядке выполнили повторную ревизию послеоперационной раны, выявили гематому ложа ПАТ объёмом 500 мл, при этом артерия и вена нефротрансплантата проходимы, трансплантат был признан жизнеспособным. Явного источника кровотечения не отмечено, выполнили эвакуацию гематомы, санацию и дренирование ложа ПАТ.
Дальнейшее течение раннего послеоперационного периода без хирургических осложнений. В составе консервативной терапии проводили антибактериальную, гастропотективную терапию, коррекцию электролитных нарушений, иммуносупрессивную терапию. С 11-х суток возвращена антикоагулянтная терапия эноксапарином и сулодек-сидом. В связи с отсроченной функцией нефро-трансплантата пациентке проводили заместительную почечную терапию ПГД (суммарно 8 сеансов).
С 22-х послеоперационных суток отметили восстановление водо-выделительной функции ПАТ, постепенное снижение уровня азотистых шлаков. На 37-е сутки с удовлетворительной функцией нефротрансплантата пациентка была переведена на амбулаторный этап лечения под наблюдение нефролога МГНЦ ГКБ № 52.
Динамика гематологических и биохимических показателей пациентки иллюстрирована на рисунке 2.
б
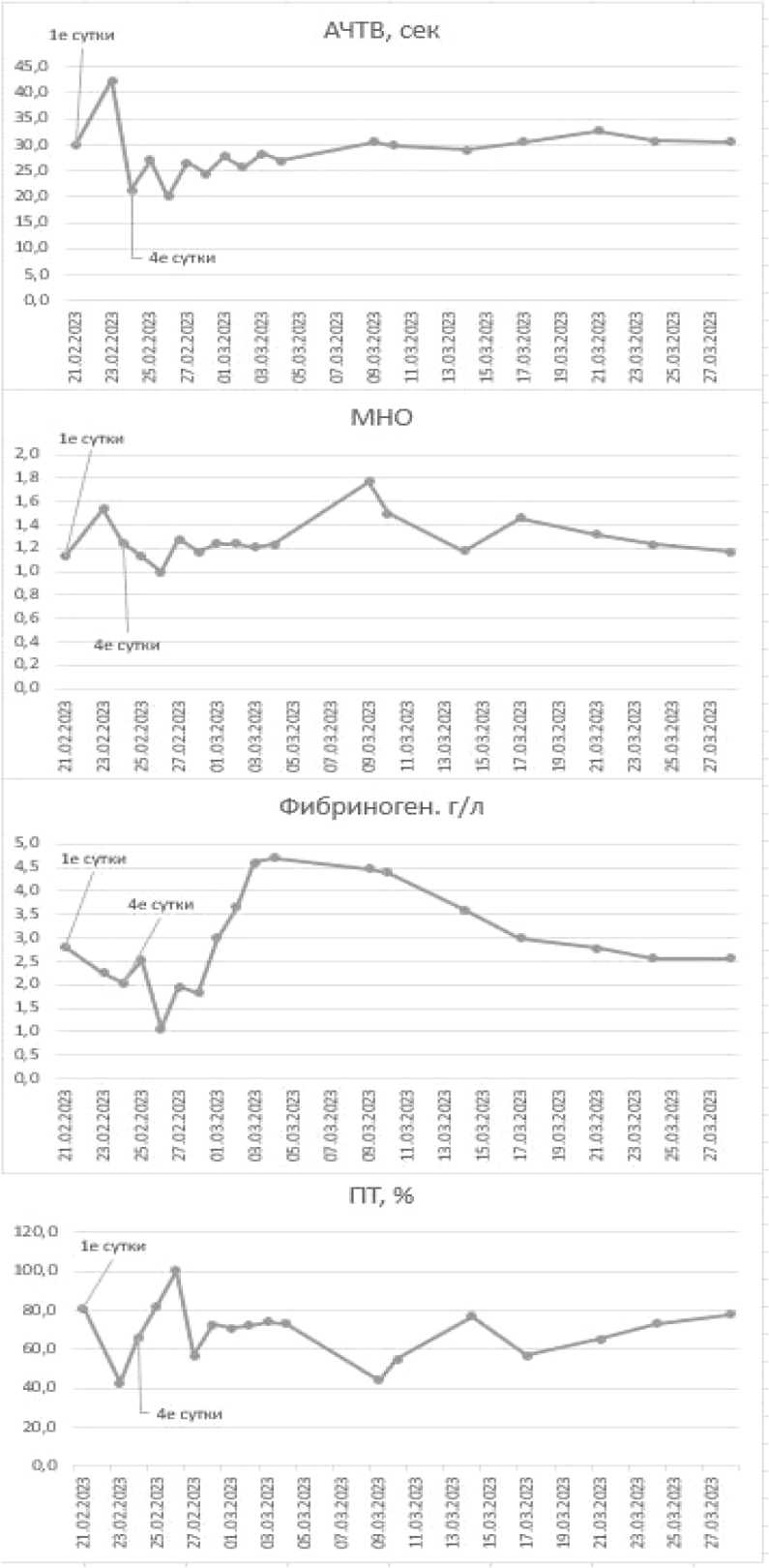
Рисунок 2. Динамика показателей крови: а – биохимических; б – общего анализа крови, в – коагулограммы; г – коагулограммы и гомоцистеина Figure 2. Dynamics of blood parameters: a – biochemical; б – general blood analysis; в – coagulograms; г – coagulograms and homocysteine
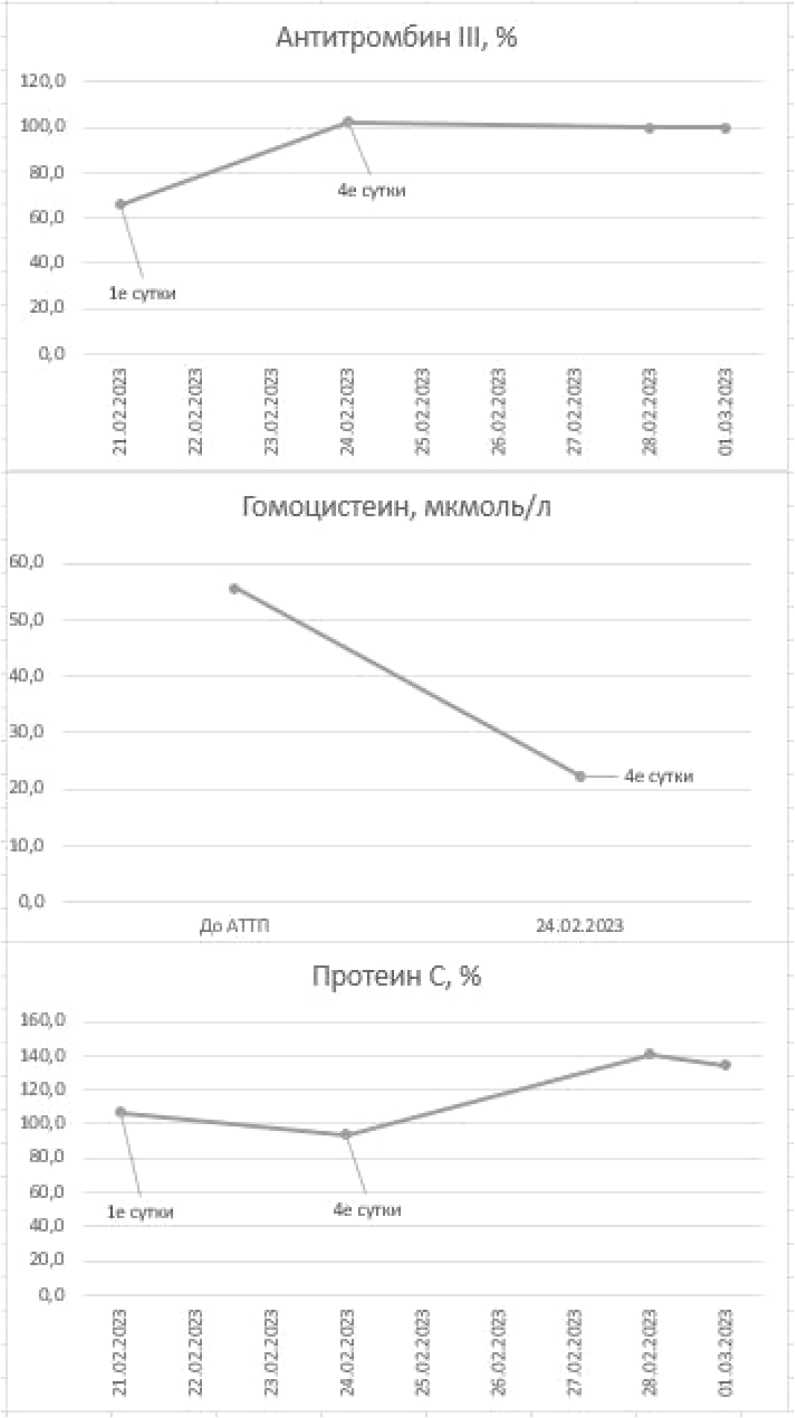
В настоящий момент у пациентки сохраняется удовлетворительная функция ПАТ – уровень креатинина сыворотки крови по состоянию на 01.04.2024 составил 130 мкмоль/л, мочевины крови – 12,5 ммоль/л, уровень гемоглобина – 134 г/л, содержание тромбоцитов - 284 х 10 9 /л, общий анализ мочи - без особенностей, уровень гомоцистеина плазмы крови – 12,7 мкмоль/л.
Обсуждение
Настоящее клиническое наблюдение демонстрирует влияние повышенного уровня гомоцистеина плазмы крови у пациентки с хронической болезнью почек на развитие хирургических осложнений. Учитывая высокий риск тромбообразования в послеоперационном периоде, пациентке продолжили введение фолиевой кислоты в необходимой дозе, но, несмотря на это, ранний послеоперацион- ный период осложнился развитием венозного тромбоза ПАТ – сосудистого осложнения категории тяжести IIIb по Clavien-Dindo. Это потребовало проведения экстренного оперативного вмешательства и назначения усиленной антикоагулянтной терапии, даже несмотря на высокий риск развития кровотечения. Дальнейший послеоперационный период сопровождался двумя эпизодами диффузного кровотечения с формированием гематомы ложа ПАТ, что требовало проведения экстренного оперативного вмешательства и коррекции консервативной терапии, это позволило сохранить почечный аллотрансплантат.
Выводы
Одним из важных организационных выводов считаем необходимость тщательного подхода к обследованию пациентов при постановке в лист ожидания и обязательного включения в алгоритм исследования определения уровня гомоцистеина крови. При выявлении уровня гомоцистеина более 15 мкмоль/л, необходим комплексный подход к предоперационной подготовке и коллегиальному определению тактики послеоперационного ведения пациента совместно с гематологами.
Список литературы Трансплантация почки при гипергомоцистеинемии: клиническое наблюдение
- Paradkar MU, Padate B, Shah SAV, Vora H, Ashavaid T. Association of Genetic Variants with Hyperhomocysteinemia in Indian Patientswith Thrombosis. Indian J Clin Biochem. 2020;35(4):465-473. PMID: 33013017. DOI: 10.1007/s12291-019-00846-9 PMID: 33013017
- Cianciolo G, De Pascalis A, Di Lullo L, Ronco C, Zannini C, La Manna G. Folic Acid and Homocysteine in Chronic Kidney Disease and Cardiovascular Disease Progression: Which Comes First? Cardiorenal Med. 2017;7(4):255-266. PMID: 29118764. DOI: 10.1159/000471813 EDN: YGJLVJ
- PMID: 29118764
- Решетняк Т.М., Середавкина Н.В., Насонов Е.Л. Гипергомоцистеинемия - фактор риска тромбоза при антифосфолипидном синдроме. Тромбоз, гемостаз, реология. 2019; 78(2): 37-44. DOI: 10.25555/THR.2019.2.0878 EDN: QXGEXX
- Angelini A, Cappuccilli ML, Magnoni G, Croci Chiocchini AL, Aiello V, Napoletano A, et all. The link between homocysteine, folic acid and vitamin B12 in chronic kidney disease. G Ital Nefrol. 2021;38(4): 2021-vol4. PMID: 34469084. PMID: 34469084
- Rossi GP, Seccia TM, Barton M, Danser AHJ, de Leeuw PW, Dhaun N, et al. Endothelial factors in the pathogenesis and treatment of chronic kidney disease Part II: Role in disease conditions: a joint consensus statement from the European Society of Hypertension Working Group on Endothelin and Endothelial Factors and the Japanese Society of Hypertension. J Hypertens. 2018;36(3):462-471. PMID: 29135628. DOI: 10.1097/HJH.0000000000001600 EDN: YEPVZJ
- PMID: 29135628
- Wu HHL, Wang AY. Vitamin B12 and chronic kidney disease. Vitam Horm. 2022;119:325-353. PMID: 35337625. DOI: 10.1016/bs.vh.2022.01.011 EDN: BWDMYX
- PMID: 35337625
- Langan RC, Goodbred AJ. Vitamin B12 Deficiency: Recognition and Management. Am Fam Physician. 2017;96(6):384-389. PMID: 28925645. PMID: 28925645


