Транспозиция нативной вены - метод выбора при невозможности формирования стандартной артериовенозной фистулы
Автор: Беляев А.Ю., Городов С.Ю., Кудрявцева Е.С., Тазетдинов Д.З.
Журнал: Хирургическая практика @spractice
Рубрика: Современное состояние проблемы: обзоры, лекции
Статья в выпуске: 4, 2013 года.
Бесплатный доступ
Пациентам на программном гемодиализе необходимо обеспечить длительно функционирующий постоянный сосудистый доступ. Транспозиция нативных вен, используемых для формирования артериовенозных фистул, обеспечивает создание таких доступов, превосходя по результатам выживаемости и безопасности синтетические сосудистые протезы и центральные венозные катетеры.
Программный гемодиализ, постоянный сосудистый доступ, артериовенозная фистулa, транспозиция авф
Короткий адрес: https://sciup.org/142211537
IDR: 142211537 | УДК: 616.1;
Текст научной статьи Транспозиция нативной вены - метод выбора при невозможности формирования стандартной артериовенозной фистулы
Стратегическая перспектива, при которой заместительная почечная терапия будет всеобъемлюще обеспечена посредством трансплантации донорскими или клонированными почками, так же как и ближайшая теоретически достижимая цель – низкопоточные и продолжительные методики очищения крови для каждого пациента, достаточно далеки в ближайшем будущем [12].
Современные технологии обеспечения программного гемодиализа (ПГД) позволяют существенно улучшить качество и продолжительность жизни пациентов, увеличить сроки их нахождения на гемодиализе за счет успешных решений в области коррекции анемии и очистки воды. Поэтому возникают дополнительные требования к более длительному функционированию постоянного сосудистого доступа (ПСД), что влечет за собой увеличение количества хирургических и ангиопласти-ческих вмешательств, необходимых для его поддержания или создания нового доступа, и, как следствие, к исчерпанию потенциала вен пациента.
Создание нативной артериовенозной фистулы (АВФ) является приоритетной задачей для гарантии наличия хорошо функционирующего долговременного сосудистого доступа [38–40, 47]. К сожалению, во многих случаях формирование стандартной дистальной (между a. radialis и v. cephalica) или проксимальной (между a. brachialis и v. cephalica) АВФ невозможно по причине многочисленных предшествующих сосудистых операций, индивидуальных особенностей архитектоники сосудов пациента или их патологических изменений. В таких ситуациях ПСД может быть обеспечен посредством имплантации синтетического сосудистого протеза (ССП), постановки тоннельного центрального внутривенного катетера (т-ЦВК) или формирования нестандартных нативных АВФ.
Создание ПСД с помощью ССП по большинству показателей значительно уступает АВФ. В последние годы в ведущих сосудистых центрах мира отмечена выраженная тенденция к ограничению показаний для применения ССП в качестве сосудистого доступа. Это объясняется статистически достоверной меньшей длительностью функционирования ССП и большим количеством необходимых корригирующих процедур в послеоперационном периоде по сравнению с АВФ. Кроме этого, ССП являются серьезным фактором риска в отношении возможных инфекционных осложнений. Поэтому, несмотря на то, что при наличии адекватных (по проходимости и диаметру) магистральных сосудов конечности не существует технических проблем в имплантации ССП, доказано, что функционально пригодная нативная АВФ предпочтительнее сосудистого доступа, созданного с применением синтетических материалов [38–40].
Применение т-ЦВК, получившее распространение в последние годы, является оправданным, а во многих случаях и единственно приемлемым вариантом для проведения ПГД при невозможности или нецелесообразности формирования ПСД у определенной категории пациентов (после исчерпания ресурса нативных сосудов, при наличии противопоказаний к проведению перитонеального диализа, у маленьких детей, у пациентов с выраженным поражением сосудов, дилатационной кардиомиопатией или онкологическими заболеваниями в терминальной стадии). Однако только около 30–50% т-ЦВК остаются функционально пригодными через 1 год, даже с учетом выпол- нения корригирующих вмешательств [3], а частота развития инфекционных осложнений и смертность существенно превышает таковую при формировании АВФ или имплантации ССП [38–40]. Все это не позволяет в полной мере отнести данный вид сосудистого доступа к категории постоянного. Наиболее оправданным является применение т-ЦВК в качестве сосудистого доступа на момент «созревания» АВФ или в раннем послеоперационном периоде после имплантации ССП [18].
В России в этом плане ситуация принципиально не отличается от стран с высокоразвитой структурой по обеспечению заместительной почечной терапии методом ПГД. По данным Российского диализного общества, «следует отметить высокий процент (89,9%) использования нативной артериовенозной фистулы, являющейся оптимальным из имеющихся видов доступа. За 2005–2009 гг. можно отметить тенденцию к увеличению доли больных, имеющих в качестве сосудистого доступа ЦВК, что повышает риск развития инфекционных осложнений и стоимости лечения» [2].
Из нестандартных видов нативных АВФ в некоторых сосудистых центрах раньше формировали так называемые «ретроградные» АВФ, зарекомендовавшие себя, с одной стороны, высокой выживаемостью и возможностью отсрочки применения ССП для создания ПСД, с другой – низкими функциональными показателями (не более 65% АВФ такого типа пригодны к эксплуатации) и большой частотой развития осложнений [4, 21, 34]. Несмотря на хорошие показатели выживаемости «ретроградных» АВФ, подавляющее большинство специализированных сосудистых центров в настоящее время отказались от этого варианта ПСД по причине короткого времени развития серьезных осложнений (резко выраженный синдром венозной гипертензии с трофическими нарушениями, высокий риск инфицирования мягких тканей и возникновения обильных кровотечений).
Поэтому все большее внимание уделяется альтернативным вариантам создания нативных АВФ, при которых может быть обеспечена его длительная эксплуатация при минимальном количестве осложнений.
Метод транспозиции АВФ заключается в формировании ПСД путем перемещения нативных вен (в перспективе фистуль- ных), которые в силу своих топографо-анатомических особенностей (близкого расположения к артерии и нервам или их глубокого расположения) не были бы доступны для гарантированных и безопасных пункций (рис. 1). Таким образом обеспечивается удобное для канюляции положение вены, которая после транспозиции располагается поверхностно и разведена по глубине и проекции с сосудисто-нервным пучком (рис. 2, 3).
На сегодняшний день не вызывает сомнения превосходство транспозированных АВФ над ССП по показателям сохранности функции и безопасности, в плане развития серьезных осложнений [10, 22, 43, 45]. Кроме этого, количество и суммарная стоимость корригирующих вмешательств по поддержанию функции транспозированных АВФ существенно меньше по сравнению с ССП [15, 32, 36, 50]. В частности, среднегодовые финансовые затраты в США (за 2007 год) на одного пациента с АВФ, ССП, ЦВК составили: $59588, $72729, $79364 соответственно. Средние затраты на каждое вмешательство (ангио-пластическое или хирургическое) с целью коррекции осложнения ПСД у тех же групп пациентов составили соответственно $3194, $7451, $5960 [12].
Одноэтапная транспозиция осуществляется следующим образом: выделяется, мобилизуется (с лигированием и пересечением ее притоков) и проводится посредством тоннелера во вновь сформированном подкожном тоннеле будущая фистульная вена, после чего между ней и артерией создается сосудистый анастомоз (рис. 4–6). Одноэтапные транспозиции выполняются на предплечье (рис. 7), плече и бедре.
Для создания нативных АВФ методом транспозиции могут использоваться: на предплечье – v. cephalica и v. basilica , на плече – v. cephalica , v. basilica , v. brachialis , на бедре – v. saphena magna . На руке перемещаемые вены анастамозируются с a. brachialis , на ноге – с a. femoralis .
Протяженность перемещенного участка вены плеча должна быть достаточной для осуществления эффективного гемодиализа, но не максимально возможной, так как с увеличением длины мобилизованного сегмента растет вероятность развития тромбоза, а также дегенеративных изменений сосудистой стенки [49].
Формирование АВФ методом транспозиции может выполняться в один или в два этапа.
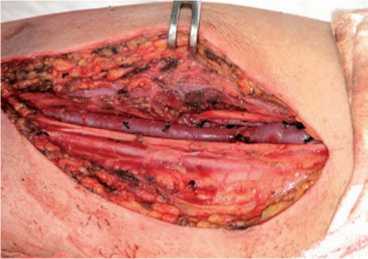
Рис. 1. Мобилизованная «созревшая» v. brachialis в составе сосудисто-нервного пучка на плече (рядом с веной – n. medianus и a. brachialis)
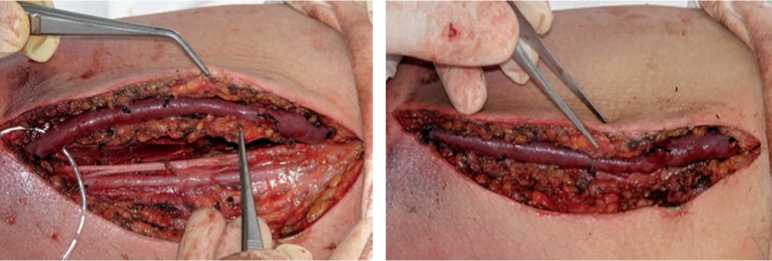
Рис. 2. Перемещение v. brachialis во вновь созданный подкожный тоннель
Рис. 3. Окончательное расположение транспозированной вены
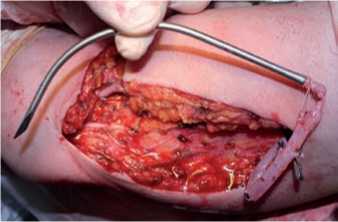
Рис. 4. Вена (v. basilica) мобилизована и присоединена к тоннелеру
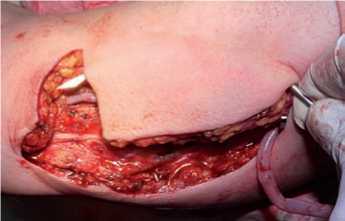
Рис. 5. Проведение вены к артерии в подкожном тоннеле
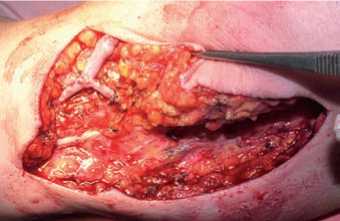
Рис. 6. Анастомоз между a. brachialis и транспозированной v. basilica
При двухэтапных транспозициях первый этап заключается в формировании сосудистого соустья между веной и артерией (рис. 8).
После «созревания» фистульной вены вторым этапом выполняется ее перемещение с формированием нового сосудистого анастомоза между ней и артерией или без такового (рис. 9, 10). Двухэтапные транспозиции выполняются только на плече. Временной интервал между первым и вторым этапом может достигать от 4 до 11 недель [16, 20, 31, 44].
Двухэтапная транспозиция по сравнению с одноэтапной обеспечивает лучшие показатели выживаемости АВФ при меньшем количестве осложнений [23, 25]. Преимущества двухэтапного метода заключаются в том, что мобилизации подвергается уже «созревшая» фистульная вена существенно большего по сравнению с первоначальным диаметром и утолщенной сосудистой стенкой, вследствие этого более устойчивой к трав-матизации при мобилизации вены [6]. Недостатками двухэтапного метода являются большее время до начала использования АВФ, а также высокая стоимость [29, 35].
Наиболее распространенным вариантом транспозиции АВФ является перемещение v. basilica на плече (брахиобазиляр-ная АВФ). В последние годы особый интерес к транспозиции брахиобазилярной АВФ как альтернативному методу создания проксимальной АВФ у пациентов обусловлен публикацией обобщенных рекомендаций по сосудистому доступу [38–40]. По усредненным данным различных авторов, кумулятивная выживаемость брахиобазилярных АВФ через 1 год составляет 72% (в диапазоне 23–95%), через 2 года – 62% (11–86%) [8, 17, 19, 30, 42]. Доли АВФ, непригодных для использования после транспозиции одно- или двухэтапным способом, сопоставимы и составляют 15–21% [37, 46]. Стеноз и тромбоз – наиболее частые осложнения транспозированных АВФ, требующие ангио-пластической или хирургической коррекции [11]. Следует отметить, что в ряде случаев брахиобазилярная АВФ не требует транспозиции, так как может быть функционально пригодной (по протяженности поверхностно расположенного участка фистульной вены) для проведения гемодиализа без выполнения транспозиции.
Транспозицию v. brachialis (брахиобрахиальная АВФ) целесообразно всегда выполнять в два этапа [28]. Вена имеет тонкую венозную стенку, часто недостаточный диаметр, множе- ство коллатералей. Поэтому показатели «созревания» (47–65%) и выживаемости брахиобрахиальных АВФ (через 1 год – 40– 46%) существенно хуже по сравнению с брахиобазилярными [14, 33, 48].
Показанием к транспозиции v. cephalica может являться отсутствие адекватной a. radialis в дистальных отделах предплечья или глубокое расположение вены из-за выраженной подкожной жировой клетчатки.

Рис. 7. Одномоментная транспозиция v. basilica на предплечье
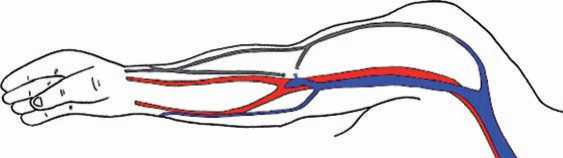
Рис. 8. I этап – анастомоз между a. brachialis и v. intermedia basilica

Рис. 9. II этап – транспозиция v. basilica без формирования нового анастомоза
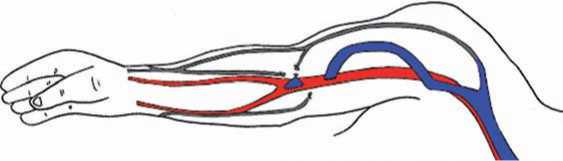
Рис. 10. II этап – транспозиция v. basilica с формированием нового анастомоза
Формирование АВФ на бедре путем транспозиции v. saphena magna получило неоднозначные оценки. Одни считают его приоритетным по отношению к имплантации сосудистых протезов на нижней конечности [13, 26]. Другие полагают, что область применения метода существенно ограничена по причине высокой частоты развития серьезных осложнений (синдром «обкрадывания», сердечная недостаточность, аневризмы и псевдоаневризмы, длительные кровотечения из пункционных отверстий, раневые инфекции), неизбежно развивающихся при эксплуатации этого вида сосудистого доступа и требующих дополнительных реконструктивных вмешательств или ликвидации доступа [5, 7, 24, 27]. Так или иначе, метод на сегодняшний день не получил широкого распространения.
Данные о нашем опыте транспозиции глубоко расположенных вен плеча впервые опубликованы в 2007 году [1]. На 01.06.13 нами выполнено 79 транспозиций вен с целью создания ПСД (37 – v. basilica , 30 – v. brachialis , 12 – v. cephalica ). Кумулятивная 1-годичная выживаемость АВФ составила 75,4%, а причиной утраты функции во всех случаях явился тромбоз. Не было выявлено ни одного осложнения, связанного с инфицированием послеоперационных ран или развитием ишемических нарушений.
Подытоживая опыт исследователей в этой области, можно констатировать, что результаты применения транспозиции АВФ вселяют определенный оптимизм в плане дополнительного обеспечения ПСД методом выполнения технически сложной и дорогостоящей операции, но определяющей клинический успех при минимуме осложнений.
Авторы не имеют конкурирующих интересов.
Список литературы Транспозиция нативной вены - метод выбора при невозможности формирования стандартной артериовенозной фистулы
- Беляев А.Ю. Первоначальный опыт формирования артериовенозных фистул для гемодиализа методом транспозиции вен верхней конечности//Вестник трансплантологии и искусственных органов. 2007. № 6 (38), С. 25-9.
- Бикбов Б.Т., Томилина Н.А. Состояние заместительной терапии больных с хронической почечной недостаточностью в Российской Федерации в 1998-2009 гг. (отчет по данным Российского регистра заместительной почечной терапии)//Нефрология и диализ. 2011. Т 13. № 3. С. 150-264.
- Руководство по диализу/Под ред. Джон Т. Даугирдас, Питер Дж. Блейк, Тодд С. Инг. Пер. с англ. под ред. А.Ю. Денисова и В.Ю. Шило. -Третье издание. -М.: Центр диализа. -Тверь: ООО “Издательство “Триада”, 2003. 744 c.
- Филипцев П.Я., Мойсюк Я.Г., Иванов И.А., Сокольский А.С. Тактика ангиохирургического обеспечения больных на программном гемодиализе (методические рекомендации)//М., МОНИКИ им. М.Ф.Владимирского. 1987. С. 3-14.
- Alcocer F., Perez S., Martinez C. Small skin incision and fistula elevation for hemodialysis using the femoral vein//J Vasc Surg. 2012. 56 (3): 753-6.
- Angle N., Chandra A. The two-stage brachial artery-brachial vein autogenous fistula for hemodialysis: an alternative autogenous option for hemodialysis access//J Vasc Surg. 2005. 42 (4): 806-10.
- Antoniou G.A., Lazarides M.K., Georgiadis G.S. et al. Lower-extremity arteriovenous access for haemodialysis: a systematic review. Eur J Vasc Endovasc Surg. 2009. 38 (3): 365-72.
- Ayez N., van Houten V.A., de Smet A.A. et al. The basilic vein and the cephalic vein perform equally in upper arm arteriovenous fistulae//Eur J Vasc Endovasc Surg. 2012. 44 (2): 227-31.
- Bazan H.A., Schanzer H. Transposition of the brachial vein: a new source for autologous arteriovenous fistulas//J Vasc Surg. 2004. 40 (1): 184-6.
- Basel H., Ekim H., Odabasi D. et al. Basilic vein transposition fistulas versus prosthetic bridge grafts in patients with end-stage renal failure//Ann Vasc Surg. 2011. 25 (5): 634-9.
- Beaulieu M.C., Gabana C., Rose C. et al. Stenosis at the area of transposition -an under-recognized complication of transposed brachiobasilic fistulas//J Vasc Access. 2007. 8 (4): 268-74.
- Best practice in vascular access/Edited by Jan Tordoir. Edizioni Minerva Medica S.p.A. 2010. 177 p.
- Bourquelot P., Rawa M., Van Laere O., Franco G. Long-term results of femoral vein transposition for autogenous arteriovenous hemodialysis access//J Vasc Surg. 2012. 56 (2): 440-5.
- Casey K., Tonnessen B.H., Mannava K. et al. Brachial versus basilic vein dialysis fistulas: a comparison of maturation and patency rates//J Vasc Surg. 2008. 47(2): 402-6.
- Chemla E.S., Morsy M.A. Is basilic vein transposition a real alternative to an arteriovenous bypass graft? A prospective study//Semin Dial. 2008. 21 (4): 352-6.
- Dorobantu L.F., Stiru O., Iliescu V.A., Novelli E. The brachio-brachial arteriovenous fistula: a new method in patients without a superficial venous system in the upper limb//J Vasc Access. 2006. 7 (2): 87-9.
- Dukkipati R., de Virgilio C., Reynolds T., Dhamija R. Outcomes of brachial artery-basilic vein fistula//Semin Dial. 2011. 24 (2): 220-30.
- Ethier J., Mendelssohn D.C., Elder S.J. et al. Vascular access use and outcomes: an international perspective from the dialysis outcomes and practice patterns study//Nephrol Dial Transplant. 2008. 23 (10): 3219-3226.
- Field M., Van Dellen D., Mak D. et al. The brachiobasilic arteriovenous fistula: effect of patient variables//J Vasc Access. 2011. 12 (4): 325-30.
- Francis D.M., Lu Y., Robertson A.J. et al. Two-stage brachiobasilic arteriovenous fistula for chronic haemodialysis access//ANZ J Surg. 2007. 77 (3): 150-5.
- Geis W.P., Giacchino J.L., Iwatsuki S. et al. The reverse fistula for vascular access//Surg Gynecol Obstet. 1977. 145 (6): 901-4.
- Glass C., Porter J., Singh M. et al. A large-scale study of the upper arm basilic transposition for hemodialysis//Ann Vasc Surg. 2010. 24 (1): 85-91.
- Gonzalez E., Kashuk J.L., Moore E.E. et al. Two-stage brachial-basilic transposition fistula provides superior patency rates for dialysis access in a safety-net population//Surgery. 2010. 148 (4): 687-93.
- Gradman W.S., Laub J., Cohen W. Femoral vein transposition for arteriovenous hemodialysis access: improved patient selection and intraoperative measures reduce postoperative ischemia//J Vasc Surg. 2005. 41 (2): 279-84.
- Harper S.J., Goncalves I., Doughman T., Nicholson M.L. Arteriovenous fistula formation using transposed basilic vein: extensive single centre experience//Eur J Vasc Endovasc Surg. 2008. 36 (2): 237-41.
- Hazinedaroglu S.M., Tuzuner A., Ayli D. et al. Femoral vein transposition versus femoral loop grafts for hemodialysis: a prospective evaluation//Transplant Proc. 2004. 36 (1): 65-7.
- Illig K.A., Orloff M., Lyden S.P., Green R.M. Transposed saphenous vein arteriovenous fistula revisited: new technology for an old idea//Cardiovasc Surg. 2002. 10 (3): 212-5.
- Jennings W.C., Howard C.A., Lee F.S., McMurray D. Extending outflow brachial vein length for transposition arteriovenous fistulas//J Vasc Access. 2011. 12 (4): 377-80.
- Kakkos S.K., Haddad G.K., Weaver M.R. et al. Basilic vein transposition: what is the optimal technique?//Eur J Vasc Endovasc Surg. 2010. 39 (5): 612-9.
- Koksoy C., Demirci R.K., Balci D. et al. Brachiobasilic versus brachiocephalic arteriovenous fistula: a prospective randomized study//J Vasc Surg. 2009. 49 (1): 171-177.
- Korkut A.K., Kosem M. Superficialization of the basilic vein technique in brachiobasilic arteriovenous fistula: surgical experience of 350 cases during 4 years period//Ann Vasc Surg. 2010. 24 (6): 762-7.
- Lazarides M.K., Georgiadis G.S., Papasideris C.P. et al. Transposed brachial-basilic arteriovenous fistulas versus prosthetic upper limb grafts: a meta-analysis//Eur J Vasc Endovasc Surg. 2008. 36 (5): 597-601.
- Lioupis C., Mistry H., Chandak P. et al. Autogenous brachial-brachial fistula for vein access. Haemodynamic factors predicting outcome and 1 year clinical data//Eur J Vasc Endovasc Surg. 2009. 38 (6): 770-6.
- Lomonte C., Casucci F., Antonelli M. et al. Autogenous side-to-side brachial-basilic fistulas without vein transposition: a valuable option?//Semin Dial. 2009. 22 (2): 194-8.
- Matsumoto H., Yamamoto E., Kamiya C. et al. Early use of brachial-basilic arteriovenous fistula//J Vasc Access. 2012. 13 (2): 251-5.
- Maya I.D., O'Neal J.C., Young C.J. et al. Outcomes of brachiocephalic fistulas, transposed brachiobasilic fistulas, and upper arm grafts//Clin J Am Soc Nephrol. 2009. 4 (1): 86-92.
- Moossavi S., Tuttle A.B., Vachharajani T.J. et al. Long-term outcomes of transposed basilic vein arteriovenous fistulae//Hemodial Int. 2008. 12 (1): 80-4.
- NKF-DOQI clinical practice guidelines for vascular access//New York, National Kidney Foundation. 1997. 191 p.
- NKF-K/DOQI Clinical Practice Guidelines for Vascular Access: update 2000//Am J Kidney Dis. 2001. 37 (Suppl 1): S137-81.
- NKF-KDOQI Clinical practice guidelines for vascular access//Am J Kidney Dis. 2006. 48 (Suppl 1): S248-S272.
- Oliver M.J., McCann R.L., Indridason O.S. et al. Comparison of transposed brachiobasilic fistulas to upper arm grafts and brachiocephalic fistulas//Kidney Int 2001. 60 (4): 1532-9.
- Paulson K.A., Gordon V., Flynn L., Lorelli D. Modified two-stage basilic vein transposition for hemodialysis access//Am J Surg. 2011. 202 (2): 184-7.
- Pflederer T.A., Kwok S., Ketel B.L., Pilgram T. A comparison of transposed brachiobasilic fistulae with nontransposed fistulae and grafts in the Fistula First era//Semin Dial. 2008. 21 (4): 357-63.
- Reynolds T.S., Zayed M., Kim K.M. et al. A comparison between one-and two-stage brachiobasilic arteriovenous fistulas//J Vasc Surg. 2011. 53 (6): 1632-8.
- Sala Almonacil V., Plaza Martínez A., Zaragozá García J. et al. Comparison between autogenous brachial-basilic upper arm transposition fistulas and prosthetic brachial-axillary vascular accesses for hemodialysis//J Cardiovasc Surg (Torino). 2011. 52 (5): 725-30.
- Syed F.A., Smolock C.J., Duran C. et al. Comparison of outcomes of one-stage basilic vein transpositions and two-stage basilic vein transpositions//Ann Vasc Surg. 2012. 26 (6): 852-7.
- Tordoir J., Canaud B., Haage P. et al. European best practice guidelines (EBPG) on vascular access//Nephrol Dial Transplant. 2007. 22 (Suppl 2): ii88-ii117.
- Torina P.J., Westheimer E.F., Schanzer H.R. Brachial vein transposition arteriovenous fistula: is it an acceptable option for chronic dialysis vascular access?//J Vasc Access. 2008. 9 (1): 39-44.
- Weyde W., Krajewska M., Letachowicz W. et al. A new technique for autogenous brachiobasilic upper arm transposition for vascular access for hemodialysis//J Vasc Access. 2006. 7 (2): 74-6.
- Woo K., Doros G., Ng T., Farber A. Comparison of the efficacy of upper arm transposed arteriovenous fistulae and upper arm prosthetic grafts//J Vasc Surg. 2009. 50 (6): 1405-11.
- Yilmaz M., Senkaya I., Saba D., Bicer M. Long-term outcomes of basilic vein transposition fistula for hemodialysis.//Vasa. 2007. 36 (1): 29-32.


