Трифенилсурьма и пентафенилсурьма - исходные соединения в синтезе фенильных производных пятивалентной сурьмы. Строение трифенилсурьмы, бис(3,4-дифторбензоато)трифенилсурьмы и карбоната тетрафенилсурьмы
Автор: Ефремов Андрей Николаевич, Шарутин Владимир Викторович
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Химия элементоорганических соединений
Статья в выпуске: 2 т.14, 2022 года.
Бесплатный доступ
В настоящей работе уточнено строение трифенилсурьмы (1). Взаимодействием эквимолярных количеств сольвата пентафенилсурьмы (Ph5Sb∙0,5PhH) (2) с 3,4-дифторбензойной кислотой в бензоле получена и структурно охарактеризована бис(3,4-дифторбензоато)трифенилсурьма Ph3Sb[OC(O)C6H3F2-3,4]2 (3). А также уточнено строение триклинной модификации карбоната тетрафенилсурьмы (4). По данным рентгеноструктурного анализа, проведенного при 293 К на автоматическом четырехкружном дифрактометре D8 Quest Bruker (двухкоординатный CCD - детектор, Мо Kα-излучение, λ = 0,71073 Å, графитовый монохроматор), кристаллы характеризуются: C36H30Sb2 (1), M 706,10; сингония триклинная, группа симметрии Р1 ; параметры ячейки: a = 10,941(11), b = 11,825(16), c = 13,747(13) Å; a = 102,57(5)°, β = 104,22(5)°, g = 108,35(6)°; V = 1550(3) Å3; Z = 2; размер кристалла 0,5 × 0,44 × 0,11 мм; интервалы индексов отражений -13 ≤ h ≤ 14, -15 ≤ k ≤ 15, -17 ≤ l ≤ 17; всего отражений 37455; независимых отражений 6837; Rint 0,0252; GOOF 1,121; R1 = 0,0257, wR2 = 0,0605; остаточная электронная плотность -0,84/0,23 e/Å3; C32H21O4F4Sb (3), M 667,24; сингония моноклинная, группа симметрии С2/с; параметры ячейки: a = 12,652(5), b = 22,466(10), c = 11,561(5) Å; β = 120,027(15)°; V = 2845(2) Å3; Z = 4; размер кристалла 0,5×0,45×0,12 мм; интервалы индексов отражений -16 ≤ h ≤ 16, -28 ≤ k ≤ 28, -14 ≤ l ≤ 14; всего отражений 27275; независимых отражений 3163; Rint 0,029; GOOF 1,107; R1 = 0,0372, wR2 = 0,1058; остаточная электронная плотность 1,61/-0,53 e/Å3; C49H40O3Sb2 (4), M 920,31; сингония триклинная, группа симметрии Р1 ; параметры ячейки: a = 10,093(4), b = 13,994(5), c = 15,665(6) Å; a = 73,917(15)°, β = 79,76(2)°, g = 74,312(15)°; V = 2034,0(13) Å3; Z = 2; размер кристалла 0,26 × 0,22 × 0,05 мм; интервалы индексов отражений -12 ≤ h ≤ 12, -17 ≤ k ≤ 17, -20 ≤ l ≤ 20; всего отражений 50553; независимых отражений 9006; Rint 0,0333; GOOF 1,066; R1 = 0,0239, wR2 = 0,0522; остаточная электронная плотность -0,43/0,77 e/Å3. Атомы сурьмы в 3 имеют искаженную тригонально-бипирамидальную координацию с атомами кислорода в аксиальных положениях (угол OSbO - 174,13(12)°, расстояния Sb-С и Sb-O составляют 2,101(3)-2,118(4) Å и 2,118(3) Å). Структурная организация в кристаллах 3 и 4 обусловлена слабыми межмолекулярными контактами типа О···Н-C 2,49 и 2,56 Å соответственно. Полные таблицы координат атомов, длин связей и валентных углов депонированы в Кембриджском банке структурных данных (№ 2117872 для 1, № 2121388 для 3, № 2121833 для 4; deposit@ccdc.cam.ac.uk; http://www.ccdc.cam.ac.uk).
Сольват, пентафенилсурьма, бензол, бис(3, 4-дифторбензоато)трифенилсурьма, синтез, строение, трифенилсурьма, карбонат тетрафенилсурьмы, рентгеноструктурный анализ
Короткий адрес: https://sciup.org/147237503
IDR: 147237503 | УДК: 546.865+547.47+548.312.5
Текст научной статьи Трифенилсурьма и пентафенилсурьма - исходные соединения в синтезе фенильных производных пятивалентной сурьмы. Строение трифенилсурьмы, бис(3,4-дифторбензоато)трифенилсурьмы и карбоната тетрафенилсурьмы
В основе одного из эффективных способов синтеза соединений пятивалентной сурьмы лежит реакция окислительного присоединения, когда из триарильных соединений сурьмы, кислоты НХ и пероксида получают арильные производные пятивалентной сурьмы Ar 3 SbX 2 . Указанная реакция впервые была осуществлена на примере синтеза диацетата трифенилсурьмы из трифенил-сурьмы, уксусной кислоты и пероксида водорода [1]. Именно по этой схеме были синтезированы дикарбоксилаты трифенилсурьмы [2], диоксиматы трифенилсурьмы [3] и другие производные пятивалентной сурьмы общей формулы Ph 3 SbX 2 [4].
Строение базового реагента для получения фенильных производных пятивалентной сурьмы ранее изучалось [5], однако только в настоящей работе удалось выполнить наиболее точное ис- следование особенностей структуры трифенилсурьмы (1). По данным рентгеноструктурного анализа, атомы сурьмы в двух кристаллографически независимых молекулах трифенилсурьмы имеют тетрагональную координацию с атомами углерода фенильных заместителей и неподеленной электронной парой в вершинах тетраэдра (рис. 1, табл. 1). Длины связей Sb–C и величины углов CSbC равны 2,148(3)-2,166(3) А и 95,12(13)°-97,87(11)° соответственно.
Рис. 1. Строение соединения 1
Не менее важным соединением в химии фенильных производных сурьмы является пента-фенилсурьма ( 2 ), синтез которой впервые был описан в 1952 году [6], а особенности ее строения – несколько позже [7–10]. Известно, что пентафенилсурьма является прекурсором для получения многочисленных фенильных производных пятивалентной сурьмы [4]. Как правило, одноосновные карбоновые кислоты легко отщепляют одну фенильную группу в 2 [11–15] с образованием карбоксилатов тетрафенилсурьмы, которые, в свою очередь, образуют с кислотами аддукты Ph4SbOC(O)R∙HOC(O)R [16]. Реакции дикарбоновых кислот в зависимости от соотношения исходных реагентов могут сопровождаться замещением одного или двух активных атомов водорода в карбоксильных группах [17–19].
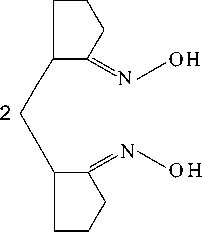
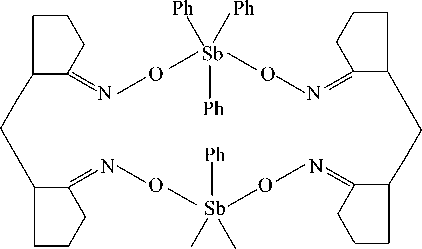
Показано, что взаимодействие диоксима метилендициклопентанона-2,2’ с пентафенилсурь-мой в жестких условиях (90 ° С, 5 ч) при мольном соотношении исходных реагентов 1:2 соответственно приводит к образованию макроциклического сурьмаорганического соединения - бис -р, - [(метилендициклопентанон-2,2’-диоксимато)трифенилсурьмы], в молекулах которого симметричные диоксимные радикалы чередуются со структурными блоками трифенилсурьмы [20].
Ph Ph
В настоящей работе описан подобный случай отщепления 3,4-дифторбензойной кислотой двух фенильных заместителей от пентафенилсурьмы с образованием бис (3,4-дифторбензоато)трифенилсурьмы. Несмотря на эквимолярное соотношение исходных реагентов, продуктом реакции являлась бис (3,4-дифторбензоато)трифенилсурьма ( 3 ).
Ph 5 Sb + 2 HOC(O)C 6 H 3 F 2 -3,4 ^ Ph 3 Sb[OC(O)C 6 H 3 F 2 -3,4] 2 + 2 PhH
В ИК-спектре соединения 3 наблюдается полоса поглощения средней интенсивности валентных колебаний связей Sb–C при 428 см–1. Наличие карбонильной группы характеризуется присутствием полосы поглощения валентных колебаний связи С=О сильной интенсивности при 1634 см–1. Полосы поглощения, характеризующие колебания ν(С–О) в карбоксилатных лигандах, наблюдаются при 1333 см–1. ИК-спектр соединения 3 также содержит характерные полосы валентных колебаний углеродного скелета ароматических фрагментов: 1508, 1481, 1425 см–1. Валентным колебаниям связей C Ar –H отвечает полоса поглощения средней интенсивности при 3022 см–1, внеплоскостным деформационным колебаниям этих же связей – полосы при 823, 794 и 758 см–1, плоскостным деформационным колебаниям – полосы при 1113, 1065 и 1022 см–1 [21–23].
По данным РСА, в центросимметричных молекулах соединения 3 атомы сурьмы имеют искаженную тригонально-бипирамидальную координацию с атомами кислорода карбоксилатных лигандов в аксиальных положениях (рис. 3).
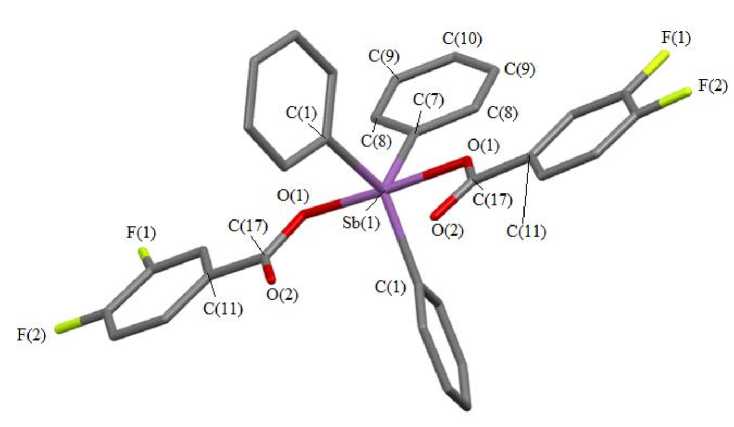
Рис. 2. Строение соединения 3 (атомы водорода не показаны)
Сумма углов CSbC в экваториальной плоскости молекулы составляет 359,96(11)°, аксиальный угол OSbO равен 174,13(12)°, атом сурьмы не выходит из экваториальной плоскости. Конформация арильных лигандов по отношению к экваториальной плоскости [С 3 ] пропеллерная. Двугранные углы между плоскостями бензольных колец и экваториальной плоскостью составляют 20,20° [C(1)–C(6)], 78,01° [C(7)–C(10)]. Длины связей Sb–C имеют близкие значения: 2,101(3), 2,118(4) Å, а расстояния Sb–O (2,118(3) Å) соизмеримы с ковалентными длинами связей Sb–O (2,05 Å [24]). Плоскости карбоксильных групп практически компланарны (угол между ними составляет 5,24 ° ), а карбоксилатные лиганды в молекулах 3 расположены таким образом, что внутримолекулярные контакты Sb—O(=C) формируются внутри наибольшего экваториального угла СSbC (137,6(2) ° ), что характерно для большинства структурно охарактеризованных дикарбоксилатов триарилсурьмы [5]. Бидентатные карбоксилатные лиганды координируют на атом металла симметрично, при этом внутримолекулярные расстояния Sb—O(=C) равны 3,014(5) А, что меньше суммы ван-дер-ваальсовых радиусов атомов Sb и O (3,58 Å [25]).
Пентафенилсурьма способна реагировать с кислородом [26] и углекислым газом [27]. Выделенный в последней работе карбонат бис(тетрафенилсурьмы) способен реагировать с солями тетрафенилстибония, присоединяя еще один катион за счет изменения структурной функции карбонатной группы с μ2-хелатно-мостиковой на μ3-мостиковую, с образованием ионных комплексов с трис(тетрафенилстибокси)метилий-катионом [28]. Так, при кристаллизации продуктов реакций пентафенилсурьмы с 2,4-динитробензолсульфоновой кислотой из смеси бензол–октан на воздухе наряду с целевым продуктом – 2,4-динитробензолсульфонатом тетрафенилсурьмы – с выходом 32 % выделен сольват ионного комплекса сурьмы с трехкоординированным атомом углерода в катионе [(Ph4SbO)3C]+[OSO2C6H3(NO2)2-2,4]– ⋅ 3PhH. Катион имеет практически плоский цен- тральный фрагмент СO3Sb3. Углы ОСО и COSb близки к 120°, связи C–O изменяются в интервале 1,277(4)–1,290(3) Å, расстояния Sb–O [2,266(2)–2,299(2) Å] превышают сумму ковалентных радиусов атомов сурьмы и кислорода. Минорным продуктом реакции является карбонат бис(тетрафенилсурьмы) (4), из которого, как полагают авторы, и образуется ионный комплекс, поэтому интересно было изучить структуру карбоната тетрафенилсурьмы более тщательно.
В настоящей работе уточнена структура триклинной модификации карбоната тетрафенил-сурьмы 4 , которая ранее была установлена с точностью R = 4,9 % в работе [29]. Результаты нашего исследования кристалла 4 были более точными (R = 3,7 %), чем в работе [28]. Координационные полиэдры двух атомов сурьмы в 4 различны: один из атомов сурьмы имеет тригонально-бипирамидальное окружение (OSbC акс 176,38(8)°), другой – искаженное октаэдрическое ( транс углы CSbО 154,59(8), 157,47(8)° (рис. 3).
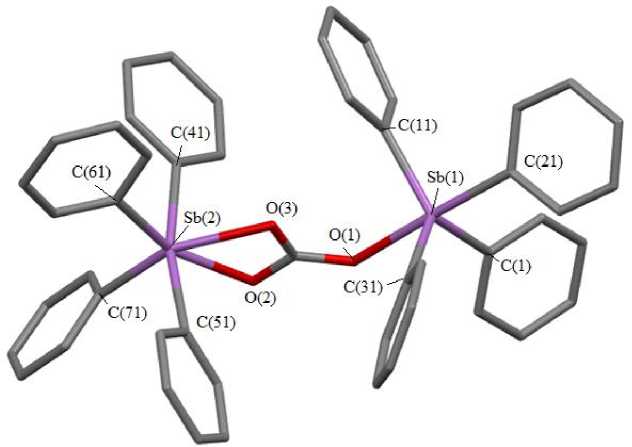
Рис. 3. Строение соединения 4 (атомы водорода не показаны)
Интервалы изменения длин связей Sb–C в структуре 4 составляют 2,0992(15)–2,634(2) Å, а расстояния Sb–О равны 2,1844(17)–2,3104(17) Å, что больше суммы ковалентных радиусов указанных элементов [27]. Длины связей C–O в карбонатных группах составляют 1,281(3); 1,277(3); 1,296(3) Å, при этом более короткой связи Sb–О соответствует более длинная связь С–О.
Экспериментальная часть
Сольват пентафенилсурьмы с бензолом Ph 5 Sb∙½PhH (2). После перекристаллизации пен-тафенилсурьмы из бензола получили бесцветные кристаллы с т. разл. 135,5 °С. Найдено: C 72,41; H 5,19. C 32 H 21 O 4 F 4 Sb. Вычислено: C 72,49; H 5,13.
Синтез бис (3,4-дифторбензоато)трифенилсурьмы Ph 3 Sb[OC(O)C 6 H 3 F 2 -3,4] 2 (3) . Смесь 0,150 г (0,27 ммоль) сольвата пентафенилсурьмы с бензолом и 0,043 г (0,27 ммоль) 3,4-дифторбензойной кислоты в 10 мл бензола нагревали 5 минут при 80 С, охлаждали до комнатной температуры и добавляли 2 мл октана. Через 24 ч выделяли 0,06 г (41 %) бесцветных кристаллов 3 с т. разл. 134 °С. ИК-спектр ( ν , см–1): 3022, 2953, 1634, 1599, 1508, 1481, 1425, 1333, 1273, 1227, 1200, 1113, 1065, 1023, 997, 937, 901, 839, 802, 779, 770, 733, 692, 638,546, 489, 451, 428. Найдено: C 57,37; H 3,21. C 32 H 21 O 4 F 4 Sb. Вычислено: C 57,55; H 3,15.
Элементный анализ на C и H выполнен на элементном анализаторе Carlo Erba CHNS-O EA 1108. Температуры плавления измерены на синхронном термоанализаторе Netzsch 449C Jupiter (рис. 4).
ИК-спектр соединения 3 записывали на ИК-Фурье спектрометре Shimadzu IRAffinity-1S в таблетке KBr в области 4000–400 см–1.
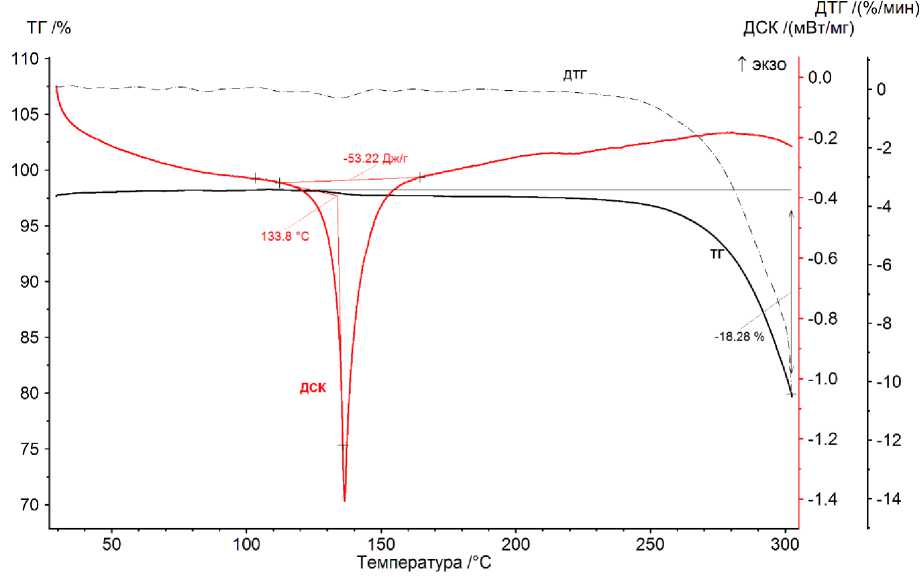
Рис. 4. Кривые ДТГ и ДСК для образца 3
Рентгеноструктурный анализ ( РСА ) кристаллов проведен на автоматическом четырехкружном дифрактометре D8 QUEST фирмы Bruker (Mo K α -излучение, λ = 0,71073 Å, графитовый монохроматор). Сбор, редактирование данных и уточнение параметров элементарной ячейки, а также учет поглощения проведены с помощью программ SMART и SAINT-Plus [30]. Все расчеты по определению и уточнению структур выполнены с помощью программ SHELXL/PC [31], OLEX2 [32]. Структуры определены прямым методом и уточнены методом наименьших квадратов в анизотропном приближении для неводородных атомов. Положение атомов водорода уточняли по модели наездника ( U изо (H) = 1,2 U экв (C)). Кристаллографические данные и результаты уточнения структур приведены в табл. 1, геометрические характеристики координационного полиэдра атома сурьмы – в табл. 2.
Таблица 1
Кристаллографические данные, параметры эксперимента и уточнения структур 1, 3, 4
|
Параметр |
1 |
3 |
4 |
|
Формула |
C 36 H 30 Sb 2 |
C 32 H 21 O 4 F 4 Sb |
C 49 H 40 O 3 Sb 2 |
|
М |
706,10 |
667,24 |
920,31 |
|
Т , К |
293 |
293 |
293 |
|
Сингония |
Триклинная |
Моноклинная |
Триклинная |
|
Пр. группа |
P 1 |
C2/c |
P 1 |
|
a , Å |
10,941(11) |
12,652(5) |
10,093(4) |
|
b, Å |
11,825(16) |
22,466(10) |
13,994(5) |
|
c, Å |
13,747(13) |
11,561(5) |
15,665(6) |
|
α ,º |
102,57(5) |
90,00 |
73,917(15) |
|
β,º |
104,22(5) |
120,027(15) |
79,76(2) |
|
γ ,º |
108,35(6) |
90,00 |
74,312(15) |
|
V , Å3 |
1550(3) |
2845(2) |
2034,0(13) |
|
Z |
2 |
4 |
2 |
|
ρ (выч.), г/см3 |
1,513 |
1,558 |
1,503 |
|
µ , мм–1 |
1,764 |
1,032 |
1,369 |
|
F (000) |
696,0 |
1328,0 |
920,0 |
Окончание табл. 1
|
Параметр |
1 |
3 |
4 |
|
Размер кристалла, мм |
0,5 × 0,44 × 0,11 |
0,5 × 0,45 × 0,12 |
0,26 × 0,22 × 0,05 |
|
Область сбора данных по 2 θ , град. |
5,74–54,42 |
6,6–54,32 |
5,802–54,44 |
|
Интервалы индексов отражений |
–13 ≤ h ≤ 14, –15 ≤ k ≤ 15, –17 ≤ l ≤ 17 |
–16 ≤ h ≤ 16, –28 ≤ k ≤ 28, –14 ≤ l ≤ 14 |
–12 ≤ h ≤ 12, –17 ≤ k ≤ 17, –20 ≤ l ≤ 20 |
|
Измерено отражений |
37455 |
27275 |
50553 |
|
Независимых отражений |
6837 |
3163 |
9006 |
|
R int |
0,0252 |
0,0291 |
0,0333 |
|
Переменных уточнения |
343 |
187 |
477 |
|
GOOF |
1,121 |
1,107 |
1,066 |
|
R -факторы по F 2 > 2 σ ( F 2) |
R 1 = 0,0257, wR 2 = 0,0605 |
R 1 = 0,0372, wR 2 = 0,1058 |
R 1 = 0,0239, wR 2 = 0,0522 |
|
R -факторы по всем oтражениям |
R 1 = 0,0330, wR 2 = 0,0652 |
R 1 = 0,0425, wR 2 = 0,1124 |
R 1 = 0,0349, wR 2 = 0,0572 |
|
Остаточная электронная плотность (min/max), e/A3 |
–0,84/0,23 |
–0,53/1,61 |
–0,43/0,77 |
Таблица 2
|
Связь |
d , Å |
Угол |
ω , град. |
|
1 |
|||
|
Sb(1)–С(1) |
2,163(3) |
С(11)Sb(1)С(1) |
95,87(11) |
|
Sb(1)–С(11) |
2,155(3) |
C(11)Sb(1)C(21) |
95,55(11) |
|
Sb(1)–С(21) |
2,158(4) |
C(21)Sb(1)C(1) |
97,46(14) |
|
Sb(2)–С(51) |
2,148(3) |
C(51)Sb(2)C(31) |
97,65(12) |
|
Sb(2)–С(31) |
2,165(3) |
C(51)Sb(2)С(41) |
95,12(13) |
|
Sb(2)–С(41) |
2,166(3) |
C(31)Sb(2)С(41) |
95,43(12) |
|
3 |
|||
|
Sb(1)–O(1) |
2,118(3) |
O(1)Sb(1)O(11) |
174,13(12) |
|
Sb(1)–O(11) |
2,118(3) |
C(11)Sb(1)C(7) |
111,18(11) |
|
Sb(1)–С(7) |
2,118(4) |
C(1)Sb(1)С(7) |
111,18(11) |
|
Sb(1)–С(1) |
2,101(3) |
C(11)Sb(1)С(1) |
137,6(2) |
|
Sb(1)∙∙∙O(2) |
3,014(5) |
C(1)Sb(1)O(11) |
91,87(13) |
|
Преобразования симметрии: 12- X , +y, 3/2-z |
|||
|
4 |
|||
|
Sb(1)–C(31) |
2,117(3) |
C(31)Sb(1)C(1) |
115,22(11) |
|
Sb(1)–O(1) |
2,2505(17) |
C(11)Sb(1)C(1) |
116,55(9) |
|
Sb(1)–C(1) |
2,119(2) |
C(21)Sb(1)O(1) |
176,38(8) |
|
Sb(1)–С(11) |
2,0992(15) |
C(51)Sb(2)С(41) |
167,09(9) |
|
Sb(1)–С(21) |
2,168(3) |
C(71)Sb(2)O(3) |
154,59(8) |
|
Sb(2)–O(3) |
2,3104(17) |
C(71)Sb(2)C(7) |
125,66(8) |
|
Sb(2)–O(2) |
2,1844(17) |
C(61)Sb(2)O(2) |
157,47(8) |
|
Sb(2)–C(51) |
2,169(2) |
C(61)Sb(2)C(51) |
92,76(10) |
|
Sb(2)–C(71) |
2,162(2) |
C(61)Sb(2)C(71) |
106,18(10) |
|
Sb(2)–C(7) |
2,634(2) |
C(61)Sb(2)C(7) |
128,14(9) |
|
Sb(2)–С(61) |
2,162(3) |
C(61)Sb(2)С(41) |
91,79(10) |
|
Sb(2)–С(41) |
2,173(2) |
C(41)Sb(2)С(7) |
84,92(8) |
Длины связей и валентные углы в соединениях 1, 3 , 4
Полные таблицы координат атомов, длин связей и валентных углов депонированы в Кембриджском банке структурных данных (№ 2117872 для 1, 2121388 для 3, 2121833 для 4; ; .
Выводы
Взаимодействием эквимолярных количеств сольвата пентафенилсурьмы (Ph5Sb∙0,5PhH) с 3,4-дифторбензойной кислотой в бензоле получена и структурно охарактеризована бис (3,4-дифторбензоато)трифенилсурьма Ph 3 Sb[OC(O)C 6 H 3 F 2 -3,4] 2 . Уточнено строение трифенилсурьмы и триклинной модификации карбоната тетрафенилсурьмы.
Финансирование работы
Работа выполнена при финансовой поддержке РФФИ в рамках научного проекта № 20-3390099.
Список литературы Трифенилсурьма и пентафенилсурьма - исходные соединения в синтезе фенильных производных пятивалентной сурьмы. Строение трифенилсурьмы, бис(3,4-дифторбензоато)трифенилсурьмы и карбоната тетрафенилсурьмы
- Improved Methods for the Sinthesis of Antimony Triacetate, Triphenylantimonyldiacetate and Pentaphenylantimony / T.C. Thepe, R.J. Garascia, M.A. Selvoski et al. // Ohio J. Sci. - 1977. - V. 77, № 3. - P. 134-135.
- Синтез и строение бис(1-адамантанкарбоксилото)трифенилсурьмы / В.В. Шарутин, О.К. Шарутина, А.П. Пакусина и др. // Журн. неорг. химии. - 2008. - Т. 53, № 8. - С. 1335-1341.
- Шарутин, В.В. Синтез и строение салицилальдоксиматов тетра- и трифенилсурьмы / В.В. Шарутин, О.К. Шарутина, О.В. Молокова // Журн. неорг. химии. - 2012. - Т. 57, № 6. - С. 902.
- Шарутин, В.В. Синтез, реакции и строение арильных соединений пятивалентной сурьмы / B.В. Шарутин, А.И. Поддельский, О.К. Шарутина // Коорд. химия. - 2020. - Т. 46, № 10. - C. 579-648. DOI: 10.31857/S0132344X20100011.
- Cambridge Crystallografic Datebase. Release 2020. Cambridge. deposit@ccdc.cam.ac.uk; http: //www .ccdc.cam.ac.uk
- Wittig, G. Pentaphenyl-arsen und Pentaphenyl-antimon / G. Wittig, K. Clauss // Europ. J. Org. Chem. - 1952. - Bd. 577. - S. 26-39. DOI:10.1002/JLAC.19525770104.
- Wheatley, P.J. An X-ray Diffraction Determination of the Crystal and Molecular Structure of Pentaphenylantimony / P.J. Wheatley // J. Chem. Soc. - 1964. - № 718. - P. 3718-3723. DOI: 10.1039/JR9640003718.
- Beauchamp, A.L. A Reinvestigation of the Crystal and Molecular Structure of Pentaphenylantimony / A.L. Beauchamp, M.J. Bennett, F.A. Cotton // J. Am. Chem. Soc. - 1968. - V. 90. - P. 66756680. DOI: 10.1021/ja01026a020.
- Brabant, C. Structure Crystalline du Pentaphenylantimone Dans le Solvate Cycljhexanique (C6H5)5Sb • У C6H12 / C. Brabant, B. Blanck, A.L. Beauchamp // J. Organomet. Chem. - 1974. -V. 82. - P. 231-234. DOI: 10.1016/S0022-328X(00)90360-7.
- Geometry of Pentaphenylantiminy in Solution: Support for a Trigonal Bipyramidal Assignment from X-ray Absorption Spectroscopy and Vibrational Spectroscopic Data / B. Lindquist-Kleissler, M. Weng, P. Le Magueres et al. // Inorg. Chem. - 2021. - V. 60. - P. 8566-8574. DOI: 10.1021/acs.inorgchem.1c00496.
- Синтез и строение 1-адамантанкарбоксилата тетрафенилсурьмы и бис(1- адамантанкар-боксилата) трифенилсурьмы / В.В. Шарутин, В.С. Сенчурин, О.К. Шарутина и др. // Журн. общ. химии. - 2009. - Т. 79, №. 10. - С. 1636-1643.
- Шарутин, В.В. Синтез и строение N-бензоилглицината тетрафенилсурьмы. / B.В. Шарутин, О.К. Шарутина, К.А. Хныкина // Журн. неорган. химии. - 2016. - Т. 61, № 2. - C. 192-194. DOI: 10.7868/S0044457X16020197.
- Шарутин, В.В. Синтез и строение фенилпропионатов тетра- и трифенилсурьмы / B.В. Шарутин, О.К. Шарутина, А.Р. Котляров // Журн. неорган. химии. - 2015. - Т. 60, № 4. - C. 525-528. DOI: 10.7868/S0044457X15040236.
- Шарутин, В.В. Синтез и строение 4-оксибензоатов тетра- и трифенилсурьмы / B.В. Шарутин, О.К. Шарутина, В.С. Сенчурин // Журн. неорган. химии. - 2014. - Т. 59, № 9. - C. 1182-1186. DOI: 10.7868/S0044457X14090189.
- Синтез и строение кислого фталата тетрафенилсурьмы / В.В. Шарутин, О.К. Шарутина, И.Г. Мельникова и др. // Изв. РАН. Сер. хим. - 1996. - № 8. - С. 2082-2085.
- Синтез и строение аддуктов нитрата тетрафенилсурьмы с азотной кислотой и ацетата тетрафенилсурьмы с уксусной кислотой / В.В. Шарутин, В.С. Сенчурин, О.К. Шарутина и др. // Журн. неорган. химии. - 2008. - Т. 53, № 7. - С. 1194-1198.
- Шарутин, В.В. Синтез и строение кислого малоната татрафенилсурьмы / В.В. Шарутин, В.С. Сенчурин, О.К. Шарутина // Журн. неорг. химии. - 2014. - Т. 59, № 2. - С. 247. DOI: 10.7868/S0044457X14020184.
- Шарутин, В.В. Синтез и строение сукцината, малата и тартрата бис(тетрафенилсурьмы) / В.В. Шарутин, О.К. Шарутина // Коорд. химия. - 2014. - Т. 40, № 9. - С. 559. DOI: 10.7868/S0132344X14090072.
- Sharutin, V.V. Interaction of Pentaphenylantimony with Acetylenedicarboxylic Acid. Molecular Structure of Bis(tetraphenylantimony) Acetylenedicarboxilate / V.V. Sharutin, O.K. Sharutina, Yu.O. Gubanova // Вестник ЮУрГУ. Серия «Химия». - 2015. - Т. 7, № 4. - С. 17-22. DOI: 10.14529/chem150403
- Cnm^ и строение бис-ц-[(метилендициклопентанон-2,2'-диоксимато)трифенилсурьмы] / B.В. Шарутин, О.В. Молокова, О.К. Шарутина и др. // Коорд. химия. - 2005. - Т. 31, № 3. - C.172-176.
- Тарасевич, Б.Н. ИК-спектры основных классов органических соединений / Б.Н. Тарасевич. - М.: МГУ, 2012. - 54 с.
- Инфракрасная спектроскопия органических и природных соединений: учебное пособие / А.В. Васильев, Е В. Гриненко, А О. Щукин и др. - СПб.: СПбГЛТА, 2007. - 54 с.
- Spectral Database for Organic Compounds, SDBS. Release 2021. National Institute of Advanced Industrial Science and Technology.
- Covalent Radii Revisited / B. Cordero, V. Gómez, A.E. Platero-Prats et al. // Dalton Trans. -2008. - V. 21. - P. 2832-2838. DOI: 10.1039/B801115J.
- Consistent van der Waals Radii for the Whole Main Group / M. Mantina, A.C. Chamberlin, R. Valero et al. // J. Phys. Chem. A. - 2009. - V. 113, № 19. - P. 5806-5812. DOI: 10.1021/jp8111556.
- Синтез, строение и реакции ц-оксо-бис(тетрафенилсурьмы) / В.В. Шарутин, О.К. Шарутина, В.С. Сенчурин и др. // Коорд. химия. - 2001. - Т. 27, № 9. - C. 710-716.
- Карбонат тетрафенилсурьмы. Синтез и строение / В.В. Шарутин, О.К. Шарутина, Т.П. Платонова и др. // Журн. общ. химии. - 2001. - Т. 71, № 10. - С. 1637-1640.
- Шарутин, В.В. Арильные сурьмаорганические производные трехкоординированного углерода / В.В. Шарутин, О.К. Шарутина, А.Н. Ефремов // Журн. неорган. химии. - 2020. - Т. 65, № 1. - С. 49-55. DOI: 10.31857/S0044457X20010158.
- Ferguson, G. The Crystal and Molecular Structure of ^-Carbonato-bis(tetraphenylantimony): a System Containing Penta- and Hexacoordinated Antimony / G. Ferguson, D.M. Hawley // Acta Cryst. -1974. - V. 30. - P. 103-111. DOI: 10.1107/S0567740874002299.
- Bruker. SMART and SAINT-Plus. Versions 5.0. Data Collection and Processing Software for the SMART System. Bruker AXS Inc., Madison, Wisconsin, USA, 1998.
- Bruker. SHELXTL/PC. Versions 5.10. An Integrated System for Solving, Refining and Displaying Crystal Structures from Diffraction Data. Bruker AXS Inc., Madison, Wisconsin, USA, 1998.
- OLEX2: Complete Structure Solution, Refinement and Analysis Program / O.V. Dolomanov, L.J. Bourhis, R.J. Gildea et al. // J. Appl. Cryst. - 2009. - V. 42. - P. 339-341. DOI: 10.1107/S0021889808042726.


