Тромбоэмболия легочной артерии при наличии синдрома хронической сердечной недостаточности: особенности структурно-функционального состояния сердечно-сосудистой системы
Автор: Статкевич Т.В., Митьковская Н.П., Балыш Е.М., Ромбальская А.Р., Петрова Е.Б., Моклая Е.В., Левкович И.Э.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 2 т.35, 2020 года.
Бесплатный доступ
Цель исследования: установить особенности структурно-функционального состояния сердечно-сосудистой системы пациентов с тромбоэмболией легочной артерии (ТЭЛА) при наличии синдрома хронической сердечной недостаточности (ХСН).Материал и методы. В исследование включен 231 пациент с диагнозом ТЭЛА, выставленным при поступлении в стационар. В дальнейшем пациенты были разделены на подгруппы в зависимости от верификации диагноза методом компьютерной томографии и наличия синдрома ХСН.Результаты и обсуждение. Резкое увеличение давления в системе легочной артерии (ЛА) способствует формированию и усугублению правожелудочковой систолической дисфункции, которая в условиях наличия ХСН приобретает большую распространенность и степень выраженности, что подтверждается эхокардиографическими признаками дисфункции правых отделов сердца: большими значениями линейных размеров правых отделов сердца, индекс объема правого предсердия составил 32,3 (29,4-37,9) мл/м2 против 29,1 (26,6-32,3) мл/м2 (U = 1583,00, p
Тромбоэмболия легочной артерии, венозные тромбоэмболические осложнения, хроническая сердечная недостаточность, сердечно-сосудистая система
Короткий адрес: https://sciup.org/149126171
IDR: 149126171 | УДК: 616.131-005.755-02: | DOI: 10.29001/2073-8552-2020-35-2-114-122
Текст научной статьи Тромбоэмболия легочной артерии при наличии синдрома хронической сердечной недостаточности: особенности структурно-функционального состояния сердечно-сосудистой системы
–122
Тромбоэмболия легочной артерии (ТЭЛА), распространенное сердечно-сосудистое заболевание с высоким риском летального исхода, является одной из трех основных причин сердечно-сосудистой смертности после инфаркта миокарда и инсульта. Заболевание требует быстрой диагностики и начала терапии часто в условиях гемодинамической нестабильности пациентов. Риск развития ТЭЛА прогрессивно увеличивается с возрастом, и в настоящее время в клинической практике закономерно возрастает количество пациентов с ТЭЛА и сопутствующей терапевтической патологией [1, 2].
Одной из ключевых концепций ведения пациентов с ТЭЛА на современном этапе является мультидисципли-нарный подход и создание многопрофильных команд для оптимизации диагностических и лечебных подходов. В отношении ТЭЛА преимущество данной концепции связано с чрезвычайной гетерогенностью клинических проявлений: от бессимптомного течения до остановки сердца, разноплановостью характера предрасполагающих факторов, различными терапевтическими стратегиями для пациентов, относящихся к определенным группам риска, а также с высоким уровнем коморбидности. Командная работа с привлечением нескольких экспертов для выработки оптимального, скоординированного и всестороннего плана ведения для каждого пациента с ТЭЛА требует учета сопутствующей патологии, которая может влиять на процессы диагностики и лечения [3–6].
Госпитализация по причине хронической сердечной недостаточности (ХСН) рассматривается как значимый предрасполагающий фактор ТЭЛА. Наличие у пациентов с ТЭЛА синдрома ХСН может маскировать клиническую картину и, соответственно, влияет на процесс диагностики. Чувствительность лабораторных маркеров, определяющих прогноз венозных тромбоэмболических осложнений, также напрямую зависит от наличия синдрома ХСН. В дополнение, обозначенная комор-бидность повышает риск неблагоприятных исходов, осложнений и увеличивает продолжительность госпитализации [2, 7–9].
Таким образом, наличие синдрома ХСН у пациентов с ТЭЛА, с одной стороны, может повышать риск развития венозных тромбоэмболических осложнений, с другой стороны, создает новую клиническую ситуацию, требующую учета ее патофизиологических особенностей при выборе лечебно-диагностической и превентивной тактики [2, 10].
Материал и методы
Цель исследования: установить особенности структурно-функционального состояния сердечно-сосудистой системы пациентов с ТЭЛА при наличии синдрома ХСН.
В исследование были включены пациенты, госпитализированные в учреждения здравоохранения г. Минска в течение 2017–2018 гг. и имеющие в качестве первичного диагноза ТЭЛА ( n = 231).
В дальнейшем пациенты были разделены на подгруппы в зависимости от верификации диагноза методом мультиспиральной компьютерной томографии (МСКТ) с контрастированием легочной артерии (ЛА) и наличия синдрома ХСН (рис. 1).
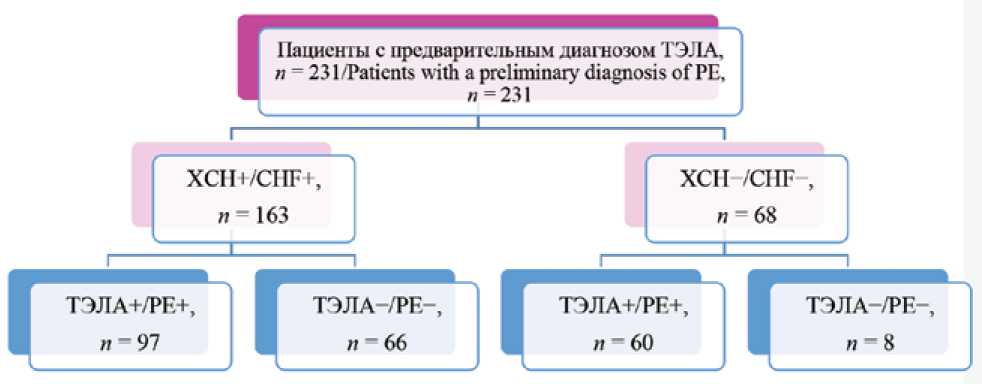
Рис. 1. Дизайн исследования Fig. 1. Study design
В рамках сформулированной цели исследования подгруппы пациентов без верифицированного диагноза ТЭЛА в дальнейшем анализе не участвовали. Основную группу составили 97 пациентов с синдромом ХСН и верифицированной МСКТ ТЭЛА [возраст – 70 (64–79) лет; мужской пол – 54,6% ( n = 53)]. Пациенты, имеющие ТЭЛА при отсутствии синдрома ХСН, составили группу сравнения [ n = 60; возраст – 59,5 (50–67,5) лет; мужской пол – 58,3% ( n = 35)].
Развитие синдрома ХСН в абсолютном большинстве случаев было связано с наличием ишемической болезни сердца (70,1%, n = 68), наиболее часто представленной постинфарктным кардиосклерозом (36,1%, n = 35). У 29,9% пациентов ( n = 29) ХСН была обусловлена артериальной гипертензией, кардиомиопатиями, нарушениями ритма и проводимости. 73,2% пациентов основной группы ( n = 71) до поступления в стационар получали медикаментозную терапию, предусмотренную протоколами диагностики и лечения заболеваний сердечно-сосудистой системы, включавшую ингибиторы ангиотен-зинпревращающего фермента или сартаны, – 95,8% ( n = 68), бета-адреноблокаторы – 58,8% ( n = 57), блокаторы кальциевых каналов – 17,5% ( n = 17), антиаритми-ческие препараты – 13,4% ( n = 13), антитромботические препараты – 59,8% ( n = 58), статины – 32,9% ( n = 32), сердечные гликозиды – 7,2% ( n =7).
Были использованы клинические методы исследования, включившие анализ данных анамнеза, жалоб пациента, предъявляемых при поступлении в стационар, результатов первичного объективного осмотра. Всем пациентам проведена запись электрокардиограммы и рентгенография органов грудной клетки на этапе приемного покоя, МСКТ с контрастированием ЛА, ультразвуковое исследование вен нижних конечностей.
Ультразвуковое исследование сердца осуществляли в первые сутки заболевания. Определяли следующие структурно-гемодинамические показатели состояния камер сердца: размер левого предсердия (ЛП), диаметр аорты на уровне концов створок аортального клапана, амплитуду раскрытия аортального клапана, конечный диастолический (КДД) и конечный систолический (КСД) диаметры полости левого желудочка (ЛЖ), толщину задней стенки (ЗСЛЖс, ЗСЛЖд) ЛЖ и межжелудочковой перегородки (МЖПс, МЖПд) в систолу и диастолу, переднезадний размер правого желудочка (ПЗРПЖ). Вычисляли показатели систолической функции ЛЖ: конечный диастолический (КДО) и конечный систолический (КСО) объемы ЛЖ, ударный объем (УО) ЛЖ, фракция выброса ЛЖ (ФВ) в М-(Teichgolz) и В-модальном (Simpson) режиме. Определяли индексированные показатели, производилась оценка локальной сократимости миокарда, индекса локальной сократимости миокарда (ИЛСМ).
Оценку структурно-функционального состояния правых отделов сердца проводили путем анализа линейных размеров правого предсердия (ПП) и правого желудочка (ПЖ), определения индекса объема ПП, систолической экскурсии плоскости трикупидального кольца (TAPSE), площади ПП, наличия гипокинеза свободной стенки ПЖ, нарушений локальной сократимости ПЖ. Оценивали диаметр нижней полой вены (НПВ) на вдохе и выдохе, рассчитывался процент спадения. Определяли диаметр ЛА, среднее и систолическое давление в ЛА (ДЛА).
Лабораторные исследования включали определение концентрации в сыворотке крови миокардиального белка, связывающего жирные кислоты, высокочувствительного тропонина, мозгового натрийуретического пептида, показателей гемостаза и функции почек и проводились методом твердофазного иммуноферментного анализа (метод двойного связывания) с использованием коммерческих наборов фирмы Bioassay Technology Laboratory на первые сутки с момента развития клинической симптоматики. Последующий анализ оптической плотности производили с использованием системы Multiscan (Labsystems, Финляндия).
Обработку полученных данных осуществляли с использованием статистического пакета STATISTICA 10.0. Для описания количественных признаков было проанализировано соответствие вида распределения значений изучаемого признака закону нормального распределения, что регламентировало выбор способа описания центральной тенденции и рассеяния значений признака, выбор методов дальнейшего анализа данных. Количественные признаки, имеющие приближенно нормальное распределение, описывали средним значением и средним квадратическим отклонением. Количественные показатели признаков, не имеющих нормального распределения, описывали медианой и межквартильным интервалом (25-й и 75-й процентили). Применяли критерии Колмогорова – Смирнова, Лиллиефорса, Шапиро – Уилка.
При нормальном распределении признака использовали методы параметрической статистики. Оценку статистической значимости разности сравниваемых величин проводили на основании величины критерия Стъюдента (t). Если гипотезу о нормальности распределения признака в совокупности отвергали, для обработки данных применяли метод непараметрической статистики Манна – Уитни ( U ).
Сравнение групп по качественным признакам проводили с использованием анализа частоты встречаемости признака. Значимость различий данных, характеризующих качественные признаки в исследуемых группах, определяли на основании величины критерия соответствия (х 2 ). Результаты исследования считали статистически значимыми при вероятности безошибочного прогноза не менее 95% ( р < 0,05).
Результаты и обсуждение
Анализ клинических характеристик пациентов (табл. 1) продемонстрировал преобладание в подгруппе пациентов с ТЭЛА и ХСН лиц пожилого и старческого возраста 70 (64–79) лет против 59,5 (50–67,5) лет в подгруппе пациентов с ТЭЛА без симптомов ХСН. Обращает на себя внимание высокая распространенность фибрилляции и/или трепетания предсердий в подгруппе пациентов с ХСН при наличии ТЭЛА - 51,5% (n = 50). Постоянная форма фибрилляции и/или трепетания предсердий встречалась у 28,0% (n = 14), пароксизмальная/персисти-рующая - у 56% (n = 28), впервые выявленная - у 16% (n = 8) пациентов.
Различий по другим признакам в подгруппах пациентов с ТЭЛА не зарегистрировано, но следует отметить высокую частоту встречаемости артериальной гипертензии среди пациентов всех групп исследования.
Таблица 1. Клиническая характеристика пациентов, включенных в исследование
Table 1. Clinical characteristics of patients included in the study
|
Показатели Variables |
ТЭЛА+, ХСН+, PE+, CHF+, n = 97 |
ТЭЛА+, ХСН–, PE+, CHF–, n = 60 |
Статистическая значимость Significance of differences |
|
Возраст, лет Age, years Ме (25-75%) |
70 (64–79)* |
59,5 (50–67,5) |
U = 1516; p < 0,001 |
|
Мужской пол, % (n) Male, % (n) |
54,6 (53) |
58,3 (35) |
– |
|
ИМТ, кг/м2 , BMI, kg/m2 Ме (25-75%) |
29,0 (25,9–35,1) |
28,9 (25,2–31,3) |
– |
|
Артериальная гипертензия, % (n) Hypertension, % (n) |
91,8 (89) |
73,3 (44) |
– |
|
Сахарный диабет, % (n) Diabetes, % (n) |
19,6 (19) |
13,3 (8) |
– |
|
Онкологическое заболевание, % (n) Cancer, % (n) |
10,3 (10) |
18,3 (11) |
– |
|
Фибрилляция предсердий и/или трепетание предсердий, % (n) , Аtrial fibrillation and/or atrial flutter, % (n) |
51,5 (50)* |
5,0 (3) |
X 2= 35,95; р < 0,001 |
|
Количество дней стационарного лечения Hospital stay, days Ме (25-75%) |
16 (14–22) |
16 (12–21) |
– |
Примечание: * – статистическая значимость различия при межгрупповом сравнении показателей при p < 0,05; ИМТ - индекс массы тела.
Note: * – significance of differences in case of intergroup comparison of parameters ( p < 0.05); BMI - body mass index.
С целью изучения особенностей клинической картины ТЭЛА при наличии ХСН были проанализированы наиболее часто встречающиеся клинические проявления заболевания: одышки или чувства нехватки воздуха, кашля, цианоза, боли в груди, подобной плевриту, кровохарканья, синкопального состояния, признаков тромбоза глубоких вен.
Анализ жалоб пациентов, предъявляемых при поступлении в стационар, подтверждает неспецифический характер клинической картины ТЭЛА. Одышка, или чувство нехватки воздуха, наиболее часто встречающееся клиническое проявление заболевания, выявлено у 72,2% (n = 70) пациентов с ТЭЛА при наличии ХСН и у 70,0% (n = 40) пациентов при отсутствии последней. Среди пациентов с ТЭЛА, протекавшей на фоне ХСН, необходимо отметить больший удельный вес лиц с развитием обморока или пресинкопального состояния на этапе поступления в стационар при сравнении с подгруппой ТЭЛА+, ХСН- [32% (n = 31) против 16,7% (n = 10); х2 = 4,49, p < 0,05], что косвенно свидетельствует о большей выраженности гемодинамических расстройств. Среди пациентов подгруппы ТЭЛА+, ХСН+ чаще регистрировались признаки цианоза [48,5% (n = 47) против 31,7% (n = 19); χ2 = 4,29, p < 0,05] и реже возникал болевой синдром в грудной клетке, подобный плевриту [16,5% (n = 16) против 35,0% (n = 21); χ2= 7,05, p < 0,01].
В подгруппах пациентов с ТЭЛА проведен анализ частоты развития осложнений. В качестве осложненного течения рассматривались случаи развития гемодинами- ческих расстройств – шока или гипотензии, что свидетельствовало о высоком риске смерти согласно 30-дневному внутригоспитальному прогнозу, тяжелой дыхательной недостаточности, требовавшей проведения искусственной вентиляции легких (ИВЛ), инфаркт-пневмонии, инфаркта миокарда ПЖ, сохранения выраженной легочной гипертензии (систолическое давление в ЛА – более 50 мм рт. ст.) к 14-му дню заболевания. Удельный вес пациентов с определенным типом осложненного течения ТЭЛА в исследуемых подгруппах представлен на рисунке 2.
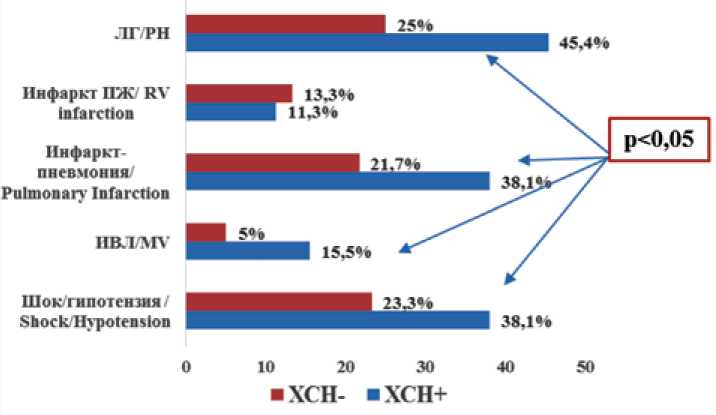
Рис. 2. Удельный вес пациентов с определенным типом осложненного течения ТЭЛА в исследуемых подгруппах Примечание: ЛГ – легочная гипертензия, ПЖ – правый желудочек, ИВЛ – искусственная вентиляция легких.
Fig. 2. The proportion of patients with complicated course of pulmonary embolism in the studied subgroups
Note: PH – pulmonary hypertension; RV – right ventricle; MV – mechanical ventilation.
Течение ТЭЛА у пациентов при наличии синдрома ХСН характеризовалось склонностью к осложненному варианту заболевания. В указанной подгруппе установлена более высокая частота развития шока/гипотензии [38,1% ( n = 37) против 23,3% ( n = 14), χ 2= 4,64, р < 0,05], тяжелой дыхательной недостаточности, потребовавшей проведения ИВЛ [15,5% ( n = 15) против 5,0% ( n = 3), χ 2 = 4,00, р < 0,05], инфаркт-пневмонии [38,1% ( n = 37) против 21,7% ( n = 13), χ 2 = 4,64, р < 0,05] и выраженной легочной гипертензии [45,4% ( n = 44) против 25,0% ( n = 15), χ 2= 6,55, р < 0,05], что согласуется с результатами клинического обследования и динамикой лабораторных маркеров неблагоприятного прогноза.
В рамках оценки факторов, определяющих прогноз при ТЭЛА, был проведен анализ результатов использования шкалы PESI. Пациенты с ТЭЛА и синдромом ХСН характеризовались более неблагоприятным прогнозом, о чем свидетельствовали большие среднегрупповые значения баллов по шкале PESI (рис. 3) – 114 (89–160) баллов и 2 (1–2) балла при использовании оригинальной и упрощенной версии шкалы соответственно против 81 (67–130) балла и 1 (0–2) балла в группе пациентов, не имевших ХСН.
Структурно-функциональные показатели левых отделов сердца, выявленные при проведении эхокардиографии, свидетельствовали о наличии выраженных изменений у пациентов с ХСН, что представляется законо- мерным с учетом формирования групп исследования и использования наличия синдрома ХСН в качестве разделяющего признака (табл. 2).
Для пациентов с ТЭЛА при наличии синдрома ХСН характерно течение заболевания на фоне более значимой дисфункции правых отделов сердца, что подтверждается увеличенными линейными размерами ПП и ПЖ (табл. 3). Индекс объема ПП в группе пациентов с ХСН составил 32,3 (29,4–37,9) мл/м2 против 29,1 (26,6–32,3) мл/м2 ( U = 1583,00, p < 0,001).
Резкое увеличение давления в системе ЛА способствует формированию правожелудочковой систолической дисфункции, которая в условиях наличия ХСН приобретает большую распространенность и степень выраженности. Значения TAPSE в подгруппе с ХСН составили 16 (15–18) мм против 18 (16–21) мм ( U = 1556,00, p < 0,001). Удельный вес пациентов с превышением отношения диаметров ПЖ/ЛЖ 0,9 в подгруппе с синдромом ХСН составил сопоставимое значение с группой сравнения, что с учетом более высокой распространенности дилатации ПЖ [54,6% (n = 53) против 25,0% ( n = 15), χ 2= 13,26; p < 0,001], нарушений локальной сократимости [39,2% ( n = 38) против 27,3% ( n = 13), χ 2 = 5,18; p < 0,05] и систолической дисфункции ПЖ [58,8% ( n = 57) против 30,0% ( n = 18), χ 2= 12,29, p < 0,001] может свидетельствовать о снижении диагностической ценности рассматриваемого показателя в категории пациентов с синдромом ХСН.
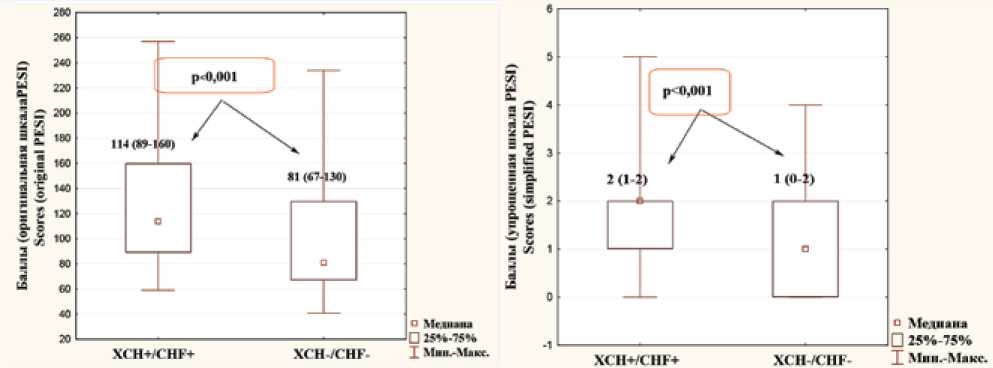
Рис. 3. Медиана и межквартильный интервал значения баллов, полученных при использовании оригинальной и упрощенной шкалы PESI, в исследуемых подгруппах
Fig. 3. Median and interquartile range scores obtained using the original and simplified PESI scales in the studied subgroups
Таблица 2. Эхокардиографические показатели пациентов, характеризующие функцию левых отделов сердца, в исследуемых подгруппах
Table 2. Echocardiographic parameters of patients characterizing the function of the left heart in the studied subgroups
|
Показатели Variables |
ТЭЛА+, ХСН+ PE+, CHF+, n = 97 |
ТЭЛА+, ХСН–, PE+ CHF–, n = 60 |
Статистическая значимость Significance of differences |
|
Аорта, диаметр на уровне аортального клапана, мм Aorta, diameter at the level of aortic valve, mm Ме (25–75%) |
34 (31–37) |
32 (30–34) |
U = 1964,00; р < 0,001 |
|
Передне-задний размер ЛП, мм / LA anteroposterior size, mm Ме (25-75%) |
42 (39–46) |
38 (36–40) |
U = 1099,50; р < 0,001 |
|
Индекс объема ЛП, мл/м2 LA volume index, mL/m2 Ме (25–75%) |
38 (34–44) |
31 (27–33) |
U = 997,00; р < 0,001 |
|
Дилатация ЛП, % (n) LA dilation, % (n) |
76,3 (74) |
0,0 (0) |
χ 2= 86,58, р < 0,001 |
|
КДД ЛЖ, мм LV FDS, mm Ме (25–75%) |
54 (47–58) |
48 (44–51) |
U = 1570,00; р < 0,001 |
|
КСД ЛЖ, мм LV FSS, mm Ме (25–75%) |
35 (31–41) |
30 (27–33) |
U = 1352,00; р < 0,001 |
|
Дилатация ЛЖ, % (n) LV dilation, % (n) |
37,1 (36) |
0,0 (0) |
χ 2= 28,89, р < 0,001 |
|
ФВ ЛЖ, % LV EF, % Ме (25–75%) |
52 (47–58) |
60 (57–65) |
U = 941,50; р < 0,001 |
|
МЖПд, мм IVSTd, mm Ме (25–75%) |
11 (9–12) |
11 (10–12) |
– |
|
МЖПс, мм IVSTs, mm Ме (25–75%) |
15 (13–16) |
15 (14–16) |
– |
|
Амплитуда МЖП, мм IVS amplitude, mm Ме (25–75%) |
6 (4–7) |
7 (6–9) |
U = 1272,00; р < 0,001 |
|
ЗСЛЖд, мм LVPWTd, mm Ме (25–75%) |
10 (9–11) |
9,5 (9–11) |
– |
|
ЗСЛЖс, мм LVPWTs, mm Ме (25–75%) |
14 (13-1–7) |
15 (14–16) |
U = 1933,50; р < 0,05 |
|
Амплитуда ЗСЛЖ, мм LVPV amplitude, mm Ме (25–75%) |
7 (5–9) |
9 (7,5–10) |
U = 1152,50; р < 0,001 |
|
Индекс ММЛЖ, г/м2 LVMMI, g/m² Ме (25–75%) |
107,8 (85,2–126,1) |
95,2 (84,9–109,3) |
U = 1260,50; р < 0,05 |
Окончание табл. 2
End of table 2
|
Показатели Variables |
ТЭЛА+, ХСН+ PE+, CHF+, n = 97 |
ТЭЛА+, ХСН–, PE+ CHF–, n = 60 |
Статистическая значимость Significance of differences |
|
Индекс локальной сократимости ЛЖ LV Local Contractility Index Ме (25–75%) |
1,1 (1,0–1,3) |
1 (1–1) |
U = 1563,00; р < 0,001 |
Примечание: ЛП – левое предсердие, ЛЖ – левый желудочек, КДД ЛЖ – конечный диастолический размер левого желудочка, КСД ЛЖ – конечный систолический размер левого желудочка, ФВ ЛЖ – фракция выброса левого желудочка, МЖПд – толщина межжелудочковой перегородки в диастолу, МЖПс – толщина межжелудочковой перегородки в систолу, МЖП – межжелудочковая перегородка, ЗСЛЖд – толщина задней стенки левого желудочка в диастолу, ЗСЛЖс – толщина задней стенки левого желудочка в систолу, ЗСЛЖ –задняя стенка левого желудочка, ИММЛЖ – индекс массы миокарда левого желудочка.
Note: LA – left atrium; LV – left ventricle; LV FDS – left ventricular final diastolic size; LV FSS – left ventricular final systolic size; LV EF – left ventricular ejection fraction; IVSTd – interventricular septum thickness in diastole; IVSTs – interventricular septum thickness in systole; IVS – interventricular septum; LVPWTd – left ventricular posterior wall thickness in diastole; LVPWTs – left ventricular posterior wall thickness in systole; LVPW – left ventricular posterior wall; LVMMI – left ventricular myocardial mass index.
Таблица 3. Эхокардиографические показатели пациентов, характеризующие функцию правых отделов сердца, в исследуемых подгруппах
Table 3. Echocardiographic parameters of patients characterizing the function of the right heart in the studied subgroups
|
Показатели Variables |
ТЭЛА+, ХСН+, PE+, CHF+, n = 97 |
ТЭЛА+, ХСН–, PE+, CHF–, n = 60 |
Статистическая значимость Reliability of differences |
|
Площадь ПП, см2 RA area, sm2 Ме (25–75%) |
22 (20–24) |
18 (18–22) |
U = 1313,00; р < 0,001 |
|
Объем ПП, мл RA volume, ml Ме (25–75%) |
66 (56–78) |
56 (52–66) |
U = 1474,50; р < 0,001 |
|
Индекс объема ПП, мл/м2 RA volume index, ml/m2 Ме (25–75%) |
32,3 (29,4–37,9) |
29,1 (26,6–32,3) |
U = 1583,00; р < 0,001 |
|
Дилатация ПП, % (n) RA dilation, % (n) |
70,1 (68) |
36,7 (22) |
χ 2= 16,94; р < 0,001 |
|
Передне-задний размер ПЖ, мм RV anteroposterior size, mm Ме (25–75%) |
31 (28–34) |
30 (26–32) |
U = 2011,50; р < 0,05 |
|
Размер ПЖ, парастернальное сечение, мм RV size, parasternal section, mm Ме (25–75%) |
6 39 (36–43) |
37 (33–43) |
U = 2143,50; р < 0,05 |
|
Дилатация ПЖ, % (n) RV dilation, % (n) |
54, (53) |
25,0 (15) |
χ2= 13,26; р < 0,001 |
|
Соотношение диаметров ПЖ/ЛЖ более 0,9, % (n) RV/LV ratio > 0,9, % (n) |
23,7 (23) |
30,0 (18) |
– |
|
НПВ (выдох), мм IVC (exhale), mm Ме (25–75%) |
22 (18–26) |
20 (18–24) |
– |
|
НПВ (вдох), мм IVC (inhale), mm Ме (25–75%) |
14 (6–19) |
9 (6–16) |
U = 1949,00; р < 0,05 |
|
Процент спадания НПВ, % IVC drop rate, % Ме (25–75%) |
39,1 (27,0–62,0) |
52,5 (29,4–68,4) |
U = 1971,00; р < 0,05 |
|
Гипокинез свободной стенки ПЖ, % (n) Depressed contractility of the RV free wall, % (n) |
21,6 (21) |
13,3 (8) |
– |
|
Нарушение локальной сократимости ПЖ, % (n) Impaired local RV contractility, % (n) |
39,2 (38) |
21,7 (13) |
χ 2= 5,18; р < 0,05 |
|
TAPSE, мм TAPSE, mm Ме (25–75%) |
16 (15–18) |
18 (16–21) |
U = 1556,00; р < 0,001 |
|
Систолическая дисфункция ПЖ, % (n) RV systolic dysfunction, % (n) |
58,8 (57) |
30,0 (18) |
χ 2= 12,29; р < 0,001 |
|
Систолическое давление в ЛА, мм рт. ст. Systolic pressure in PA, mm/Hg Ме (25–75%) |
40 (33–50) |
35 (22–46) |
U = 2006,0; р < 0,05 |
|
Диаметр ствола ЛА, мм PA diameter, mm Ме (25–75%) |
26 (22–29) |
26 (22–28) |
– |
Примечание: ПП – правое предсердие, ПЖ – правый желудочек, ЛЖ – левый желудочек, НПВ – нижняя полая вена, TAPSE – систолическая экскурсия кольца трехстворчатого клапана, ЛА – легочная артерия.
Note: RA – right atrial; RV – right ventricular; LV – left ventricular; IVC – inferior vena cava; TAPSE – tricuspid valve systolic excursion; PA – pulmonary artery.
Возникающая при ТЭЛА перегрузка давлением ПЖ способствует перенапряжению миокарда и стимулирует выработку мозгового натрийуретического пептида (BNP), который в настоящее время рассматривается как маркер неблагоприятного прогноза [2]. С другой стороны, повышенные значения этого показателя являются лабораторным отражением наличия у пациента ХСН. Видимо, указанные закономерности и обусловливают более выраженное повышение BNP у пациентов с ТЭЛА и ХСН. Анализ данных, полученных при проведении лабораторных методов исследования, свидетельствует о том, что ТЭЛА у пациентов с ХСН протекает на фоне более значимого повышения значений лабораторных прогностических показателей [BNP – 395 (204–789) пг/мл против 104,2 (38,9–212) пг/мл, U = 1162,00, p < 0,001], снижения функции почек [креатинин – 109,6 (92,0–135,9) мкмоль/л против 92 (75,7–118,9) мкмоль/л, U = 1961,00, p < 0,001; скорость клубочковой фильтрации (СКФ) – 50 (39–64) мл/мин/1,73 м2 против 66,5 (52,5–88,5) мл/мин/1,73 м2].
Изучение дополнительных маркеров правожелудочковой дисфункции включало анализ значений высокочувствительного тропонина, миокардиального белка, связывающего жирные кислоты, и копептина. Повышение уровня тропонина, высокочувствительного показателя, свидетельствующего о некрозе кардиомиоцитов, у пациентов с ТЭЛА часто отражает повреждение миокарда и дисфункцию ПЖ и ассоциируется с высокой смертностью и осложненностью клинического течения [2, 11]. Полученные у пациентов с синдромом ХСН результаты подтверждают выявленную эхокардиографически большую степень вовлеченности ПЖ. Среднегрупповые значения в подгруппах ХСН+ и ХСН– составили соответственно: высокочувствительный тропонин – 212 (194,5– 297,6) нг/мл против 184,8 (168,0–194,8) нг/мл, U = 279,50, p < 0,01; миокардиальный белок, связывающий жирные кислоты, – 0,37 (0,18–1,2) нг/мл против 0,2 (0,08–0,3) нг/мл, U = 530,00, p < 0,001; копептин – 0,2 (0,05–0,92) нг/мл против 0,09 (0,04–0,15) нг/мл, U = 563,00, p < 0,01.
Заключение
-
1. В подгруппе пациентов с ТЭЛА и ХСН анализ клинических характеристик пациентов продемонстрировал преобладание лиц пожилого и старческого возраста. Об-
- ращает на себя внимание высокая распространенность фибрилляции и/или трепетания предсердий в подгруппах пациентов с ХСН, составившая 51,5%.
-
2. Клиническая картина ТЭЛА у пациентов с синдромом ХСН характеризовалась неспецифичностью, развитием жалоб, характерных как для ТЭЛА, так и для декомпенсации синдрома сердечной недостаточности. Выявлена большая частота встречаемости лиц с развитием обморока или пресинкопального состояния на этапе поступления в стационар среди пациентов с ТЭЛА и ХСН, что может быть фактическим отражением большей выраженности гемодинамических расстройств.
-
3. Течение ТЭЛА у пациентов при наличии синдрома ХСН характеризуется склонностью к осложненному течению заболевания с большей частотой развития шока/ гипотензии, тяжелой дыхательной недостаточности, потребовавшей проведения ИВЛ, инфаркт-пневмонии и выраженной легочной гипертензии, что согласуется с результатами клинического обследования, динамикой лабораторных маркеров неблагоприятного прогноза и большими среднегрупповыми значениями баллов по шкале PESI.
-
4. Для пациентов с ТЭЛА при наличии синдрома ХСН характерно течение заболевания на фоне более значимой дисфункции правых отделов сердца, что подтверждается увеличенными линейными размерами ПП и ПЖ. Удельный вес пациентов с превышением отношения диаметров ПЖ/ЛЖ 0,9 в подгруппе с синдромом ХСН составил сопоставимое значение с группой сравнения, что с учетом более высокой распространенности дилатации ПЖ, нарушений локальной сократимости и систолической дисфункции ПЖ может свидетельствовать о снижении диагностической ценности рассматриваемого показателя в категории пациентов с синдромом ХСН.
-
6. Анализ данных, полученных при проведении лабораторных методов исследования, подтверждает, что ТЭЛА у пациентов с ХСН протекает на фоне более значимого повышения лабораторных маркеров дисфункции и повреждения ПЖ, входящих в модель прогнозирования неблагоприятного исхода ТЭЛА (BNP, высокочувствительный тропонин, миокардиальный белок, связывающий жирные кислоты, копептин, снижение функции почек).
Список литературы Тромбоэмболия легочной артерии при наличии синдрома хронической сердечной недостаточности: особенности структурно-функционального состояния сердечно-сосудистой системы
- Статкевич Т.В., Патеюк И.В., Балыш Е.М., Петрова Е.Б., Моклая Е.В., Левкович И.Э. и др. Тромбоэмболия легочной артерии: особенности течения на фоне хронической сердечной недостаточности. Неотложная кардиология и кардиоваскулярные риски. 2018;2(2):382-386. Statkevich T.V., Patsiayuk I.V., Balysh E.M., Petrova E.B., Moklaya E.V., Levkovich I.E. et al. Pulmonary embolism: characteristic features of the course in the presence of heart failure. Emergency Cardiology and Cardiovascular Risks. 2018;2(2):382-386 (In Russ.).
- Konstantinides S.V., Meyer G. 2019 ESC Guidelines on the diagnosis and management of acute pulmonary embolism. Eur. Heart J. 2019;40(42):3453-3455. DOI: 10.1093/eurheartj/ehz726.
- Petris A.O., Konstantinides S.V., Tint D., Cimpoes D., Pop C. Therapeutic advances in emergency cardiology: Acute Pulmonary Embolism. Am. J. Ther. 2019;26(2):e248-256. DOI: 10.1097/MJT.0000000000000917.
- Rosovsky R., Zhao K., Sista A., Rivera-Lebron B., Kabrhel C. Pulmonary embolism response teams: Purpose, evidence for efficacy, and future research directions. Res. Pract. Thromb. Haemost. 2019;3(3):315-330. DOI: 10.1002/rth2.12216.
- Lavender Z., MacNabb M. Pulmonary embolism response team. JAAPA.
- Yuriditsky E., Mitchell O.J., Sibley R.A., Xia Y., Sista A.K., Zhong J. et al. Low left ventricular outflow tract velocity time integral is associated with poor outcomes in acute pulmonary embolism. Vase. Med. 2019;10:1358863X19880268. DOI: 10.1177/1358863X19880268.
- Doherty S. Pulmonary embolism: An update. Aust. Fam. Physieian. 2017;46(11):816-820.
- Gupta R., Fortman D.D., Morgenstern D.R., Cooper C.J. Short- and long-term mortality risk after acute pulmonary embolism. Curr. Cardiol. Rep. 2018;20(12):135. DOI: 10.1007/s11886-018-1084-6.
- Hepburn-Brown M., Darvall J., Hammerschlag G. Acute pulmonary embolism: a concise review of diagnosis and management. Intern. Med. J. 2019;49(1):15-27. DOI: 10.1111/imj.14145.
- Bethishou L., Gregorian T., Won K., Lopez K., Tsu L.V. Management of venous thromboembolism in the elderly: A review of the non-vitamin K oral anticoagulants. Consult. Pharm. 2018;33(5):248-261. DOI: 10.4140/ TCP.n.2018.248.
- El-Menyar A., Sathian B., Al-Thani H. Elevated serum cardiac tropo-nin and mortality in acute pulmonary embolism: Systematic review and meta-analysis. Respir. Med. 2019;157:26-35. DOI: 10.1016/j. rmed.2019.08.011.


