Тромбоз воротной вены после дважды установленного трансъюгулярного внутрипечёночного портосистемного стентирования (клиническое наблюдение)
Автор: Гуска М. С., Кузнецова А. Д., Казымов Б. И., Алекберов К. Ф., Казиахмедова З. Г., Яремин Б. И.
Журнал: Вестник медицинского института "РЕАВИЗ": реабилитация, врач и здоровье @vestnik-reaviz
Рубрика: Клинический случай
Статья в выпуске: 1 т.14, 2024 года.
Бесплатный доступ
Актуальность. Трансплантация печени включает реконструкцию нескольких сосудистых структур. Портальная реконструкция несёт множество трудностей в связи с нередким интраоперационным обнаружением её тромбоза. Тромбоз воротной вены является состоянием, вызванным застоем кровотока, повреждением сосудов или гиперкоагуляцией, приводящим к частичной или полной окклюзии воротной вены. Распространённость тромбоза колеблется от 2,1 до 23,3% среди кандидатов на трансплантацию печени без гепатоцеллюлярного рака. По данным аутопсии, частота тромбоза при циррозе печени составляет 6-64%.Цель: анализ случая тромбоза воротной вены у пациента с двумя предварительными попытками установки трансюгулярных внутрипеченочных портосистемных стентови их тромбозом.Материалы и методы: клинический случай тромбоза стента и бассейна воротной вены у 53-летнего пациента с декомпенсированным циррозом печени в исходе вирусного гепатита С с портальной гипертензией. Особенностью данного случая является то, что после проведённого дважды трансюгулярного внутрипеченочного портосистемного стентирования, тромбоз вопротной вены был обнаружен только интраоперационно. Проведена трансплантация печени, функциональность трансплантата не была нарушена.Заключение. Этот случай иллюстрирует необходимость будущих исследований по теме тромбоза воротной вены и методик идентифицирования его дооперационно.
Твпс, тромбоз твпс, тромбоз бассейна воротной вены, mltr классификация
Короткий адрес: https://sciup.org/143182256
IDR: 143182256 | УДК: 616.65-006-089 | DOI: 10.20340/vmi-rvz.2024.1.CASE.1
Текст научной статьи Тромбоз воротной вены после дважды установленного трансъюгулярного внутрипечёночного портосистемного стентирования (клиническое наблюдение)
Тромбоз воротной вены (ТВВ) — это обструкция её внепеченочной части с вовлечением внутрипеченоч-ных ветвей и притоков, или без них [1]. Распространенность ТВВ у пациентов с циррозом печени без гепатоцеллюлярной карциномы в листе ожидания трансплантации печени составляет от 2,1 до 23,3 % [2]. Этиологическими факторами ТВВ обычно являются цирроз в исходе диффузных заболеваний печени, злокачественные новообразования, воспалительные заболевания и травмы органов брюшной полости, системные тромбофилии [1, 2]. Редкой причиной ТВВ является проведение трансъюгулярного внут-рипечёночного портосистемного стентирования.
Тромбоз стента может развиться во время его установки, либо в течение нескольких дней после установки [8, 10]. Предполагаемыми причинами тромбоза могут быть утечка желчи в шунт, синдромы гиперкоагуляции или неправильное расположение стента. Непосредственным результатом развития тромбоза является окклюзия TIPS, приводящая к рецидиву осложнений портальной гипертензии, а также потенциально вызывающая ишемию кишечника в результате венозного застоя при тромбозе, распространяющегося на селезёночную и брыжеечную вену [11]. В случае тромбоза впервые установленного стента возникает трансъюгулярная внутрипечёночная портосистемная стент-шунтовая недостаточность, что делает необходимым установку второго параллельного TIPS [12]. Несмотря на то, что риск рецидива ТВВ при ТВПС изучался лишь в нескольких ретроспективных исследованиях, в них было выявлено, что формирование тромбоза воротной вены было обнаружено у 26,7% пациентов с циррозом печени, перенёсших TIPS, что было аналогично пациентам без TIPS [13–15].
Описание клинического случая
Пациент 53 года, мужчина. Из анамнеза известно, что с 50 лет выявлен вирусный гепатит С. Заболевание дебютировало с пожелтения кожных покровов, увеличения живота в размерах, тогда пациент обратился в больницу по месту жительства, где по данным обследования выявлен цирроз печени в исходе вирусного гепатита С класс С (11 баллов) по Child-Pugh, варикозное расширение вен пищевода 3 степени, гиперспленизм: тромбоцитопения, панцитопения. Печёночно-клеточная недостаточность: гипопротеинемия, гипоальбуминемия, гипокоагуляция, энцефалопатия 1 степени. Через год после установки диагноза в связи с ухудшением состояния направлен на установку ТВПС (рис. 1), перед чем был выполнен портальный тромболизис. По данным КТ выявлен тромбоз бассейна воротной вены M1L2T1R0. В связи с высоким риском кровотечения было выполнено лигирование ВРВП пищевода. Но через полгода с клинической картиной желудочно-кишечного кровотечения поступил в стационар, где было проведено повторное лигирование ВРВП. Уже через месяц произошёл рецидив, и проводилось повторное лигирование и склерозирование. По экстренным показаниям поступил в отделение реанимации для ожидания трансплантации печени.
Трансплантация была выполнена через несколько недель. Во время операции в брюшной полости отмечалось большое количество мутной асцитичечской жидкости с слизистым компонентом, выявлены признаки портальной гипертензии – расширенные венозные коллатерали в брюшной полости до 0,5 см. Печень значительно увеличена в размерах, ригидная, бурого цвета, бугристая по всей поверхности, с включениями фиброза. Воротная вена расширена до 3 см, с признаками тромбоза, плотная, тромбоз воротной, селезёночной вен – M1L2T1R0. Воротная вена пересечена, из проксимального отдела воротной вены и селезёночной вены удалён ранее установленный стент длиной 12 см с фрагментами тромба. Был проведён кавальный флашинг, выявлены сохраняющиеся пристеночные тромбы воротной и селезёночной вены, проведена тромбэктомия, достигнут адекватный венозный кровоток. Выполнена гепатэктомия с сохранением ретропеченочного отдела нижней полой вены. Кровопотеря составила 1000 мл.
Инструментальные исследования: на 1-е сутки после операции по данным УЗИ эхо-признаков нарушения гемодинамики трансплантата печени не выявлено. Далее, в течении недели по данным УЗИ: воротная вена – 1,3 см, кровоток сохранён; ЛСК – 0,28 м/сек; печёночная артерия – 0,4 см; ЛСК – 0,36 м/сек; РИ – 0,6; печёночная вена – 0,8 см, ЛСК – 0,24 м/сек; форма допплеровской кривой фазного типа (HV0).
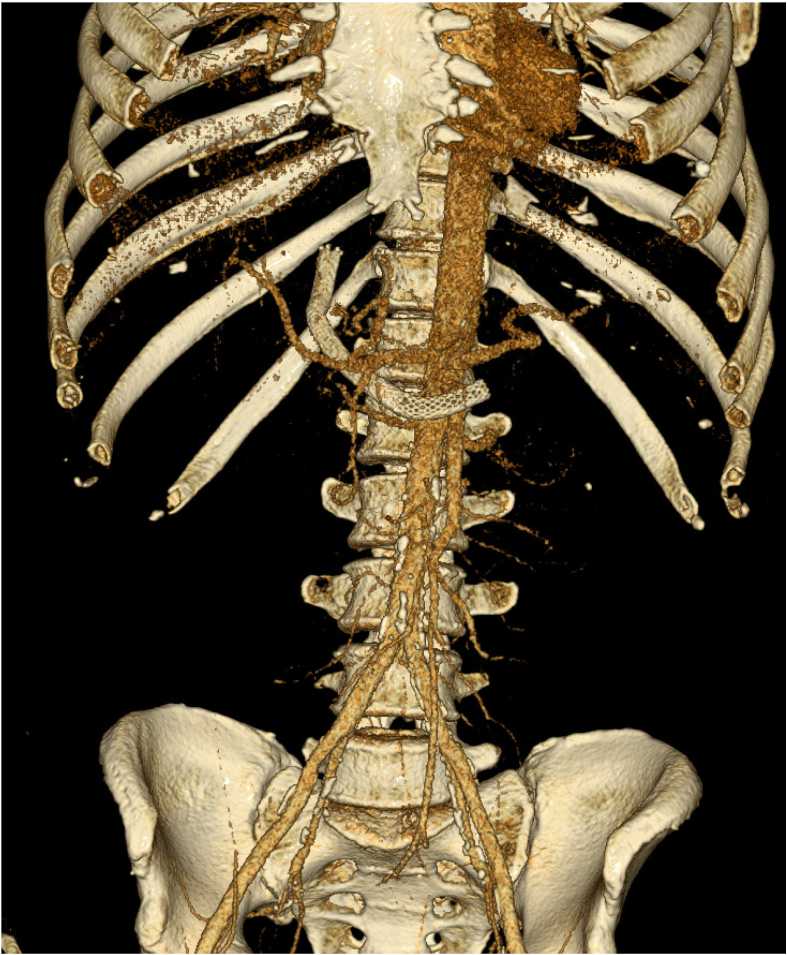
Рисунок 1. 3D реконструкция KT брюшной полости с установленным ТВПС
Figure 1. 3D CT reconstruction of the abdomen with TIPS installed
Лабораторные анализы: после операции концентрация МНО, протромбинового времени в пределах нормы. На момент выписки МНО – 1,14, протромбин – 13,3 с, АЧТВ – 28,2 с, тромбоциты – 251 х 10*9/л, гемоглобин - 73 г/л, эритроциты -2,40 х 10*12/л.
Лечение: во время операции была проведена реинфузия CATS-эритроцитов – 878 мл, Ht 18% и компонентов крови – СЗП 720 мл, эр. взвесь – 620 мл. В послеоперационном периоде проводилась инфузионная (альбумин 20%, стерофундин, аминоплаз-маль-гепа, глюкоза 5%, липоплюс), обезболивающая (кетопрофен, трамал, анальгин), антибактериальная (сульмаграф, флуконазол, бисептол) и имун-носупресивная (адваграф 7 мг, микофенолата мо-фетил 720 мг х 2 р/сут., метипред) терапии, а также дополнительная терапия (гепарин, вазапростан, арикстра, фуросемид, омез, карди АСК).
Пациент был выписан из стационара в удовлетворительном состоянии, трансплантат на момент выписки функционировал нормально. Через 2 месяца было выполнено УЗИ трансплантата – воротная вена 2,3 см. Кровоток сохранён на уровне ствола фрагментарно, на уровне ветвей не регистируется. В просвете – тромботические массы. Печёночная артерия – 0,4 см, ЛСК –0,36 м/сек., РИ –
0,41, печёночная вена – 0,8 см, ЛСК – 0,24 м/сек. Форма допплеровской кривой фазного типа (HV0) УЗДГ признаки тромбоза воротной вены. МНО – 1,03, протромбин – 12,0, тромбиновое время – 16,9, концентрация фибриногена – 4,22.
Обсуждение
Подобно любому венозному тромбозу, для ТВВ актуальна триада Вирхова: гиперкоагуляция, повреждение эндотелия и стаз, хотя этиология этих изменений совершенно различна. Венозный стаз часто встречается при циррозе печени, синдроме Бадда-Киари, веноокклюзионной болезни и выражается в снижении линейной скорости кровотока (ЛСК) в воротной вене, что можно выявить при проведении ультразвуковой допплерографии. Главную роль в возникновении стаза играет повышенное внутрипечёночное сосудистое сопротивление из-за сдавления портальных трактов регенераторными узлами при циррозе печени [17]. Повышенная активность симпатической нервной системы, нарушение способности печени деактивировать эндогенные и экзогенные вазодилататоры приводят к дилатации сосудов спланхнического кровеносного русла и, как следствие, увеличивают объём крови, поступающий в систему воротной вены [18]. В ряде исследований показатель ЛСК менее 15 см/c в во- ротной вене при циррозе печени был определён как независимый прогностический фактор развития ТВВ [19, 20].
Пациенты с ТВВ должны быть обследованы на предмет местных и системных тромбофилических состояний. К системным тромбофилиям относятся миелопролиферативные и аутоиммунные заболевания, пароксизмальная ночная гемоглобинурия. К местным – воспалительные заболевания и злокачественные новообразования брюшной полости. Скрининг на врожденные тромбофилические состояния включает в себя поиск врожденного дефицита протеина С и S, антитромбина, выявление Лейденовской мутации, генетического маркера G20210А и антифосфолипидных антител [21].
Традиционные лабораторные показатели коагуляции, такие как протромбиновое время (ПВ), международное нормализованное отношение (МНО) и активированное частичное тромбопластиновое время (АЧТВ), оказались неинформативными при циррозе печени, поскольку эти показатели лишь частично оценивают системы гемостаза. Глобальные тесты, в том числе тесты образования тромбина в плазме, анализы фибринолиза в плазме и вязкоэластические тесты образования сгустков цельной крови, сыграли важную роль в разработке современной концепции ребалансированного гемостаза [22]. Тесты на образование тромбина в плазме и вязкоупругие тесты цельной крови, такие как тромбоэластография (ТЭГ) или ротационная тромбоэла-стометрия (ROTEM), показали, что пациенты с циррозом печени имеют нормальную или повышенную тромбингенерирующую способность и почти нормальное образование сгустков цельной крови [23].
Наследственная или приобретенная тромбофилия наблюдается у 20% лиц с ТВВ и чаще встречается у лиц с циррозом печени и ТВВ по сравнению с лицами только с циррозом печени [24]. Наследственная тромбофилия, такая как мутация фактора V Лейдена и мутация гена протромбина G20210A, связана с ТВВ [25]. Сообщалось о низких уровнях антитромбина и белков C и S при циррозе печени, однако неясно, является ли это истинной наследственной тромбофилией или приобретённой вследствие заболевания печени. Мета-анализ показал, что антитромбин и белки C и S не имеют существенного отношения к развитию ТВВ при циррозе печени [26].
Ряд исследований показал, что повреждение эндотелия воротной системы на фоне портальной гипертензии также играет роль в патогенезе ТВВ [27]. Carnevale R и соавт. обнаружили стимуляцию выработки фактора свертывания VIII от воздействия ЛПС кишечной микрофлоры на эндотелий кишечника, установив механизм возникновения известной до этого повышенной концентрации фактора VIII у пациентов с циррозом печени [28]. Praktiknjo M и со-авт. предположили возможность измерения концентрации ЛПС в венозной крови как предиктора повреждения эндотелия и дисбаланса системы гемостаза с преобладанием свертывания [29]. К другим причинам повреждения эндотелия можно отнести врастание злокачественных новообразований в сосуды воротной системы [30], воспалительные заболевания органов брюшной полости, затрагивающие эндотелий вен [31], ятрогенное повреждение венозных стволов [32].
Также описаны случаи ТВВ после ТВПС и их корреляция с лейкопенией, тяжестью цирроза по шкале Чайлд-Пью и наличием асцита до шунтирования. Выживаемость пациентов с ТВВ после выполнения ТВПС была ниже по сравнению с пациентами без послеоперационного тромбоза [33]. К специфическим причинам ТВВ можно отнести тромбоз, возникший после трансплантации печени. ТВВ снижает выживаемость реципиентов и увеличиваюет частоту потери трансплантата [34]. ТВВ у реципиентов в листе ожидания и выполнение тромбинтимэктомии во время трансплантации в некоторых работах определены как факторы риска послеоперационного ТВВ [35, 36], в других же исследованиях авторы не обнаружили влияния этих факторов на развитие тромбоза [37, 38].
Заключение
Этот случай иллюстрирует необходимость будущих исследований по теме тромбоза воротной вены и методик идентифицирования его дооперационно.


