Трудности дифференциального диагноза между атипической лейомиомой и лейомиосаркомой тела матки
Автор: Коган Евгения Александровна, Соломахина Марина Александровна, Аскольская Светлана Ивановна, Попов Юрий Вячеславович, Козаченко Андрей Владимирович, Файзулина Нафиса Мануваровна, Кекеева Татьяна Владимировна, Шикеева Амуланг Алексеевна
Журнал: Клиническая практика @clinpractice
Рубрика: Клинический случай
Статья в выпуске: 1 (25), 2016 года.
Бесплатный доступ
Лейомиома матки это доброкачественная гормонозависимая опухоль у женщин. Частота встречаемости ЛМ среди гинекологических заболеваний составляет, по данным разных авторов, от 25 до 50%. Причем у женщин репродуктивного возраста ее частота составляет около 30%. ВОЗ рекомендует выделять лейомиому, которую в отечественной литературе часто обозначают как простую или обычную лейомиому, и ее гистологические варианты (клеточная, митотически активная, эпителиоидная, миксоидная, атипическая лейомиома и липолейомиома и т.д.).Нами был проведен клинико-морфологический анализ атипической лейомиомы матки у женщины 44 лет. При иммуногистохимическом исследовании материала выявлялась положительная реакция на гладкомышечный актин, дисмин, рецепторы прогестерона, Н-кальдесмон. Отрицательные реакции на c-kit, ЭР, кератины. Индекс пролиферации по Ki-67 не превышал 10%. При молекулярно-генетическом исследовании в исследуемых локусах микросателлитнойнестабильностиипотеригетерозиготности,характерныхдлялейомиосаркомы, не обнаружено.
Лейомиома матки, лейомиосаркома
Короткий адрес: https://sciup.org/14338551
IDR: 14338551
Текст научной статьи Трудности дифференциального диагноза между атипической лейомиомой и лейомиосаркомой тела матки
Лейомиома матки (ЛМ) – это доброкачественная гормонозависимая опухоль у женщин. Частота встречаемости ЛМ среди гинекологических заболеваний составляет по данным разных авторов от 25 до 50% [1, 2], причем, у женщин репродуктивного возраста ее частота составляет около 30%. В исследовании, проведенном американскими учеными, принимали участие 1364 женщины в возрасте до 50 лет и было выявлено, что заболеваемость миомой матки среди данной группы женщин достигает 80% [3]. Важное значение при выборе тактики лечения, прогноза и осложнений, имеет установление гистологического типа лейомиомы матки. Точность гистологического диагноза усложняется тем, что, с одной стороны, в настоящее время существуют различные классификации ЛМ, а с другой – морфологи по-разному интерпретируют особенности гистологического строения лейомиомы матки.
ВОЗ (2003г.) рекомендует выделять обычную или простую ЛМ и гистологические варианты ЛМ (клеточная, митотически активная, эпителиоидная, миксоидная, атипическая лейомиома и липолейомиома и т.д.) [4]. В настоящее время описано три основные формы миомы матки. Простая лейомиома, развивающаяся по типу доброкачественной очаговой мышечной гиперплазии, митозы либо отсутствуют вовсе, либо единичные. Зачастую морфологическими признаками простой лейомиомы являются дистрофические изменения (гиалиноз – 50%, отек – 41%). Наибольшие трудности в диагностике представляют митотически активная и атипическая ЛМ, поскольку могут обладать относительно высокой митотической активностью и признаками клеточного атипизма [4, 5]. В целях дифференциальной диагностики в трудных случаях митотически активной и атипической ЛМ тела матки возникла необходимость поиска нового, более совершенного метода диагностики. Известен ряд исследований, посвященных анализу генетических изменений, характерных для лейомиосаком (ЛМС) матки [6, 7, 8]. Авторами установлено, что для данного типа сарком характерны аллельные делеции (потеря гетерозиготности (ПГ) и микросателлитная нестабильность (МН) локусов 3р, 9р, 10р, 10q, 17q. Однако, в каждом из перечисленных исследований авторы оценивали генетические изменения в ЛМС матки только в отдельных локусах и не пытались рассмотреть совокупность этих изменений и создать на их основе диагностическую систему для дифференциальной диагностики ЛМС и пЛМ.
К маркерам канцерогенеза относят внутриге-номные перестройки микросаттелитных ДНК, происходящие при нарушениях процессов репарации. Микросателлитные ДНК – тандемно организованные, высокоповторяющиеся последовательности, расположенные в нетранслируе-мой области генома, длиной от 1 до 4 пар нуклеотидов. Опухолевый геном характеризуется генетической нестабильностью микросателлитов. Признаками нестабильности повторов являются ПГ – изменение суммарной длины микросателлитов и МН – появление новых микросателлитов. ПГ и МН являются чувствительными маркерами опухолевых клеток. Проблемы, возникающие при необходимости дифференциальной диагностики высокодифференцированной ЛМС и пЛМ, обусловлены тем, что применяемые в настоящее время диагностические методы (инструментальные исследования, морфологические и иммуногистохимические) не достаточно информативны. Поэтому, было принято решение исследовать опухоль генетическим методом [9, патент на изобретение 19RU11 248158513 C1 51МПК G01N33/574 (2006.01)].
Приводим собственное наблюдение атипической ЛМ матки с клинико-морфологическим, иммуногистохимическим и молекулярногенетическим дифференциальным диагнозом с ЛМС матки.
Пациентка П., 44 лет. Наследственность по онкопатологии не отягощена. В 2007 г – по поводу травмы ноги выполнена артроскопия и остеосинтез. Менструации с 12 лет по 5 дней, через 26 дн., половая жизнь с 17 лет. Было 2 беременности, закончившиеся родами (из них 1 – кесарево сечение). После 1-х родов – диатермокоагуляция «эрозии» шейки матки. Рост 175 см, вес 70 кг. Жалобы на боли внизу живота различной интенсивности, иррадиирующие в поясницу, обильные менструации. В течение последних 5 лет – миома матки с постепенным ростом, за лето 2013 года отмечено увеличение узла миомы. По данным УЗИ – миома матки больших размеров со вторичными изменениями в узле (возможно, клеточная миома). При гинекологическом осмотре тело матки увеличено до 15-16 недель беременности.
26 августа 2013 г. в плановом порядке произведена операция: гистероскопия, диагностическое выскабливание слизистой полости матки, лапароскопия, разделение спаек, миомэктомия без вскрытия полости матки, реинфузия аутоэритроцитов. Интраоперационно: в малом тазу тело матки бледно-розового цвета, увеличено за счет межмышечного узла миомы, растущего по левому ребру матки до 14 см в диаметре. Отмечается выраженный отек узла, расширение сосудистой сети под серозным покровом матки. К передней стенке матки подпаян мочевой пузырь толстой сосудистой спайкой. Придатки матки с 2-х сторон без особенностей, фолликулярный аппарат яичников сохранен, маточные трубы визуально не изменены, фимбрии сохранены. Печень, желчный пузырь, аппендикс без патологии. Париетальная брюшина гладкая, блестящая. Свободной жидкости в брюшной полости нет. После разделения спаек над узлом миомы рассечен серозный покров и миометрий, узел захвачен 10 мм пулевым зажимом, вылущен с техническими трудностями ввиду отсутствия четких границ тканей, хрупкости опухолевого узла, его отека; часть узла отправлена на срочное гистологическое исследование; стенка матки зашита восьмиобразными викриловыми швами в 2 этажа, отмечается повышенная кровоточивость тканей. Узел удален из брюшной полости путем морцеляции. Брюшная полость промыта физраствором и осушена. К швам на матке подведена пластинка Surgicel. Троакары извлечены. Апоневроз левого троакарного отверстия зашит. Швы на кожу. Асептические наклейки. Моча по катетеру 250 мл. Общая кровопотеря 1100 мл. Произведена реинфузия аутоэритроцитов 600
мл с Ht=60%.
Патологоанатомическое исследование было проведено в два этапа – срочное и плановое. На срочное гистологическое исследование было было прислано два фрагмента из узлового образования матки: 2,5х1,0 см и 1,5х1,5 см соответственно, серого цвета, мягкой консистенции. В результате исследования криостатных срезов была диагностирована клеточная лейомиома тела матки. На плановое исследование был доставлен морцелят миоматозного узла массой 217 гр., серого цвета, волокнистого строения, соскоб с поверхности разреза не получен. При микроскопическом исследовании: опухоль построена из многочисленных пучков гладкомышечных клеток с увеличенными, местами гиперхромными ядрами и слабо выраженной соединительнотканной стромой. Митотическая активность составила менее 5 митозов в 10 полях зрения (Рис.1 А, Б). В интерстициальной строме опухоли встречались очаги кровоизлияний и небольшие фокусы коагуляционного некроза. На отдельных участках выявлялись структуры внутрисосудистого лейомиоматоза При иммуногистохимическом исследовании материала были получены следующие результаты: опухолевые клетки дают положительную реакцию на гладкомышечный актин (SMA), десмин (Des), рецепторы прогестерона (PR), Н-кальдесмон; отрицательные реакции на c-kit (CD117), ЭР, кератины, CD10, р53, р16. Индекс пролиферации Ki-67 имел непостоянные показатели, не
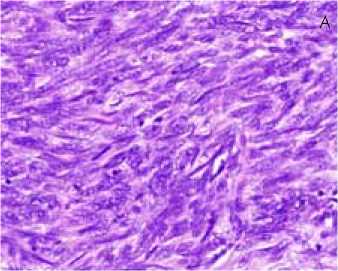
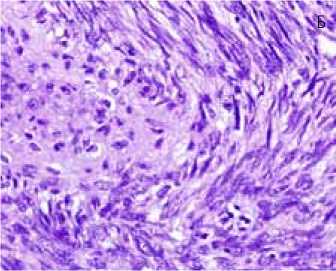
Рис. 1. Гистологическое строение атипической лейомиомы матки
1А: лейомиома построена из пучков гладкомышечных клеток с гиперхромными ядрами тесно прилегающие друг к другу. Окраска гематоксилин и эозин, х400
1Б: периваскулярная зона роста с фигурами митоза в лейомиоме. Окраска гематоксилин и эозин, х400
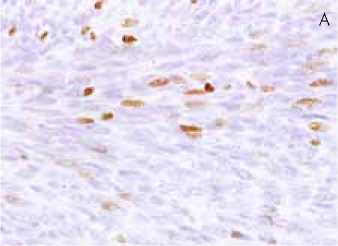
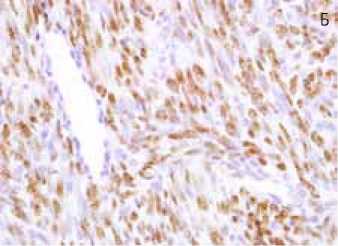
Рис. 2. Иммуногистохимическая характеристика атипической лейомиомы
2А: экспрессия Ki67 в ядрах опухолевых клеток, х400
2Б: экспрессия прогестероновых рецепторов в ядрах опухолевых клеток, х400
превышая 10% (Рис. 2 А, Б). Для проведения дифференциального диагноза между атипической ЛМ и ЛМС было проведено молекулярногенетическое исследование образцов ткани ЛМ и эндометрия (контроль) этой пациентки.
Молекулярно-генетическое исследование было проведено в лаборатории эпигенетики ФГБУ МГНЦ РАМН ведущим научным сотрудником Кекеевой Ю.В. Исследовалась микроса-теллитная нестабильность генома опухоли по методике группы авторов (патент на изобретение 19RU11 248158513 C1 51МПК G01N33/574 (2006.01) .
Выделение ДНК из операционного материала, фиксированного в формалине с последующей парафинизацией, осуществлялось с помощью коммерческого набора «ДНК-Сорб (В/ АМ)» (ИнтерЛабСервис, РФ) и/или, для особо малых количеств материала, набором «QIAamp DNA FFPE Tissue kit» (QIAGEN, Германия) в соответствии с приложенными инструкциями. Депарафинизацию материала проводили по стандартной схеме. Анализ микросателлит-ной нестабильности и потери гетерозиготности локусов D3S1295, D9S942, D10S1213, D10S1146, D10S24, D10S218 выполняли с помощью количественного флуоресцентного капиллярного денатурирующего электрофореза на генетическом анализаторе AB Genetic Analyzer 3500xl. Геномную ДНК выделяли набором QIAamp DNA FFPE Tissue kit для последующей амплификации. Продукты ПЦР детектировали при помощи электрофореза в 6% денатурирующем ПААГ, 8% ПААГ.
В исследованном материале ЛМ не было обнаружено микросателлитной нестабильности и потери гетерозиготности, характерных для ЛМС. Таким образом, с учетом гистологического, иммуногистохимического и генетического исследований, гистологической картины, опухоль матки следует расценивать как атипическую лейомиому тела матки.
Заключение
Морфологическое исследование и определение гистологического типа лейомимы в настоящее время стало эффективнее, благодаря внедрению и широкому использованию современных методов диагностики опухолей. В трудных случаях дифференциальной диагностики ЛМ и ЛМС рекомендуется использование комплекса гистологических, иммуногистохимических и молекулярно-генетических методов диагностики с анализом микросателлитной нестабильности и потери гетерозиготности локусов D3S1295, D9S942, D10S1213, D10S1146, D10S24, D10S218.
Список литературы Трудности дифференциального диагноза между атипической лейомиомой и лейомиосаркомой тела матки
- Vollenhoven BJ, Healy DL. Short-and long-term effects of ovulation induction. Endocrinol Metab Clin North Am. 1998 Dec; 27(4): 903-14.
- Гинекология. Учебник. Под ред. Савельева Г.М., Бреусенко В.Г. 2007 г. 432 с.
- Baird DT, Brown A, Cheng L, Critchley HO, Lin S, Narvekar N, Williams AR. Mifepristone: a novel estrogen-free daily contraceptive pill. Steroids. 2003 Nov;68(10-13):1099-105.
- WHO classification of tumours of female reproductive organs. WHO. France, Lyon: International Agency for Research on Cancer, 2014. 307 p.
- Миома матки (современные проблемы этиологии, патогенеза, диагностики и лечения)/Под ред. И.С. Сидровой. М.: Медицинское информационное агенство, 2002. 256 с.
- Quade BJ, Pinto AP, Howard DR, Peters WA 3rd, Crum CP. Frequent loss of heterozygosity for chromosome 10 in uterine leiomyosarcoma in contrast to leiomyoma. American Journal of Pathology. 1999;154(3):945-50.
- Sabah M, Cummins R, Leader M, Kay E. Leiomyosarcoma and malignant fibrous histiocytoma share similar allelic imbalance pattern at 9p. Virchows Archiv. 2005; 446:251-8.
- Cho YL, Bae S, Koo MS. Array comparative genomic hybridization analysis of uterine leiomyosarcoma. Gynecol Oncol. 2005; 99(3): 545-51.
- Шикеева А.С., Кекеева Т.В., Завалишина Л.Э., Андреева Ю.Ю., Франк Г.А. Анализ потери гетерозиготности и микросателлитной нестабильности в дифференциальной диагностике лейомиосарком и пролиферирующих лейомиом матки. Архив патологии. 2011. 73, 47-50.


