Тучные клетки миокарда и адаптация сердца к физической нагрузке
Автор: Арташян Ольга Сергеевна, Храмцова Юлия Сергеевна, Тюменцева Наталья Валерьевна, Юшков Борис Германович, Черешнев Валерий Александрович
Журнал: Человек. Спорт. Медицина @hsm-susu
Рубрика: Физиология
Статья в выпуске: 2 т.21, 2021 года.
Бесплатный доступ
Цель: изучить основные морфометрические показатели кардиомиоцитов, микроциркуляторного русла и тучных клеток сердца крыс при физической нагрузкe на фоне нормального и измененного метаболизма кардиомиоцитов. Материалы и методы. Крыс подвергали физической нагрузке, которая заключалась в ежедневном плавании с грузом 20 % от массы тела, 5 циклов по 1 минуте нагрузка/отдых, на протяжении 4 недель. Для изменения метаболизма кардиомиоцитов использовали вещество мельдоний. На гистологических препаратах производили оценку состояния сердца по показателям: количество кардиомиоцитов на 1 мм2, диаметр кардиомиоцитов, количество ядер кардиомиоцитов, количество кровеносных сосудов на 1 мм2, площадь кровеносных сосудов в мм2; количество тучных клеток на 1 мм2; оценивали синтетическую и дегрануляционную активность тучных клеток. Результаты. Установлено, что у крыс при ежедневном плавании гипертрофия кардиомиоцитов и возрастание числа кровеносных сосудов развиваются параллельно увеличению числа и функциональной активности тучных клеток в миокарде. Под влиянием вещества мельдоний, смещающего энергетический обмен кардиомиоцитов в сторону окисления глюкозы, отмечается ослабление гипертрофии последних и отсутствует реакция тучных клеток. Заключение. Выявленные результаты указывают на возможную связь физиологической гипертрофии миокарда с состоянием иммунной системы и зависимость чувствительности кардиомиоцитов к медиаторам тучных клеток от метаболических процессов в них.
Тучные клетки (мастоциты), миокард, кардиомиоциты, гипертрофия, стресс, физическая нагрузка, мельдоний
Короткий адрес: https://sciup.org/147231909
IDR: 147231909 | УДК: 612.017.2 | DOI: 10.14529/hsm210204
Текст научной статьи Тучные клетки миокарда и адаптация сердца к физической нагрузке
Введение. В последние годы сформировалось четкое представление об иммунной системе как элементе единой нейроиммуно-эндокринной системы и внимание исследователей все больше привлекает ее роль в регуляции физиологических функций. Особый интерес представляют тучные клетки – многоликие фигуры естественного иммунитета, определяющие значительно больше процессов в тканях, нежели просто генерирование воспаления и расширение сосудов в IgE-зависимых реакциях на антиген.
Физиологическая гипертрофия миокарда появляется, когда сердце испытывает большие периодические нагрузки, сменяющиеся паузами. Такой вид увеличения сердца часто встречается у спортсменов, когда интенсивные тренировки сменяются отдыхом. Вместе с ростом волокон мышц растут нервы, капилляры, поэтому кровоснабжение, нервная трофика остаются нормальными. Такой вид гипертрофии означает сбалансированный рост тканей, который позволяет сердцу эффективно работать в условиях повышенной нагрузки. Вместе с тем возникает вопрос о координации роста мышечных клеток, сосудов и нервов. На роль такого координатора могут претендовать тучные клетки. В миокарде они составляют 4–9 % от общего количества немышечных клеток [1]. Тучные клетки локализуются в периваскулярной ткани, адвентиции сосудов, выявляются также в коронарной атероме. Они являются высоко гетерогенными иммунными клетками, обладающими созвездием поверхностных рецепторов и продуцирующими широкий спектр воспалительных и иммуномодулирующих медиаторов. Эти особенности позволяют клеткам действовать как часовые в опасных ситуациях, а также реагировать на метаболические изменения в их микроокружении [6]. Сердечные тучные клетки хранят и секретируют целый ряд медиаторов, которые могут определять множественные эффекты в гомеостатическом контроле кардиометаболических функций [4].
Кардиомиоциты способны адаптировать- ся к доступным ресурсам и вырабатывать энергию путем окисления глюкозы, жирных кислот, лактата и кетоновых тел. Соотношение между путями получения энергии меняется при действии на организм экстремальных факторов и при патологии [2].
Цель работы: изучить основные морфометрические показатели кардиомиоцитов, микроциркуляторного русла и тучных клеток сердца крыс при физической нагрузкe на фоне нормального и измененного метаболизма кардиомиоцитов.
Материалы и методы. Исследование проводили на половозрелых крысах самцах линии Вистар массой 125–270 г. Условия содержания и обращение с используемыми в эксперименте животными соответствовали Директиве Европейского парламента и Совета от 22 сентября 2010 г. «О защите животных, которых используют для научных целей» (2010/63/EU). На проведение данного экспериментального исследования получено разрешение локального этического комитета ИИФ УрО РАН (протокол № 10 от 03.06.2016).
Животных подвергали физической нагрузке, которая заключалась в ежедневном плавании с грузом 20 % от массы тела, 5 циклов по 1 минуте нагрузка/отдых, на протяжении 4 недель.
Для изменения метаболизма кардиомиоцитов использовали вещество мельдоний – согласно международному союзу теоретической и прикладной химии (МСТПХ, англ. IUPAC) – 3-(2,2,2-триметилгидразиний) пропионата дигигдат [3]. В условиях ишемии мельдоний способствует смещению энергетического обмена в сторону окисления глюкозы, что в условиях дефицита O 2 позволяет клеткам снизить его потребление и увеличить образование энергии.
Экспериментальные животные были разделены на 2 группы: 1) крысы, подвергнутые только физической нагрузке, n = 7; 2) крысы, которым за 10 минут перед каждым воздействием вводили внутримышечно вещество мельдоний в дозе 10 мг/кг, n = 7. Контрольную группу составили интактные крысы (n = 7). Животных выводили из эксперимента через 4 недели путем передозировки эфирного наркоза.
Для гистологического исследования брали сердца, которые фиксировали в 10%-ном растворе нейтрального формалина. После стандартной гистологической проводки на автома- те закрытого типа Shandon Excelsior (MICROM International GmbH, Германия) материал заливали в парафин с помощью станции для заливки биологических тканей парафином EG 1160 (Leica, Германия). После этого полученные парафиновые блоки нарезали на полуавтоматическом микротоме Thermo scientific Microm HM 450 (MICROM International GmbH, Германия), толщина срезов сердца составляла 4–5 мкм.
Для морфометрических исследований препараты окрашивали гематоксилин-эози-ном, для выявления тучных клеток – толуидиновым синим и азуром II. С помощью светового микроскопа (Leica DFC 420, Германия) производили оценку состояния сердца с помощью программы Imagej по следующим показателям: количество кардиомиоцитов на 1 мм2, диаметр кардиомиоцитов, количество ядер кардиомиоцитов, количество кровеносных сосудов на 1 мм2, площадь кровеносных сосудов в мм2.
Подсчет тучных клеток в сердце проводили на единицу площади с пересчетом на 1 мм2. Для оценки синтетической и дегрануляцион-ной активности тучные клетки классифицировали на 4 типа. К «1» типу относили клетки с малым содержанием гранул секрета в цитоплазме, который располагался околомембран-но. Тип «2» – клетки с хорошо дифференцированной гранулярностью в цитоплазме и диффузным расположением гранул. Тип «3» – крупные клетки с плотным и диффузным расположением гранул в цитоплазме. К типу «0» относили дегранулированные клетки с признаками нарушения целостности цитоплазматической мембраны и выделения в окружающее тканевое пространство цитоплазматических гранул. Для определения синтетической активности вычисляли средний гистохимический коэффициент (СГХК): СГХК = (3n + 2n + + 1n + 0n) / 100, где n – соответственно число клеток типа 3, 2, 1 или 0 согласно классификации, приведенной выше, 100 – общее число подсчитанных клеток в группе. Для оценки функциональной активности по выбросу гранул тучных клеток в межклеточное пространство использовали коэффициент дегрануляции (КД, %), который рассчитывали по формуле: КД = Д/(Д+Н) × 100, где Д – число клеток с явными признаками дегрануляции, Н – число не активированных тучных клеток.
Статистическую обработку данных проводили с помощью программы Statistica 8.0.
Сравнение групп выполняли с использованием критерия Манна – Уитни. Различия считали достоверными при р < 0,05.
Результаты. Полученные данные свидетельствуют, что у интактных крыс сердце характеризуется наличием кардиомиоцитов со средним диаметром 69,17 ± 7,08 мкм. Количество кровеносных сосудов, пронизывающих волокна кардиомиоцитов, составляет 2,56 ± 0,69 единицы на 1мм2 (табл. 1, рис. 1).
При анализе состояния тучных клеток ин- тактного сердца были выявлены разнообразные типы мастоцитов, отличающиеся содержанием гранул в цитоплазме. В ткани сердца встречается относительно большое количество клеток с низким и средним содержанием гранул в цитоплазме типа «1+» и «2+». Наблюдается низкое содержание клеток, находящихся в состоянии активной дегрануляции типа «0». В то же время в физиологических условиях в сердце содержится достаточно низкое количество зрелых мастоцитов
Таблица 1
Table 1
Основные морфологические показатели сердца крыс экспериментальных групп
The main morphological indicators of the rat heart in experimental groups
|
Показатели сердца Heart indicators |
Экспериментальные группы Experimental groups |
||
|
Интактные крысы Intact rats |
Крысы, подвергавшиеся физической нагрузке Trained rats |
Крысы, подвергавшиеся физической нагрузке + мельдоний Trained rats + meldonium |
|
|
Площадь сосудов (мм2) Vessel area (mm2) |
0,16 ± 0,07 |
0,05 ± 0,01 |
0,11 ± 0,05 |
|
Количество сосудов (ед. / 1 мм2) Number of vessels (per mm2) |
2,56 ± 0,69 |
5,25 ± 0,63* |
2,60 ± 0,98** |
|
Количество кардиомиоцитов (кл. / 1 мм2) Number of cardiomyocytes (per mm2) |
200,80 ± 11,37 |
211,50 ± 5,6 |
200,13 ± 13,23 |
|
Диаметр кардиомиоцитов (мкм) Diameter of cardiomyocytes (μm) |
69,17 ± 7,08 |
102,00 ± 4,08* |
85,05 ± 3,43*,** |
|
Количество ядер кардиомиоцитов (ед. / 1 мм2) Number of nuclei (per mm2) |
314,96 ± 23,23 |
319,00 ± 17,23 |
369,00 ± 24,74 |
Примечание: * различие с группой интактных крыс достоверно (р < 0,05), ** различие с группой крыс, подвергавшихся физической нагрузке, достоверно (р < 0,05).
Note: * differences are significant in relation to intact rats (р < 0.05), **differences are significant in relation to trained rats (р < 0.05).
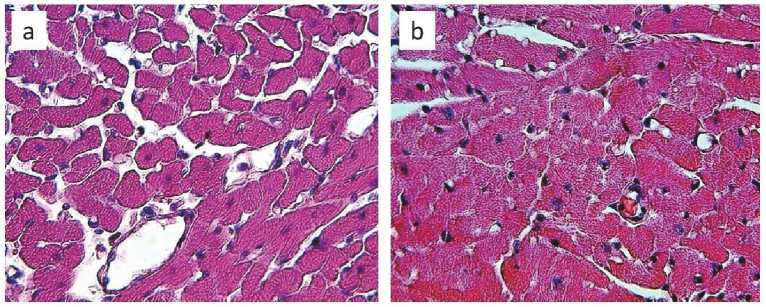
Рис. 1. Кардиомиоциты крыс, окраска гематоксилин-эозин, увеличение ×400: а – кардиомиоциты интактных крыс, b – кардиомиоциты крыс, подвергавшихся физической нагрузке
Fig. 1. Cardiomyocytes of rats, hematoxylin and eosin staining, ×400: а – cardiomyocytes of intact rats, b – cardiomyocytes of trained rats
с высоким содержанием гранул в цитоплазме типа «3+», что свидетельствует о том, что тучные клетки сердца находятся в состоянии относительной активности (табл. 2, рис. 2).
У крыс, подвергавшихся плаванию на протяжении 4 недель, развивается отчетливо выраженная физиологическая гипертрофия: количество кардиомиоцитов и ядер на единицу площади достоверно не изменяется, но существенно выражена функциональная гипертрофия волокон. Наблюдается возрастание числа кровеносных сосудов, образовавшихся путем неоангиогенеза в миокарде. В ходе этого процесса происходит реорганизация первичной капиллярной сети (см. табл. 1). Поддержание адекватного уровня кровотока является непременным условием восполнения структурно-функциональных повреждений клеток при гипоксии и ишемии. Главными участниками стимуляции ангиогенеза выступают факторы роста сосудов, поступающие в ишемизированную сердечную ткань. Они
Таблица 2
Table 2
Характеристика тучных клеток сердца крыс экспериментальных групп
Mast cells of the rat heart
|
Показатели тучных клеток Indicators of mast cells |
Экспериментальные группы Experimental groups |
||
|
Интактные крысы Intact rats |
Крысы, подвергавшиеся физической нагрузке Trained rats |
Крысы, подвергавшиеся физической нагрузке + мельдоний Trained rats + meldonium |
|
|
Количество клеток «3+» (кл. / 1 мм2) Number of cells «3+» (per mm2) |
0,76 ± 0,08 |
0,97 ± 0,21 |
0,80 ± 0,14 |
|
Количество клеток «2+» (кл. / 1 мм2) Number of cells «2+» (per mm2) |
1,32 ± 0,11 |
2,61 ± 0,06* |
1,80 ± 0,37** |
|
Количество клеток «1+» (кл. / 1 мм2) Number of cells «1+» (per mm2) |
1,40 ± 0,23 |
1,55 ± 0,26 |
1,06 ± 0,01* |
|
Количество клеток «0» (кл. / 1 мм2) Number of cells «0» (per mm2) |
0,04 ± 0,01 |
0,25 ± 0,07* |
0,06 ± 0,01 |
|
Общее количество клеток (кл. / 1 мм2) Total number of cells (per mm2) |
3,52 ± 0,18 |
5,38 ± 0,14* |
3,72 ± 0,21** |
|
СГХК Mean histochemical coefficient |
1,80 ± 0,21 |
1,79 ± 0,05 |
1,91 ± 0,10 |
|
Коэффициент дегрануляции, % Degranulation coefficient, % |
1,14 ± 0,13 |
4,65 ± 0,12* |
1,61 ± 0,86** |
Примечание: * различие с группой интактных крыс достоверно (р < 0,05), ** различие с группой крыс, подвергавшихся физической нагрузке, достоверно (р < 0,05).
Note: * differences are significant in relation to intact rats (р < 0.05), **differences are significant in relation to trained rats (р < 0.05).
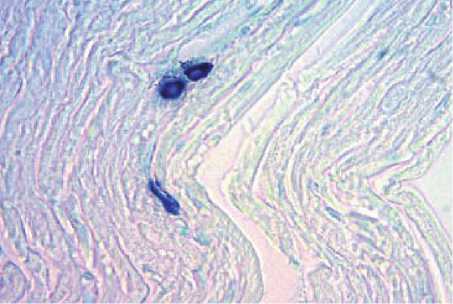
Рис. 2. Тучные клетки сердца крыс, окраска толуидиновый синий, увеличение ×400 Fig. 2. Mast cells of the rat heart, toluidine blue staining, ×400
активируют локальную перфузию и защищают клетки от токсического влияния окислительного стресса.
У экспериментальных животных, подвергавшихся систематической физической нагрузке, наблюдаются как количественные, так и качественные изменения состава тучных клеток в сердце. Общее количество мастоци-тов достоверно увеличивается, происходит это за счет возрастания разных типов клеток, как активно синтезирующих, накапливающих гранулы внутри цитоплазмы, так и дегранулирующих (см. табл. 2). Эти изменения популяции тучных клеток коррелируют с процессами активации со стороны микроциркуля-торного русла в миокарде. Тучные клетки отвечают на стресс увеличением функциональной активности, активируя ангиогенез и усиливая проницаемость сосудов. Секретирующие тучные клетки способны индуцировать и усиливать ангиогенез путем целого комплекса взаимосвязанных механизмов. К ним относятся: активные проангиогенные вещества, такие как фактор роста эндотелия сосудов (VEGF), фактор роста фибробластов (FGFβ), трансформирующий ростовой фактор бета (TGFβ), фактор некроза опухоли (TNFα) и IL-8; протеиназы и гепарин, гистамин, и другие [5, 7]. Все это свидетельствует о реализации компенсаторно-приспособительной реакции компонентов миокарда в виде функциональной гипертрофии кардиомиоцитов и в адаптивном усилении микроциркуляции за счет появления новых сосудов в ответ на повышенную нагрузку, связанных с регуляторным влиянием активированных тучных клеток.
В группе крыс, подвергавшихся плаванию и получавших мельдоний, большинство гистологических показателей не отличается от показателей крыс интактной группы, кроме небольшой гипертрофии кардиомиоцитов (табл. 1).
На фоне приема мельдония количественные и качественные изменения со стороны популяции тучных клеток выражены слабее и все показатели схожи с показателями интактных животных (см. табл. 2).
На нашей экспериментальной модели с длительной периодической физической нагрузкой было продемонстрировано, что прием мельдония – вещества, которое кардинально изменяет метаболизм кардиомиоцитов – ослабляет развитие гипертрофии последних, а также рост и развитие сосудистой сети в сердце по сравнению с контрольными живот- ными. Тучные клетки объективно реагируют на состояние кардиомиоцитов в этих условиях и не активируются в ответ на достаточно сильный стресс, вызванный повышенной физической нагрузкой, соответственно, не оказывают заметного влияния на изменение структуры сердца. Это может быть расценено неоднозначно с точки зрения адаптации сердца к повышенной нагрузке. С одной стороны, мельдоний в условиях недостатка кислорода (при высоких нагрузках у ранее нетренированного животного) помогает более рационально использовать ресурсы клеток сердца, не дает им «перегреться» и пострадать от стресса, переключая метаболические оксида-тивные пути с митохондрий на пероксисомы. С другой стороны, при данном типе метаболизма в кардиомиоцитах, в сердце в целом не происходит структурной адаптации к стрессу, в том числе нет адекватного нагрузке ответа со стороны популяции тучных клеток, и перехода всей системы на новый уровень функционирования.
Заключение. Развитие физиологической гипертрофии миокарда при периодической физической нагрузке зависит от состояния метаболизма в кардиомиоцитах и функциональной активности тучных клеток. Под влиянием вещества мельдоний, смещающего энергетический обмен кардиомиоцитов в сторону окисления глюкозы, отмечается ослабление гипертрофии последних и отсутствие активации тучных клеток сердца. Это указывает на возможную связь физиологической гипертрофии миокарда с состоянием иммунной системы и зависимость чувствительности кардиомиоцитов к медиаторам тучных клеток от метаболических процессов в них.
Работа выполнена в рамках госзадания ИИФ УрО РАН (тема № ААА-А18-118020590108-7). Работа выполнена с использованием оборудования ЦКП ИИФ УрО РАН.
Список литературы Тучные клетки миокарда и адаптация сердца к физической нагрузке
- Горбунов, А.А. Соединительнотканный компонент миокарда: новый этап изучения давней проблемы / А.А. Горбунов // Морфологiя. - 2007. - Т. I, № 4. - С. 6-12.
- Горбунова, А.А. Мельдоний: связь строения, структуры и свойств / А.А. Горбунова, С.Ю. Киреев, И.В. Рашевская // Вестник Пензен. гос. ун-та. Актуальные вопросы естествознания. - 2017. - № 2. - С. 92-99.
- Государственная фармакопея Российской Федерации. - М.: Науч. центр экспертизы средств мед. применения, 2008. - 704 с.
- Mast cells regulate myofilament calcium sensitization and heart function after myocardial infarction / A. Ngkelo, A. Richart, J.A. Kirk et al. // J Exp Med. - 2016. - Vol. 213, No. 7. - Р. 1353-1374.
- Norrby, K. Mast cells and angiogenesis / K. Norrby // APMIS. - 2002. Vol. 110, No. 5. - Р. 355-371.
- Physiological Roles of Mast Cells: Collegium Internationale Allergologicum Update 2019 / G. Varricchi, F.W. Rossi, M.R. Galdiero et al. // Int Arch Allergy Immunol. - 2019. - Vol. 179. - P. 247-261.
- Vascular endothelial growth factors synthesized by human lung mast cells exert angiogenic effects / A. Detoraki, R.I. Staiano, F. Granata et al. // J Allergy Clin Immunol. - 2009. - Vol. 123. - Issue 5. - P.1142-1149.


