Твердофазный иммуноферментный анализ (прямой вариант) для выявления токсигенных холерных вибрионов О1, О139 серогрупп
Автор: Алексеева Л.П., Якушева О.А., Евдокимова В.В., Яговкин М.Э., Зюзина В.П.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Микробиология
Статья в выпуске: 4, 2022 года.
Бесплатный доступ
В результате проведённых исследований оптимизирован метод прямого твёрдофазного иммуноферментного анализа (ТИФА) для выявления токсигенных штаммов холерных вибрионов О1, О139 серогрупп на основе моноклональных и поликлональных антитоксических иммуноглобулиновых пероксидазных конъюгатов. Установлены оптимальные параметры его постановки: сенсибилизация планшета токсинсодержащими препаратами, разведёнными в фосфатно-солевом буфере (ФСБ) рН 7.4 до титра 1:2-1:4, их адсорбция на твёрдой фазе планшета в течение 2 ч. при 37°С, блокировка свободных сайтов связывания 1%-ным раствором бычьего сывороточного альбумина (БСА) - 30 мин. (37°С), время контакта исследуемого образца с моно- или поликлональным пероксидазными конъюгатами - 30 мин. (37°С). Испытания на гомологичных и гетерологичных штаммах показали высокую специфичность иммуноферментного анализа и возможность его использования для обнаружения токсигенных холерных вибрионов.
Холерный токсин, поликлональный и моноклональный пероксидазные конъюгаты, иммуноферментный анализ, лабораторная диагностика холеры
Короткий адрес: https://sciup.org/147239678
IDR: 147239678 | УДК: 579.843.1:612.017.4:57.083.3 | DOI: 10.17072/1994-9952-2022-4-280-287
Текст научной статьи Твердофазный иммуноферментный анализ (прямой вариант) для выявления токсигенных холерных вибрионов О1, О139 серогрупп
В настоящее время в лабораторной практике для оценки токсигенности холерных вибрионов О1, О139 серогрупп и эпидемической значимости выделенных штаммов широко используются молекулярногенетические методы [Mehrabadi et al., 2012; Jin et al., 2013; Greig et al., 2018; Hossain et al., 2018]. Однако определение генов, кодирующих синтез холерного токсина (ХТ), не всегда указывает на наличие экспрессии самого токсина. Кроме того, в ряде ситуаций прямое выявление токсина остаётся предпочтительным, поскольку отмечен высокий уровень мутаций в локусе ctx, которые могут приводить к ложноотрицательным результатам [Ahn-Yoon et al., 2003; Tuteja et al., 2007; Петрова и др., 2009; Алексеева и др., 2019; Bayat et al., 2019]. В связи с этим одновременно используются и иммунологические методы с высокой чувствительностью и специфичностью, так как штаммы холерных вибрионов Эль Тор и серо-группы О139 отличаются низким уровнем продукции токсина in vitro [Shlyapnikov et al., 2012; Meza-Lucas et al., 2016]. В последние годы отечественными специалистами зарегистрированы две тест-системы: иммунохроматографическая «Тест-полоска Vibrio cholerae tox+» [Баранова и др., 2020] и сэндвич-вариант «Тест-система ИФА для определения продукции ХТ штаммами V. cholerae » [Михеева и др., 2014.]. Однако некоторые параметры первой тест-системы, несмотря на экспрессность и простоту постановки, не в полной мере отвечают диагностическим требованиям по чувствительности, вторая отличается многостадийностью, многокомпонентностью, многократной отмывкой планшета, необходимостью приборного оснащения. В связи с этим остаётся актуальной проблема совершенствования и разработки новых, чувствительных и специфических диагностических средств, особенно предполагающих экспресс-тестирование. Нами в рамках плановой темы были разработаны иммуноглобулиновые пероксидазные конъюгаты на основе антитоксических моно- и поликлональных антител, которые можно использовать в прямом варианте твёрдофазного иммуноферментного анализа (ТИФА) для определения продукции ХТ штаммами V. cholerae О1, О139 серогрупп, что позволяет предложить ТИФА в качестве дополнительного или альтернативного теста [Якушева и др., 2020].
Цель настоящей работы – оптимизация условий постановки прямого варианта твёрдофазного имму-ноферментного анализа на полистироловых планшетах с помощью моно- и поликлональных пероксидазных конъюгатов, предназначенных для выявления токсигенных штаммов холерных вибрионов О1, О139 серогрупп.
Материалы и методы исследований
В работе использовали бактериальные штаммы из коллекции Музея живых культур с центром патогенных для человека вибрионов ФКУЗ Ростовский-на-Дону противочумный институт Роспотребнадзора (табл. 1).
В качестве источника токсина использовали супернатанты токсигенных штаммов. Разведения токсина и токсинсодержащих образцов готовили в буферных растворах – 0.01 М карбонат-бикарбонатном (КББ), рН 9.5; 0.01 М фосфатно-солевом (ФСБ), рН 7.4.
Положительным контролем служил препарат очищенного ХТ 0.05 мкг/мл [Алексеева и др., 2019], отрицательным – среда AKI.
Постановку ТИФА осуществляли следующим образом: в 96-луночные полистироловые планшеты последовательно вносили: исследуемый образец + моно- или поликлональный пероксидазный конъюгат + субстратная смесь + стоп-реагент [Егоров, 1991; Crowther, 2009]. Работу проводили, используя планшеты различных производителей: «Медполимер» (РФ), «Nunc» (Дания), «Costar» (USA). После каждого этапа следовала процедура отмывания планшета от несвязавшихся компонентов реакции.
Выявление холерного токсина в супернатантах (СН) токсигенных штаммов холерных вибрионов осуществляли с помощью моно- и поликлональных пероксидазных конъюгатов, полученных в ФКУЗ Ростовского-на-Дону противочумного института Роспотребнадзора. Все штаммы выращены в среде АКI по стандартному методу M. Iwanaga [Iwanaga, Kuyyakanond, 1987]. Бактерии подращивали в пробирках (высота 150 мм; диаметр 15 мм) в среде AKI в течение 4 ч. при 37°С. Культуру переносили в колбы Эрленмейера в дозе 2×107 м.к./мл, соблюдая соотношение один объем бульона AKI на 10 объемов колбы. Последующее культивирование проводили при интенсивном встряхивании на термостатируемом шуттель-аппарате «Environmental Shaker-Incubator» ES-20/60 при 120 об./мин в течение 20 ч. при 37°С. Бактериальную массу обеззараживали мертиолятом натрия (1:10000), выдерживали 1 сут. в холодильнике, после чего делали трехкратные высевы на специфическую стерильность. Обеззараженные микробные клетки осаждали центрифугированием в течение 10 мин. при 8000 об./мин. Экспериментальная работа проводилась с учетом требований санитарных правил СП 3.3686-21 «Санитарно-эпидемиологические требования по профилактике инфекционных болезней», СП 1.3.2322-2008 «Безопасность работы с микроорганизмами III и IV групп патогенности (опасности) и возбудителями паразитарных болезней».
Таблица 1
Штаммы холерных вибрионов О1 и О139 серогрупп, использованные в работе
[Strains of V. cholerae O1 and O139 serogroups used in this study]
Штаммы I Генотип I Источник выделения I Год выделения^1 Место выделения
Vibrio cholerae О1 серогруппы классического биовара
|
569B |
ctxAВ1+, tcpA+ |
человек |
1950 |
Индия |
|
500 |
ctxAВ1+, tcpA+ |
- |
1968 |
Пакистан |
|
1763 |
ctxAВ1+, tcpA+ |
человек |
1947 |
Индокитай |
Vibrio cholerae О1 серогруппы Эль Тор биовара
|
1310 |
ctxAВ3+, tcpA+ |
человек |
1966 |
Ирак, г. Багдад |
|
3119 |
ctxAВ3+, tcpA+ |
человек |
1970 |
г. Одесса |
|
5879 |
ctxAВ3+, tcpA+ |
человек |
1972 |
г. Таганрог |
|
12214 |
ctxAВ3+, tcpA+ |
человек |
1976 |
н/д |
|
13020 |
ctxAВ3+, tcpA+ |
человек |
1986 |
г. Азов |
|
14383 |
ctxAВ3+, tcpA+ |
человек |
1990 |
Ростовская обл. х. Колузаево |
|
14455 |
ctxAВ3+, tcpA+ |
человек |
1990 |
г. Ставрополь |
|
14460 |
ctxAВ3+, tcpA+ |
человек |
1990 |
г. Ставрополь |
|
14464 |
ctxAВ3+, tcpA+ |
человек |
1990 |
г. Ставрополь |
Vibrio cholerae О1 серогруппы Эль Тор биовара (геноварианты)
|
17917 |
ctxAВ1+, tcpA+ |
вода |
1999 |
вода |
|
19667 |
ctxAВ7+, tcpA+ |
человек |
2014 |
г. Москва |
Vibrio cholerae О139 серогруппы
|
16070 |
ctxAВ+, tcpA+ |
н/д |
н/д |
Индия |
|
16063 |
ctxAВ+, tcpA+ |
человек |
1993 |
Ростовская обл. г. Азов |
|
16064 |
ctxAВ+, tcpA+ |
человек |
1993 |
Ростовская обл. г. Азов |
Vibrio cholerae О1 серогруппы Эль Тор биовара
|
19766 |
сtxАВ–, tcpА– |
вода |
2015 |
г. Элиста, пруд Заячий |
|
19778 |
сtxАВ–, tcpА– |
вода |
2015 |
Иркутская обл. р. Ангара |
|
19791 |
сtxАВ–, tcpА– |
вода |
2015 |
Краснодарский край, р. Агура |
|
19813 |
сtxАВ–, tcpА– |
человек |
1998 |
г. Мариуполь |
|
19875 |
сtxАВ–, tcpА– |
вода |
2015 |
г. Элиста, пруд Заячий |
Vibrio cholerae О139 серогруппы
|
17675 |
сtxАВ–, tcpА– |
вода |
1997 |
г. Москва, р. Москва |
|
17677 |
сtxАВ–, tcpА– |
вода |
1997 |
г. Москва, р. Москва |
|
17678 |
сtxАВ–, tcpА– |
вода |
1997 |
г. Москва, р. Москва |
Гетерологичные микроорганизмы
|
Escherichia сoli 1961 |
н/д |
1965 |
н/д |
|
Escherichia сoli 1962 |
н/д |
1965 |
н/д |
|
Aeromonas hydrophila Р-143 |
вода |
1944 |
г. Ростов-на-Дону, р. Дон |
|
Aeromonas hydrophila Р-1269 |
вода |
1959 |
г. Санкт-Петербург, р. Нева |
|
Salmonella typhimurium 1288 |
н/д |
1960 |
г. Лондон |
|
Salmonella typhimurium 4446 |
н/д |
н/д |
г. Лондон |
Примечание: н/д – нет данных.
Оценивали эффективность 3-температурных режимов для адсорбции токсинсодержащих препаратов на твёрдой фазе полистироловых планшетов: 1) 2 ч. в термостате (37°С); 2) 2 ч. в термостате (37°С) и 18– 20 ч. при температуре 4°С; 3) 18–20 ч. (4°С).
Процедуру блокирования свободной от иммунореагентов поверхности полистироловых планшетов проводили в течение 30 мин. (37°С) с применением в качестве блокирующего агента бычьего сывороточного альбумина в концентрациях 0.5, 1 и 2%; эмбриональной 5%-ной телячьей сыворотки; 1%-ного сухого обезжиренного молока.
Контакт ХТ с конъюгатами осуществляли в течение 30, 45, 60 мин. с целью определения оптимального времени инкубации.
Для разведения конъюгата использовали 0.01М ФСБ с добавлением 0.05%-ного Твин-20 (рН 7.4). Реакцию проявляли свежеприготовленным субстратным раствором ТМБ (3.3'.5.5'-тетраметилбензидин) в течение 25 мин., после её остановки 2 М серной кислотой измеряли значения оптической плотности. Результаты ИФА регистрировали с помощью спектрофотометра «Bio Tek EL 800» (Bio Tek Instruments, США) при длине волны 450 нм (референс-волна 630 нм). Все исследования проводили не менее чем в трех повторностях.
При анализе результатов были использованы статистические методы (p < 0.05). Все исследования осуществлялись в трех повторностях [Ашмарин, Воробьев, 1962].
Результаты и их обсуждение
Своевременная и достоверная характеристика свойств штаммов холерных вибрионов, выделенных от людей и из объектов окружающей среды, является важным моментом при определении тактики противоэпидемических мероприятий. Однако решающее значение приобретает получение информации о способности конкретных штаммов продуцировать холерный энтеротоксин и, следовательно, вызывать холерогенный синдром у чувствительного хозяина. В экспериментах использовали антитоксические моно- и поликлональные пероксидазные конъюгаты, предназначенные для детекции токсигенных штаммов холерных вибрионов О1 и О139 серогруппы в прямом варианте планшетного ИФА.
На первом этапе оптимизации условий постановки ТИФА были приняты во внимание сорбционные свойства твёрдой фазы, в качестве которой использовались 96-луночные планшеты для ИФА. С этой целью препараты очищенного ХТ титровали в планшетах различных производителей. Судя по показателям оптической плотности (ОП) в отношении ХТ, равном 1.505±0.018, максимальной сорбционной способностью обладали планшеты фирмы «Costar», тогда как планшеты фирм «Медполимер» и «Nunc» имели ОП 0.801±0.002 и 1.207±0.021 соответственно. В итоге установлено, что предпочтительнее использование планшетов фирмы «Costar». Планшеты других производителей обладали меньшей сорбционной способностью и однородностью сорбции. В связи с этим для работы выбраны планшеты «Costar», позволяющие достигать более высокой чувствительности и стандартности анализа.
Чувствительность, точность, воспроизводимость являются основными параметрами иммунофермент-ного анализа, которые могут существенно изменяться при вариации условий эксперимента (температура, ионная сила, рН реакционной среды, концентрационные соотношения компонентов и продолжительность их взаимодействия). Это определяет необходимость оптимизации каждой стадии анализа, для чего используют эмпирический подбор параметров в постановке ТИФА [Курчева и др., 2016].
Первоначально установили оптимальную сенсибилизирующую дозу токсинсодержащих образцов на твёрдой фазе планшета и буферный раствор для их разведения и адсорбции. Испытуемые препараты разводили в КББ рН 9.6 или ФСБ рН 7.4, начиная с 1:2, поскольку неразведённые супернатанты наряду с токсином содержат широкий спектр биологически активных веществ, что может приводить к ложноположительным результатам, особенно в реакции с антитоксической поликлональной сывороткой. Наличие ХТ в составе СН выявляли с помощью моно- и поликлональных пероксидазных конъюгатов в прямом варианте ТИФА. Продемонстрировано (рис. 1), что применение ФСБ для разведения испытуемых образцов более предпочтительно, так как обеспечивает эффективную адсорбцию токсина на поверхности полистироловых планшетов, и тому подтверждение высокие показатели ОП в реакции с моно- и поликлональным конъюгатами по сравнению с КББ.
1,8 ■) СН (рауводемке в ФСБ) *
„ поликлональный конъюгат
1,4
\ СН (ратводгмнг в ФСБ) *
_ ' _ ' моноклональный конъюгат
О 0,6 -I «Х? ----- СН (рауведенне в КББ) *
поликлональный конъюгат 0.4 - >№
0.2 J
О ----- 1------ 1------1-----1 - - * - - СН (рауведяше в КББ) *
2 4 8 16 монок-томальный конъюгат
Ратведеннесупернатанта
Рис. 1. Определение оптимальных разведений супернатанта штамма V. cholerae El Tor ctx+.
По горизонтали: обратное значение титра супернатанта штамма V. cholerae El Tor 19167; по вертикали: средние значения оптических плотностей в ТИФА
[Determination of optimal dilutions of V. cholerae El Tor ctx+ strain supernatant.
Horizontal: inverse titer value of the supernatant of V. cholerae El Tor 19167 strain; vertical: average optical densities in ELISA test]
Определение оптимального разведения супернатантов показало, что оно находится в пределах 1:2 1:4, поскольку именно в этом диапазоне регистрируются максимальные значения ОП.
Интенсивность иммуноферментной реакции также существенно зависит от времени экспозиции для адсорбции токсина в лунках планшета и температуры, при которой она осуществляется. В наших экспериментах были испытаны три различных режима, указанных в «Материалах и методах исследований».
Анализ полученных результатов (рис. 2) позволил установить, что оптимальным для сенсибилизации в лунках планшета токсинсодержащих образцов является режим 2 ч. и температура 37°С, в то время как при выдержке в течение 18–20 ч. в условиях холодильника и 2 ч. в термостате (37°С) адсорбционная способность несколько ниже. Менее эффективной является сенсибилизация СН, если она длится 18 ч. только при 4°С.
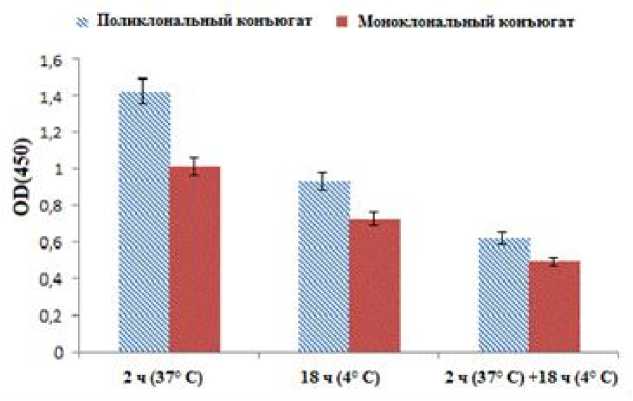
Рис. 2. Определение оптимальных условий сенсибилизации супернатантов токсигенных холерных вибрионов в планшетном варианте ТИФА.
По горизонтали: время и температура экспозиции адсорбции токсина в лунках планшета; по вертикали: средние значения оптических плотностей в ТИФА
[Determination of optimal conditions for sensitization of supernatants of toxigenic cholerae vibrio in the ELISA plate version.
Horizontal: time and temperature of toxin adsorption exposure in the wells of the plate; vertical: mean values of optical densities in the ELISA test]
С целью снижения неспецифической реакции были проведены исследования по уменьшению фоновых «помех» при использовании различных концентраций 0.5, 1, 2% бычьего сывороточного альбумина (БСА), 5%-ной эмбриональной телячьей сыворотки, 1% сухого обезжиренного молока в фосфатносолевом буфере рН 7.4. Результаты экспериментов показали, что блокирование свободных центров связывания на планшете целесообразно проводить 1%-ным раствором БСА в ФСБ рН 7.4, поскольку его использование уменьшало фоновые «помехи», при этом увеличение концентрации БСА не влияло на результаты.
Следующий этап наших исследований включал определение оптимального рабочего разведения полученных конъюгатов, дающих максимальную цветовую реакцию при внесении их в полистироловые планшеты. Рабочее разведение моноклонального пероксидазного конъюгата составило 1:32, а поликлонального – 1:64, чувствительность метода – 10 нг/мл ХТ [Якушева и др., 2020].
Для определения оптимальной продолжительности инкубации токсинсодержащих препаратов с конъюгатами в ТИФА оценивали интенсивность реакции в зависимости от времени экспозиции (30, 45, 60 мин.) при температуре 37°С. Полученные результаты свидетельствуют, что оптимальными условиями инкубирования пероксидазных конъюгатов с токсином на твёрдой фазе являются: время – 30 мин. и температура – 37°С, поскольку в этом диапазоне регистрировали увеличение ОП. Более продолжительное время инкубации конъюгатов с исследуемыми образцами увеличивало время постановки реакции и сопровождалось появлением фонового окрашивания.
Испытания оптимизированного ТИФА проводили согласно вышеописанным отработанным параметрам, результаты которого отражены в табл. 2.
Из данных таблицы следует, что используемые моно- и поликлональные пероксидазные конъюгаты специфичны, так как отсутствуют перекрёстные реакции с нетоксигенными холерными вибрионами и представителями гетерологичных микроорганизмов. Согласно данным литературы, холерные вибрионы биовара Эль Тор, в отличие от генетически измененных вариантов, обладают низкой токсинопродуцирующей способностью [Шашкова и др., 2011]. В наших опытах при взаимодействии супернатантов с поли- и моноклональными конъюгатами зарегистрированы высокие значения ОП порядка (1.522±0.021– 1.812±0.010) в отношение геновариантов вибрионов биовара Эль Тор и V. cholerae Classical в сравнении с 284
положительным контролем (1.618±0.013). В то же время типичные вибрионы продуцируют токсина в два-три раза меньше, что подтверждают показатели ОП, максимальное значение которых равняется 0.581±0.026.
Таблица 2
Результаты определения активности и специфичности моно - и поликлональных пероксидазных конъюгатов в прямом методе ТИФА
[Results of activity and specificity determination of mono- and polyclonal peroxidase conjugates in the direct method ELISA]
|
Штаммы |
Кол-во штаммов |
Оптическая плотность (ОП) |
|
|
Поликлональный конъюгат |
Моноклональный конъюгат |
||
|
Vibrio cholerae О1 Classical ctx+ |
3 |
1.812±0.010 |
1.407±0.012 |
|
Vibrio cholerae О1 El Tor ctx+ |
2 |
1.522±0.021 |
1.204±0.007 |
|
Vibrio cholerae О1 El Tor ctx+ |
9 |
0.581±0.026 |
0.508±0.011 |
|
Vibrio cholerae О1 El Tor ctx- |
5 |
0.102±0.004 |
0.108±0.005 |
|
Vibrio cholerae О139 ctx+ |
3 |
0.494±0.007 |
0.416±0.003 |
|
Escherichia сoli |
2 |
0.114±0.004 |
0.113±0.005 |
|
Aeromonas hydrophila |
2 |
0,112±0.002 |
0.104±0.004 |
|
Salmonella typhimurium |
2 |
0.116±0.005 |
0.116±0.004 |
|
Положительный контроль ХТ 0,05 мкг/мл |
1.618±0.013 |
0.116±0.004 |
|
|
Отрицательный контроль среда AKI |
0.090±0.009 |
0.087±0.003 |
|
Примечание.В таблице представлены средние значения оптических плотностей (ОП) и стандартное отклонение.
Заключение
Установлены оптимальные параметры и условия постановки прямого варианта ТИФА: сенсибилизация планшета токсинсодержащими препаратами, разведёнными в ФСБ рН 7.4 до 1:2–1:4, блокирование свободных сайтов связывания 1%-ным раствором БСА в ФСБ, время экспозиции опытных образцов с полистиролом планшета – 2 ч. (37°С), рабочее разведение конъюгатов 1:32–1:64, время инкубирования конъюгатов с ХТ на твёрдой фазе – 30 мин. при 37°С.
В итоговых испытаниях на штаммах установлена высокая специфичность и чувствительность тест-системы, что свидетельствует о возможности её использования для обнаружения токсигенных штаммов холерных вибрионов О1, О139 в качестве альтернативы сэндвич-варианту GM 1 ИФА.
Список литературы Твердофазный иммуноферментный анализ (прямой вариант) для выявления токсигенных холерных вибрионов О1, О139 серогрупп
- Алексеева Л.П. и др. Современные методические приемы очистки холерного токсина // Вестник биотехнологии и физико-химической биологии им. Ю.А. Овчинникова. 2019. Т. 15, № 1. С. 5-9.
- Ашмарин И.П. Воробьев А.А. Статистические методы в микробиологических исследованиях. Л.: Медгиз, 1962. 180 с.
- Баранова Е.В. и др. Конструирование иммунохроматографического теста на основе моноклональных антител для выявления холерного токсина // Вестник биотехнологии и физико-химической биологии имени Ю.А. Овчинникова. 2020. Т. 16, № 2. С. 18-27.
- Егоров А.М. Теория и практика иммуноферментного анализа. М.: Высш. шк., 1991. 288 с.
- Курчева С.А. и др. Разработка диагностической тест-системы для выявления специфических антител к возбудителю бруцеллеза в непрямом методе иммуноферментного анализа // Современные проблемы науки и образования. 2016. № 2. URL: http://www.science-education.ru/ru/article/view?id=24244.
- Михеева Е.А. и др. Получение и характеристика антителопродуцирующих гибридом и моноклональных иммуноглобулинов к энетеротоксину Vibrio cholerae // Биотехнология. 2014. Т. 30, № 3. С. 49-54.
- Петрова Е.Э. и др. Получение и характеристика моноклональных антител к холерному токсину // Биоорганическая химия. 2009. Т. 35, № 3. С. 357-367.
- Шашкова А.В. и др. Фенотипический и молекулярно-генетический анализ генетически измененного токсигенного штамма V. cholerae 301 биовара Эль Тор, изолированного в 2011 г. в России // Проблемы особо опасных инфекций. 2011. № 14. С. 61-64.
- Якушева О.А. и др. Характеристика и оценка диагностической значимости поли и моноклональ-ных пероксидазных конъюгатов к холерному токсину // Вестник биотехнологии и физико-химической биологии им. Ю.А. Овчинникова. 2020. Т. 16, № 2. С. 37-43.
- Ahn-Yoon S. et al. Ganglioside-liposome immunoassay for the ultrasensitive detection of cholera toxin // Analytical Chemistry. 2003. Vol. 75, № 10. P. 2256-2261. doi: 10.1021/ac026428t.
- Bayat M. et al. Corrigendum to "Development of IgY-Based Sandwich ELISA as a Robust Tool for Rapid Detection and Discrimination of Toxigenic Vibrio cholera // Canadian Journal of Infectious Diseases and Medical Microbiology. 2019. doi: 10.1155/2019/4164982.
- Crowther John R. Molecular Biology Techniques, ELISA Guide. Second edition. Humana Press, part of Springer Science + Business Media, LLC 2009.
- Greig D.R. et al. A real-time multiplex PCR for the identification and typing of Vibrio cholerae // Diagnostic Microbiology and Infectious Disease. 2018. Vol. 90, № 3. P. 171-176. doi: 10.1016/j.diagmicrobio.
- Hossain Z.Z. et al. Quantitative Analysis of Nucleic Acid Extraction Methods for Vibrio cholerae Using Real-time PCR and Conventional PCR // Mymensingh Medical Journal. 2018. Vol. 27, № 2. P. 327-335.
- Iwanaga M., Kuyyakanond T. Large production of cholera toxin by Vibrio cholerae O1 in yeast extract peptone water // Journal of Clinical Microbiology. 1987. Vol. 25, № 1. P. 2314-2316.
- Jin D. et al. Quantitative detection of Vibrio cholera toxin by real-time and dynamic cytotoxicity monitoring // Journal of Clinical Microbiology. 2013. Vol. 51, № 12. P. 3968-3974. doi: 10.1128/JCM.01959-13.
- Mehrabadi J.F. et al. Detection of toxigenic Vibrio cholerae with new multiplex PCR // Journal of Infection and Public Health. 2012. Vol. 5, № 3. P. 263-267. doi: 10.1016/j.jiph.2012.02.004.
- Meza-Lucas A. et al. Comparison of DOT-ELISA and Standard-ELISA for Detection of the Vibrio cholerae Toxin in Culture Supernatants of Bacteria Isolated from Human and Environmental Samples // Indian Journal of Microbiology. 2016. Vol. 56, № 3. P. 379-382. doi: 10.1007/s12088-016-0596-2.
- Shlyapnikov Y.M. et al. Rapid simultaneous ultrasensitive immunodetection of five bacterial toxins. // Analytical Chemistry. 2012. Vol. 84, № 13. P. 5596-6603. doi: 10.1021/ac300567f.
- Tuteja U. et al. Simultaneous direct detection of toxigenic and non-toxigenic Vibrio cholerae from rectal swabs and environmental samples by sandwich ELISA // Journal of Medical Microbiology. 2007. Vol. 56, № 10. P. 1340-1345. doi: 10.1099 / jmm.0.47166-0.


