Участие гормонов в процессах когнитивного и социально-эмоционального старения
Автор: Булгакова Светлана Викторовна, Романчук Наталья Петровна
Журнал: Бюллетень науки и практики @bulletennauki
Рубрика: Биологические науки
Статья в выпуске: 8 т.6, 2020 года.
Бесплатный доступ
Старение связано с общепризнанными изменениями функций головного мозга, в том числе и когнитивных. Кроме того, возраст вносит свои коррективы в работу эндокринной системы. В свою очередь, изменение гормонального фона в процессе старения накладывает отпечаток на работу клеток головного мозга, когнитивные функции, социально-эмоциональное функционирование. Исследована, взаимосвязь между половыми гормонами, кортизолом, окситоцином и когнитивным и социально-эмоциональным функционированием. Половые гормоны вовлечены в рост нейритов, синаптогенез, дендритное ветвление, миелинизацию и другие важные механизмы нервной пластичности. Физиологические и патологические концептуализированные теории свидетельствуют о том, как половые гормоны потенциально вызывают изменения нейропластичности через четыре нейрохимические системы нейротрансмиттеров: серотонин, допамин, ГАМК и глутамат. Многие области мозга экспрессируют высокую плотность рецепторов эстрогенов и прогестерона, таких как миндалина, гипоталамус и гиппокамп. Гиппокамп имеет особое значение в контексте опосредующей структурной пластичности в мозге взрослого человека, исследованы различия в поведении, нейрохимических паттернах и структуре гиппокампа с изменяющейся гормональной средой. Существует значительная связь между дисрегуляцией эмоций и симптомами депрессии, тревоги, патологии пищевого поведения и злоупотребления психоактивными веществами. Более высокие уровни регуляции эмоций, связаны с высоким уровнем социальной компетентности.
Старение, кортизол, эстрогены, тестостерон, окситоцин, социально-эмоциональное функционирование, когнитивные функции
Короткий адрес: https://sciup.org/14117868
IDR: 14117868 | УДК: 616.83/.85:616.89 | DOI: 10.33619/2414-2948/57/09
Текст обзорной статьи Участие гормонов в процессах когнитивного и социально-эмоционального старения
Бюллетень науки и практики / Bulletin of Science and Practice Т. 6. №8. 2020
УДК 616.83/.85:616.89
Прогресс науки и техники увеличил продолжительность жизни человека. Следовательно, пул лиц пожилого и старческого возраста стал растущим сегментом общества, и вопрос о поддержке и расширении когнитивного и социально-эмоционального функционирования в этих возрастных группах, стал вопросом большого политического, общественного и академического интересов. Этот интерес еще больше стимулируется свидетельствами того, что некоторые люди остаются когнитивно, социально и эмоционально активными в старости в отличии от других [1]. Более глубокое понимание взаимосвязи между множеством факторов, способствующим индивидуальным различиям в траекториях старения, может дать возможность разработки профилактических и лечебно-диагностических мероприятий, направленных на снижение заболеваемости, смертности и повышение качества жизни пожилых людей.
По мере старения происходит снижение когнитивных функций. Отмечается снижение скорости обработки информации, способности рассуждать, изменяются компоненты памяти [1]. Хотя существует заметная неоднородность изменений когнитивных функций внутри популяции лиц пожилого и старческого возраста. Наряду с обширной литературой о когнитивном старении, есть все больше свидетельств возрастных модификаций в социальноэмоциональных областях [2]. Так, пожилые люди по сравнению с молодыми хуже интерпретируют мимику лица, связанную с эмоциями или доверием. Кроме того, пожилые также испытывают трудности с запоминанием социальной и эмоциональной информации, такой как имена, лица и негативные эмоциональные картинки или текст [3]. Напротив, опыт положительного аффекта увеличивается с возрастом. Кроме того, пожилые люди становятся лучше в некоторых аспектах регуляции эмоций и решения эмоциональных проблем и часто проявляют повышенную мудрость, связанную с накопленными знаниями и жизненным опытом [4].
Ряд исследований показали возможные механизмы когнитивных и социальноэмоциональных возрастных изменений с психологической, контекстуальной и биологической точек зрения [3, 5]. Тем не менее, ряд вопросов остаются открытыми. Данный обзор литературы посвящен анализу роли четырех гормональных систем - кортизола, эстрогена, тестостерона и окситоцина - в возрастных изменениях функции мозга, в частности, в контексте когнитивного и социально-эмоционального старения.
Взаимодействие гормонов, головного мозга и поведения при старении
Один из способов осмысления взаимодействия между мозговыми процессами, гормональной активностью и поведением — думать о мозге как об эндокринном органе. В рамках этой модели мозг регулирует выработку гормонов (через гипоталамус и гипофиз) и сам является мишенью для стероидных и половых гормонов, которые преодолевают гематоэнцефалический барьер и оказывают воздействие на центральную нервную систему и нижележащие области [6]. Как таковые, гормоны играют центральную роль в физиологических процессах и инициации сигнальных путей, ответственных за рост, развитие, старение, иммунитет, репродукцию и поведение. Чтобы полностью оценить многогранные факторы, которые влияют на познание и социально-эмоциональное функционирование, крайне важно иметь четкое представление о динамике возрастных эндокринных изменений [7– 8].
Уровень и функция многих гормонов модифицируются с возрастом, что влечет за собой ряд психологических и физиологических изменений. Типичными изменениями являются снижение секреции периферических желез и модификации центральных механизмов, контролирующих высвобождение гормонов. Это включает в себя снижение тормозных систем и подавление циркадианных ритмов. Эти возрастные изменения в эндокринной системе являются сложными и отличаются у различных гормонов. Кроме того, на эндокринную систему влияет ряд факторов, такие как социально-демографические (например, этническая принадлежность, социальный статус), образ жизни (например, уровень физической активности, индекс массы тела, начало или прекращение курения, питание) и психологические факторы (например, общее состояние здоровья, восприимчивость к стрессу, социальная интеграция) (Рисунки 1–2) [7–8].
Short term
Stress
More
Spinal cord
Adrenal medulla
САН (corticotropinreleasing hormone)
Corticotrope cells of interior pituitary
ACTH
To target in blood
cortex
B Short-term stress response
Mineralocorticoids Glucocorticoids
Catecholamines (epinephrine and norepinephrine)
-
1. Increased heart rate
-
2. Increased blood pressure
-
3. Liver converts glycogen to glucose and releases glucose to blood
-
4. Dilation of bronchioles
-
5. Changes in blood flow patterns leading to increased alertness, decreased digestive system activity, and reduced urine output
S. Increased metabolic rate
Long-term stress response
-
1. Retention of sodium and water by kidneys
-
2. Increased blood volume and blood pressure
-
1. Proteins and fats converted to glucose or broken down for energy
-
2. Increased blood sugar
-
3. Suppression of immun system
Рисунок 1. Гормоны и стресс: нарушение гомеостатической регуляции. Краткосрочная и долгосрочная реакция на стресс.
Эндокринные дефициты у пожилых людей включают снижение периферических уровней эстрогенов и тестостерона, с увеличением содержания ЛГ, ФСГ и глобулина, связывающего половые гормоны. Кроме того, наблюдается снижение сывороточных концентраций GH, IGF‐I и DHEA(S). Эндокринные функции, которые необходимы для жизни, такие как функции надпочечников и щитовидной железы, показывают минимальное общее изменение базальных уровней со старением, которые происходят в пределах гипоталамо-гипофизарно-надпочечниковой/тиреоидной оси [9].
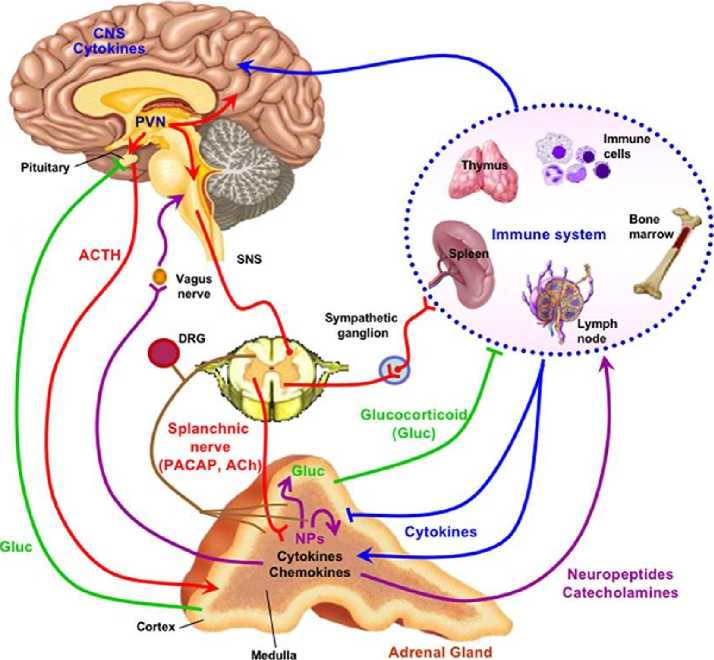
Рисунок 2. Регуляция мозгового вещества надпочечников, для сердечно-сосудистого, нейронального и метаболического гомеостатического контроля, во время стресса.
Например, у пожилых людей физические и психологические изменения, вызванные индексом массы тела, курением, безработицей и потерей партнера, были связаны с увеличение скорости индивидуального снижения уровня тестостерона, в то время как психологические факторы (самооценка, восприимчивость стресса) способствовали индивидуальным различиям в секреции кортизола. Возрастные гормональные изменения также могут быть результатом патологии, связанной с риском заболевания или снижением продолжительности жизни [10– 11].
Изменения в головном мозге и поведении редко связаны с действиями одного гормона. Чаще, они отражают совокупные изменения в нескольких гормональных системах, которые имеют рекурсивное взаимодействие друг с другом [12]. Информация об этом представлена ниже.
Кортизол: старение, познавательная и социоэмоциональная функции
Кортизол — это стероидный гормон, высвобождаемый осью гипоталамус-гипофиз-надпочечники (HPA). Как основной эффектор реакции биологического стресса у людей, он участвует в разнообразных физиологических, метаболических, иммунологических и психологических процессах, направленных на их успешное преодоление [13]. Рецепторы кортизола хорошо представлены в лимбических структурах, участвующих в аффективном ответе (то есть гиппокампе, гипоталамусе, миндалине) и в центральных для исполнительной функции областях, таких как префронтальная кора и передняя поясная извилина. В результате эффекты кортизола выходят за рамки системы реагирования на стресс и угрозу и влияют на настроение, внимание и память [14].
Проведенные исследования показали отрицательную связь между эндогенными утренними уровнями кортизола и когнитивными показателями такими, как скорость обработки информации и исполнительная функция [14]. Что касается влияния кортизола на память, данные в настоящее время неоднозначны [13, 15]. В то время как кортизол (вызванный стрессом или острым введением), по-видимому, улучшает консолидацию памяти, при этом он ухудшает восстановление памяти. Однако эта связь не является универсальной и может быть изменена с помощью диспозиционных и ситуационных факторов, таких как задание на тестирование, эмоциональное возбуждение [2].
Существуют также доказательства того, что эффекты кортизола на когнитивные функции варьируют в зависимости от его уровня. В частности, имеются свидетельства когнитивных улучшений в условиях умеренного, ограниченного во времени повышения уровня кортизола, но также есть и доказательства когнитивных нарушений, когда концентрации кортизола постоянно чрезмерно высокие [16]. Возможно, что повышенная мотивация к обучению и улучшенная координация областей мозга, участвующих в когнитивных операциях, связаны с умеренные кратковременные выбросами кортизола [17]. Напротив, неблагоприятные эффекты от постоянного и высокого уровня кортизола могут быть результатом атрофии структур мозга, критически важных для памяти и мышления (например, гиппокамп) [13].
Ряд работ посвящен изучению взаимосвязи между уровнем кортизола и социальноэмоциональной функцией. Социально стимулирующие и эмоционально вызывающие контексты, такие как социальное неприятие и чувство смущения и одиночества, вызывают выброс кортизола. Более высокие стресс-реактивные уровни кортизола связаны с нарушением социальной компетентности, большей несостоятельностью в социальных ситуациях, снижением межличностного доверия, агрессивными нападками на личность [13, 18].
Влияние кортизола на ключевые когнитивные процессы и структуры мозга, связанные с этими процессами, позволяет предположить, что кортизол может играть важную роль в развитии некоторых когнитивных и социально-эмоциональных изменений, наблюдаемых при старении. Это становится особенно вероятным, если учесть возрастные изменения уровня и ритма секреции кортизола. В частности, средние уровни кортизола постепенно увеличиваются с возрастом. Кроме того, характерное для лиц молодого и среднего возраста снижение уровня кортизола в течение дня исчезает при старении. В то же время стрессовые уровни кортизола часто выше у пожилых людей, чем у молодых [1, 13, 19]. Метаанализ 45 исследований показал значительно большую секрецию кортизола в ответ на фармакологические и психосоциальные проблемы у пожилых по сравнению с молодыми участниками [20]. Возраст ассоциированные изменения стрессовой секреции кортизола были примерно в три раза более выражены у женщин, чем у мужчин. Следует отметить, что не было ни возрастных, ни половых различий в исходных уровнях кортизола до стрессового стимула. Это согласуется с другими исследованиями, предполагающими, что базовые уровни кортизола могут не различаться у молодых и пожилых людей [21–22]. Однако, хотя перекрестные исследования, сравнивающие базальные уровни кортизола, не предполагают различий между молодыми и пожилыми людьми, продольные исследования, оценивающие изменение исходного уровня кортизола с возрастом у отдельных лиц, могут предположить данный гормон в качестве лучшего прогноза для риска развития когнитивных нарушений [2].
Повышение уровня кортизола в ответ на стресс был определен как признак хорошего функционирования оси HPA. То есть некоторая степень роста уровня гормона является адаптивным ответом на стрессовые ситуации, а также имеет важное значение для когнитивной функции. Свидетельством этому является исследование, показавшее, что низкий ответ кортизола на острый стресс у пожилых людей связан с ухудшением декларативной и рабочей памяти [23]. Эти данные подчеркивают динамическую сложность изучения гормональных стресс-реакций, так как как динамическая реактивность системы (гиперактивная против гипоактивной реакции на стрессы), так и ее внутренняя модуляция (более короткая или продолжительная) могут влиять на результаты [24].
Предполагается, что негативное воздействие кортизола на головной мозг и различные органы и системы пожилых людей происходит в результате постоянной активации системы биологического стресса. Эта модель аллостатической нагрузки представляется особенно полезной для объяснения возрастного снижения когнитивных функций. Хроническое повышение секреции кортизола повреждает структуры головного мозга и системы организма. Это, в свою очередь, ускоряет физиологический и когнитивный процесс старения [25]. Эта мысль подтверждается данными о том, что возрастное повышение уровня эндогенного кортизола было связано со снижением производительности памяти и исполнительной функции, атрофией гиппокампа и когнитивными нарушениями при старении [26].
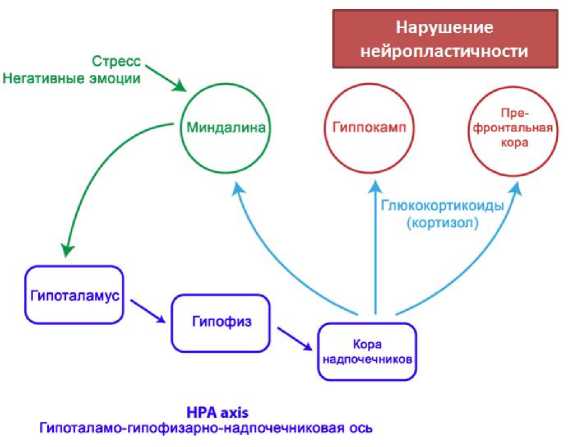
Рисунок 3. Влияние стресса на гипоталамо-гипофизарно-надпочечниковую ось.
Примечательно, что однонаправленные связи между кортизолом и когнитивным, и физическим функционированием при старении не выявлены во всех исследованиях, в связи с чем был обнаружен ряд модулирующих психосоциальных факторов. Одним, из которых является общее состояние здоровья, что, безусловно, следует учитывать. Нарушение регуляции активности оси HPA характерно для деменции и прогрессирующего когнитивного нарушения при старении. Изменения в активности оси HPA также являются признаком большой депрессии [27], хотя имеются неоднозначные результаты относительно направления взаимосвязи кортизол-депрессия (Рисунок 3) [1, 28]. Существуют доказательства того, что хроническое чувство одиночества может стимулировать систему HPA и ускорять процесс старения. Так, уровни кортизола были выше у лиц пожилого и старческого возраста, людей с низким социальным статусом [29]. Кроме того, пожилые люди, часто подверженные негативным возрастным стереотипам, в связи с чем испытывают больший стресс и, как следствие, у них наблюдается худшая траектория старения. Это может быть результатом того, что организм с возрастом становится менее устойчивым и менее способным модулировать усиленное физиологическое возбуждение, вызванное неблагоприятными эмоциями. Подтверждение этой гипотезы получено в результате исследований, показавших, что подсознательное воздействие на пожилых людей отрицательных возрастных стереотипных простых чисел было связано с повышенным сердечно-сосудистым стрессом как до, так и после участия в когнитивных тренингах и предсказывало худшее их выполнение. Эти данные свидетельствуют о том, что негативные возрастные стереотипы могут напрямую вызывать стресс у пожилых людей и негативно влияют на когнитивные функции (Рисунок 3) [28].
Стереотипная угроза в значительной степени влияет на когнитивные способности пожилых людей, психическое и физическое здоровье. Старение вызывало меньшую синхронизацию тета-диапазона и улучшенную синхронизацию альфа-диапазона ЭЭГ. Первичное старение может активировать негативные самоидентификации на текущую рабочую самоидентификацию во время позднего нейронного времени и истощает когнитивный ресурс [30].
Достоверное уменьшение объема гиппокампа у больных депрессией (по сравнению с группой здоровых испытуемых) уже после первого депрессивного эпизода достигает 11% для серого и до 25% для белого вещества. Значения уменьшения объема нервной ткани (в частности, 10–25% для гиппокампа) у человека и лабораторных животных примерно одинаковы. Это позволяет предполагать, что и длина дендритов гиппокампальных нейронов у пациентов с депрессией уменьшается не менее чем на 30–50%, т. е. число синаптических контактов и объем перерабатываемой информации сокращается на 1–2 порядка, что и ведет к серьезному нарушению эмоционального реагирования [31].
По данным функциональной нейровизуализации (магнитно-резонансной спектроскопии или функциональной МРТ — фМРТ и позитронно-эмиссионной томографии — ПЭТ), у больных депрессией в этих лимбических структурах и в префронтальной коре снижены локальный мозговой кровоток и метаболизм глюкозы, тогда как объем миндалины и уровень ее метаболизма увеличены.
Аффективные расстройства у человека, как и вызванные стрессом и сходные с депрессией нарушения поведения у животных, ассоциируются с повреждением лимбических и ряда других структур мозга в виде нарушения морфологии и функции дендритов (их укорочения, снижения числа шипиков и синаптических контактов) и проводящих путей, а также снижения метаболизма и гибели части нервных и глиальных клеток.
Эти данные согласуются с клиническими наблюдениями о высокой коморбидности депрессии и тревоги, а также с современными представлениями о том, что хронический стресс и тревожные расстройства, вызванные стрессогенными факторами, могут не просто предшествовать депрессии или ассоциироваться с ней, но и являться причиной некоторых форм депрессивных расстройств. Локализация морфологических нарушений в лимбической системе, базальных ганглиях и ростральных отделах коры может обусловливать многие как собственно аффективные (снижение настроения, тревога, раздражительность), так и моторные, вегетативные и мнестико-когнитивные расстройства при депрессии.
Основной причиной повреждения и гибели клеток мозга считается эксайтотоксичность ( англ. excitotoxicity ) — цитотоксическое действие ряда агентов, прежде всего возбуждающих аминокислот (глутамата, NMDA), а также кальция. В норме последовательность синаптических событий приводит к генерации постсинаптическим нейроном нервного импульса. Однако в условиях патологии (при избытке основных возбуждающих нейротрансмиттеров — глутамата и NMDA, Са2+ и при генетически обусловленном нарушении активности Na+/K+АТФазы) может происходить лавинообразное увеличение внутриклеточной концентрации Са2+, что ведет за собой повреждение и утрату отдельных отростков или гибель нервной клетки.
Этим деструктивным процессам в наибольшей степени способствует повышенное содержание кортикостероидов (главным образом, кортизола), характерное для состояний
Бюллетень науки и практики / Bulletin of Science and Practice Т. 6. №8. 2020 дистресса и депрессии. Роль гиперактивности гипоталамо-гипофизарно-адреналовой оси в нейропластических явлениях подтверждается тем, что у лабораторных животных вызванных стрессом и сходных с депрессией состояниях в крови значительно повышено содержание кортикотропин-рилизинг-фактора (КТРФ), АКТГ и кортизола; искусственное введение кортикостероидов (в отсутствие стресса) вызывает такие же изменения нервной ткани, как и стрессогенная ситуация, а адренэктомия предотвращает влияние стрессоров. У 33–66% больных депрессией отмечается гиперплазия надпочечников, а содержание кортизола повышено и положительно коррелирует с тяжестью состояния.
Нейроваскулярная дегенерация — нейронные повреждения и нарушения гематоэнцефалического барьера (ГЭБ), бета-амилоидный индуцированный оксидативный и нитрозативный стресс, дисфункция митохондрий и нейроинфламмация, способствуют и усугубляют течение болезни. Сосудистые когнитивные нарушения включают гетерогенную группу когнитивных расстройств различной степени тяжести. Патогенные факторы, участвующие в развитии сосудистой деменции, подчеркивают актуальность цереброклеточного стресса и гормональных реакций на нейроваскулярные и нейропротекторные механизмы [32].
Главная функция ГЭБ — поддержание гомеостаза мозга. Он защищает нервную ткань от циркулирующих в крови микроорганизмов, токсинов, клеточных и гуморальных факторов иммунной системы, которые воспринимают ткань мозга как чужеродную. ГЭБ выполняет функцию высокоселективного фильтра, через который из артериального русла в мозг поступают питательные, биоактивные вещества; в направлении венозного русла с глимфатическим потоком выводятся продукты жизнедеятельности нервной ткани [31].
Для гомеостаза головного мозга необходим функционирующий ГЭБ (Рисунок 4) [32]. При нейродегенеративных заболеваниях — сосудистой деменции и болезни Альцгеймера (БА), которые вызывают структурно-функциональные изменения мозга, происходит дальнейшая нейродегенерация.
В characteristics of CNS endothelial cells
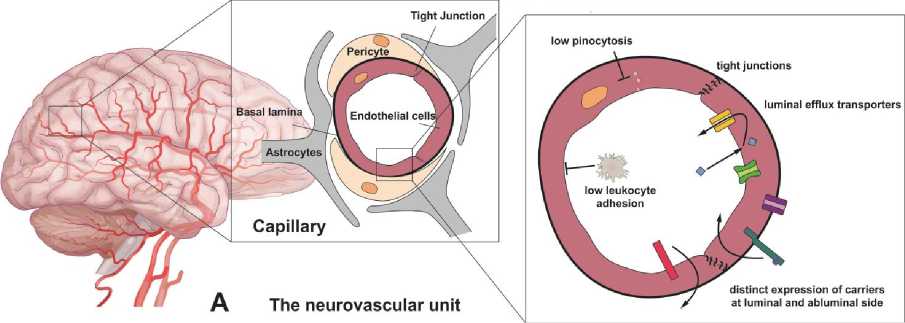
Рисунок 4. Гематоэнцефалический барьер при БА [32].
Важным реабилитационным и лечебно-профилактическим направлением является нейробиологическая роль механизмов защиты эндогенных клеток от стресса как потенциально инновационного подхода связанного с сосудисто‐индуцированным патогенным детерминизмом сосудистой деменции и БА.
Рост числа сердечно-сосудистых заболеваний (сосудистой коморбидности), коррелирующий с возрастом, обусловлен прогрессированием эндотелиальной дисфункции, приводящей к системному атеросклерозу. На фоне локального и/или тотального поражения сосудов организм с трудом обеспечивает и субстратную органную перфузию и адекватное функционирование механизмов синтеза энергии. Если говорить о маркерах ингибирования энергосинтеза, выявляемых у пациентов пожилого возраста, то их можно подразделить на:
–клинические, реализующиеся нарушениями когнитивной, эмоциональной и двигательной сфер;
–лабораторные, характеризующиеся гипергликемией, лактатацидозом и дисбалансом свободно-радикальных процессов с ростом уровня МДА на фоне снижения антипероксидной активности плазмы;
–инструментальные, демонстрирующие наличие очагов лакунарной ишемии и других признаков хронической ишемии мозга при КТ/МРТ, а также снижение амплитуды спектра ЭЭГ и КСА ЭЭГ со сосудистой деменции вигом частотного диапазона в сторону медленных волн, совокупность которых является отражением депрессии электрогенеза мозга.
При исследовании взаимосвязи БА и сосудистых изменений, следует учитывать также роль характерной для этого заболевания церебральной амилоидной ангиопатии. Она может приводить не только к лобарным кровоизлияниям (что хорошо известно), но также к поражению мелких церебральных — кортикальных и лептоменингеальных — сосудов с возникновением небольших завершенных и незавершенных инфарктов. Взаимосвязь сосудистых факторов риска с возникновением БА в настоящее время довольно трудно объяснить только теми процессами, которые происходят на клеточном уровне, особое значение в патогенезе этого заболевания придают патологии капилляров, приводящей к церебральной гипоперфузии. По данным целого ряда патоморфологических исследований, при БА отмечаются выраженные изменения капилляров в виде истончения базальной мембраны, дегенерации перицитов, отложения коллагена, изменений эндотелиальных клеток [31].
Рассматривая этиопатогенетическое значение капилляропатии и хронической церебральной гипоперфузии при БА, следует учитывать и тот факт, что поражение капилляров может возникать вследствие характерных для этого заболевания первично-дегенеративных изменений. Поражение капилляров в силу законов гидродинамики приводит к нарушениям ламинарного тока крови и церебральной гипоперфузии. Как результат, страдает внутриклеточный метаболизм, возникает целый каскад изменений в нейронах, связанный с процессами эксайтотоксичности и оксидантного стресса, что, в свою очередь, стимулирует амилоидогенез. Экспериментально было показано, что длительно существующее состояние гипоперфузии приводит к гиппокампальным нарушениям. Этот процесс сопровождается нарушениями памяти, структурным изменением капилляров в области гиппокампа, нарушением обмена глюкозы и белков, отложением β-амилоида, активацией глиальной ткани, гибелью нейронов гиппокампа.
Большинство нейронов не иннервируют непосредственно общую сосудистую систему; большинство нейронно-опосредованных входов составляют скорее глиальные посредники (Рисунок 5). Что касается нейроглиоваскулярной сигнализации, наиболее важными структурно-функциональными единицами считаются астроциты, чьи терминальные процессы называются сосудистой сетью, обертывание вокруг кровеносных сосудов в мозге, чтобы способствовать целостности ГЭБ, а также облегчению нейроваскулярной связи [33].
Мозг человека составляет всего 2% от общего веса тела, но получает от 15% до 20% от общего сердечного выброса. Поэтому очевидно, что мозг требует эффективного и адекватного кровоснабжения для поддержки метаболических требований, которые он предъявляет. В отличие от большинства органов и тканей, мозг имеет жестко регулируемый ГЭБ, который предотвращает утечку крови в паренхиму и защищает мозг от токсических агентов и инфекции [31].
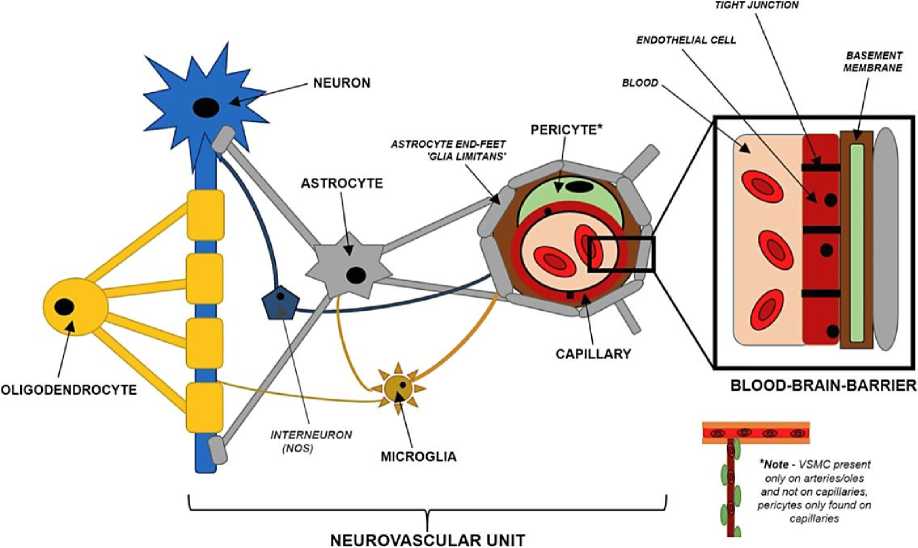
Рисунок 5. Нейроваскулярные структурно-функциональные единицы при сосудистой деменции и БА [33].
Нейроны, таким образом, не находятся в прямой ассоциации с кровью, но функционально и структурно связаны с сетью типов клеток в структуре, называемой нейроваскулярной единицей (neurovascular unit (NVU)). NVU облегчают церебральный кровоток (cerebral blood flow (CBF)) в ответ на метаболическую активность нейронов в отношениях, называемых нейроваскулярной связью. Нейроваскулярные связи нарушаются в определенных неврологических условиях. Необходимо, установить как сердечно-сосудистые заболевания могут повлиять на регуляцию CBF и нейроваскулярные связи (Рисунок 6) [33].
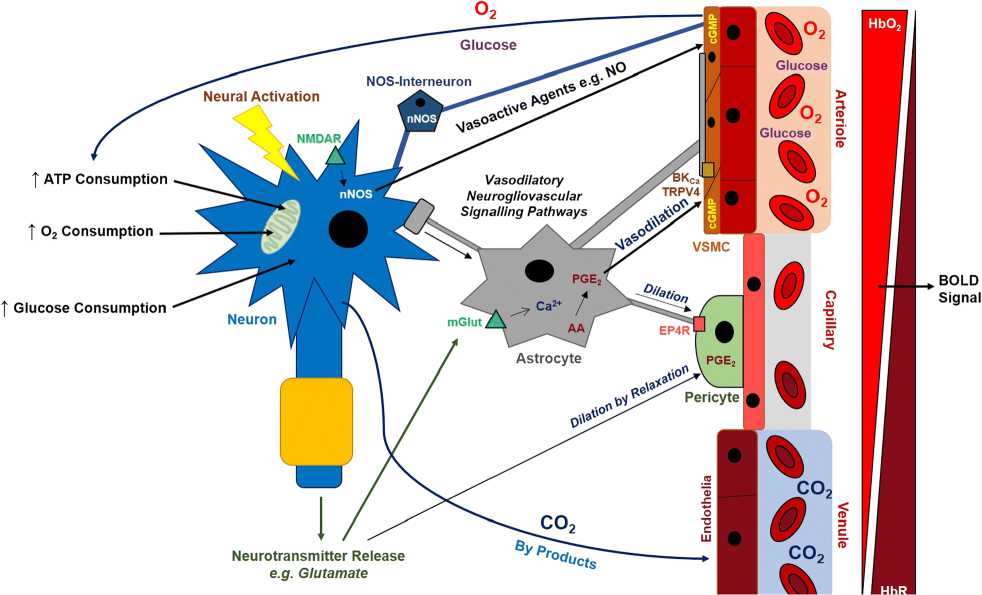
Рисунок 6. Нейрофизиология нейроваскулярных связей при сосудистой деменции и БА [33].
Нейрофизиология нейроваскулярных связей. NVU облегчает гемодинамические изменения (изменение в CBF) в ответ на нервную деятельность. Эта связь называется нейроваскулярной связью или функциональной гиперемией и необходима для нормального
сс) О I
Бюллетень науки и практики / Bulletin of Science and Practice Т. 6. №8. 2020 метаболического функционирования нейронов и мозга в целом (Рисунок 6). Нейроваскулярная связь, как полагают, управляется прямыми нейронными и эндотелиальными взаимодействиями, или через сложные нейроглиоваскулярные сигнальные пути [33].
Эстрогены и тестостерон: старение, познавательная и социоэмоциональная функции
Роль половых стероидных гормонов (эстрогена и тестостерона) в реализации репродуктивной функции хорошо известна. Также появляется все больше свидетельств того, что половые гормоны влияют на когнитивное и социально-эмоциональное функционирование при старении. При поправке на такие факторы, как статус заболевания, вес и потребление алкоголя, увеличение возраста достоверно было связано со снижением уровня эстрогена и тестостерона у женщин и мужчин. Кроме того, связанный с возрастом дефицит эстрогена и тестостерона был предиктором развития синдрома старческой астении [34].
Стероидные гормоны действуют как трофические факторы в развитии и пластичности мозга. Они участвуют в росте нейритов, миелинизации, увеличивая синаптический рост и способствуя формированию дендритных ветвей и нервных связей. Что касается процесса старения, то есть доказательства долгосрочных нейропротективных эффектов эстрогенов при старении гиппокампа [34]. По сравнению с женщинами в постменопаузе, у молодых здоровых женщин желудочки мозга меньше, меньше спинномозговой жидкости и больше серого вещества. Тем не менее, у женщин в постменопаузе при длительном приеме эстрогенов наблюдалась тенденция, сравнимая с молодыми. То есть они показали меньшие объемы желудочков и больший объем белого вещества, чем женщины в постменопаузе без терапии эстрогенами. Гормоны не влияли на объемы серого вещества. Кроме того, по мнению W. E. Ottowitz et al. (2008), гормоны яичников эстроген и прогестерон, по-видимому, усиливают корково-корковые и корково-подкорковые связи в мозге человека [35]. Например, инфузии эстрогена увеличивала связность между гиппокампом и лобной корой, а также миндалиной и префронтальной корой, представляющие собой структуры, связанные с когнитивными и эмоциональными процессами [36].
В дополнение к этим структурным эффектам количество циркулирующих гормонов яичников влияло на функциональные способности у людей, в частности, на вербальную память [35]. Более того, было обнаружено, что введение эстрогена защищает от нейродегенерации только женщин, у которых дегенерация еще не началась. Благоприятное влияние гормонов яичников на когнитивные способности было также показано в контексте болезни Альцгеймера (AD) у молодых женщин без клеточных повреждений. Однако, как только появились первые признаки нейродегенерации, дополнительно вводимые эстрогены усиливали дегенерацию и ускоряли прогрессирование заболевания [34].
Таким образом, одной из возможных причин большей распространенности АД у женщин, по сравнению с мужчинами, может быть относительно резкое снижение гормонов яичников в постменопаузе.
Связь между уровнем тестостерона и когнитивными функциями неоднозначна. Некоторые исследователи подтверждают связь между снижением уровня тестостерона в пожилом возрасте и снижением когнитивных функций у мужчин [37]. Другие показывают то, что более высокий уровень тестостерона не способствует повышению когнитивных способностей [38]. Кроме того, хотя некоторые авторы [39] предполагают нейропротекторное действие тестостерона у пожилых мужчин, другие отрицают [40]. Вполне возможно, что существует оптимальный уровень тестостерона, который, если его превзойти, оказывает негативное влияние на когнитивные функции [34]. Кроме того, нейропротекторный эффект, о котором сообщается для тестостерона, может быть результатом его превращения в эстроген в мозге. Или это может быть связано с прямым связыванием тестостерона с участками с высокой плотностью андрогенных рецепторов, такими как гиппокамп, структура мозга, которая имеет решающее значение для формирования памяти [39]. Примечательно, что исследования по введению эстрогена не показали терапевтического воздействия на симптомы БА у женщин. Напротив, был отмечен некоторый успех в применении тестостерона для улучшения пространственной памяти и общего качества жизни у пациентов мужского пола [34].
В дополнение к роли в познании, гормоны яичников, как было показано, влияют на социально-эмоциональное функционирование. Например, различия в уровнях половых гормонов могут лежать в основе большей эмоциональной выразительности и повышенной способности распознавать выражения лица, характерных для женщин, по сравнению с мужчинами [2]. Кроме того, определенные периоды эндогенной гормональной вариабельности яичников были связаны с более выраженной симптоматикой негативного настроения у женщин, например, при предменструальном синдроме [34]. Кроме того, у женщин в лютеиновой фазе цикла (более высокие уровни эстрогенов и прогестерона) отмечалась повышенная чувствительность передне-медиальной орбитофронтальной коры, но более низкая латеральной орбитофронтальной коры к отрицательным стимулам по сравнению с женщинами в фолликулиновой фазе [41]. Сходным образом, реактивная активность мозга на позитивные и негативные стимулы была различной в таких областях, как медиальная префронтальная кора и инсула у женщин в постменопаузе, получавших эстроген, по сравнению с женщинами, получавшими эстроген плюс прогестин, и женщинами без заместительной гормональной терапии (ЗГТ). В частности, интактные женщины по сравнению с женщинами, принимающими ЗГТ проявляли большую активность в медиальной префронтальной коре, инсулах и энторинальной коре при появлении позитивных картинок [42].
В отличие от эстрогенов, высокий уровень тестостерона, по-видимому, снижает эмпатию и увеличивает агрессию. Это дает основание полагать, что при определенных условиях тестостерон может отрицательно влиять на аспекты социально-эмоционального функционирования. Так, уровни биодоступного тестостерона были связаны с большей распространенностью депрессии, как это наблюдается у гипогонадных мужчин [34]. Примечательно, что некоторые из этих эффектов тестостерона на социально-эмоциональное функционирование были специфичными для пола. Это может быть связано с достоверно более низким уровнем тестостерона у женщин, по сравнению с мужчинами, что делает лиц слабого пола более чувствительными к колебаниям уровня гормона. Например, в исследовании, проведенном с участием молодых женщин, введение тестостерона снижало когнитивную эмпатию по сравнению с плацебо [43]. Точно так же, хотя эндогенный тестостерон показал положительную связь с сексуальностью, в тоже время, он имел отрицательную связь с пищевым рефлексом как у мужчин, так и у женщин. Кроме того, у мужчин найдена положительная связь между биологически активным тестостероном и доминированием и агрессией. У женщин, усиливающий агрессию эффект естественных высоких уровней тестостерона наблюдался только при высоких уровнях кортизола [44].
Окситоцин: старение, познавательная и социоэмоциональная функции
Окситоцин является нейропептидом с периферическим и центральным действием. Хотя гормон традиционно ассоциируется с родами и кормлением грудью, рецепторы окситоцина были также обнаружены в органах, не связанных с фертильностью. В поведении это отражается на модуляторных эффектах окситоцина на широкий спектр процессов, связанных с когнитивными и социально-эмоциональными функциями. Предполагается роль в нейрогенезе. Так, введение окситоцина стимулирует нейрогенез у взрослых грызунов даже в условиях стресса и повышенных уровнях глюкокортикоидов [45].
Доказано динамическое взаимодействие между системами окситоцина и вазопрессина, аргинина. Эти два нейропептида имеют отдаленного общего эволюционного предка и отличаются только двумя аминокислотами. Хотя их центральные эффекты часто контрастируют, но существуют также и функциональные совпадения. В частности, окситоцин обладает сродством к рецептору вазопрессина аргинина 1А, подтипу рецептора вазопрессина, наиболее часто встречающемуся в мозге [46]. Эксперименты на животных указывают на то, что рецепторы вазопрессина аргинина могут играть роль в некоторых из центральных эффектов окситоцина [47]. Тем не менее, большинство клинических и генетических исследований на людях были сосредоточены на окситоцине, а не на аргинин-вазопрессине.
Есть ряд доказательств того, что введение окситоцина улучшает социальную память у животных и людей. Например, у людей он улучшает распознавание счастливых, испуганных, злых выражений лица [48]. Кроме того, интраназальный окситоцин повышает восприятие лица, как привлекательного и вызывает доверие к нему, а также усиливает доверие между людьми и готовность идти на социальные риски [49]. Это влияет на привязанность, процессы сближения, социализацию. Наоборот, социальные связи могут влиять на уровень окситоцина в плазме у людей. Кроме того, интраназальный окситоцин усиливал положительный эффект поведением во время лабораторного конфликта между парами и снижал уровни кортизола в постконфликтных и вызываемых стрессом ситуациях [50]. Последний факт подтверждает взаимодействие между окситоцином и кортизолом. Об этом потенциальном снижающем стресс-эффекте окситоцина дополнительно свидетельствуют данные о том, что люди с повышенным содержанием окситоцина в плазме имели большее количество бесконфлитных отношений и положительных взаимодействий с партнерами. Различные теории о роли окситоцина в социально-эмоциональных процессах отводят окситоцину роль в усилении активации социальных нервных цепей вознаграждения, в снижении социальной тревожности и в продвижении социального подхода у людей и животных [51].
Однако следует отметить, что в исследованиях, опубликованных в литературе, имеют место разногласия. В частности, есть данные о том, что на ответ от введения окситоцина влияют личные, контекстуальные и методологические факторы, такие как пол, генетический паспорт, распределение и плотность рецепторов окситоцина, а также таких диспозиционных переменных, как тревожность, социальная обстановка и специфические особенности инструкции по выполнению задания [52].
Хотя окситцин был концептуализирован как уникальный «социальный нейропептид», есть мнения о том, что социальные эффекты окситоцина являются частью его более широкой, общей функции, определяющей наше современное понимание влияния окситоцина на несоциальное познание [53]. С одной стороны, ряд исследований предполагают потенциальный амнезийный эффект от введения окситоцина для несоциальной информации. Так, имеются данные об ухудшении показателей вербальной памяти после введения однократной дозы окситоцина [54–55]. Более того, M. Ansseau et al. (1987) обнаружили значительную амнезию у пациента с обсессивно-компульсивным расстройством после применения интраназального окситоцина в течение 4 недель [55]. Тем не менее, этот последний результат необходимо интерпретировать с осторожностью, учитывая то, что ученые описали всего один случай. С другой стороны, эти результаты контрастируют с работой на пациентах с шизофренией, которая показала улучшение показателей вербальной памяти после интраназального введения окситоцина в течение 3 недель [56].
Бюллетень науки и практики / Bulletin of Science and Practice Т. 6. №8. 2020
Крайне важно отметить, что исследования роли окситоцина в когнитивном и социальноэмоциональном функционировании у людей были почти исключительно проведены на молодых взрослых в отличии от работ по изучению кортизола и половых гормонов. Данные об окситоцине и старении в исследованиях на животных малочисленны и неоднозначны. Некоторые ученые не обнаруживают существенного влияния старения на систему окситоцина [57], в то время как другие сообщают о возрастных изменениях [58]. Примечательно, что исследования, в которых сообщается о сопоставимости системы окситоцина у пожилых и молодых людей, относятся к периферическим эффектам гормона, тогда как работы, документирующие возраст связанные изменения, говорят о центральных эффектах. Таким образом, учитывая тот факт, что окситоцин обладает двумя способами действия, локально как нейромедиатор и периферически как гормон [59], возможно, что старение может изменить передачу окситоцина в центральной нервной системе, но не в периферической [60]. Взаимосвязь между уровнями окситоцина в этих двух «пространствах» (мозг / спинномозговая жидкость против периферических) и их связь с мозговой активностью является активной областью исследований. Кроме того, часто глубокие межличностные и социальные изменения, связанные с преклонным возрастом (потеря партнера, сокращение социальных связей) и наличие защитного эффекта социальных отношений на возрастные когнитивные изменения указывают на ключевую роль этого глубоко социального гормона в процессе старения [61].
Влияние пола, возраста, гормонов на когнитивную и социально-эмоциональную функции
Отмечены половые различия при старении эндокринной системы. В частности, имеются данные о том, что кортизол, эстроген, тестостерон и окситоцин демонстрируют разные профили у мужчин и женщин с возрастом. Следовательно, взаимодействие между этими гормонами у молодых и пожилых людей могут отличаться. Тем не менее, их специфические особенности для пола при старении полностью не изучены.
Имеются данные о половых различиях действия кортизола в зависимости от возраста. Так, пожилые женщины могут быть наиболее восприимчивыми к воздействию кортизола в когнитивной и социально-эмоциональной сферах. Кроме того, имеются данные, свидетельствующие о том, что кортизол связан со снижением объема гиппокампа у пожилых мужчин, но не у пожилых женщин [62]. B. Kudielka (2004) подчеркивает сложность оценки вклада возраста и пола при изучении реакции на психосоциальный стресс [21]. Так, пожилые женщины показали самый высокий уровень стрессового выброса кортизола в кровь по сравнению со всеми другими группами. Напротив, у мужчин старших возрастных групп был более высокий ответ слюнного кортизола по сравнению с женщинами старшего возраста. Точно так же у молодых мужчин по сравнению с молодыми женщинами был более высокий ответ кортизола слюны на ряд когнитивных тестов, в то время как у мужчин старшего возраста по сравнению с женщинами старшего возраста в ответ на эти задачи наблюдался меньший уровень кортизола слюны [62].
Более высокие реакции на стресс у женщин пожилого и старческого возраста, по сравнению с мужчинами, могут быть связаны с изменениями уровня эстрогена у женщин в постменопаузе. Это подтверждается данными о повышении реакции оси HPA на психосоциальный стресс в постменопаузу по сравнению с пременопаузой. Исследование на животных показало влияние эстрогена на регуляцию оси HPA и уровень кортикостерона [63]. Тем не менее, ряд экспериментальных исследований на людях показал противоречивые результаты. Например, у молодых мужчин применение эстрадиола в течение 48 часов приводило к повышению чувствительности тканей к кортизолу [64]. Напротив, более длительное лечение эстрадиолом у женщин в постменопаузе не изменяло реакции оси HPA, вызванной психосоциальным стрессом [22]. Работа A. N. Sharma (2014) показала ингибирующий эффект от введения эстрогена у пожилых женщин по сравнению со стимулирующим эффектом от введения тестостерона у пожилых мужчин на активность оси HPA [65]. В частности, эстроген усиливает отрицательную обратную связь кортизола системы HPA, тем самым обеспечивая сигнал для подавления дальнейшего высвобождения гормонов. Эти данные согласуются с результатами исследований, согласно которым эстроген может действовать непосредственно на надпочечники и мишени центрального HPA, изменяя обратную связь по оси HPA. Они также предполагают возможную положительную роль лечения эстрогенами в снижении гиперреактивности кортизола у женщин в постменопаузе [66]. Однако лечение эстрадиолом женщин в постменопаузе оказывало влияние на повышение частоты плохого настроения и ухудшение познавательной способности после психосоциального стресса [67]. Различные результаты, полученные у животных и людей молодого и пожилого возраста в ответ на воздействие стрессовых факторов, подчеркивают необходимость дополнительных исследований для выяснения природы взаимосвязи эстроген-кортизол и влияния этих гормонов на когнитивное и социально-эмоциональное старение.
Что касается специфических для пола эффектов окситоцина, то на животных моделях доказана различная роль гормона у особей мужского и женского пола. Напротив, исследования на людях, изучающие роль окситоцина в контексте когнитивного и социоэмоционального функционирования, в основном проводились на мужчинах [59]. В исследованиях по введению окситоцина были продемонстрированы половые различия воздействия окситоцина на реакции эмоциональной эмпатии, эмоциональные образы и лица, разговорную близость и зрительный контакт, эмоциональные и сердечно-сосудистые реакции на социальный стрессор, и признание родства и конкуренции [68].
Половые различия роли окситоцина в сексуально-диморфных репродуктивных императивах и стратегиях выживания были сформированы в результате долгой эволюции [69]. Среди половых различий функции окситоцина — лактация у большинства видов млекопитающих. Кроме того, существуют половые различия в стресс-регуляторных эффектах. Так, благодаря окситоцину женщины более склонны к «стремлению и дружбе», в то время как мужчины склонны «конкурировать и побеждать». Современные исследования изучают взаимодействие между стероидными половыми гормонами (эстрогеном и тестостероном) и нейропептидом окситоцином в отношении их дифференциальных действий на активность нейронных сетей [70].
Одним из таких примеров является стероидная/пептидная теория социальных связей (S/P Theory) S. M. van Anders (2011) [71]. Эта теория предлагает объединение разнообразных литературных данных по различным гормонам в единую эвристику. В частности, рассматриваются некоторые парадоксы, возникающие при применении «гипотезы вызова» тестостерона к различным типам социальных связей. Согласно теории S/P, тестостерон смягчает социальные эффекты окситоцина (а также аргинина вазопрессина), тем самым облегчая различие между сексуальной близостью (связанной с высоким окситоцином и высоким тестостероном) и пищевым рефлексом (связанным с высоким окситоцином и низким тестостероном). Теория S/P — полезный взгляд на динамическую, социальную и специфическую для пола роль нейропептидов (например, окситоцина) и стероидных гормонов (тестостерона и эстрогена) в течение жизни. Например, связь между высоким содержанием окситоцина и низким уровнем тестостерона имеет значение для нашего понимания гормонального вклада в изменения партнерской сексуальности на протяжении всей жизни, а также для формирования различных социальных связей, уникальных для процесса старения.
Таким образом, взаимосвязи между половыми гормонами, кортизолом, окситоцином и когнитивным и социально-эмоциональным функционированием сложные и не до конца изучены, что требует дальнейших исследований.
Интеграционный подход к роли гормонов в когнитивном и социоэмоциональном старении: гормоны как «различные маркеры»
Как указывалось выше, в настоящее время известно, что хронически высокий уровень гормона стресса кортизола оказывает нейротоксическое воздействие на стареющий мозг, в первую очередь отрицательно влияя на когнитивные функции и социально-эмоциональное функционирование. Напротив, половые гормоны эстроген и тестостерон, по-видимому, оказывают нейропротективное действие при когнитивном старении, но могут снижать социальность при определенных условиях и во взаимодействии с другими гормонами. Относительным новичком в этой области является нейропептид окситоцин, который, по-видимому, в значительной степени способствует социально-эмоциональному функционированию, но имеет некоторые смешанные эффекты в этой области и еще не изучен в контексте старения и влияния на когнитивные функции. Важно отметить, что в дополнение к единичным эффектам, исследования, связывающие гормоны с когнитивным и социальноэмоциональным функционированием при старении, выявляют сложные, взаимозависимые эффекты между гормонами.
Несмотря на многочисленные исследования по этим вопросам, мы все еще только начинаем понимать как конкретные эффекты, так и интерактивные взаимоотношения гормонов и их роль в старении. В соответствии с этим подходом и с учетом будущих исследований мы предлагаем применить модель эмпирического плюрализма K. S. Kendler (2012) для изучения гормональных изменений при старении [72].
В рамках этого подхода мы полагаем, что рассмотренные выше гормоны представляют собой «создателей различий», которые поддаются как коррелятивному (изучению корреляции между гормональной функцией, мозгом и поведением), так и механистическому исследованиям. Применительно к исследованию нейробиологии старения этот подход отмечает, что важные факторы, влияющие на различия, распределены по нескольким биологическим уровням анализа (генетика, молекулярная и системная нейробиология, нейропсихология), а также находятся в разных социальных, политических и культурный аспектах [2].
Эта перспектива позволяет адекватно представить сложные рекурсивные взаимодействия и неоднородную причинность гормональных эффектов на две взаимосвязанные, но отдельные области познания и социально-эмоционального функционирования. Необходимо, чтобы в будущем изучение гормонов и старения было бы полезным при анализе сложных взаимодействий индивидуум-среда и рассмотрении биологических (например, половых, генетических, нейрохимических, нейроструктурных, функциональных), психологических (например, личности, опыта, совладания) и контекстуальные факторов высшего порядка (например, реляционные события, социальная среда) [2].
Подобные факторы являются измеримыми, их можно экспериментально исследовать и рассматривать как факторы риска в каждой из этих областей, а также связи между ними. Примерами таких факторов являются стили воспитания детей, стрессовые события в жизни или социальная поддержка.
В частности, известно, что гормональные эффекты варьируют в зависимости от врожденных биологических характеристик, связанных с полом человека, а также от генетического состава, и, вероятно, модулируются временными, реляционными и социальными процессами, связанными со старением. Эти факторы взаимодействуют с психологическими процессами и социально-контекстуальными факторами высшего порядка, в том числе личностными качествами, предыдущим опытом, стилями выживания и культурными условиями. И вместе они модулируют физиологические реакции, эпигенетические модификации и последующие гормональные и мозговые изменения на протяжении всей жизни.
Влияние гормональной среды на нейрохимические паттерны в структуре гиппокампа
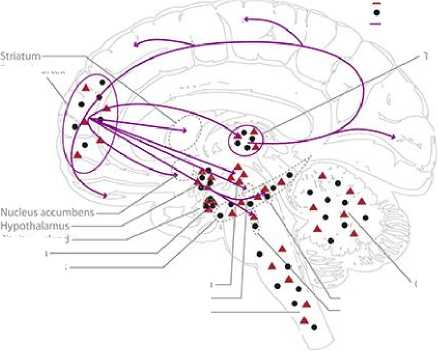
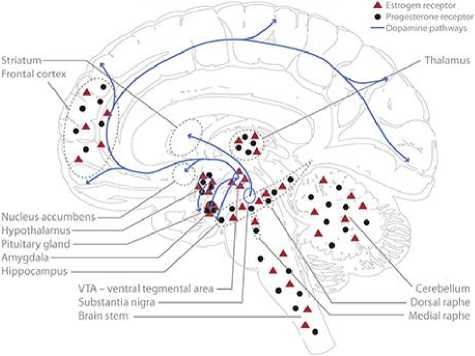
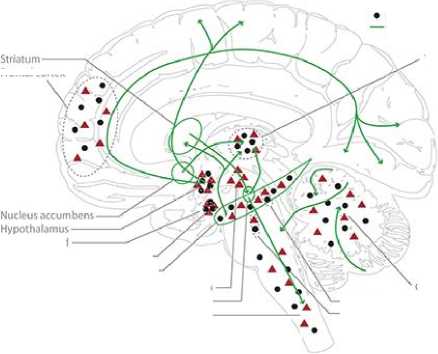
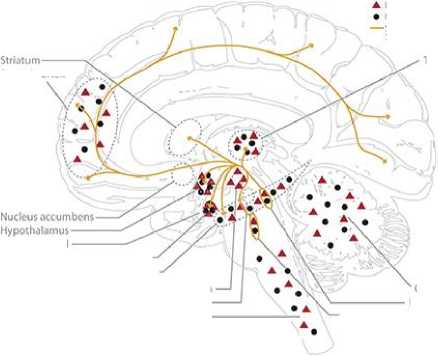
Половые гормоны были вовлечены в рост нейритов, синаптогенез, дендритное ветвление, миелинизацию и другие важные механизмы нервной пластичности. Установлено, взаимодействие между половыми гормонами и доминирующими нейротрансмиттерами, такими как серотонин, допамин, ГАМК и глутамат (Рисунок 7) [73].
в
A E itrogen receptor hegrtwixK receptor ■Quumile pathways
Cerebellum Dorsal raphe Medial raphe
Thalamus
Pituitary gland Amygdala Hippocampus
VTA - ventral tegmental area Substantia nigra-----------
Brainstem---------------
Frontal cortex
c
Pituitary gland Amygdala------------------
Hippocampus---------------
VTA - ventral tegmental area Substantia nigra-----------
Brainstem ---------------
л > receptor
• Progesterone receptor
•GABA pathways
GABA-.
Cerebellum ■ Dorsal raphe Medial raphe
Thalamus
Frontal cortex
Pituitary gland Amygdala------------------
Hippocampus---------------
VTA - ventral tegmental area Substantia nigra-----------
Brainstem ---------------
D
Estrogen receptor Progesterone receptor ■Serotonin pathway
Frontal cortex
Cerebellum Dorsal raphe Medial raphe
Рисунок 7. Схематическое представление основной центральной глутаматергической системы человека (A, фиолетовый), гамкергической системы (B, зеленый), дофаминергической системы (C, синий) и серотонинергической системы (D, оранжевый), включая схематическое отображение распределения эстрогенов (ERa и ERß в сочетании) и рецепторов прогестерона в головном мозге человека [73].
Thalamus
Физиологические и патологические концептуализированные теории свидетельствуют о том, как половые гормоны потенциально вызывают изменения нейропластичности через эти
Ice) 0 ~|
Бюллетень науки и практики / Bulletin of Science and Practice Т. 6. №8. 2020 четыре нейрохимические системы. Многие области мозга экспрессируют высокую плотность рецепторов эстрогенов и прогестерона, таких как миндалина, гипоталамус и гиппокамп. Гиппокамп имеет особое значение в контексте опосредующей структурной пластичности в мозге взрослого человека, исследованы различия в поведении, нейрохимических паттернах и структуре гиппокампа с изменяющейся гормональной средой (Рисунок 7) [73].
Физиологически происходящие гормональные переходные периоды у людей могут быть использованы для моделирования того, как изменения в половых гормонах влияют на функциональную связь, нейромедиацию и структуру мозга in vivo .
Классические рецепторы эстрогена (ERa/β) и рецепторы прогестерона (PR A/B ) высоко выражены в областях мозга, участвующих в эмоциях и познании, таких как миндалина и гиппокамп.
ГАМКергические проекции берут свое начало от (1) гипоталамуса к затылочной коре и теменной коре; (2) от гиппокампа к таламусу и стриатуму и (3) от прилежащего ядра к таламусу. Мозжечок также сильно иннервируется ГАМКергическими проекциями [73].
Эмоциональная саморегуляция
Эмоциональная саморегуляция или регулирование эмоций — это способность реагировать на текущие потребности в опыте с диапазоном эмоций таким образом, который является социально приемлемым и достаточно гибким, чтобы позволить спонтанные реакции, а также способность задерживать спонтанные реакции по мере необходимости, его также можно определить как внешние и внутренние процессы, ответственные за мониторинг, оценку и модификацию эмоциональных реакций. Эмоциональная саморегуляция относится к более широкой совокупности процессов регуляции эмоций, которая включает в себя как регуляцию собственных чувств, так и регулирование чувств других людей.
Регуляция эмоций — это сложный процесс, который включает в себя инициирование, торможение или модулирование своего состояния или поведения в данной ситуации – например, субъективное переживание (чувства), когнитивные реакции (мысли), связанные с эмоциями физиологические реакции (например, частота сердечных сокращений или гормональная активность) и эмоциональное поведение (телесные действия или выражения). Функционально эмоциональная регуляция может также относиться к таким процессам, как склонность фокусировать свое внимание на задании и способность подавлять неподходящее поведение под руководством. Регуляция эмоций — это очень важная функция в жизни человека.
Каждый день люди постоянно подвергаются воздействию самых разнообразных потенциально возбуждающих стимулов. Неадекватные, экстремальные или бесконтрольные эмоциональные реакции на такие стимулы могут препятствовать функциональному соответствию в обществе; поэтому люди должны заниматься той или иной формой регуляции эмоций почти все время. Вообще говоря, эмоциональная дисрегуляция была определена как трудности в контроле влияния эмоционального возбуждения об организации и качестве мыслей, действий и взаимодействий. Люди с эмоциональной дисрегуляцией демонстрируют паттерны реагирования, в которых существует несоответствие между их целями, реакциями и/или способами выражения и требованиями социальной среды. Например, существует значительная связь между дисрегуляцией эмоций и симптомами депрессии, тревоги, патологии пищевого поведения и злоупотребления психоактивными веществами. Более высокие уровни регуляции эмоций, вероятно, связаны как с высоким уровнем социальной компетентности, так и с выражением социально приемлемых эмоций.
Бюллетень науки и практики / Bulletin of Science and Practice Т. 6. №8. 2020
Нейропластичность и самореализация личности
Краеугольный камень самооценки Homo sapiens для самоактуализации и самореализации личности — это самооткрытие, саморазвитие, самообладание, самореализация. Нейропластичность — это внутреннее свойство и перепрограммирование мозга на протяжении всей его жизнедеятельности. Депрессия — это разрушительный синдром, с аллостатической перегрузкой и транзиторной дизрегуляцией функций неврологического, метаболического и иммунологического статуса, а также перепрограммированием в гипоталамо-гипофизарно-надпочечниковой оси [1].
-
H. sapiens формируя и выполняя цели, может измерить и гордиться своими достижениями. Процесс постановки и достижения целей не только позволяет достичь большего и улучшить производительность, но и дает мозгу H. sapiens сосредоточиться при построении своей уверенности в себе и самооценки. А самооценка — это краеугольный камень для самоактуализации и самореализации личности (самооткрытие, саморазвитие, самообладание, самореализация) (Рисунок 8).
Рисунок 8. Краеугольный камень самооценки H. sapiens для самоактуализации и самореализации личности (самооткрытие, саморазвитие, самообладание, самореализация).
Абрахам Маслоу в течение всей своей жизни пытался доказать тот факт, что люди постоянно находятся в процессе самоактуализации. Под этим термином он имел ввиду стремление человека к саморазвитию и постоянной реализации внутреннего потенциала. Самоактуализация является высшей ступенью среди потребностей, которые составляют несколько уровней в человеческой психике.
Абрахам Маслоу признавал, что люди имеют множество различных потребностей, но также полагал, что эти потребности можно разделить на пять основных категорий:
–Физиологические: голод, жажда и т. д.
–Потребности в безопасности: комфорт, постоянство условий жизни.
–Социальные: социальные связи, общение, привязанность, забота о другом и внимание к себе, совместная деятельность.
–Престижные: самоуважение, уважение со стороны других, признание, достижение успеха и высокой оценки, служебный рост.
–Духовные: познание, самоактуализация, самовыражение, самоидентификация.
В современной системе иерархии человеческих потребностей выделяется семь основных уровней (приоритетов) (Рисунок 9):
–Физиологические потребности: голод, жажда и т. д. (низший).
–Потребность в безопасности: чувство уверенности, избавление от страха и неудач.
–Потребность в принадлежности и любви.
–Потребность в уважении: достижение успеха, одобрение, признание.
–Познавательные потребности: знать, уметь, исследовать.
–Эстетические потребности: гармония, порядок, красота.
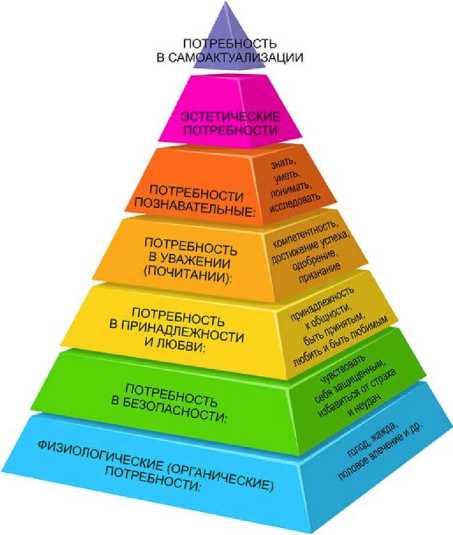
Рисунок 9. Современная иерархия человеческих потребностей. Ступени (снизу вверх): 1. Физиологические. 2. Безопасность. 3. Любовь/Принадлежность к чему-либо. 4. Уважение. 5. Познание. 6. Эстетические. 7. Самоактуализация.
Потребность в самоактуализации: реализация своих целей, способностей, развитие собственной личности (высший).
По мере удовлетворения низлежащих потребностей, все более актуальными становятся потребности более высокого уровня, но это вовсе не означает, что место предыдущей потребности занимает новая, только когда прежняя удовлетворена полностью. Также потребности не находятся в неразрывной последовательности и не имеют фиксированных положений, как это показано на схеме. Такая закономерность имеет место как наиболее устойчивая, но у разных людей взаимное расположение потребностей может варьироваться.
Инновационные методы П4-медицины управления нейропластичностью позволяют провести своевременную профилактику факторов, снижающих нейропластичность, сохранить факторы положительного влияния на нейропластичность, а главное – своевременно применить в практическом здравоохранении комбинированные методы сохранения и развития нейропластичности головного мозга человека [74].
Своевременное применение в практическом здравоохранении перечисленных ниже десяти комбинированных и/или дополнительных методов управления нейропластичностью позволяют достичь сохранения и развития нейрогенеза и нейропластичности, а также других поставленных целей [74].
Бюллетень науки и практики / Bulletin of Science and Practice Т. 6. №8. 2020
Представляем десять основных факторов, отрицательно влияющих на процессы нейропластичности головного мозга человека [74]:
–Электромагнитная «перегрузка» и интернет зависимость.
–Хронический стресс.
–Бессонница и хронические виды инсомний.
–Отсутствие культуры жизнедеятельности.
–Низкий уровень духовности и нравственности.
–Тунеядство и паразитирование в обществе.
–Прелюбодеяние.
–Загрязненная питьевая вода.
–Плохая экология.
–Несбалансированное питание и продукты низкого качества.
В последнее время установлены десять основных факторов, положительно влияющих на процессы нейропластичности [74]:
–Духовность и нравственность личности.
–Творческие виды деятельности.
–Здоровый образ жизни, гигиена мозга и гимнастика для мозга.
–Качественная и чистая питьевая вода.
–Хорошая экология.
–Качественное, сбалансированное и функциональное питание.
–Циркадианный сон.
–Повышение стрессоустойчивости.
–Персонифицированные геропротекторы.
–Гармоничная семья.
Десять комбинированных и/или дополнительных методов, которые активируют процессы нейрогенеза и нейропластичность [74]:
–Творческая личность, постоянно совершенствующая и длительно сохраняющая информационный поток на протяжении всей жизнедеятельности.
–Гигиена мозга и гимнастика для мозга.
–Хорошая экология, качественная и чистая питьевая вода, с повышенным содержанием микроэлементов (по требованию).
–Коммуникации с природой, растительным и животным миром.
–Нутригеномика и нутригенетика, употребление функциональных продуктов питания «Самарский здоровяк».
–Управление циркадианными ритмами, региональное и сезонное воздействие на хронобиологические циркадианные процессы.
–Современные персонифицированные геропротекторы с позиции доказательной медицины.
–Управление стрессоустойчивостью и ее повышение.
–Управляемые целевые показатели артериальной гипертонии и артериальной гипотонии.
–Гармоничная семья, семейные интеллектуальные нейрокоммуникации на протяжении всей жизни.
Человек никогда не бывает статичен, он всегда в динамике, в движении. Как свободное существо человек ответственен за реализацию наибольшего числа жизненных возможностей. С гуманистической точки зрения поиск подлинного существования требует чего-то большего, чем удовлетворение биологических потребностей, и, даже большего, чем удовлетворение социальных потребностей. Современный H. sapiens отказывается от становления, отрицая
Бюллетень науки и практики / Bulletin of Science and Practice Т. 6. №8. 2020 заложенную в них возможность полноценного человеческого существования. Для гуманистического психолога такой человек, отказавшийся от поиска смысла, наполнения им своей жизни является предателем самого себя. Тот, кто предал человеческую сущность не в состоянии ответить на основные вопросы своей жизни: кто я? Имеет ли моя жизнь смысл? Как я могу реализовать себя, даже, если я навсегда один? Вместо этого человек может подчиниться требованиям общества и не выходить за эти пределы. Исследователи отмечают, что поиск смысла жизни — дело трудное: многие становятся отчужденными по отношению к себе и другим, некоторым не хватает мужества настоять на своем, иные предпочитают принять то, что говорят друзья и родители, общество в целом. H. sapiens должен принять на себя ответственность за выбор и направление своей судьбы, так как он ответственен за одну единственную жизнь — свою собственную.
Таким образом, современная проблема XXI века — это поиск универсального фильтра-помощника человеку труженику. В современном мире H. sapiens в части многофункциональной задачи решает человек-специалист, поэтому защитный интерфейсный фильтр должен быть соответствующим.
Проблема выбора медико-социального помощника для качественного и полноценного сна, состоит из следующих технологий и инструментов: музыка, медитация, физическая активность, лечебная физкультура, многофункциональное питание, сохраненная здоровая микробиота и др.
Эволюционная генетика и эпигенетика 21 века, с одной стороны, и искусственный интеллект и виртуальная реальность, с другой, позволили использовать сон и сновидения, для нейрореабилитации висцерального и когнитивного мозга.
Мозг H. sapiens анализирует сон и обрабатывает содержания сновидений, которые состоят из вариаций сценариев, встречающихся в повседневной жизни, в которых мы взаимодействуем с физическим и социальным миром, неизбежно влияет на наши когнитивные способности и последующую оценку содержания реального мира.
H. sapiens 21 века будет имеет возможность понимать физиологические и нейрофизиологические паттерны сна, управлять и изменять свои привычки сна.
Хрономедицинские технологии — это математические модели и искусственный интеллект, которые предсказывают биологический возраст человека с помощью данных метилирования ДНК, модификации гистонов, ремоделирование нуклеосом и микроРНК, и являются наиболее точными биомаркерами процесса старения. Эпигенетические механизмы (метилирование ДНК, модификации гистонов, нкРНК) взаимосвязаны и образуют «эпигенетическую сеть». Факторы образа жизни и воздействия окружающей среды оставляют эпигенетические следы на нашей ДНК, которые влияют на экспрессию генов, некоторые из них оказывают защитное действие, а другие — вредное. Генетические и эпигенетические факторы, обеспечивающие долголетие и сверхдолголетие, требуют от человека разумного нового взаимодействия с природой и обществом, и ответственности за будущие здоровые поколения [75].
Новая эпигенетика H. sapiens управляет взаимодействием эпигенетических механизмов старения и долголетия с биологией, биофизикой, физиологией и факторами окружающей среды в регуляции транскрипции. Старение — это структурно-функциональная перестройка (перепрограммирование) и постепенное снижение физиологических функций организма, которые приводят к возрастной потере профессиональной пригодности, болезням, и к смерти. Понимание причин здорового старения составляет одно из самых проблемных междисциплинарных направлений.
Бюллетень науки и практики / Bulletin of Science and Practice Т. 6. №8. 2020
Генетический и эпигенетический вклад в старение и долголетие человека огромен. В то время как факторы окружающей среды и образа жизни важны в более молодом возрасте, вклад генетики проявляется более доминантно в достижении долголетия и здоровой старости. Эпигеномные изменения во время старения глубоко влияют на клеточную функцию и стрессоустойчивость. Дисрегуляция транскрипционных и хроматиновых сетей, вероятно, является важнейшим компонентом старения. В ближайшем будущем искусственный интеллект и крупномасштабная биоинформационная система анализа сможет выявить вовлеченность многочисленных сетей взаимодействия [75].
Выводы
В связи с увеличением продолжительности жизни растет популяция лиц пожилого и старческого возраста, а вместе с этим и процент когнитивных нарушений и модификаций в социально-эмоциональных областях.
Ряд исследований показали возможные механизмы когнитивных и социальноэмоциональных возрастных изменений с психологической, контекстуальной и биологической точек зрения.
Так доказана роль кортизола, эстрогена, тестостерона и окситоцина - в возрастных изменениях функции головного мозга, в частности, в контексте когнитивного и социальноэмоционального старения.
Тем не менее, ряд вопросов остаются открытыми и требуют дальнейшего изучения.
Список литературы Участие гормонов в процессах когнитивного и социально-эмоционального старения
- Романчук Н. П., Пятин В. Ф., Волобуев А. Н., Булгакова С. В., Тренева Е. В., Романов Д. В. Мозг, депрессия, эпигенетика: новые данные // Бюллетень науки и практики. 2020. Т. 6. №5. С. 163-183. DOI: 10.33619/2414-2948/54/21
- Ebner N. C., Kamin H., Diaz V., Cohen R. A., MacDonald K. Hormones as "difference makers" in cognitive and socioemotional aging processes // Frontiers in Psychology. 2015. V. 5. P. 1595. DOI: 10.3389/fpsyg.2014.01595
- English T., Carstensen L. Estrechamiento selectivo de las redes sociales a través de la edad adulta se asocia con la mejora de la experiencia emocional en la vida diaria // Revista Internacional de Desarrollo del Comportamiento. 2014. V. 38. №2. P. 195-202.
- Voelkle, M. C., Ebner, N. C., Lindenberger, U., & Riediger, M. Here we go again: Anticipatory and reactive mood responses to recurring unpleasant situations throughout adulthood // Emotion. 2013. V. 13. №3. P. 424. DOI: 10.1037/a0031351
- McEwen, B. S., Davis, P. G., Parsons, B., & Pfaff, D. W. The brain as a target for steroid hormone action // Annual review of neuroscience. 1979. V. 2. №1. P. 65-112. DOI: 10.1146/annurev.ne.02.030179.000433
- Conrad C. D., Bimonte-Nelson H. A. Impact of the hypothalamic-pituitary-adrenal/gonadal axes on trajectory of age-related cognitive decline // Progress in brain research. Elsevier, 2010. V. 182. P. 31-76.
- DOI: 10.1016/S0079-6123(10)82002-3
- Булгакова С. В., Романчук П. И., Тренева Е. В. Инсулин, головной мозг, болезнь Альцгеймера: новые данные // Бюллетень науки и практики. 2020. Т. 6. №3. С. 96-126.
- DOI: 10.33619/2414-2948/52/10
- Булгакова С. В., Романчук Н. П., Тренева Е. В. Глюкагоноподобный пептид 1, головной мозг, нейродегенеративные заболевания: современный взгляд // Бюллетень науки и практики. 2020. Т. 6. №4. С. 153-172.
- DOI: 10.33619/2414-2948/53/19
- Chahal H. S., Drake W. M. The endocrine system and ageing // The Journal of Pathology: A Journal of the Pathological Society of Great Britain and Ireland. 2007. V. 211. №2. P. 173-180.
- DOI: 10.1002/path.2110
- Liu S. Y., Wrosch C., Miller G. E., Pruessner J. C. Self-esteem change and diurnal cortisol secretion in older adulthood // Psychoneuroendocrinology. 2014. V. 41. P. 111-120.
- DOI: 10.1016/j.psyneuen.2013.12.010
- Булгакова С. В., Захарова Н. О., Тренева Е. В., Лобинская М. А. Современные представления об анемическом синдроме у лиц старших возрастных групп (обзор литературы) // Современные проблемы здравоохранения и медицинской статистики. 2020. №2. С. 45-68.
- DOI: 10.24411/2312-2935-2020-00031
- Kassel O., Herrlich P. Crosstalk between the glucocorticoid receptor and other transcription factors: molecular aspects // Molecular and cellular endocrinology. 2007. V. 275. №1-2. P. 13-29.
- DOI: 10.1016/j.mce.2007.07.003
- Булгакова С. В., Тренева Е. В., Захарова Н. О., Николаева А. В. Влияние старения надпочечников на работу различных органов и систем (обзор литературы) // Врач. 2020. Т. 31. №6. С. 34-39.
- DOI: 10.29296/25877305-2020-06-06
- Venero C., Díaz-Mardomingo C., Pereda-Pérez I., García-Herranz S., Utrera L., Valencia A., Peraita H. Increased morning salivary cortisol levels in older adults with nonamnestic and multidomain mild cognitive impairment // Psychoneuroendocrinology. 2013. V. 38. №4. P. 488-498.
- DOI: 10.1016/j.psyneuen.2012.07.007
- Van Ast V. A., Cornelisse S., Meeter M., Joëls M., Kindt M. Time-dependent effects of cortisol on the contextualization of emotional memories // Biological psychiatry. 2013. V. 74. №11. P. 809-816.
- DOI: 10.1016/j.biopsych.2013.06.022
- Moriarty A. S., Bradley A. J., Anderson K. N., Watson S., Gallagher P., McAllister-Williams R. H. Cortisol awakening response and spatial working memory in man: A U-shaped relationship // Human psychopharmacology: clinical and experimental. 2014. V. 29. №3. P. 295-298.
- DOI: 10.1002/hup.2399
- Landfield P. W., Blalock E. M., Chen K. C., Porter N. M. A new glucocorticoid hypothesis of brain aging: implications for Alzheimer's disease // Current Alzheimer Research. 2007. V. 4. №2. P. 205-212.
- DOI: 10.2174/156720507780362083
- Nater U. M., Hoppmann C. A., Scott S. B. Diurnal profiles of salivary cortisol and alpha-amylase change across the adult lifespan: evidence from repeated daily life assessments // Psychoneuroendocrinology. 2013. V. 38. №12. P. 3167-3171.
- DOI: 10.1016/j.psyneuen.2013.09.008
- Heaney J. L. J., Phillips A. C., Carroll D. Ageing, depression, anxiety, social support and the diurnal rhythm and awakening response of salivary cortisol // International Journal of Psychophysiology. 2010. V. 78. №3. P. 201-208.
- DOI: 10.1016/j.ijpsycho.2010.07.009
- Agrigoroaei S., Polito M., Lee A., Kranz-Graham E., Seeman T., Lachman M. E. Cortisol response to challenge involving low controllability: The role of control beliefs and age // Biological psychology. 2013. V. 93. №1. P. 138-142.
- DOI: 10.1016/j.biopsycho.2013.01.003
- Kudielka B. M., Buske-Kirschbaum A., Hellhammer D. H., Kirschbaum C. HPA axis responses to laboratory psychosocial stress in healthy elderly adults, younger adults, and children: impact of age and gender // Psychoneuroendocrinology. 2004. V. 29. №1. P. 83-98.
- DOI: 10.1016/S0306-4530(02)00146-4
- Almela M., Hidalgo V., van der Meij L., Pulopulos M. M., Villada C., Salvador A. A low cortisol response to acute stress is related to worse basal memory performance in older people // Frontiers in aging neuroscience. 2014. V. 6. P. 157.
- DOI: 10.3389/fnagi.2014.00157
- Lupien S. J., McEwen B. S., Gunnar M. R., Heim C. Effects of stress throughout the lifespan on the brain, behaviour and cognition // Nature reviews neuroscience. 2009. V. 10. №6. P. 434-445.
- DOI: 10.1038/nrn2639
- Juster R. P., McEwen B. S., Lupien S. J. Allostatic load biomarkers of chronic stress and impact on health and cognition // Neuroscience & Biobehavioral Reviews. 2010. V. 35. №1. P. 2-16.
- DOI: 10.1016/j.neubiorev.2009.10.002
- Huang C. W., Lui C. C., Chang W. N., Lu C. H., Wang Y. L., Chang C. C. Elevated basal cortisol level predicts lower hippocampal volume and cognitive decline in Alzheimer's disease // Journal of Clinical Neuroscience. 2009. V. 16. №10. P. 1283-1286.
- DOI: 10.1016/j.jocn.2008.12.026
- Schrijvers E., Direk N., Koudstaal P. J., Kirschbaum C., Hofman A., Tiemeier H., Breteler MAssociations of serum cortisol with cognitive function and dementia: the Rotterdam Study // Journal of Alzheimer's Disease. 2011. V. 25. №4. P. 671-677.
- DOI: 10.3233/JAD-2011-110224
- Chui H., Hoppmann C. A., Gerstorf D., Walker R., Luszcz M. A. Cumulative load of depressive symptoms is associated with cortisol awakening response in very old age // Research in Human Development. 2014. V. 11. №2. P. 126-141.
- DOI: 10.1080/15427609.2014.906738
- Пятин В. Ф., Романчук Н. П., Булгакова С. В., Романов Д. В., Сиротко И. И., Давыдкин И. Л., Волобуев А. Н. Циркадианный стресс Homo sapiens: новые нейрофизиологические, нейроэндокринные и психонейроиммунные механизмы // Бюллетень науки и практики. 2020. Т. 6. №6. С. 115-135.
- DOI: 10.33619/2414-2948/55/16
- Piazza J. R., Charles S. T., Stawski R. S., Almeida D. M. Age and the association between negative affective states and diurnal cortisol // Psychology and Aging. 2013. V. 28. №1. P. 47.
- DOI: 10.1037/a0029983
- O'Brien L. T., Hummert M. L. Memory performance of late middle-aged adults: Contrasting self-stereotyping and stereotype threat accounts of assimilation to age stereotypes // Social Cognition. 2006. V. 24. №3. P. 338-358.
- DOI: 10.1521/soco.2006.24.3.338
- Волобуев А. Н., Романчук П. И. Биофизика кровообращения при сосудистой деменции и болезни Альцгеймера // Бюллетень науки и практики. 2019. Т. 5. №4. С. 76-102.
- DOI: 10.33619/2414-2948/41/08
- Storck S. E., Pietrzik C. U. The Blood brain-barrier and its role in Alzheimer's disease // Neuroforum. 2018. V. 24. №4. P. A197-A205.
- DOI: 10.1515/nf-2018-A014
- Shabir O., Berwick J., Francis S. E. Neurovascular dysfunction in vascular dementia, Alzheimer's and atherosclerosis // BMC neuroscience. 2018. V. 19. №1. P. 62.
- DOI: 10.1186/s12868-018-0465-5
- Булгакова С. В., Романчук Н. П. Половые гормоны и когнитивные функции: современные данные // Бюллетень науки и практики. 2020. Т. 6. №3. С. 69-95.
- DOI: 10.33619/2414-2948/52/09
- Ottowitz W. E., Siedlecki K. L., Lindquist M. A., Dougherty D. D., Fischman A. J., Hall J. E.Evaluation of prefrontal-hippocampal effective connectivity following 24 hours of estrogen infusion: An FDG-PET study // Psychoneuroendocrinology. 2008. V. 33. №10. P. 1419-1425.
- DOI: 10.1016/j.psyneuen.2008.09.013
- Vest R. S., Pike C. J. Gender, sex steroid hormones, and Alzheimer's disease // Hormones and behavior. 2013. V. 63. №2. P. 301-307.
- DOI: 10.1016/j.yhbeh.2012.04.006
- Emmelot-Vonk M. H., Verhaar H. J. J., Nakhai-Pour H. R., Grobbee D. E., Van Der Schouw Y. T. Effect of testosterone supplementation on sexual functioning in aging men: A 6-month randomized controlled trial // International journal of impotence research. 2009. V. 21. №2. P. 129-138.
- DOI: 10.1038/ijir.2009.5
- Holland J., Bandelow S., Hogervorst E. Testosterone levels and cognition in elderly men: a review // Maturitas. 2011. V. 69. №4. P. 322-337.
- DOI: 10.1016/j.maturitas.2011.05.012
- Gooren L. Testosterone and the brain // Journal of Men's Health and Gender. 2007. V. 4. №3. P. 344-351.
- DOI: 10.1016/j.jmhg.2007.06.001
- Kret M. E., De Gelder B. A review on sex differences in processing emotional signals // Neuropsychologia. 2012. V. 50. №7. P. 1211-1221.
- DOI: 10.1016/j.neuropsychologia.2011.12.022
- Shafir T., Love T., Berent-Spillson A., Persad C. C., Wang H., Reame N. K.,.. Smith Y. R. Postmenopausal hormone use impact on emotion processing circuitry // Behavioural brain research. 2012. V. 226. №1. P. 147-153.
- DOI: 10.1016/j.bbr.2011.09.012
- Montoya E. R., Terburg D., Bos P. A., Van Honk J. Testosterone, cortisol, and serotonin as key regulators of social aggression: A review and theoretical perspective // Motivation and emotion. 2012. V. 36. №1. P. 65-73.
- DOI: 10.1007/s11031-011-9264-3
- Denson T. F., Mehta P. H., Tan D. H. Endogenous testosterone and cortisol jointly influence reactive aggression in women // Psychoneuroendocrinology. 2013. V. 38. №3. P. 416-424.
- DOI: 10.1016/j.psyneuen.2012.07.003
- Szeto A., Nation D. A., Mendez A. J., Dominguez-Bendala J., Brooks L. G., Schneiderman N., McCabe P. M. Oxytocin attenuates NADPH-dependent superoxide activity and IL-6 secretion in macrophages and vascular cells // American Journal of Physiology-Endocrinology and Metabolism. 2008. V. 295. №6. P. E1495-E1501.
- DOI: 10.1152/ajpendo.90718.2008
- Jafarzadeh N., Javeri A., Khaleghi M., Taha M. F. Oxytocin improves proliferation and neural differentiation of adipose tissue-derived stem cells // Neuroscience letters. 2014. V. 564. P. 105-110.
- DOI: 10.1016/j.neulet.2014.02.012
- Mak P., Broussard C., Vacy K., Broadbear J. H. Modulation of anxiety behavior in the elevated plus maze using peptidic oxytocin and vasopressin receptor ligands in the rat // Journal of psychopharmacology. 2012. V. 26. №4. P. 532-542.
- DOI: 10.1177/0269881111416687
- Striepens N., Kendrick K. M., Maier W., Hurlemann R. Prosocial effects of oxytocin and clinical evidence for its therapeutic potential // Frontiers in neuroendocrinology. 2011. V. 32. №4. P. 426-450.
- DOI: 10.1016/j.yfrne.2011.07.001
- Shahrestani S., Kemp A. H., Guastella A. J. The impact of a single administration of intranasal oxytocin on the recognition of basic emotions in humans: a meta-analysis // Neuropsychopharmacology. 2013. V. 38. №10. P. 1929-1936.
- DOI: 10.1038/npp.2013.86
- Cardoso C., Ellenbogen M. A., Orlando M. A., Bacon S. L., Joober R. Intranasal oxytocin attenuates the cortisol response to physical stress: a dose-response study // Psychoneuroendocrinology. 2013. V. 38. №3. P. 399-407.
- DOI: 10.1016/j.psyneuen.2012.07.013
- De Dreu C. K. W. Oxytocinergic circuitry motivates group loyalty. 2014.
- DOI: 10.1037/14250-022
- MacDonald K., Feifel D. Oxytocin's role in anxiety: A critical appraisal // Brain research. 2014. V. 1580. P. 22-56.
- DOI: 10.1016/j.brainres.2014.01.025
- Harari-Dahan O., Bernstein A. A general approach-avoidance hypothesis of oxytocin: accounting for social and non-social effects of oxytocin // Neuroscience & Biobehavioral Reviews. 2014. V. 47. P. 506-519.
- DOI: 10.1016/j.neubiorev.2014.10.007
- Herzmann G., Young B., Bird C. W., Curran T. Oxytocin can impair memory for social and non-social visual objects: a within-subject investigation of oxytocin's effects on human memory // Brain research. 2012. V. 1451. P. 65-73.
- DOI: 10.1016/j.brainres.2012.02.049
- Heinrichs M., Meinlschmidt G., Wippich W., Ehlert U., Hellhammer D. H. Selective amnesic effects of oxytocin on human memory // Physiology & behavior. 2004. V. 83. №1. P. 31-38.
- DOI: 10.1016/j.physbeh.2004.07.020
- Ansseau M., Legros J. J., Mormont C., Cerfontaine J. L., Papart P., Geenen V.,.. Franck G. Intranasal oxytocin in obsessive-compulsive disorder // Psychoneuroendocrinology. 1987. V. 12. №3. P. 231-236.
- DOI: 10.1016/0306-4530(87)90009-6
- Feifel D., MacDonald K., Cobb P., Minassian A. Adjunctive intranasal oxytocin improves verbal memory in people with schizophrenia // Schizophrenia research. 2012. V. 139. №1-3. P. 207-210.
- DOI: 10.1016/j.schres.2012.05.018
- Arletti R., Benelli A., Poggioli R., Luppi P., Menozzi B., Bertolini A. Aged rats are still responsive to the antidepressant and memory-improving effects of oxytocin // Neuropeptides. 1995. V. 29. №3. P. 177-182.
- DOI: 10.1016/0143-4179(95)90021-7
- Melis M. R., Mauri A., Argiolas A. Opposite changes in the content of oxytocin-and vasopressin-like immunoreactive peptides in the rat thymus during aging // Regulatory peptides. 1995. V. 59. №3. P. 335-340.
- DOI: 10.1016/0167-0115(95)00088-S
- Crockford C., Deschner T., Ziegler T. E., Wittig R. M. Endogenous peripheral oxytocin measures can give insight into the dynamics of social relationships: a review // Frontiers in behavioral neuroscience. 2014. V. 8. P. 68.
- DOI: 10.3389/fnbeh.2014.00068
- MacDonald K., MacDonald T. M. The peptide that binds: a systematic review of oxytocin and its prosocial effects in humans // Harvard review of psychiatry. 2010. V. 18. №1. P. 1-21.
- DOI: 10.3109/10673220903523615
- Schoofs D., Pabst S., Brand M., Wolf O. T. Working memory is differentially affected by stress in men and women // Behavioural brain research. 2013. V. 241. P. 144-153.
- DOI: 10.1016/j.bbr.2012.12.004
- Seeman T. E., Singer B., Wilkinson C. W., McEwen B. Gender differences in age-related changes in HPA axis reactivity // Psychoneuroendocrinology. 2001. V. 26. №3. P. 225-240.
- DOI: 10.1016/S0306-4530(00)00043-3
- Weiser M. J., Handa R. J. Estrogen impairs glucocorticoid dependent negative feedback on the hypothalamic-pituitary-adrenal axis via estrogen receptor alpha within the hypothalamus // Neuroscience. 2009. V. 159. №2. P. 883-895.
- DOI: 10.1016/j.neuroscience.2008.12.058
- Kirschbaum C., Wolf O. T., May M., Wippich W., Hellhammer D. H. Stress-and treatment-induced elevations of cortisol levels associated with impaired declarative memory in healthy adults // Life sciences. 1996. V. 58. №17. P. 1475-1483.
- DOI: 10.1016/0024-3205(96)00118-X
- Sharma A. N., Aoun P., Wigham J. R., Weist S. M., Veldhuis J. D.Estradiol, but not testosterone, heightens cortisol-mediated negative feedback on pulsatile ACTH secretion and ACTH approximate entropy in unstressed older men and women // American Journal of Physiology-Regulatory, Integrative and Comparative Physiology. 2014. V. 306. №9. P. R627-R635.
- Veldhuis J. D., Sharma A., Roelfsema F. Age-dependent and gender-dependent regulation of hypothalamic-adrenocorticotropic-adrenal axis // Endocrinology and Metabolism Clinics. 2013. V. 42. №2. P. 201-225.
- DOI: 10.1016/j.ecl.2013.02.002
- Dumas J. A., Kutz A. M., McDonald B. C., Naylor M. R., Pfaff A. C., Saykin A. J., Newhouse P. A. Increased working memory-related brain activity in middle-aged women with cognitive complaints // Neurobiology of aging. 2013. V. 34. №4. P. 1145-1147.
- DOI: 10.1016/j.neurobiolaging.2012.08.013
- Rupp H. A., James T. W., Ketterson E. D., Sengelaub D. R., Ditzen B., Heiman J. R. Amygdala response to negative images in postpartum vs nulliparous women and intranasal oxytocin // Social cognitive and affective neuroscience. 2014. V. 9. №1. P. 48-54.
- DOI: 10.1093/scan/nss100
- Carter C. S. Oxytocin pathways and the evolution of human behavior // Annual review of psychology. 2014. V. 65. P. 17-39.
- DOI: 10.1146/annurev-psych-010213-115110
- McCall C., Singer T. The animal and human neuroendocrinology of social cognition, motivation and behavior // Nature neuroscience. 2012. V. 15. №5. P. 681-688.
- DOI: 10.1038/nn.3084
- Van Anders S. M., Goldey K. L., Kuo P. X. The steroid/peptide theory of social bonds: integrating testosterone and peptide responses for classifying social behavioral contexts // Psychoneuroendocrinology. 2011. V. 36. №9. P. 1265-1275.
- DOI: 10.1016/j.psyneuen.2011.06.001
- Kendler K. S. The dappled nature of causes of psychiatric illness: Replacing the organic-functional/hardware-software dichotomy with empirically based pluralism // Molecular psychiatry. 2012. V. 17. №4. P. 377-388.
- DOI: 10.1038/mp.2011.182
- Barth C., Villringer A., Sacher J. Sex hormones affect neurotransmitters and shape the adult female brain during hormonal transition periods // Frontiers in neuroscience. 2015. V. 9. P. 37.
- DOI: 10.3389/fnins.2015.00037
- Романчук Н. П., Романчук П. И. Нейрофизиология и нейрореабилитация когнитивных нарушений и расстройств // Бюллетень науки и практики. 2019. Т. 5. №11. С. 176-196.
- DOI: 10.33619/2414-2948/48/19
- Романчук П. И. Возраст и микробиота: эпигенетическая и диетическая защита, эндотелиальная и сосудистая реабилитация, новая управляемая здоровая биомикробиота // Бюллетень науки и практики. 2020. Т. 6. №2. С. 67-110.
- DOI: 10.33619/2414-2948/51/07


