Участие оксида азота в проявлении респираторных эффектов экзогенного повышения уровня ИЛ-1 Р в кровеносной системе
Автор: Клинникова Анна Андреевна, Данилова Галина Анатольевна, Александрова Нина Павловна
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Физиология
Статья в выпуске: 4, 2019 года.
Бесплатный доступ
Цель исследования. Выявление роли нитрергических механизмов в способности провоспалительного цитокина ИЛ-1§ оказывать влияние на паттерн дыхания и гипоксический вентиляционный ответ. Материалы и методы. Эксперименты выполнены на 42 наркотизированных крысах. Для проведения ингибиторного анализа роли оксида азота в проявлении респираторных эффектов ИЛ-lfi использовались неселективный ингибитор NO-синтаз L-нитро-аргинин-метилэфира (L-NAME), а также высокоспецифичный ингибитор индуцибельной синтазы оксида азота аминогуанидина бикарбоната. Гипоксический вентиляционный ответ оценивался методом возвратного дыхания гипоксической газовой смесью до и после внутривенного введения человеческого рекомбинантного ИЛ-ір. Для регистрации параметров внешнего дыхания использовался метод пневмотахометрии. Результаты. Показано, что внутривенное введение ИЛ-1§ оказывает активирующее влияние на дыхание, вызывая увеличение дыхательного объема на 36,0±5,2 %, минутного объема дыхания - на 23,0±3,8 % и средней скорости инспираторного потока - на 20,0±3,0 %...
Цитокины, интерлейкин-1β, вентиляция, вентиляционный ответ на гипоксию, гипоксический хеморефлекс, оксид азота
Короткий адрес: https://sciup.org/14116407
IDR: 14116407 | УДК: 612.258.1+612.014.464+57.084.1 | DOI: 10.34014/2227-1848-2019-4-91-102
Текст научной статьи Участие оксида азота в проявлении респираторных эффектов экзогенного повышения уровня ИЛ-1 Р в кровеносной системе
Введение. Согласно традиционной точке зрения функциональные взаимодействия между органами и системами органов, регуляция их активности и формирование адаптивных реакций на изменение условий внешней и внутренней среды обеспечиваются нервными и гормональными механизмами. Роль иммунных механизмов в системной регуляции физиологических функций начали рассматривать лишь в последние десятилетия ХХ в., когда стало известно, что иммунная система может взаимодействовать с нервной системой посредством цитокинов – пептидных молекул, экспрессируемых иммунными клетками.
В настоящее время предполагается, что цитокины могут опосредовать особую систему регуляции физиологических функций, действующую наряду с нервной и гормональной системами [1]. Установлено, что цитокины играют важную роль в нейро-иммунных взаимодействиях, участвуя в межклеточной коммуникации в качестве нейромодуляторов [2–4], оказывающих прямое или опосредованное действие на клетки центральной нервной системы [5–8]. Это дает основание предполагать участие этих эндогенных пептидов в центральной регуляции различных физиологических функций, в т.ч. и функции дыхания. Уста- новлено, что содержание провоспалительных цитокинов в крови и цереброспинальной жидкости резко увеличивается при хронической обструктивной болезни легких, астме, синдроме сонного апноэ, при увеличении вентиляторной нагрузки на дыхательную систему, развитии гипоксии и гиперкапнии [9–12]. В связи с этим актуальным является исследование возможных последствий увеличенной продукции провоспалительных цитокинов и механизмов их влияния на функцию дыхания. Наиболее приоритетным направлением является изучение роли цитокинов в хеморефлек-торных механизмах регуляции дыхания, так как они определяют вентиляторный ответ на изменение газового состава крови и лежат в основе регуляции дыхания и формирования адаптивных реакций дыхательной системы.
Ранее нами было показано, что одним из механизмов влияния ключевого провоспали-тельного цитокина ИЛ-1β на дыхательные хеморефлексы является активация циклооксигеназных путей, что предполагает участие простагландинов в качестве посредников, обеспечивающих реализацию респираторных эффектов ИЛ-1β [13–15]. Вместе с тем известно, что физиологические эффекты провоспалитель-ных цитокинов могут осуществляться и через активацию NO-зависимых механизмов и усиление синтеза оксида азота, который выполняет функцию эффекторной молекулы [16]. Однако роль NO-синтазных путей в реализации влияний провоспалительных цитокинов на рефлекторные механизмы регуляции дыхания в настоящее время не определена.
Цель исследования. Выявление роли нитрергических механизмов в способности ИЛ-1β оказывать влияние на паттерн дыхания и вентиляционный ответ на гипоксию.
Материалы и методы. Для достижения цели исследования был проведен ингибиторный анализ респираторных эффектов ИЛ-1β с использованием неселективного блокатора NO-синтаз L-нитро-аргинин-метилэфира (L-NAME), а также высокоспецифичного ингибитора индуцибельной синтазы оксида азота (iNOS) аминогуанидина бикарбоната.
Исследование выполнено на 42 наркотизированных трахеостомированных спонтанно дышащих крысах-самцах линии Wistar весом
270±20 г (ЦКП «Биоколлекция ИФ РАН»). Все животные находились под общей анестезией (уретан, 1400 мг/кг). Эксперименты проводились с соблюдением основных норм и правил биомедицинской этики (Europian Community Council Directives 86/609/EEC).
Для регистрации объемно-временных параметров внешнего дыхания использовалась пневмотахографическая методика. К трахеостомической канюле подключалась пневмо-метрическая трубка MLT–1L (ADInstruments, Австралия). По кривой пневмотахограммы измерялась скорость воздушного потока (Vинсп) и частота дыхательных движений (ЧД). При интеграции пневмотахографиче-ской кривой автоматически получалась кривая дыхательных объемов – спирограмма и вычислялся дыхательный объем (ДО). Минутный объем дыхания (МОД) рассчитывался как произведение дыхательного объема на частоту дыхания (ЧД). Парциальное давление кислорода и углекислого газа (P E O 2 и P E СO 2 ) в конечной порции выдыхаемого воздуха измерялось с помощью респираторного газоанализатора (Genimi, США).
Вентиляторная чувствительность к гипоксическому стимулу исследовалась классическим методом возвратного дыхания [17], адаптированным нами для использования на мелких лабораторных животных. Дыхание производилось в замкнутом контуре, заполненном гипоксической газовой смесью, содержащей 15 % О2, что обеспечивало постепенное снижение содержания кислорода в альвеолярном газе и артериальной крови с соответствующим увеличением вентиляции легких. Вентиляционный ответ на гипоксию тестировался в диапазоне снижения парциального давления кислорода в альвеолярном газе от 80 до 40 мм рт. ст., так как в этом диапазоне зависимость величины вентиляции от интенсивности гипоксического стимула практически линейна. Для количественной оценки вентиляционного ответа на гипоксию производилось вычисление приростов ДО, МОД и Vинсп при снижении парциального давления кислорода в конечной порции выдыхаемого воздуха на 1 мм. Кроме того, производилось графическое построение зависимости роста вентиляции и ее составляющих от содержания О2 в альвео- лярном газе. Гипоксический вентиляционный ответ тестировался до внутривенного введения препаратов, а затем на 20, 40, 60 и 90-й мин после их введения.
Для повышения системного уровня про-воспалительного цитокина в кровеносную систему животных внутривенно вводилось 500 нг ИЛ-1β (Беталейкин, пр-во ФГУП Гос-НИИ ОЧБ ФМБА, г. Санкт-Петербург), разведенного в 1 мл физиологического раствора. Для выяснения роли нитрергических механизмов, участвующих в реализации респираторных эффектов ИЛ-1β, использовался метод ингибиторного анализа, основанный на применении веществ, прекращающих синтез фермента NO-синтазы. За 10 мин до внутривенного введения ИЛ-1β в хвостовую вену вводились либо L-NAME (Sigma), неселективный ингибитор NO-синтаз, в количестве 10 мг/кг массы тела, либо аминогуанидина бикарбонат (Sigma), селективный ингибитор iNOS, в количестве 50 мг/кг массы тела.
Статистическая обработка данных проводилась программными средствами с использованием статистического пакета Statistica for Windows и Microsoft Excel. Вычислялась средняя величина регистрируемых параметров и ошибка средней. Для выявления достоверности различий использовался однофакторный дисперсионный анализ. Различия считались достоверными при р<0,05.
Результаты и обсуждение. При проведении экспериментов с внутривенным введением ИЛ-1β нами было обнаружено влияние этого провоспалительного цитокина как на паттерн дыхания в спокойном состоянии, так и на гипоксический вентиляционный ответ.
Экзогенное повышение уровня ИЛ-1β в циркуляторном русле при спокойном дыхании воздухом вызывало достоверное увеличение дыхательного объема, минутного объема дыхания и средней скорости инспираторного потока. Изменение дыхательных параметров начиналось через 20 мин после введения ИЛ-1β, становясь статистически значимым через 40 мин. При этом ДО возрастал на 36,0±5,2 %, МОД – на 23,0±3,8 %, Vинсп – на 20,0±3,0 % по сравнению с фоновым уровнем. Частота дыхания достоверно не изменя- лась (табл. 1). Внутривенное введение физиологического раствора не вызывало изменения величины регистрируемых параметров.
Кроме того, введение ИЛ-1β ослабляло вентиляционный ответ на гипоксию. Наблюдалось достоверное уменьшение угла наклона линий тренда, отражающих зависимость МОД от величины гипоксического стимула. Линии тренда становились более пологими, что свидетельствует о снижении вентиляционной чувствительности к гипоксическому стимулу (рис. 1А).
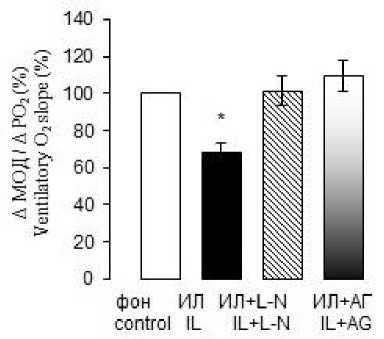
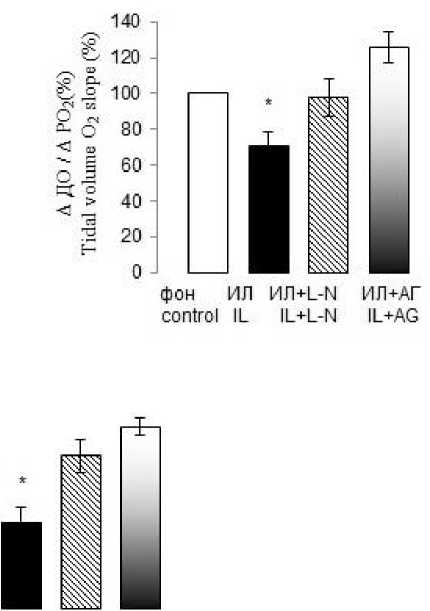
Расчет нормированных приростов ДО, МОД и Vинсп в ответ на гипоксическую стимуляцию после внутривенного введения ИЛ-1β также выявил достоверное снижение этих параметров. Прирост МОД при снижении Р ET О 2 на 1 мм рт. ст. через 40 мин действия ИЛ-1β снижался в среднем на 31 %, прирост ДО – на 30 % и Vинсп – на 47 % по сравнению с фоновыми величинами (рис. 2).
При внутривенном введении ИЛ-1β после предварительного введения ингибиторов NO-синтаз L-NAME и аминогуанидина не наблюдалось статистически значимых изменений в объемно-временных параметрах дыхания, характерных для действия ИЛ-1β (табл. 1).
Кроме того, введение ИЛ-1β на фоне действия ингибиторов NO-синтаз не вызывало изменений чувствительности дыхательной системы к гипоксической стимуляции. Вентиляционный ответ на гипоксию не ослаблялся: угол наклона линий тренда, характеризующий зависимость изменения МОД от величины гипоксической стимуляции, не изменялся после введения ИЛ-1β на протяжении всего эксперимента (рис. 1 Б, В).
Количественная оценка реакции на гипоксию после введения ИЛ-1β на фоне действия L-NAME и аминогуанидина показала, что в течение всего эксперимента не наблюдалось достоверных изменений приростов дыхательных параметров в ответ на снижение парциального давления кислорода в альвеолярном газе (рис. 2; 3 А, Б). При этом если действие неспецифического ингибитора NO-синтаз L-NAME достоверно ослабляло влияние ИЛ-1β на гипоксический ответ, то аминогуанидин, ингибитор iNOS, полностью устранял влияние ИЛ-1β на вентиляционный гипоксический ответ. Дей- ствие цитокина не проявлялось даже через 40 мин после его введения, т.е. в тот период, когда депрессивное влияние ИЛ-1β на гипоксический ответ выражено максимально.
Проведение контрольных экспериментов с введением ингибиторов NO-синтаз без по- следующего введения ИЛ-1β не выявило достоверных изменений в объемно-временных параметрах дыхания и в величине вентиляторного ответа на гипоксию, что указывает на отсутствие собственных респираторных эффектов использованных ингибиторов.
Таблица 1
Table 1
Изменение параметров дыхания при повышении системного уровня ИЛ-1β, сочетанном действии ИЛ-1β с L-NAME и ИЛ-1β с аминогуанидин бикарбонатом (АГ)
Changes in respiration parameters in case of IL-1β systemic level increase, concomitant action of IL-1β with L-NAME and IL-1β with aminoguanidine bicarbonate (AB)
|
.ft C5 В ь |
ИЛ-1β, n=7 IL-1β, n=7 |
ИЛ-1β+L-NAME, n=7 IL-1β+L-NAME, n=7 |
ИЛ-1β+АГ, n=7 IL-1β+АГ, n=7 |
||||||
|
фон background |
40 мин 40 min |
60 мин 60 min |
фон background |
40 мин 40 min |
60 мин 60 min |
фон background |
40 мин 40 min |
60 мин 60 min |
|
|
's ~9 s a 4 > о > |
117±9,6 |
143±10,8 ** |
146±10,0 ** |
220±8,3 |
237±10,1 |
244±9,3 |
168±2,2 |
188±14,3 |
186±12,7 |
|
1,0±0,08 |
1,36±0,07 ** |
1,4±0,07 ** |
1,8±0,08 |
1,9±0,07 |
1,9±0,07 |
1,5±0,06 |
1,7±0,05 |
1,7±0,08 |
|
|
я^ C* |
113±7,0 |
106±9,0 |
105±8,0 |
114±3,3 |
118±2,6 |
122±2,7 |
109±3,9 |
112±6,7 |
112±4,4 |
|
ь is s S -2 < S u о о > ^ § 1 1 |
3,8±0,55 |
4,2±0,36 |
4,3±0,40 * |
7,8±0,33 |
8,7±0,33 |
8,8±0,33 |
5,7±0,32 |
6,6±0,51 |
6,7±0,53 |
Примечание. * – р<0,05; ** – p<0,01 при сравнении с фоновыми величинами.
Note. * – p<0.05; ** – p<0.01 if compared with background values.
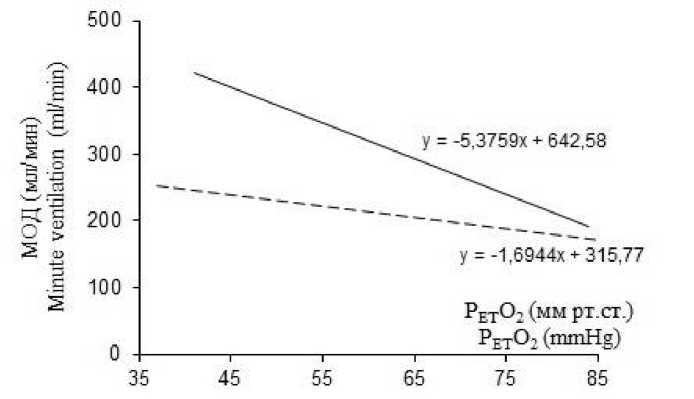
А
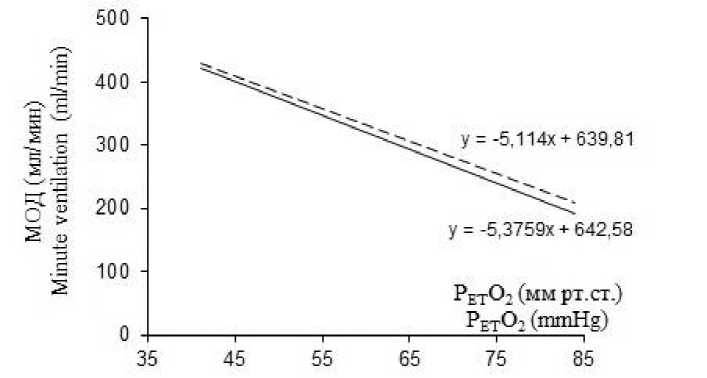
В
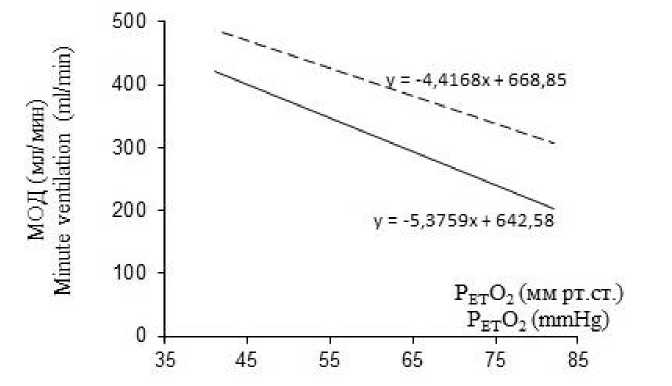
Рис. 1. Вентиляторный ответ на гипоксию до (сплошная линия) и через 40 мин после (пунктирная линия) внутривенного введения интерлейкина-1β. ИЛ-1β – без предварительного введения L-NAME (А) и с сочетанным действием ИЛ-1β с L-NAME (В) и ИЛ-1β с аминогуанидин бикарбонатом (С)
С
Fig. 1. Ventilatory response to hypoxia before (solid line) and 40 minutes after (dashed line) intravenous administration of interleukin-1β. IL-1β without prior administration of L-NAME (A) and with the concomitant action of IL-1β with L-NAME (B) and IL-1β with aminoguanidine bicarbonate (C)
А
140-1
£ 120 -
100 - ----
H 80 ■
60 ■
-
<2 40 '
-
1 20 -
В
фон ИЛ ИЛ+L-N ИЛ*АГ control IL IL+L-N IL+AG
Рис. 2. Устранение ингибирующего влияния ИЛ-1β на вентиляторный гипоксический ответ при действии L-NAME и аминогуанидина бикарбоната через 40 мин после системного введения ИЛ-1β. По оси ординат – прирост минутного объема дыхания (А), дыхательного объема (В), средней скорости инспираторного потока (С) при гипоксической стимуляции на фоне повышения системного уровня ИЛ-1β.
* – достоверные отличия от фона при p≤0,05
Fig. 2. Elimination of IL-1β inhibitory effect on the ventilatory hypoxic response under L-NAME and aminoguanidine bicarbonate, 40 minutes after IL-1β systemic administration. The Y-axis shows an increase in the minute respiration volume (A), tidal volume (B), and the average inspiratory flow rate (C) under hypoxic stimulation against the background of systemic IL-1β level increase.
* – differences are significant (p≤0.05) compared with the background value
Полученные данные указывают на то, что экзогенное повышение в циркуляторном русле уровня ИЛ-1β оказывает влияние не только на паттерн дыхания, но и на хеморе-флекторные механизмы регуляции дыхания. Под действием этого цитокина увеличивается дыхательный объем, наблюдается тенденция к увеличению частоты дыхательных движений, что приводит к увеличению минутного объема дыхания. Однако наряду с этим ИЛ-1β значительно снижает вентиляционный ответ на гипоксию, что подтверждает
данные, полученные нами в предыдущих исследованиях, в которых было обнаружено ослабление вентиляционного ответа и на гипоксию, и на гиперкапнию при внутрицере-бральных интравентрикулярных введениях ИЛ-1β [14, 15]. Ослабление дыхательных хеморефлексов, лежащих в основе регуляции функции внешнего дыхания, ведет к ухудшению компенсаторных возможностей дыхательной системы и может стать одной из причин развития дыхательной недостаточности при гиперцитокинемии. Полученные данные
позволяют предполагать, что чрезмерное эндогенное повышение уровня провоспали-тельных цитокинов при развитии системного воспаления также может ухудшать вентиляционную функцию легких.
На сегодняшний день практически не изучены пути, посредством которых повышение системного уровня цитокинов влияет на функцию респираторной системы. По всей вероят-
ности, они являются комплексными и могут включать в себя множество вторичных посредников. Усиление синтеза оксида азота клетками цереброваскулярного эндотелия, которое происходит при повышении содержания провоспалительных цитокинов в крови, может оказаться важным механизмом, определяющим влияние воспаления на респираторную функцию [14, 16, 18–21].
время (мин) time (min)
А
время (мин) time (min)
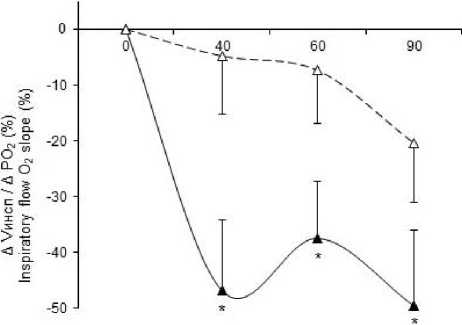
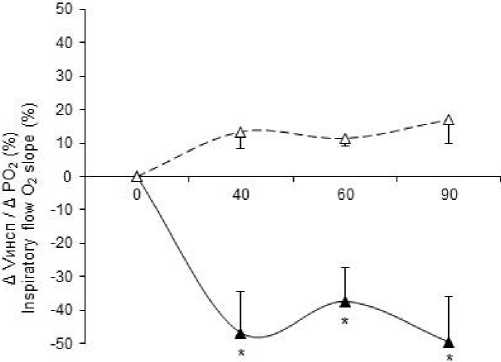
Рис. 3. Влияние L-NAME и аминогуанидина бикарбоната на модуляцию параметров гипоксического вентиляторного ответа, вызванную системным введением ИЛ-1β. По оси ординат – нормированный прирост средней скорости инспираторного потока. Сплошная линия – при системном введении ИЛ-1β, пунктирная линия – при системном введении ИЛ-1β на фоне действия L-NAME (А), на фоне действия аминогуанидина бикарбоната (В).
* – достоверные отличия от фона при p≤0,05
В
Fig. 3. The effect of L-NAME and aminoguanidine bicarbonate on the modulation of the hypoxic ventilatory response parameters caused by systemic IL-1β administration. The Y-axis shows the normalized increase in the inspiratory flow average velocity. The solid line is for systemic IL-1β administration, the dashed line is for systemic IL-1β administration against under L-NAME (A), under aminoguanidine bicarbonate (B).
* – differences are significant (p≤0.05) compared with the background value
Это предположение подтверждается результатами проведенного нами исследования, которые прямо указывают на то, что ингибирование синтеза оксида азота резко ослабляет или полностью устраняет влияние ИЛ-1β на функцию внешнего дыхания. Результаты нашего исследования показали, что повышение системного уровня ИЛ-1β влияет не только на параметры внешнего дыхания, как было показано ранее [16], но и на базовые хе-морефлекторные механизмы регуляции вентиляционной функции легких, ослабляя рефлекторное усиление легочной вентиляции в ответ на снижение содержания кислорода в крови. Кроме того, применение разных ингибиторов синтазы оксида азота позволяет сделать более конкретный вывод об участии нит-рергических путей в реализации респираторных эффектов ИЛ-1β.
Как известно неспецифический ингибитор L-NAME препятствует образованию в организме оксида азота, воздействуя на все три изоформы NO-синтаз – индуцибельную, нейрональную и эндотелиальную. При его введении наблюдалось значительное ослабление респираторных эффектов ИЛ-1β. Снижалось влияние данного цитокина на объемно-временные параметры паттерна дыхания, устранялось изменение вентиляционного ответа на гипоксию, вызванное действием ИЛ-1β. Однако ингибирование только индуцибельной NO-синтазы с помощью специфического ингибитора iNOS аминогуанидина бикарбоната оказывало такой же эффект. Респираторные влияния ИЛ-1β нивелировались даже в большей степени, чем при
использовании неспецифического ингибитора L-NAME. Это свидетельствует о том, что основным механизмом, обеспечивающим участие оксида азота в реализации респираторных эффектов ИЛ-1β при его экзогенном введении в относительно большой дозе, является усиление iNOS-активности.
Заключение. Таким образом, полученные данные позволяют предполагать, что при повышении системного уровня провоспали-тельных цитокинов одним из механизмов реализации их респираторных эффектов является усиление синтеза NO клетками церебрального эндотелия. Небольшая молекула NO может легко преодолевать гематоэнцефалический барьер, проникать внутрь нервных клеток, минуя мембранные рецепторы, и влиять на внутриклеточные процессы, изменяющие функциональное состояние нейронов, участвующих в центральной регуляции паттерна дыхания. Оксид азота является также индуктором циклооксигеназной активности, регулирующей синтез простагландинов, оказывающих тормозное влияние на медуллярные инспираторные нейроны, что может быть причиной ослабления вентиляционного ответа на гипоксию. Кроме того, нельзя исключать и возможное влияние повышенного уровня NO на периферические хеморецепторы, расположенные в кровеносном русле. Снижение чувствительности каротидных хеморецепторов также может явиться причиной ослабления вентиляционного гипоксического ответа, которое наблюдалось нами при повышении содержания ИЛ-1β в циркуляторном русле.
Работа поддержана ПРАН 0134-2018-0004 «Кортико-висцеральные взаимоотношения при адаптационных и дезадаптационных процессах в организме: роль интеграции нервной, гормональной и иммунной регуляций» по программе ПРАН ПI.43 «Фундаментальные основы технологии физиологических адаптаций».
Список литературы Участие оксида азота в проявлении респираторных эффектов экзогенного повышения уровня ИЛ-1 Р в кровеносной системе
- Симбирцев А.С. Интерлейкин-1 от эксперимента в клинику. Медицинская иммунология. 2001; 3 (3): 431-438.
- Rothwell N.J., Hopkins S.J. Cytokines and the nervous system II: Actions and mechanisms of action. Trends. Neurosci. 1995; 18: 130-136.
- Степаничев М.Ю. Цитокины как нейромодуляторы в центральной нервной системе. Нейрохимия. 2005; 22 (1): 5.
- Мюльберг А.А., Гришина Е.В. Цитокины как медиаторы нейроиммунных взаимодействий. Успехи физиологических наук. 2006; 37 (1): 18.
- Nadeau S., Rivest S. Effect of circulation tumor necrosis factor on the neuronal activity and expression of the genes encoding the tumor necrosis factor (p55 and p75) in the rat brain: a view from the blood-brain barrier. Neuroscience. 1999; 93 (4): 1449.
- Dantzer R., Konsman J.P., Bluthe R.M., Kelley K. W. Neural and humoral pathways of communication from the immune system to the brain: parallel or convergent? Auton. Neurosci. 2000; 85: 60.
- Bajetto A., Bonavia R., Barbero S., Schettini G. Characterization of chemokines and their receptors in the central nervous system: physiopathological implications. J. Neurochem. 2002; 82: 1311.
- Minami M., Katayama T., Satoh M. Brain cytokines and chemokines: roles in ischemic injury and pain. J. Pharmacol. Sci. 2006; 100: 461.
- Vernooy J.H., Kucukaycan M., Jacobs J.A., Chavannes N.H., Buurman W.A., Dentener M.A., Wouters E.F. Local and systemic inflammation in patients with chronic obstructive pulmonary disease: soluble tumour necrosis factor receptors are in-creased in sputum. Am. J. Respir. Crit. Care Med. 2002; 166: 1218-1224.
- Godoy I., Campana A.O., Geraldo R.R. Cytokines and dietary energy restriction in stable chronic obstructive pulmonary disease patients. Eur. Respir. J. 2003; 22: 920
- Koechlin C., Couillard A., Cristol J.P. Does systemic inflammation trigger local exercise-induced oxidative stress in COPD? Eur. Respir. J. 2004; 23: 538.
- Vassilakopoulos T., Divangahi M., Rallis G. Differential cytokine gene expression in the diaphragm in response to strenuous resistive breathing. Am. J. Respir. Crit. Care Med. 2004; 170: 154.
- Данилова Г.А., Александрова Н.П. Изменение вентиляторного ответа на гипоксию при повышении уровня интерлейкина-iр в крови и цереброспинальной жидкости. Ульяновский медико-биологический журнал. 2012; 2: 92-97.
- Aleksandrova N.P., Danilova G.A., Aleksandrov V.G. Interleukin-1beta suppresses the ventilatory hypoxic response in rats via prostaglandin-dependent pathways. Can. J. Physiol. Pharmacol. 2017; 95 (6): 681-685.
- DOI: 10.1139/cjpp-2016-0419
- Данилова Г.А., Александрова Н.П., Александров В.Г. Изменение вентиляторного ответа на гипер-капнию при экзогенном повышении уровня интерлейкина-iбета в крови и цереброспинальной жидкости. Ульяновский медико-биологический журнал. 2015; 2: 118-124.
- Graff G.R., Gozal D. Cardiorespiratory responses to interleukin-1beta in adult rats: role of nitric oxide, eicosanoids and glucocorticoids. Arch. Physiol. Biochem. 1999; 107: 97-112.
- Rebuck A.S., Campbell E.J. A clinical method for assessing the ventilatory response to hypoxia. Am. Rev. Respir. Dis. 1974; 109: 345-350.
- Ericsson A., Liu C., Hart R.P., Sawchenko P.E. Type 1 interleukin-1 receptor in the rat brain: distribution, regulation, and relationship to sites of IL-1-induced cellular activation. J. Comp. Neurol. 1995; 361: 681-698.
- Nakamori T., Morimoto A., Murakami N. Effect of a central CRF antagonist on cardiovascular and thermoregulatory responses induced by stress or IL-iр. American Journal of Physiology. i993; 265: 834-839.
- Watanabe T., Tan N., Saiki Y., Makisumi T., Nakamura S. Possible in-volvement of glucocorticoids in the modulation of interleukin-1-induced cardiovascular responses in rats. Journal of Physiology. 1996; 491 (1): 231-239.
- Herlenius E. An inflammatory pathway to apnea and autonomic dysregulation. Respiratory Physiology and Neurobiology. 2011; 178: 449-457.


