Углеродный эндопротез тазобедренного сустава
Автор: Золкин Петр Иванович, Кавалерский Геннадий Михайлович, Середа Андрей Петрович, Аберяхимов Харис Максимович, Алтуфьев Александр Васильевич, Бережнова Анна Александровна
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 2, 2015 года.
Бесплатный доступ
Цель. Обоснование прочностных свойств и износостойкости эндопротеза тазобедренного сустава из углеродного материала. Материалы и методы. Разработана конструкция углеродного эндопротеза тазобедренного сустава. Подобран и применен при изготовлении эндопротеза долговечный биосовместимый углеродный материал. Исследованы и приведены свойства применяемых материалов. Протез состоит из ножки, чашки и головки. Все детали собираются в единое медицинское изделие в свободном состоянии во время хирургической операции. Ножка эндопротеза изготавливается из углепластика и плотно фиксируется в бедренной кости по безцементной посадке. Головка эндопротеза изготавливается из прочного мелкозернистого графита марки МПГ-7 и соединяется с ножкой по конусной посадке. Чашку эндопротеза изготавливают из графита МПГ-7 и сажают в вертлужную впадину на костный цемент. Соединение чашки с головкой происходит по скользящей посадке. Результаты. Показано, что коэффициент трения графита по графиту равен 0,1, эрозийный износ за 20 часов непрерывного истирания с нагрузкой 100 кг (вес человека) составляет 0,453×10-9 м/м, что позволяет предполагать износостойкость изделия в течение 100 лет. Заключение. Предложенный материал для имплантации обладает высокой биосовместимостью, не токсичен, не изменяется под воздействием биологических сред, не подвержен коррозии при контакте с живой тканью, характеризуется отсутствием усталостных напряжений, низким коэффициентом трения и величиной износа, способностью стимулировать рост биологической ткани. Ни один из применяемых в настоящее время имплантируемых материалов не обладает таким набором свойств.
Углеродный эндопротез, тазобедренный сустав, хирургическое лечение, углепластик, биосовместимость, имплантат
Короткий адрес: https://sciup.org/142121823
IDR: 142121823 | УДК: 616.728.2-089.227.843-77-032.3 | DOI: 10.18019/1028-4427-2015-2-32-35
Текст научной статьи Углеродный эндопротез тазобедренного сустава
Хирургическое лечение тазобедренного сустава связано с проблемой современного медицинского материаловедения. Это объясняется тем, что материалы должны быть биосовместимыми и работоспособными до 100 лет.
В настоящее время в восстановительной хирургии тазобедренной области используются многочисленные металлические, керамические и полимерные материалы. Известно, что сочетание металлических медицинских изделий в имплантатах осложняет работу эндопротеза из-за гальвано-электрических явлений вследствие различных электрохимических потенциалов, приводящих к металлозу окружающих биологических тканей или к коррозии деталей. Кроме того, металлам свойственно вызывать резорбцию костной ткани, а усталостные явления часто приводят к разрушению эндопротеза. Керамические материалы очень износоустойчивы, но, к сожалению, очень дороги. Хрупкость керамики ограничивает сферу её применения и вызывает резорбцию кости при прямом контакте [1]. Полимерные материалы нередко вызывают злокачественные перерождения окружающих тканей, проявляют хладотекучесть, старение, что приводит к деформации и разрушению эндопротеза [2].
Следовательно, возникает необходимость разра- ботки таких материалов для эндопротезирования тазобедренных суставов, которые могли бы обеспечивать долгосрочную биосовместимость с живым организмом человека без длительной замены. АО «НИИгра-фит» имеет многолетний опыт разработки углеродных медицинских изделий из углепластика ОСТЕК, используемых в хирургии костей свода черепа [3] и костей челюстно-лицевой области [4]. В офтальмологии используют углеродный войлок «Карботекстим-М» для формирования опорно-двигательной культи после энуклеации глазного яблока и при других пластических операциях в области орбиты, а также дренажи из углеродной нити для лечения глаукомы [5] и др. Все названные углеродные изделия внедрены в клиническую практику страны и, как показывает опыт, без отторжений, что говорит о биосовместимости углеродных материалов и надёжной работоспособности.
Биологическая совместимость рассматривается как отсутствие существенных биохимических реакций при непосредственном и длительном контакте углеродных материалов с живыми тканями. Долговечность работоспособности эндопротезов определяет не только биосовместимость, но и физико-химические и поверхностные свойства материала. Технология производства углеродных материалов для медицинских целей позволяет полу- чать материал с заданными свойствами, близкими к кости человека. В итоге углеродные материалы обладают:
-
– биосовместимостью;
-
– отсутствием токсичности и канцерогенности;
-
– неизменностью под воздействием биологических сред и отсутствием коррозии при контакте с живой тканью;
-
– отсутствием усталостных напряжений;
-
– низким коэффициентом трения и величиной износа;
-
– способностью стимулировать рост биологической ткани;
-
– возможностью получать высокопористые или высокоплотные материалы;
-
– возможностью получать поверхности медицинских изделий высокой чистоты;
– возможностью применения быстрой стерилизации любого типа.
Ни один из применяемых в настоящее время имплантируемых материалов не обладает таким набором свойств.
На рисунке 1 представлена конструкция эндопротеза тазобедренного сустава. Он состоит из трех отдельных сборных деталей, которые компонуются во время операции. Ножка эндопротеза изготавливается из углепластика, получаемого методом горячего прессования пресс-пакета, состоящего из полотна углеродной ткани марки ТГН-2М и пленки термопластичного полиамида 12/10, сложенных послойно в виде слоеного пирога. Углеродную ткань ТГН-2М получают из вискозной нити при температуре 2400˚С, что обеспечивает высокую химическую чистоту. Для получения углепластика с высокими прочностными свойствами ткань подвергают электрохимической обработке, что увеличивает поверхностную пористость структуры ткани и повышает степень взаимодействия с полиамидным связующим веществом.
Процесс прессования пакета происходит при температуре 210-220 °С, давлении 100 кг/см2, время выдержки 2 часа. Свойства углепластика приведены в таблице 1.
Таблица 1
Физико-механические свойства углепластика
|
№ п/п |
Свойства материала |
Значение |
|
1 |
Плотность, г/см3 |
1,15-1,20 |
|
2 |
Предел прочности при изгибе, МПа |
17,0-20,0 |
|
3 |
Модуль упругости, ГПа |
1,8-2,3 |
|
4 |
Содержание углерода, % |
≥ 99,0 |
|
5 |
Содержание золы, %, не более |
1,0 |
Рис. 1. Конструкция углеродного эндопротеза тазобедренного сустава: 1 – ножка, 2 – головка, 3 – чашка
С целью обеспечения больных различного возрастного состава с патологией тазобедренной области нами разработано 8 вариантов ножек эндопротезов, представленных на рисунке 2 и в таблице 2.

Рис. 2. Ножка протеза (схема)
Таблица 2
Типоразмеры конструкций ножек
|
Наименование |
Длина ножки А, мм |
Длина ножки В, мм |
Офсет С, мм |
Длина шейки D, мм |
Толщина Е, мм |
|
Ножка 9 |
144,3 |
130 |
38,5 |
20,5 |
14 |
|
Ножка 10 |
154 |
140 |
39,5 |
20 |
15 |
|
Ножка 11 |
159,3 |
145 |
40 |
20,5 |
15 |
|
Ножка 12 |
165 |
150 |
41 |
21 |
15 |
|
Ножка 13 |
169,3 |
155 |
41,5 |
20,5 |
15 |
|
Ножка 15 |
179 |
165 |
43 |
20 |
16 |
|
Ножка 18 |
194,2 |
180 |
44,5 |
20,5 |
18,5 |
|
Ножка 20 |
204 |
190 |
45,5 |
20 |
19 |
Свойства углеродного эндопротеза во многом идентичны свойствам кости здорового человека. Конструкция системы «кость-имплантат» хорошо функционирует на протяжении длительного времени, когда её части равномерно нагружены. Применение конструкции из углепластика с упругими характеристиками, близкими к характеристикам кости, гарантирует создание ситуации, при которой во время ходьбы имплантат деформируется вместе с костью. Это сводит на нет концентрацию остаточных напряжений, разрушение ножки и расшатывание её в местах плотного контакта с костью.
Прочностные и поверхностные свойства углеродного эндопротеза необходимы для замещения части органа или ткани за счет механических свойств, которые будут выполнять функции утраченной ткани, не изменяя своих физико-механических и биологических свойств. Плотной фиксации ножки эндопротеза при безцементном её укреплении в бедренной кости способствует набухание на 2-4 % углепластика в биологической среде. Такая фиксация позволяет углероду проявлять свою способность провоцировать рост соединительнотканной пленки, выступающей в роли дополнительного крепления эндопротеза в кости.
Соединения головки эндопротеза с ножной осуществляется посредством конусной посадки 12/14 во время операции после имплантирования ножки в бедренную кость.
Головку (рис. 3, табл. 4) и чашку (рис. 4, табл. 5) изготавливают из мелкозернистого прочного графита марки МПГ-7 промышленного производства по ТУ 1915-028-00200851-2009. Свойства графита приведены в таблице 3.
Таблица 3
Физико-механические свойства графита МПГ-7
|
№ |
Свойства материала |
Значение |
|
1 |
Плотность, г/см3, не менее |
1,85 |
|
2 |
Предел прочности при изгибе, МПа, не менее |
50,0 |
|
3 |
Предел прочности на сжатие, МПа, не менее |
110,0 |
|
4 |
Удельное электросопротивление, мкОм×м, не более |
15,0 |
|
5 |
Массовая доля углерода, %, не менее |
99,5 |
|
6 |
Массовая доля золы, %, не более |
0,5 |
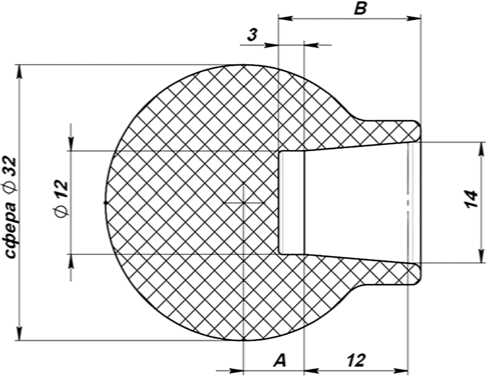
Рис. 3. Головка протеза (схема)
Таблица 4
Типоразмеры конструкций головок
|
Наименование |
А, мм |
В, мм |
|
Головка 32 минус 3 |
-3 |
19,5 |
|
Головка 32 ноль |
0 |
16,7 |
|
Головка 32 плюс 3 |
3 |
16,5 |
|
Головка 32 плюс 7 |
7 |
16,5 |
|
Головка 32 плюс 10 |
10 |
16,5 |
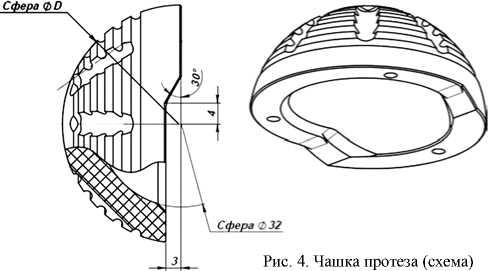
Таблица 5
Типоразмеры конструкций чашек
|
Наименование |
D, мм |
|
Чашка 1 |
46 |
|
Чашка 2 |
48 |
|
Чашка 3 |
50 |
|
Чашка 4 |
52 |
|
Чашка 5 |
54 |
|
Чашка 6 |
56 |
Графит МПГ-7 обладает мелкозернистой структурой с величиной зерна менее 50 нм и относится к наноматериалам. Микроструктура материала представлена на рисунках 5-8. Производство графита ведут при температуре 2800˚С, что обеспечивает материалу высокие антифрикционные свойства и химическую чистоту.

Рис. 5. Наноструктура МПГ-7, ρ=1,93 г/см3

Рис. 6. Наноструктура МПГ-7, ρ=1,93 г/см3

Рис. 7. Наноструктура МПГ-7, ρ=1,93 г/см3

Рис. 8. Наноструктура МПГ-7, ρ=1,93 г/см3
Работоспособность углеродного эндопротеза тазобедренного сустава зависит от антифрикционных свойств трущихся элементов, т.е. головки и чашки. В лаборатории антифрикционных материалов АО «НИ-Играфит» были определены коэффициент трения и эрозионный износ. Исследования проводили на испытательной машине фирмы «Амслер». Образцы для исследования изготавливались двух видов:
– ролик, диаметром 50 мм и высотой 10 мм;
– пластина, размером 10×10×14 мм.
Перед испытаниями рабочие поверхности графита подвергались полировке.
Условия испытаний:
-
1. Пластина графита устанавливается неподвижно.
-
2. Ролик скользит по поверхности пластины со скоростью 0,5 м/с.
-
3. Нагрузка на ролик составляет 100 кг (условно принятый вес человека).
-
4. Время непрерывного эксперимента составляет 20 часов.
Исследованиями было установлено:
-
– коэффициент трения пары графит-графит составляет 0,11±0,01;
– эрозионный износ графита – (0,56÷0,84)∙10-9 м/м (метр износа на метр пройденного пути).
Такой износ пары трения графит-графит гарантирует 100-летнюю механическую эксплуатацию.
Таким образом, разработана конструкция углеродного эндопротеза тазобедренного сустава. Подобран и применен при изготовлении эндопротеза долговечный биосовместимый углеродный материал. Исследованы и приведены свойства применяемых материалов.
Соединение чашки с биологической костью вертлужной впадины осуществляется во время операции с помощью костного цемента.
Список литературы Углеродный эндопротез тазобедренного сустава
- Мусалатов Х.А. Углеродные имплантаты в травматологии и ортопедии: автореф. дис… д-ра мед. наук. М., 1990. 47 с.
- Применение углеродных имплантатов в травматологии и ортопедии/Г.С. Юмашев, Х.А. Мусалатов, И.Н. Лавров, А.В. Яншевский, В.С. Бородкин, Ю.С. Лопатто, С.В. Бровкин, А.Г. Юмашев//Эндопротезирование в травматологии и ортопедии: сб. науч. тр. Саратов, 1987. С. 6-9.
- Исследование свойств углеродных материалов, используемых в медицине/П.И. Золкин, Т.В. Леонова, Т.В. Юдина, В.Ф. Татарников//Конверсия в машиностроении. 2003. № 3. С. 100-104.
- Головин Р.В. Клинико-экспериментальное изучение эффективности применения рентгеноконтрастного углеродного материала при реконструктивно-восстановительных операциях в челюстной области: автореф. дис…канд. мед. наук. М., 2005. 32 с.
- Разработка дренажа из углеродной нити для лечения глаукомы на этапе исследований in vitro/В.В. Нероев, В.П. Быков, П.И. Золкин, О.И. Кваша, Т.А. Белёвцева//Рос. офтальмолог. журн. 2010. Т. 3, № 3. С. 44-47.
- Золкин П.И., Островский В.С. Углеродные материалы в медицине. М.: Металлургиздат, 2014. С. 142.


