Ультраструктура биодеградируемых имплантатов: изменения во времени
Автор: Ахпашев Александр Анатольевич, Джамбинова Екатерина Александровна, Канаев Алексей Семенович, Агзамов Джахангир Салимович
Журнал: Клиническая практика @clinpractice
Рубрика: Оригинальные исследования
Статья в выпуске: 1 (21), 2015 года.
Бесплатный доступ
В статье подробно описаны биохимические процессы, происходящие во времени и с распадом полимера в кости. Оригинально применен метод сканирующей электронной микроскопии для оценки состояния фиксаторов, которые провели несколько лет в кости. Полученные данные объективно свидетельствуют о биологической активности имплантатов в костной ткани и еще раз подчеркивают важность выбора материалов, которые будут имплантированы в организм человека.
Реконструкция передней крестообразной связки, интерферентные винты, биодеградируемые винты
Короткий адрес: https://sciup.org/14338512
IDR: 14338512
Текст научной статьи Ультраструктура биодеградируемых имплантатов: изменения во времени
Во всем мире роль артроскопических методов лечения и диагностики повреждений коленного сустава значительно выросла [Bigony L. et al 2008]. В тоже же время, существует много разногласий по установлению показаний к оперативному лечению при повреждениях коленного сустава и по выбору хирургической тактики. Выбор трансплантата при реконструкции передней крестообразной связки (ПКС), сроки оперативного лечения – все это зачастую остается предметом предпочте- ний каждого конкретного хирурга [Bostman O. et al 1992; Franco MG, et al 1994; Andersson C. et al 1992; Bruce D. et al.2005.; Chang SK et al. 2003].
Одним из основных вопросов в технике артроскопической реконструкции ПКС остается выбор метода фиксации трансплантата. В настоящее время существует большое количество типов имплантатов для фиксации трансплантата ПКС, при этом в литературе нет четких данных о преимуществах тех или иных способах фиксации в зависимости от типа трансплантата [Bostman O. et al. 1998; Daniels A.U. et al. 1990; Hoffmann R. et al. 1989; Barber F.A. et al. 1995; Brown C.H. et al.1993; Alejandro Espejo-Baena et al. 2014; Colombet P. et al. 2005].
В то же время, растет доля используемых имплантатов, выполненных из различных полимерных или биополимерных – рассасывающихся материалов («bioabsorbable implants», Pertti T. 2004), которые должны в разные сроки, в зависимости от их состава, замещаться костной тканью [Barber F. 1995; Johnson L. et al. 1995; Achtnich A. et al. 2014]. При этом в мировой литературе нет единого научного мнения об отдаленных результатах использования подобных рассасывающихся имплантатов в травматологии и ортопедии: от мнения о невозможности замещения имплантата костной тканью [Bergsma E. et al. 1995], до выводов о замещении имплантата костной тканью в короткие сроки – до 36 недель [Bцstman O. et al. 1992; Bach FD et al. 2002; Bourke HE et al. 2013].
Важнейшим элементом артроскопической техники реконструкции передней крестообразной связки является обеспечение стабильной фиксации трансплантата, которая обеспечивает возможность раннего восстановительного лечения и исключает нестабильность трансплантата в местах фиксации до момента его врастания. Преимущественно используется внутриканальная фиксация при помощи интерферентных титановых винтов [Лазишвили Г.Д. c соавт. 1997]. Производится фиксация костными штифтами [Иванов В.А. с соавт.], методом компрессионной импакции [Никитин В.В. 1985], широко используются различные модификации подвешивающих вариантов фиксации трансплантатов, с этой целью предложены различные виды фиксаторов (Trans-Fix, TightRope ACL, Endobutton CL и др.) [Королев А.В. 2004]. Перспективным является использование для фиксации трансплантата различных рассасывающихся материалов [Лазко Ф.Л. с соавт 1999; Лазишвили Г.Д. с соавт. 1997].
Целью фиксации трансплантата ПКС является обеспечение хорошего натяжения его до биологического приживления ткани в костных каналах [Ferretti A. et al. 2002; Stener S. et al. 2010; Rhee PC. et al.2011].
Впервые биодеградирующие имплантаты из полимолочной кислоты для внутренней фиксации были использованы в эксперименте рядом исследователей [Schmitt, E. E. et al. 1967; Cutright DE et al. 1971; Kulkarni RK et al. 1971]. В начале 80-х годов прошлого столетия были применены имплантаты из полигликолевой кислоты, но была отмечена низкая механическая прочность данных имплантатов (40-70 МРа) при хорошей гистологической совместимости [Christel P et al. 1982; Kilpikari J et al. 1983.; Vert M et al. 1984]. Некоторое время спустя, в производстве фиксаторов была применена техника усиления механической прочности имплантатов, и стало возможным получать имплантаты для фиксации переломов с прочностью на излом до 250-370 МРа [Rokkanen P et al. 1996; Tormala P et al. 1987; Vainionpaa S et al. 1987].
Впервые имплантаты из смеси полимеров (сплав полигликолевой и полимолочной кислот) были использованы в 1984 году [Rokkanen P et al. 1985].
Материалы, применяемые для изготовления имплантатов, могут быть разделены на разные группы материалов: природные материалы, керамические материалы, различные металлы, композитные материалы, полимеры [Tormala P. et al.1998]. Полимеры разделяют на органические и неорганические, синтетические и несинтетические полимеры. Полимеры также разделяют на биостабильные (инертные), биодеградирующие и частично биодеградирующие полимеры. Существует ряд характеристик, которые должны быть присущи биодеградирующим имплантатам, это: высокая первичная жесткость имплантата (имплантат не должен быть слишком жестким или слишком гибким), ожидаемые сроки сохранения показателей жесткости имплантата in vivo с течением времени [Tormala P et al. 1998]. Данным условиям соответствуют 29 типов полимеров, которые потенциально могут быть использованы в клинической практике. В настоящее время наиболее широкое применение нашли имплантаты, выполненные из полигликолевой кислоты (PGA) и полимолочной кислоты (PLA), которые являются частично кристаллизованными с линейной структурой полимерами. Данные полимеры различаются друг от друга, имплантаты из PGA являются гидрофильными, а имплантаты из PLA – гидро- фобными. PGA – это высоко кристаллизованный полимер линейной структуры, прозрачный при температуре 360 С, с точкой плавления 224-2280 С (Frazza and Schmitt 1971). PLA – высоко кристаллизованный линейный полимер с молекулярной массой 180000 – 530000 с L- (PLLA) или D- (PDLA) пространственной конфигурацией [Eling et al. 1982].
Деградация биополимеров в целом происходит следующим образом: полигликолевая кислота расщепляется до гликолевой кислоты, полимолочная кислота – до молочной кислоты, и в конечном итоге – до пировиноградной кислоты с соответствующей формой ацетила коэнзима А, затем продукты деградации проходят через цикл Кребса с образованием Н2О и СО2 и небольшого количества энергии. Конечные продукты деградации выделяются из организма при помощи внешнего дыхания и в небольшом количестве с мочой [Hollinger JO et al. 1986]. Сроки полного расщепления и замещения имплантата костной тканью сильно отличаются в зависимости от типа полимера. Так, имплантаты из PGA полностью расщепляются в сроки до 36 недель [Bostman O et al. 1992], в тоже время, имплантаты из полимолочной кислоты расщепляются и замещаются костной тканью по данным разных авторов не ранее чем 7 лет после имплантации (Nordstrom P et al. 2001; Jukkala-Partio K et al. 2002].
Нормальная гистологическая реакция на имплантат из биополимера проявляется неспе-цифической реакцией активации лимфоцитов – появлением макрофагов, гигантских многоядерных клеток инородного тела, небольших лимфоцитов и полиморфноядерных нейтрофилов (Santavirta S et al. 1990.).
В нашем исследовании мы попытались выяснить характер изменений биодеградирующих имплантатов, находившихся в костной ткани в течение различного срока, на ультра-структуральном уровне. В исследованной литературе мы не смогли найти информации подобного рода и поэтому трактовку и описание находок произвели без ссылок на литературные данные.
В ходе работы нам удалось изучить несколько имплантатов, которые были извлечены в ходе ревизионной операции по поводу разрыва аутотрансплантата (см. табл.1).
Имплантаты изучали в лаборатории экспериментальной патологии клетки ГУ НИИ морфологии человека (зав. лабораторией В.П. Черников). Предварительная подготовка образцов осуществлялась методом ионной бомбардировки золотом на напылительной установке «Eiko IB-3» (Япония) в условиях вакуума (0,2 Torr) и ионном токе – 7 mA. Просмотр препаратов производили с помощью сканирующего электронного микроскопа «Hitachi S-500» при ускоряющем напряжении 25 kV на разных увеличениях.
Таблица 1
|
Имплантат |
Материал имплантата |
Время, проведенное в кости |
|
Рассасывающийся интерферентный винт Arthrex |
L-изомер полимолочной кислоты (PLLA) |
4 года |
|
Винт BioIntrafix (DePuy Mitek) |
L-изомер полимолочной кислоты + трикальцийфосфат |
1 год |
|
Гильза BioIntrafix (DePuy Mitek) |
L-изомер полимолочной кислоты + трикальцийфосфат |
1 год |
|
Рассасывающийся интерферентный винт |
L-изомер полимолочной кислоты |
2 года |
|
Рассасывающийся интерферентный винт Arthrex |
L-изомер полимолочной кислоты |
Новый контрольный винт |
Типы изученных имплантатов

Рис. 1 Винт PLLA при увеличении х100.

Рис. 4. Винт PLLA при увеличении х5000, различные участки.

Рис. 2. Винт PLLA при увеличении х5000, различные участки.

Рис. 5. Винт BioIntrafix через 1 год нахождения в живой кости (увеличение х1000).

Рис. 3. Винт PLLA при увеличении х5000, различные участки.
увеличивает площадь соприкосновения его с окружающими тканями.
Также следует отметить, что структура материала визуально близка к аморфной.
Следующим имплантатом, который удалось исследовать, был винт BioIntrafix, представляющий собой смесь полимолочной кислоты и трикальцийфосфата. По замыслу разработчиков данного материла, трикальцийфосфат должен стать остеокондуктивным субстратом данного винта, а полимолочная кислота – обеспечить достаточные прочностные свойства имплантата.
На рис. 5 можно разглядеть поверхность винта, которая представляет собой также не-

Рис. 6. Гильза BioIntrafix через 1 год после имплантации (увеличение х1000).

Рис. 9. Биодеградирующий винт Stryker через 2 года после имплантации (увеличение х5000).

Рис. 7. Гильза BioIntrafix через 1 год после имплантации (увеличение х5000).

Рис. 10. Биодеградирующий винт Stryker через 2 года после имплантации (увеличение х5000).

Рис. 8. Гильза BioIntrafix через 1 год после имплантации (увеличение х5000).

Рис. 11. Биодеградирующий винт Arthrex через 4 года после имплантации (увеличение х1000).

Рис. 12. Биодеградирующий винт Arthrex через 4 года после имплантации (увеличение х5000).
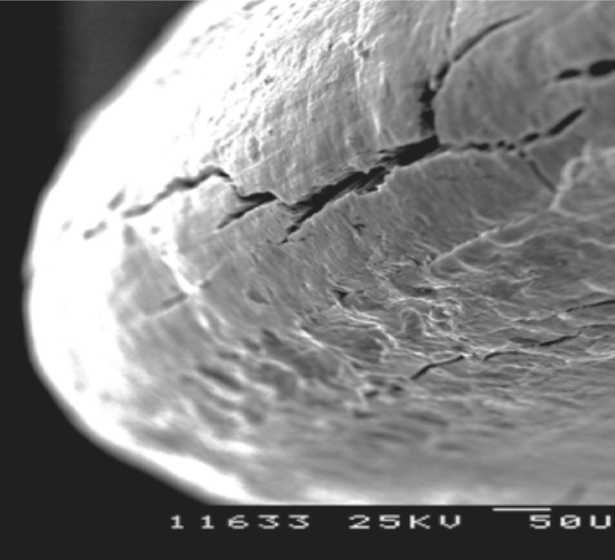
Рис. 14. Биодеградирующий винт Arthrex через 4 года после имплантации (увеличение х1000).
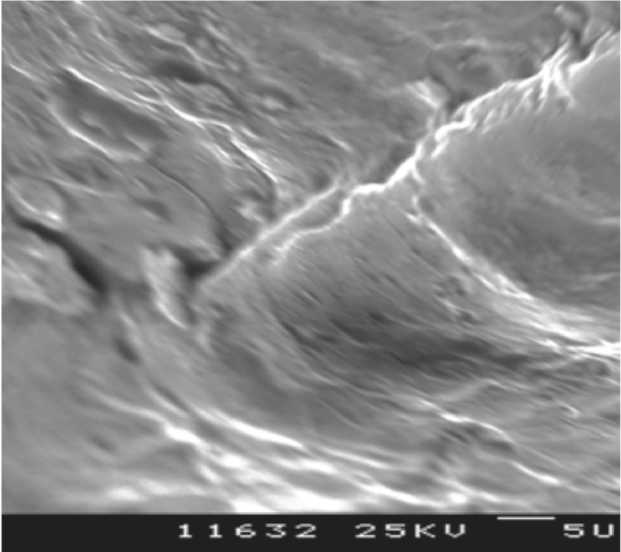
Рис. 13. Биодеградирующий винт Arthrex через 4 года после имплантации (увеличение х5000).

Рис. 15 Биодеградирующий винт Arthrex через 4 года после имплантации (макрофото)
ровную поверхность, но явных признаков разложения материала не отмечено.
Винт BioIntrafix используют вместе с гильзой (Tibial Sheath, TCP/PLA, DePuy Mitek), которую мы также исследовали. Данные имплантаты находились в кости в течение 1 года.
На рисунках 6 - 8 при различных увеличениях можно отметить неоднородность и неровность структуры, при этом, при большем увеличении определяются зоны вспучивания материала, что мы считаем признаками деградации материала.
Следует обратить внимание, что материал, из которого изготовлены данные им- плантаты, представляет собой слоистую структуру.
Нами был исследован интерферентный винт Stryker (рис. 9, 10), также выполненный из полимолочной кислоты. Данный винт существовал в костной ткани 2 года, прежде чем был исследован. При электронной микроскопии отчетливо видно, что поверхность винта сглажена, как будто оплавлена. Трещин и дефектов поверхности не отмечено.
Еще один исследованный имплантат – ин-терферентный винт Arthrex, выполненный из полимолочной кислоты и находившийся в костной ткани 4 года. На представ- ленных слайдах можно отметить выраженное различие материала имплантата с контрольным винтом: более сглаженная поверхность имплантата (рис. 11), трещины в материале (рис. 12-14). Данные изменения можно трактовать как признаки деградации материала имплантата, при этом макроскопически винт выглядит практически без изменений (рис. 15).
Таким образом, в результате нашего небольшого исследования можно сделать определенные выводы. Нам удалось исследовать имплантаты из полимолочной кислоты, которые находились в кости in vivo в течение одного, двух и четырех лет. Фиксаторы пре
Список литературы Ультраструктура биодеградируемых имплантатов: изменения во времени
- Иванов В.А., Чемирис А.И. Диагностика и лечение свежих повреждений сумочно-связочного аппарата коленного сустава//Комплексное лечение больных с повреждениями и заболеваниями костей, суставов и полостных органов. Алма-Ата, 1987. С.50-53.
- Никитин В.В. Клиника и хирургическая тактика при повреждениях капсульно-связочного аппарата коленного сустава. Автореф. дисс. … д-ра мед. наук. Уфа, 1985. 32 с.
- Королев А.В. Комплексное восстановительное лечение пациентов с повреждениями менисков и связок коленного сустава с использованием артроскопических методик: Дисс. … д-ра мед. наук. М., 2004. 364 с.
- Лазко Ф.Л., Абдулхабиров М.А., Калашников С.А. Применение рассасывающегося интерферентного винта при пластике передней крестообразной связке коленного сустава.//Сборник материалов Третьего Конгресса Российского Артроскопического Общества. Москва, 1999, с.36.
- Лазишвили Г.Д., Кузьменко В.В., Гиршин В.Э., Дубров В.Э., Гришин С.М., Новиков О.Е. Артроскопическая реконструкция передней крестообразной связки коленного сустава//Вестник травматологии и ортопедии им. Приорова Н.Н. 1997. № 1. С. 23-27.
- Лазишвили Г.Д., Гиршин С.Г., Дубров В.Э., Лишанский А.Д. Анализ ошибок и осложнений при артроскопической реконструкции передней крестообразной связки коленного сустава//Тезисы научно-практической конференции, посвященной 45-летию клиники спортивной и балетной травмы «Современные проблемы спортивной травматологии и ортопедии»/1997, С.109-110.
- Achtnich A, Forkel P, Metzlaff S, Zantop T, Petersen W. Degradation of poly-D-L-lactide (PDLLA) interference screws (Megafix®). Arch Orthop Trauma Surg. 2014 Aug;134(8):1147-53. Doi. 10.1007/s00402-014-2013-9. Epub 2014 Jun 5.
- Alejandro Espejo-Baena, Alejandro Espejo-Reina, Anatomic Outside-In Anterior Cruciate Ligament Reconstruction Using a Suspension Device for Femoral Fixation. Arthrosc Tech. 2014 Apr; 3(2): e265-e269.
- Andersson C., Gillquist J. Treatment of acute isolated and combined ruptures of the anterior cruciate ligament: A long term follow-up study.//Am. J. Sports Med. 1992. 20, p.7-12.
- Bach FD, Carlier RY, Elis JB, Mompoint DM, Feydy A, Judet O, Beaufils P, Vallée C. Anterior cruciate ligament reconstruction with bioabsorbable polyglycolic acid interference screws: MR imaging follow-up. Radiology. 2002 Nov;225(2):541-50.
- Barber F.A., Elrod B.F., McGuire D.A., Paulos L.E., Preliminary results of an absorbable interference screw. Arthroscopy. 1995 Oct;11(5):537-48.
- Bergsma E., Bruijn W., Rozema F., Bos R., Boering G. Late degradation tissue response to poly(L-lactide) bone plates and screws. Biomaterials 1995; 16: 25-31.
- Bigony L. Arthroscopic surgery: a historical perspective. Orthop Nurs. 2008;27(6):349-54. quiz 355-6.
- Böstman O, Partio E, Hirvensalo E, Rokkanen P. Foreign-body reactions to polyglycolide screws. Acta Orthop Scand 1992; 63: 173-6.
- Böstman O, Partio E, Vasenius J, Manninen M, Rokkanen P. Degradation and tissue replacement of an absorbable polyglycolide screw in the fixation of rabbit femoral osteotomies. J Bone Joint Surg 1992; 74A: 1021-1031.
- Böstman O., Pihlakamäki H. Late foreignbody reaction to an intraosseous bioabsorbable polylactide acid screw. J Bone Joint Surg Am 1998; 80: 1791-4.
- Bourke HE, Salmon LJ, Waller A, Winalski CS, Williams HA, Linklater JM, Vasanji A, Roe JP, Pinczewski LA. Randomized controlled trial of osteoconductive fixation screws for anterior cruciate ligament reconstruction: a comparison of the Calaxo and Milagro screws. Arthroscopy. 2013 Jan;29(1):74-82 DOI: 10.1016/j.arthro.2012.10.021
- Brown C.H., Hecker A.T., Hipp J.A., Myers E.R., Hayes W.C. The biomechanics of interference screw fixation of patellar tendon anterior cruciate ligament grafts. Am J Sports Med. 1993 Nov-Dec;21(6):880-6.
- Bruce D. Beynnon, Benjamin S. Uh, Robert J. Johnson, Joseph A. Abate, Claude E. Nichols, Braden C. Fleming, A. Robin Poole, Harald Roos. Rehabilitation After Anterior Cruciate Ligament Reconstruction A Prospective, Randomized, Double-Blind Comparison of Programs Administered Over 2 Different Time Intervals. The American Journal of Sports Medicine 2005; 33:3.
- Chang SK, Egami DK, Shaieb MD, Kan DM, Richardson AB. Anterior cruciate ligament reconstruction: allograft versus autograft. Arthroscopy. 2003 May-Jun;19(5):453-62. Review.
- Colombet P., Robinson J., Jambou S., Allard M., Bousquet V., De Lavigne C. Two-bundle, four-tunnel anterior cruciate ligament reconstruction. Knee Surg Sports Traumatol Arthrosc. 2005 Dec;9: 1-8.
- Christel P, Chabot IF, Leary JC, Morin C, Vert M. Biodegradable composites for internal fixation. Biomaterials p. 271, Ed. Winter GD, Gibbon DF, Plenk H, Wiley, New York, 1982.
- Cutright DE, Hunsuck EE, Beasly JD. Fracture reduction using biodegradable material, polylactic acid. J Oral Surg 1971; 29: 393-397.
- Daniels AU, Chang MK, Andriano KP. Mechanical Properties of Biodegradable Polymers and Composites Proposed for Internal Fixation of Bone. J Appl Biomater. 1990 Spring;1(1):57-78.
- Eling B, Gogolewski S, Pennings AJ. Biodegradable materials of poly(l-lactic acid): 1. Meltspun and solution spun fibers. Polymer, 1982; 23: 1587-93.
- Ferretti A, Conteduca F, Morelli F, Masi V. Regeneration of the semitendinosus tendon after its use in anterior cruciate ligament reconstruction: a histologic study of three cases. Am J Sports Med. 2002 Mar-Apr;30(2):204-7.
- Franco MG, Bach BR Jr, Bush-Joseph CA. Intraarticular placement of Kurosaka interference screws. Arthroscopy. 1994 Aug;10(4):412-7.
- Hoffmann R, Krettek C, Haas N, Tscheme H. Die distale Radiusfraktur. Frakturstab erung mit biodegradablen Osteosynthese-Stiften. Experimentelle Untersuchungen und erste klinische Erfahrungen. Unfallchirurg 1989; 92 (9): 430-4.
- Hollinger JO, Battistone GC. Biodegradable bone repair materials. Synthetic polymers and ceramics. Clin Orthop Relat Res. 1986 Jun;(207):290-305.
- Johnson L. Comparison of bioabsorbable and metal interference screw in anterior cruciate ligament reconstruction -a clinical trail. Proc AAOSM 1995, Orlando, FL.
- Jukkala-Partio K, Laitinen O, Vasenius J, Partio EK, Toivonen T, Tervahartiala P, Kinnunen J, Rokkanen P. Healing of subcapital femoral osteotomies fixed with self-reinforced poly-L-lactide screws. An experimental long-term study in sheep. Arch Orthop Trauma Surg 2002; 122: 360-364.
- Kilpikari J, Törmälä P. Biodegradable polymers for orthopaedic surgery. Trans. 9th Ann. Meeting Soc Biomater. VI, p.83, Birmingham, USA, 1983.
- Kulkarni RK, Moore EG, Hegyeli AF, Leonard F. Biodegradable poly (l-lactic acid) polymers. J Biomed Mater Res. 1971 May;5(3):169-81.
- Nordström P, Pihlajamäki H, Toivonen T, Törmälä P, Rokkanen P. Tissue response to poly-glycolide and polylevolactide pins in osteotomized cancellous bone. Clin Orthop 2001; 382: 247-257.
- Pertti T. Bioabsorbable implants in knee surgery. Academic dissertation. Helsinki, 2004.p.60.
- Rhee PC, Dahm DL, Stuart MJ, Thoreson A, An KN, Levy BA Delta screw versus RetroScrew tibial fixation for ACL reconstruction. Knee Surg Sports Traumatol Arthrosc. 2011 Dec; 19 Suppl 1():S94-100.
- Rokkanen P, Böstman O, Vainionpää S, Vihtonen K, Törmälä P, Laiho J, Kilpikari J, Tamminmäki Biodegradable implants in fracture fixation: early results of treatment of fractures of the ankle. Lancet. 1985 Jun 22;1(8443):1422-4.
- Rokkanen P, Böstman O, Vainionpää S, Mäkelä EA, Hirvensalo E, Partio EK, Vihtonen K, Pätiälä H, Törmälä P. Absorbable devices in the fixation of fractures. J Trauma 1996; 40: 123-127.
- Santavirta S, Konttinen YT, Saito T, Grönblad M, Partio E, Kemppinen P, Rokkanen P. Immune response to polyglycolic acid implants. J Bone Joint Surg 1990; 72B: 597-600.
- Schmitt E.E., R.A. Polistina. 1967. U.S. Patent 3,297,033.
- Stener S, Ejerhed L, Sernert N, Laxdal G, Rostgеrd-Christensen L, Kartus J. A long-term, prospective, randomized study comparing biodegradable and metal interference screws in anterior cruciate ligament reconstruction surgery: radiographic results and clinical outcome. Am J Sports Med. 2010 Aug; 38(8):1598-605.
- Törmälä P, Pohjonen T, Rokkanen P. Bioabsorbable polymers: materials technology and surgical applications. Proc Instn Mech Engrs, 1998; 212: 101-111.
- Törmälä P, Vainionpää S, Kilpikari J, Rokkanen P. The effects of fiber reinforcement and gold plating on the flexural and tensile strength of PGA/PLA copolymer materials in vitro. Biomaterials, 1987; 8:42.
- Vainionpää S, Kilpikari J, Laiho J, Helevirta P, Rokkanen P, Törmälä P. Strength and strength retention in vitro, of absorbable, self-reinforced polyglycolide (PGA) rods for fracture fixation. Biomaterials, 1987; 8:46.
- Vert M., Christel P., Chabot F., Leray J. Bioresorbable plastic materials for bone surgery. In: Hastings GW, Ducheyne P, eds. Macromolecular biomaterials. Boca Raton, FL: CRC, 1984; 120-142.


