Ультраструктурные аспекты биологии злокачественного роста саркомы С-45
Автор: Двадненко К.В., Гусев С.А., Федоренко Г.М., Матишов Д.Г.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 1 (43), 2011 года.
Бесплатный доступ
Проведено комплексное морфологическое исследование солидной опухоли саркомы С-45, трансплантированной под кожу спины беспородным крысам-самцам. На основании данных электронно-микроскопического исследования выделены два типа клеток саркомы С-45, отличающихся разной степени дифференцированности. Получены данные о кинетике роста опухоли, пролиферативной активности и ультраструктурной организации образующих её клеточных элементов. Исследова- ны особенности формирования микроциркуляторного русла опухоли. Выявлены морфологические особенности строения капилляров в центральных и периферических участках саркомы 45 крыс.
Саркома с-45, электронная микроскопия, ультраструктура опухолевой клетки
Короткий адрес: https://sciup.org/14055876
IDR: 14055876 | УДК: 616-006.3.04+576.385.5]-092.9
Текст научной статьи Ультраструктурные аспекты биологии злокачественного роста саркомы С-45
Эксперименты по моделированию опухолей in vivo с последующим гистологическим анализом операционного материала позволяют получить новые данные о многих морфологических характеристиках опухолевых клеток, а также о состоянии их микроокружения [1]. Оценка степени атипии, способности к инвазии и метастазированию, пролиферативной активности клеточных элементов, особенностей кровоснабжения опухоли имеют важнейшее значение для понимания процессов роста и формирования злокачественных новообразований.
Целью исследования было проведение сравнительного морфологического анализа тканевой и субклеточной организации саркомы С-45 на различных стадиях её развития. Данная опухоль используется для проведения многих экспериментально-морфологических, биохимических и иммунологических исследований [4].
Материал и методы
Объектом исследования были беспородные крысы-самцы (n=20) весом 160–180 г, выращенные в ФГУ «РНИОН Росмедтехнологий». Животные содержались в стандартных условиях вивария при фиксированном световом режиме. Работу с животными проводили в соответствии с правилами «Европейской конвенции о защите животных, используемых в экспериментах» (Директива 86/609/ЕЕС). Штамм саркомы С-45 получен в лаборатории комбинированной терапии опухолей Института экспериментальной диагностики и терапии РОНЦ им. Н.Н. Блохина РАМН. Суспензию клеток саркомы С-45 вводили крысам в подкожную жировую клетчатку области спины в индивидуальной дозе 0,5 мл (1×106 клеток).
Измерение линейных размеров опухоли проводили в трёх взаимно перпендикулярных плоскостях, после чего определяли её объём по формуле
V = (а×в×с)×π/6, где а, в, с – линейные размеры опухоли в см, V – объём опухоли.
Опухоли удаляли под эфирным наркозом через 8, 16, 23, 30 сут после трансплантации клеток С-45. Материал для светооптического исследования фиксировали в 10 % растворе нейтрального формалина. Серийные парафиновые срезы окрашивали гематоксилином-эозином и пикрофуксином по ван Гизону. Съёмку гистологических препаратов проводили на микроскопе Leica DM 4000 B с камерой Leica DFC 490 при помощи программного обеспечения Image Scope.
Материал для электронно-микроскопического исследования последовательно фиксировали в 2,5 % растворе глутаральдегида, 1 % OsO4 и после всех общепринятых этапов обработки заливали в Эпон-812. Ультратонкие срезы получали на ультрамикротоме Leica EM UC6, контрастировали цитратом свинца и просматривали в электронном микроскопе FEI Tecnai 12 Spirit при ускоряющем напряжении 80 кV.
Пролиферативную активность клеток саркомы С-45 оценивали путём подсчёта митотического индекса (МИ) – отношения числа фигур митотического деления на 1000 ядер (в %) не менее чем в 10 срезах.
Полученные данные обрабатывали статистическими методами с использованием пакета компьютерных программ «Microsoft Excel».
Результаты и обсуждение
Согласно результатам проведённых измерений, наиболее интенсивный рост опухоли происходил с 16-х по 30-е сут после трансплантации штамма С-45. К 16-м сут объём опухоли в абсолютных величинах достигал 0,56–0,75 см3, а на третьей неделе диапазон её роста колебался в пределах от 1,07 см3 до 36,5 см3 (рис. 1А). Средняя продолжительность жизни крыс после инокуляции штамма С-45 составляла 40 сут. В первые две недели после трансплантации опухоли в ткани растущей саркомы отмечена достаточно высокая митотическая активность её клеточных элементов (рис. 1Б).
Анализ световых и электронно-оптических снимков показал, что в ткани опухоли преобладает клеточный компонент. Полиморфные клетки имеют атипичные ядра и различный уровень дифференцированности. Между морфологически чётко различимыми округлыми (1-й тип) и веретеновидными (2-й тип) формами (рис. 1) существуют и промежуточные варианты. Ядра клеток 1-го типа содержат крупноглыбчатый, маргинированный хроматин, в ядрышках преобладает фибриллярный компонент. Немногочисленные органеллы представлены короткими, расширенными цистернами гранулярной эндоплазматической сети (грЭПС), отдельными митохондриями и свободными рибосомами (рис. 2А).
Клетки 2-го типа более дифференцированы, имеют ядра вытянутой формы с преобладанием диспергированного хроматина и 1–2 крупными
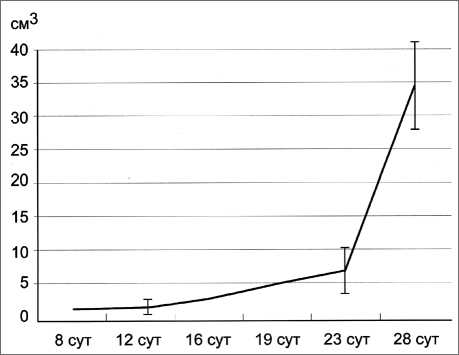
Рис. 1А. Динамика роста саркомы С-45
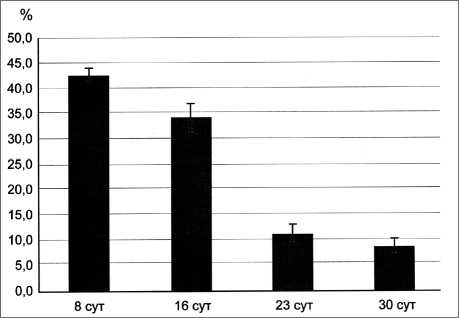
Рис. 1Б. Уровень пролиферативной активности клеток саркомы С-45 в течение эксперимента ядрышками в нуклеоплазме. В электронноплотном цитоплазматическом матриксе содержатся многочисленные свободные рибосомы, хорошо развитые элементы грЭПС, митохондрии, лизосомы, диктиосомы пластинчатого комплекса. Цистерны грЭПС часто дилатированы и заполнены мелкозернистым материалом. Пластинчатый комплекс состоит из 4–6 плотно упакованных цистерн, располагающихся в околоядерной зоне
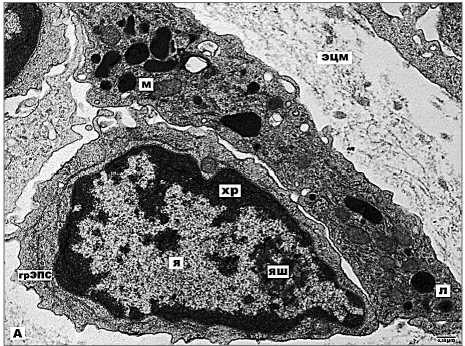
Рис. 2А. Электронная микрофотография. Низкодифференцированная клетка опухоли 1-го типа с высоким ядерно-цитоплазматическим отношением. Примечание: я – ядро, хр – хроматин, яш –ядрышко, л – лизосома, грЭПС – гранулярная эндоплазматическая сеть, м – митохондрия, эцм –экстрацел-люлярный матрикс. х9900
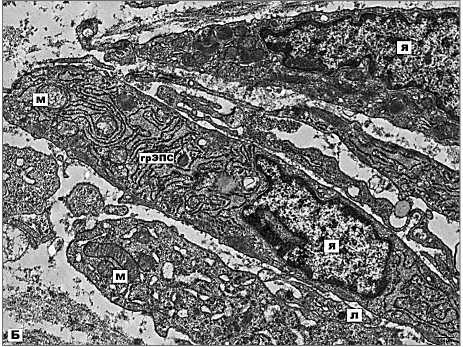
Рис. 2Б. Электронная микрофотография. Дифференцированная опухолевая клетка 2-го типа с хорошо развитыми органеллами биосинтеза в цитоплазме. Примечание: я – ядро, хр – хроматин, яш – ядрышко, л – лизосома, грЭПС –гранулярная эндоплазматическая сеть, м – митохондрия, эцм –экстрацеллюлярный матрикс. х8200
(рис. 2Б). Митохондрии полиморфны и иногда имеют признаки отёка. В мелкозернистом матриксе митохондрий хорошо различимы трубчатые, ламеллярные или везикулярные кристы, а также округлые электронно-плотные гранулы. Опухолевые клетки 2-го типа богаты включениями энергетических субстратов в виде розеток гликогена и липидных капель. Также в цитоплазме клеток хорошо развит аппарат внутриклеточного переваривания, представленный крупными вторичными лизосомами и остаточными тельцами. Часто встречаются вакуоли, осмиофильные гранулы и слоистые тельца. Клетки опухоли связаны между собой при помощи редких и примитивных десмосом, представляющих собой электронноплотные пластинки плазмолеммы соседних клеток.
Среди фигур митоза преобладают профазы и метафазы, реже встречаются ана- и телофазы. Нарушения митотического деления, такие как фрагментация хромосом, отставание хромосом в метакинезе и К-митоз, зарегистрированы во все сроки наблюдений. С 8-х по 30-е сут эксперимента в опухоли наблюдалось постепенное снижение показателей МИ. С 16-х сут развития в ткани опухоли обнаруживаются многочисленные миофибробласты, содержащие в цитоплазме толстые пучки актиновых филаментов, ориентированных параллельно длинной оси клетки.
Уже на 2-й нед после образования опухоли в ней появляются поля некроза и полости, заполненные опалесцирующей желтоватобурой жидкостью. На микроскопическом уровне наблюдаются проявления пикноза, кариорексиса, лизиса и вакуолизации клеток. Однако лейкоцитарно-лимфоцитарная инфильтрация в некротических очагах выражена незначительно.
При изучении микроциркуляторного русла опухоли нами обнаружено два типа капилляров, имеющих разную локализацию и характерные морфологические признаки. Капилляры, расположенные в глубине опухоли, практически лишены базальной мембраны и имеют неравномерный просвет. В обильной электронносветлой цитоплазме эндотелиоцитов содержатся рибосомы, овальные митохондрии с плотно упакованными кристами, отдельные цистерны грЭПС, крупные капли липидов (рис. 3А).
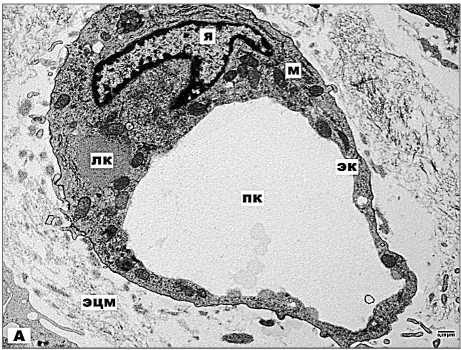
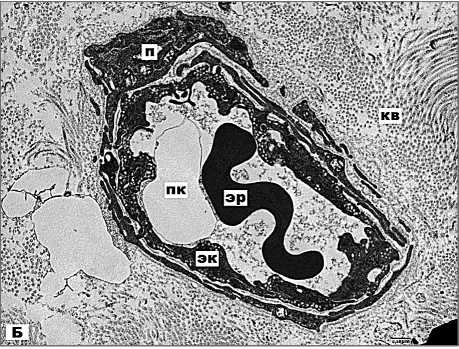
Рис. 3Б. Электронная микрофотография. Ультраструктура капилляров в субкапсулярных зонах опухоли. Примечание: эцм – экстрацеллюлярный матрикс, эк – эндотелиальная клетка, пк-просвет капилляра, я – ядро, лк – липидные капли, м – митохондрия, п – перициты, эр – эритроцит, кв – коллагеновые волокна. х6000
Рис. 3А. Электронная микрофотография. Ультраструктура капилляров в центральных зонах опухоли. Примечание: эцм – экстрацеллюлярный матрикс, эк – эндотелиальная клетка, пк-просвет капилляра, я – ядро, лк – липидные капли, м – митохондрия, п – перициты, эр – эритроцит, кв – коллагеновые волокна. х20500
Отсутствие перицитов указывает на незрелость системы микроциркуляции [3]. Капилляры, имеющие субкапсулярную локализацию, как правило, окружены одним-двумя слоями перицитов. Эндотелиоциты имеют электронноплотную цитоплазму, бедную органеллами (рис. 3Б).
Заключение
Проведённый светооптический и электронномикроскопический анализ позволяет отнести саркому С-45 к дифференцированным опухолям мезенхимального происхождения. Данная опухоль характеризуется экспансивным ростом, полиморфизмом клеточного состава и умеренной васкуляризацией. Можно предполагать о наличии в ткани саркомы С-45 системы открытого кровообращения, поскольку эндотелио-циты часто не образуют замкнутых трубок, а форменные элементы присутствуют не только в просвете сосудов, но и среди опухолевых клеток. По мере развития опухоли проявляется тенденция к её неравномерному росту [2]. Наиболее выраженные индивидуальные отклонения объёма опухоли наблюдаются у животных с 16-х по 30-е сут после трансплантации штамма С-45. Одним из наблюдавшихся нарушений нормальных морфогенетических реакций стало появление опухолевых клеток с ярко выраженным локомоторным фенотипом. Поскольку у 4 из 20 животных наблюдалось резкое замедление роста опухоли, данный факт необходимо учитывать при формировании групп животных в ходе выполнения экспериментальных работ.


