Ультраструктурные аспекты постинфарктного ремоделирования левого желудочка
Автор: Казаков В.А., Суходоло И.В., Шипулин В.М., Миллер А.А.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 4-1 т.24, 2009 года.
Бесплатный доступ
Детально изучено морфофункциональное состояние и особенности ультраструктурной организации кардиомиоцитов миокарда ушка правого предсердия и левого желудочка 40 больных ишемической кардиомиопатией с хронической сердечной недостаточностью. Впервые сопоставлены результаты электронно-микроскопических методов исследования миокарда больных людей с клиническими результатами их оперативного лечения. Получены новые данные о механизмах патогенеза повторного ремоделирования левого желудочка на ультраструктурном уровне. Показано, что наличие признаков пластической недостаточности кардиомиоцитов как левого желудочка, так и ушка правого предсердия играет ключевую роль в прогрессировании сердечной недостаточности в отдаленном послеоперационном периоде.
Постинфарктное ремоделирование левого желудочка, пластическая недостаточность кардиомиоцитов
Короткий адрес: https://sciup.org/14919145
IDR: 14919145 | УДК: 616.124.2-005.8-091.8
Текст научной статьи Ультраструктурные аспекты постинфарктного ремоделирования левого желудочка
Ишемическая болезнь сердца, финалом которой становится ишемическая кардиомиопатия (ИКМП) и хроническая сердечная недостаточность, до сих пор остается одной из самых распространенных, прогрессирующих и прогностически неблагоприятных заболеваний сердечно-сосудистой системы. По данным Kalon et al., 5-летняя выживаемость, ассоциируемая с застойной сердечной недостаточностью, сравнима с таковой при некоторых наиболее злокачественных формах рака и составляет 65% для мужчин и 45% для женщин [1]. Различные варианты реконструкции левого желудочка (ЛЖ) в сочетании с аортокоронарным шунтированием занимают ведущее место в комплексном лечении больных с обширным постинфарктным кардиосклерозом. Однако отдаленные результаты хирургического лечения показы-6
вают, что в послеоперационном периоде у 12-25% пациентов происходит повторное ремоделирование ЛЖ и прогрессирование сердечной недостаточности [2, 3]. Одним из путей улучшения клинических результатов лечения аневризм ЛЖ является доопера-ционное выявление «предрасположенности» сердца к дилатации в отдаленном послеоперационном периоде, поскольку неблагоприятные отдаленные результаты хирургического лечения являются следствием необратимых ишемических повреждений сердечной мышечной ткани. Целью нашей работы явилось изучение особенностей ультраструктуры кардиомиоцитов у больных с обширным постинфарктным кардиосклерозом.
МАТЕРИАЛ И МЕТОДЫ
Объектом исследования стали 40 больных ИКМП, которым в условиях искусственного кровообращения были выполнены аортокоронарное шунтирование и хирургическая реконструкция ЛЖ в модификации V. Dor. Клиническими критериями отбора пациентов, включенных в настоящую работу, были следующие параметры: конечно-диастолический индекс (КДИ) ЛЖ>100 мл/м2 поверхности тела, конечно-систолический индекс (КСИ) ЛЖ> 80мл/м2 поверхности тела, конечно-диастолическое давление ЛЖ>30 мм рт. ст., фракция выброса (ФВ) ЛЖ<40%, наличие участков а- и дискинеза левого желудочка, стенокардия II-IV функциональных классов по классификации Канадского общества кардиологов (CCS), недостаточность кровообращения (НК) II-IV функциональных классов по NYHA (Нью-Йоркская ассоциация сердца), длительность течения ишемической болезни сердца от 1 года до 10 лет, поражение коронарных артерий – стеноз более 75% передней нисходящей артерии или ствола, или стеноз, превышающий 75% не менее чем в двух коронарных артериях. Отсутствие органического поражения клапанов сердца также входило в клинические критерии отбора пациентов. Среднее количество пораженных коронарных артерий составило 3,5±1. Через 12 месяцев после хирургического лечения всем 40 больным (100%) повторно проводился весь комплекс тех же диагностических мероприятий, что и на доопера-ционном этапе.
У всех пациентов во время оперативного лечения брали биопсии ушка правого предсердия (ПП) и ЛЖ (n=40). Образцы миокарда не более 2 мм3 фиксировали в 2,5%-ном растворе глутарового альдегида на 0,2М какодилатном буфере с pH=7,2 при температуре +4 ° С и постфиксировали в 1%-ном растворе OsO4 на холоде в течение 4 часов [4]. В дальнейшем дегидратировали биоптаты в этаноле восходящей концентрации, заливали в смесь эпона и аралдита. Полутон-кие и ультратонкие срезы готовили на ультратоме LKB III (Швеция). Полутонкие срезы окрашивали 1%-ным раствором азура II и просматривали в световом микроскопе. Ультратонкие срезы контрастирова- ли цитратом свинца и уранилацетатом и изучали их в электронном микроскопе JEM-100 CX (Япония). Во время электронной микроскопии производили подсчет числа открытых и закрытых капилляров, на электронных микрофотографиях производили измерение удельного объема миофибрилл, митохондрий, ядер и гранул предсердных кардиомиоцитов методом точечного счета, оценивали отношение удельного объема митохондрий к удельному объему миофибрилл (митохондриально-миофибриллярное отношение), ядерно-цитоплазматическое отношение [5]. За единичный объем принимали 1 мкм3 ткани для исследования на ультраструктурном уровне. Достоверность полученных данных проверяли с помощью непараметрического критерия Ван-дер-Вардена [6].
Разницу значений в сравниваемых группах считали достоверной при p<0,05.
РЕЗУЛЬТАТЫ
При электронно-микроскопическом исследовании кардиомиоцитов миокарда ЛЖ и ушка ПП обращал на себя внимание полиморфизм ультраструктур миокардиальных клеток. Ядра чаще всего имели неправильную фестончатую форму с множеством инвагинатов и выростов ядерной мембраны, располагались в центре миокардиальных клеток, иногда смещались в подсарколеммальную зону. Нередко встречали агрегацию (компактизацию) хроматина. Отмечали расширение околоядерного пространства, при этом последнее не заполнялось митохондриями,

Рис. 1. Ультраструктура кардиомиоцитов ЛЖ больных ишемической кардиомиопатией: а – контрактурный тип повреждения миофибрилл; б – первичный глыбчатый распад миофибрилл; в – очаг внутриклеточной регенерации: скопления свободных рибосом и полирибосом на культях уцелевших миофибрилл; г – нарушение ориентации новообразованных миофибрилл, избыточный рост их в длину
гранулярным ретикулумом и элементами комплекса Гольджи, а представлено в значительном объеме разреженным цитоплазматическим матриксом, содержащим гликоген в β -форме и имеющим округлую или продолговатую форму (моногранулярный гликоген). Находили диспергированные ядрышки, сегрегацию фибриллярного и гранулярного компонентов нуклеолонеммы, кольцевидные ядрышки, что свидетельствовало об угнетении биосинтеза рРНК.
Обращало на себя внимание многообразие форм повреждений миофибрилл кардиомиоцитов миокарда ЛЖ и ушка ПП предсердия у больных ишемической кардиомиопатией. Наблюдали контрактурные повреждения миофибрилл I степени, реже – II и III степеней (рис. 1а). В большинстве кардиомиоцитов наблюдали мелкоочаговый и диффузный лизис миофибриллярных пучков, «таяние» миофибрилл. В большей степени были лизированы I-полосы, в которых располагаются тонкие (актиновые) филаменты. Значительной деструкции подвергались саркомеры в области вставочных дисков и в около-ядерной зоне. Нередко обнаруживали распад миофибрилл в результате очагового мозаичного лизиса и контрактуры отдельных групп саркомеров (рис. 1б). Такой тип повреждений описан как первичный глыбчатый распад миофибрилл, являющийся самым тяжелым из известных типов повреждений сократительного аппарата миокардиальных клеток [7].
Крайне редко в кардиомиоцитах миокарда ЛЖ и ушка ПП обнаруживали очаги внутриклеточной регенерации ультраструктур миокардиальных клеток. О процессах внутриклеточной регенерации судили по наличию скоплений свободных рибосом на культях уцелевших миофибрилл, обусловливающих синтез и сборку новообразованных контрактильных белков (рис. 1в). Следует отметить нарушение равновесия между альтеративными и репаративными процессами, протекающими в кардиомиоцитах: последние явно выражены слабее, что обусловлено, по всей видимости, пластической недостаточностью миокардиальных клеток. Новообразованные миофиламенты по мере их синтеза на полирибосомах и созревания собираются в пучки миофибрилл. Но в процессе новообразования происходит нарушение их нормальной ориентации и избыточный рост в длину, проявляющийся увеличением расстояния между соседними Z-полосами (рис. 1г).
Помимо нарушения нормальной ориентации новообразованных миофибрилл, наблюдали хаотичную ориентацию «зрелых» сократительных белков (рис. 2а). Кроме того, отмечали волнообразную деформацию сократительного аппарата кардиомиоцитов миокарда левого желудочка и ушка правого предсердия. Все эти обстоятельства, вне всяких сомнений, вносят свой вклад в десинхронизацию процессов сокращения, обусловливая тем самым систолическую дисфункцию миокарда [7].
Отмечали полиморфизм митохондрий кардиомиоцитов. Встречали митохондрии с деструктивными и дегенеративными изменениями, просветленным матриксом, разрушенными и редуцированными кристами. Отмечали нестабильность митохондриальных мембран с образованием сплошных конгломератов митохондрий, расположенных между компонентами сократительного аппарата. Наблюдали немногочисленные митохондрии с электронноплотным матриксом в состоянии вакуолизации.
Цистерны и вакуоли саркоплазматической сети и комплекса Гольджи в кардиомиоцитах ЛЖ и ушка ПП больных ИКМП редуцированы, иногда расширены. Расширение цистерн находили преимущественно в околоядерной области, реже – в пространствах между миофибриллами (в области Z-линий) и митохондриями.
Нарушение пластических процессов в кардиомиоцитах проявляется атрофическими и дистрофическими изменениями в клетках. Так, в цитоплазме некоторых сердечных миоцитов левого желудочка и ушка правого предсердия обнаруживали аутофагосомы, содержимое которых представлено в основном митохондриями и цитоплазматическим матриксом. Наличие аутофагосом свидетельствует о деградации внутриклеточных органелл. В перинуклеарной области кардиомиоцитов как ЛЖ, так и ушка ПП отмечали скопления гранул пигмента старения – липофусцина и появление избыточного количества липидных включений. Предсердные кардиомиоциты содержали различные по величине электронноплотные гранулы предсердного натрийуретического пептида.
Таблица 1
Эхокардиографические показатели и функциональный класс недостаточности кровообращения в контрольные сроки наблюдения
|
Показатели |
Предоперационные показатели (n=40) |
1 год после операции |
|
|
I группа (n=30) |
II группа (n=10) |
||
|
КДИ ЛЖ, мл/м2 |
131,3±7,8 |
112,8±5,4* |
147,0±10,2* |
|
КСИ ЛЖ, мл/м2 |
79,1±9,1 |
61,4±11,1* |
87,1±7,1* |
|
ФВ ЛЖ, % |
39,4±4,2 |
41,9±2,3* |
38,1±1,7* |
|
Класс СН по NYHA |
2,4±0,6 |
2,3±0,3* |
3,3±0,4* |
Примечание. * – p<0,05 – статистически значимая разница между группами. 8
При электронномикроскопическом исследовании микроциркуляторного звена сосудистого русла миокарда левого желудочка и ушка правого предсердия отмечали выбухание ядер эндотелиоцитов в просвет капилляров (рис. 2б), складчатость люминальной поверхности эндотелиальных клеток (рис. 2в), редукцию просвета сосудов, утолщение базальной мембраны и признаки снижения пропускной способности капилляров, массивный перикапиллярный фиброз. Повсеместно наблюдали массивные перикапиллярные отеки (рис. 2г). С одинаковой частотой встречали функционирующие и запустевающие капилляры (нефункционирующие).
Отдаленные результаты хирургического лечения позволили разделить всех больных на 2 группы: в
I группу вошли 30 пациентов, у которых через год после оперативного вмешательства КДИ ЛЖ сохранялся на послеоперационном уровне. II группу сформировали 10 больных с повторным ремоделированием левого желудочка, КДИ которых через год был аналогичным или превысил дооперацион-ные показатели (табл. 1). Через год после оперативного лечения в I группе больных фракция выброса (ФВ) левого желудочка была достоверно выше, а значения КДИ и конечно-систолического индекса (КСИ) левого желудочка достоверно ниже, чем исходные показатели. Напротив, во II группе больных отмечено статистически значимое снижение ФВ левого желудочка за счет увеличения КДИ и КСИ по сравнению с дооперационными значениями
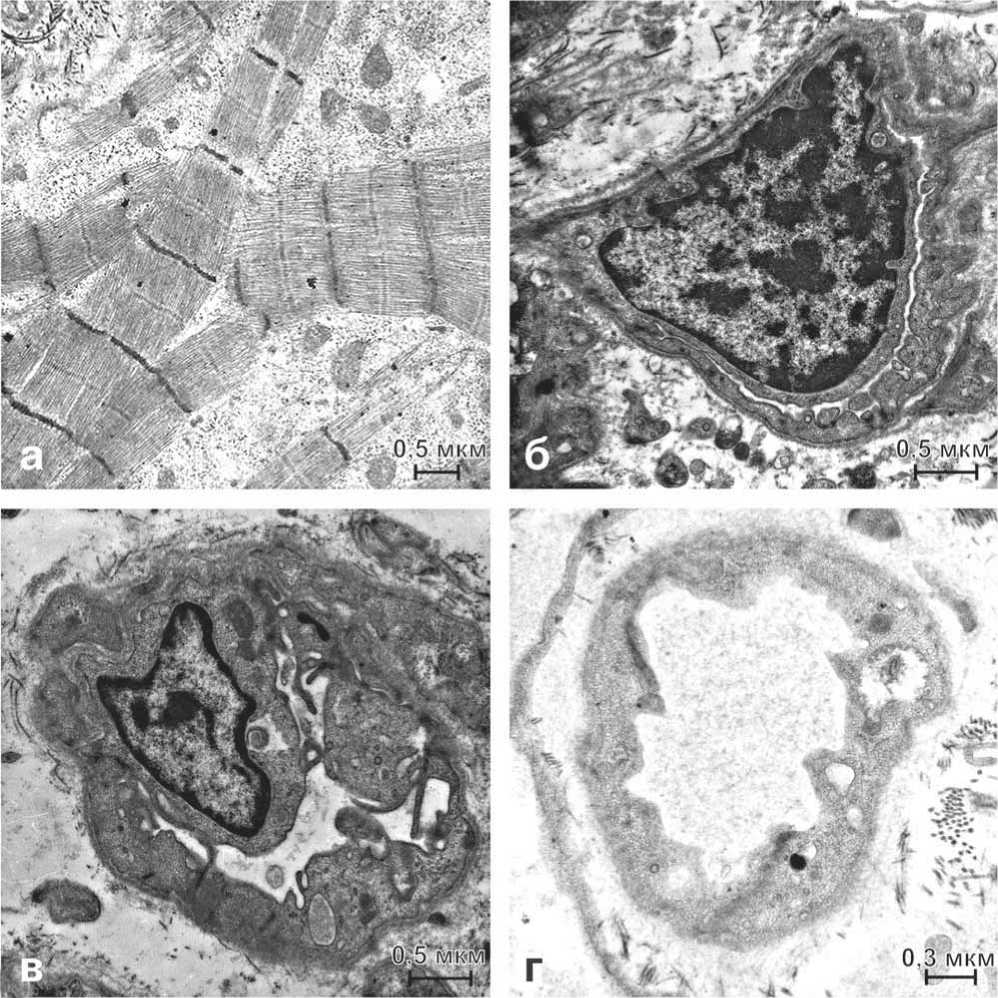
Рис. 2. Ультраструктура кардиомиоцитов ЛЖ больных ишемической кардиомиопатией: а – нарушение ориентации пучков миофибрилл; б – нефункционирующий капилляр, выбухание эндотелиоцита в просвет капилляра; в – утолщение базальной мембраны, складчатость люминальной поверхности эндотелиальных клеток; г – массивный перикапиллярный отек
Таблица 2
Морфометрические показатели ультраструктур кардиомиоцитов миокарда левого желудочка (ЛЖ) и ушка правого предсердия (ПП) у больных ишемической кардиомиопатией с разными результатами хирургического лечения, критерий Ван-дер-Вардена (М±т)
|
Показатели |
I группа (n=30) |
II группа (n=10) |
||
|
ПП |
ЛЖ |
ПП |
ЛЖ |
|
|
Удельный объем миофибрилл, мкм3/мкм3 |
0,416±0,021* |
0,503±0,032** |
0,336±0,025* |
0,419±0,043** |
|
Удельный объем митохондрий, мкм3/мкм3 |
0,175±0,023* |
0,208±0,027** |
0,243±0,021* |
0,247±0,022** |
|
Митохондриально-миофибриллярное отношение |
0,428±0,071* |
0,414±0,057** |
0,723±0,074* |
0,590±0,087** |
|
Удельный объем ядер кардиомиоцитов, мкм3/мкм3 |
0,041±0,004 |
0,041±0,007 |
0,042±0,006 |
0,040±0,006 |
|
Удельный объем гранул предсердного натрийуретического пептида, мкм3/мкм3 |
0,0032±0,0004* |
– |
0,0024±0,0007* |
– |
Примечание. *, ** – p<0,05 – статистически значимые различия между группами.
(табл. 1). В I группе больных значения ФК недостаточности кровообращения через год были ниже, а во II группе – статистически значимо выше исходных дооперационных значений (табл. 1).
Ретроспективный анализ исходной клинической характеристики пациентов, включенных в настоящее исследование, показал, что в I группе больший процент больных перенес 1 инфаркт миокарда в анамнезе, в то время как во II группе преобладали больные с множественными инфарктами миокарда. В обеих группах больных преобладал III ФК по NYHA, нарушение углеводного обмена чаще отмечали в I группе больных.
Статистический анализ морфометрических данных ультраструктур у пациентов с неблагоприятным отдаленным результатом хирургического лечения показал, что удельный объем миофибрилл кардиомиоцитов достоверно ниже, а удельный объем митохондрий кардиомиоцитов как миокарда ЛЖ, так и ушка ПП выше по сравнению с пациентами I группы. Указанные изменения отражаются в повышении митохондриально-миофибриллярного отношения. Удельный объем гранул предсердного натрийуретического пептида кардиомиоцитов ушка ПП по мере прогрессирования сердечной недостаточности статистически значимо уменьшается, что, видимо, отражает депрессию всех синтетических процессов в клетке. Удельный объем ядер кардиомиоцитов при этом существенно не изменяется (табл. 2).
ОБСУЖДЕНИЕ
Таким образом, морфофункциональное состояние миокарда ЛЖ и ушка ПП у больных ИКМП соответствует тяжести клинической картины данной нозологической формы. Причем морфофункциональное состояние миокарда ушка ПП полностью отражает морфофункциональное состояние миокарда ЛЖ, то есть является своеобразным «зеркалом» 10
последнего. Выраженность и сочетание основных форм повреждений кардиомиоцитов варьируют у разных больных, что вполне объяснимо, поскольку поражение коронарных артерий становится причиной ишемии миокарда, влияние которой на сократительную функцию сердечной мышцы неодинаково у разных пациентов и зависит от варианта поражения коронарных артерий (тяжесть и длительность ишемии), реперфузии (время и полнота восстановления кровотока), а также от особенностей морфологии сердечной мышцы каждого конкретного пациента.
Дефицит АТФ в клетке, депрессия энергозависимых процессов активного транспорта, нарушение гомеостаза тканевой жидкости вызывают накопление ионов кальция в саркоплазме и становятся ключевыми пусковыми факторами развития стойкого патологического сокращения миофибрилл – их контрактурных повреждений и первичного глыбчатого распада. Постоянно протекающие процессы альтерации приводят к очаговому выключению из функциональной деятельности части кардиомиоцитов. Функция органа в таком случае лимитируется количеством живых клеток. В условиях хронической гипоперфузии сердечной мышечной ткани альтеративная (сократительная) недостаточность миокарда дополняется регенераторно-пластической недостаточностью, что сводит на «нет» единственно возможный путь внутриклеточной регенерации кардиомиоцитов.
Список литературы Ультраструктурные аспекты постинфарктного ремоделирования левого желудочка
- Kalon K.Ho.L., Pinsky J.L., Karmd W.B., Levy D. The epidemiology of heart failure: the Framingham Study//Journal of American College of Cardiology. -1993. -Vol. 22, Suppl. A. -P. 6A-13A.
- Dor V. Left ventricular aneurysms: the endoventricular circular patch plasty//Semin Thorac Cardiovasc Surg. -1997. -Vol. 9. -P. 123-130.
- Menicanti L., Di Donato M. The Dor procedure: What has changed after fifteen years of clinical practice?//J. Thorac. Cardiovasc. Surg. -2002. -Vol. 124. -P. 886-890.
- Карупу В.Я. Электронная микроскопия. -К.: Вища школа. Головное издво, 1984. -208 с.
- Автандилов Г.Г. Медицинская морфометрия. -М.: Медицина, 1990. -384 с.
- Корюкин В.И., Корюкина Е.В. Основы теории обработки эксперимента: учебное пособие для студентов СГМУ. -Томск: СГМУ, 2000. -150 с.
- Непомнящих, Л.М. Морфогенез важнейших общепатологических процессов в сердце. -Новосибирск: Наука, Сиб. отделение, 1991. -352 с.


