Ультразвуковая диагностика и тактика при лимфоцеле после онкогинекологических операций
Автор: Степанов С.О., Новикова Е.Г., Скрепцова Н.С.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 2 (32), 2009 года.
Бесплатный доступ
Проведено ультразвуковое исследование 171 пациентки после расширенных онкогинекологических операций с лим- фаденэктомией. Выполнялось ультразвуковое исследование брюшной полости, забрюшинного пространства, малого таза, подвздошных и бедренных сосудов (областей по ходу сосудов). Послеоперационные лимфоцеле выявлены у 142 (83 %) больных, из них 40 (23,4 %) потребовалось лечение. В работе уточнено и расширено определение лимфоцеле. Предложена рациональная тактика ведения пациенток с данным осложнением. В 97,5 % случаев удалось купировать лимфоцеле без лапаротомии, применяя разработанную и усовершенствованную методику под контролем ультразвукового метода.
Лимфоцеле, инвазивные вмешательства под контролем ультразвукового исследования, расширенная экстирпация матки с тазовой лимфаденэктомией
Короткий адрес: https://sciup.org/14055130
IDR: 14055130 | УДК: 618.1-006-089.168-06:616-003.24]
Текст научной статьи Ультразвуковая диагностика и тактика при лимфоцеле после онкогинекологических операций
Стандартной операцией у большинства больных инвазивным раком шейки и тела матки является расширенная экстирпация матки с тазовой лимфаденэктомией [1, 6, 13]. От радикальности выполнения лимфаденэктомии зависят показатели выживаемости, а оставленные во время операции отдельные метастатически пораженные лимфатические коллекторы существенно ухудшают прогноз заболевания [3, 4, 10]. На сегодняшний день тазовая лимфаденэктомия остается не только лечебным, но и диагностическим методом, так как несет важную информацию о стадии процесса. На основании этих данных при необходимости проводится коррекция индивидуального плана лечения пациенток [7–9].
Повышение радикальности при расширенной экстирпации матки с придатками приводит к увеличению объема и длительности лимфо-реи и в связи с этим к увеличению частоты возникновения одного из серьезных ослож- нений лимфаденэктомии – лимфоцеле (ЛЦ) [14–16]. Известно, что послеоперационные ЛЦ являются ложными кистами, поскольку в их оболочке отсутствует эпителиальная выстилка, а составляющая стенку кисты плотная соединительнотканная капсула формируется из свернувшихся сгустков фибрина, которыми богата лимфа. Стенками ЛЦ являются органы и структуры, между и/или вокруг которых оно формируется.
С проблемой ЛЦ сталкиваются практически все онкохирурги [13, 17]. Причиной такого осложнения является пересечение лимфатических сосудов во время операции и скопления лимфы в свободном пространстве, а именно в области обтураторной ямки, по ходу подвздошных сосудов – в местах, откуда была удалена жировая клетчатка с лимфатическими узлами [2, 10, 12, 16]. Со временем естественная полость для скопления жидкости может стать замкнутой, и лимфа, оттекающая от прямой кишки, нижних конечностей, промежности, мочевого пузыря, скапливается в данных полостях. Важную роль имеет и обычная способность к реабсорбции организма жидкостных структур, нарушение которой лишь провоцирует накопление лимфы.
Несмотря на существование множества методов дренирования забрюшинного пространства и использование в хирургическом лечении «пе-ритонизационных окошек» или неполной перитонизации, вероятность образования лимфоцеле остается стабильно высокой [7, 11, 14, 18].
В клиническом течении ЛЦ наблюдаются различные исходы. При небольших размерах происходит их самопроизвольное рассасывание. Увеличение их размеров сопряжено с возможностью формирования ряда вторичных осложнений, обусловленных сдавлением структур малого таза. Появляются признаки гидронефроза, тромбоза и /или стойкие отеки нижних конечностей. Возможно развитие кишечной непроходимости, отека мягких тканей лона и половых губ. Присоединение инфекции грозит формированием абсцесса, требующего хирургического вмешательства [11, 17, 19].
Важным вопросом в хирургической онкогинекологии остается разработка эффективного малотравматичного метода устранения такого послеоперационного осложнения, как ЛЦ.
Материал и методы
В соответствии с целью исследования проанализировано послеоперационное течение у 171 пациентки, перенесших расширенные операции с тазовой лимфаденэктомией. Возраст больных, включенных в исследование, составил при раке шейки матки от 21 до 68 лет (34,6 ± 5,6 года); при раке эндометрия – от 44 до 75 лет (55,6 ± 9,5 года).
Обследование пациенток проводилось на ультразвуковых сканерах: Siemens sonoline antares, Siemens sonoline omnia, Siemens sonoline siena – в режиме реального времени, конвекс-ным датчиком 3,5 МГц, линейным датчиком 5–7 МГц, вагинально-ректальным датчиком 6–9 МГц. В зону осмотра входили брюшная полость и забрюшинное пространство, малый таз, области подвздошных и бедренных сосудов, послеоперационного рубца, участок вокруг дистального отдела дренажа или его проекции. Комплекс диагностических процедур предусматривал и внутриполостное исследование (трансвагинальное и/или трансректальное), позволяющее более качественно визуализировать район удаленных структур, так как формирование гематом или воспалительных изменений в зоне операционного вмешательства может иметь сходную эхографическую картину и клиническую симптоматику с ЛЦ.
Необходимо подчеркнуть, что как для проведения первичной эхографической диагностики ЛЦ, так и для оценки возможности его инвазивного лечения под контролем УЗИ необходимы сведения о взаимоотношении патологической полости с сосудистыми структурами. Для этого к исследованию в В-режиме добавлялось исследование в режиме пульсового и энергетического допплеровского картирования.
Эхографическими признаками формирования ЛЦ служила визуализация дополнительного образования, локализующегося в области хирургического вмешательства, с однородным внутренним содержимым и/или наличием нитевидных гиперэхогенных включений (перегородок). Его контурами были прилежащие петли кишки, сосудистый пучок, костные структуры таза. Для правильной интерпретации выявленной «лишней» зоны, в которой возможен мочевой затек, геморрагическое или серозное содержимое, а также ЛЦ, выполнялась аспирационная пункция. Полученный материал подвергался биохимическому исследованию, проводились микроскопический и бактериологический анализы [5], полученные данные свидетельствуют о том, что материал в основе своей был серозно-фибринозным экссудатом.
Результаты и обсуждение
Анализ работы показал, что формирование ЛЦ в послеоперационном периоде выявлено у 142 пациенток (83 %), из них у 40 (23,4 %) были показания для дренирования ЛЦ. Проведенные исследования выявили, что ЛЦ появляются в период с 5–6-х по 32-е сут после операции. Обычные места его расположения: область обтураторных ямок, вблизи подвздошных сосудов, полость малого таза, редко предпузырная клетчатка. Структура ЛЦ, изначально всегда жидкостная, неизбежно имеет тенденцию к
Частота аспирационных пункций лимфоцеле
Таблица
|
Число наблюдений |
Двукратная аспирация |
Трехкратная аспирация |
Четырехкратная аспирация |
Пятикратная аспирация |
|
19 |
3 (15,8 %) |
11 (57,9 %) |
3 (15,8 %) |
2 (10,5 %) |
сгущению и проявляется разной степенью организации.
Прямое влияние на формирование ЛЦ оказывало увеличение объема удаляемых во время операции клетчатки и количества лимфоузлов (ЛУ). Возраст, рост и вес пациенток не влияли на образование ЛЦ. У пациенток с предоперационной лучевой терапией ЛЦ определялись с такой же частотой, как и у больных только после хирургического лечения. С целью выявления зависимости степени лимфореи от количества удаленных ЛУ проведен подсчет последних. Оказалось, что максимальное число резецированных узлов составило 43, при колебаниях их количества от 5 до 43 (22 ± 7). Выяснено, что у 29 (16,9 %) пациенток, у которых не было ультразвуковых признаков формирования ЛЦ, количество удаленных во время операции лимфоузлов колебалось в пределах от 5 до 18 (11 ± 2).
Определяя показания к лечению ЛЦ, выбирали вариант инвазивного вмешательства под контролем УЗИ, учитывая условия доступности образования для их проведения, а именно отсутствие по ходу пункционной трассы петель кишечника и магистральных сосудов. Затем проводили аспирационную пункцию (иногда многократную) или дренирование с установкой пластикового катетера типа «pig tail».
Аспирационную пункцию ЛЦ с аспирацией содержимого осуществляли под местной анестезией методикой «свободной руки» или с применением пункционного адаптера, задающего фиксированное направление пункционной игле. Для манипуляции использовался конвексный или линейный датчик, применялись аспирационные иглы калибром 16–18G, длиной 10– 20 см. В случаях, когда ЛЦ состояло из нескольких полостей или из одной, но с внутренними гиперэхогенными перегородками, для полной эвакуации лимфы во время аспирации приходилось перфорировать перегородки пункционной иглой. На экране монитора это отображалось полным исчезновением эхографической карти- ны ЛЦ или жидкостной его части. Контрольное УЗИ пациенток проводилось в течение последующих трех суток. Визуализируя рецидив ЛЦ и определив необходимость его лечения, проводились повторные пункции (таблица).
Ретроспективный анализ проведенных манипуляций не выявил никаких осложнений, связанных с повреждением петель кишечника или сосудистых структур. Возникновение гнойносептических осложнений не отмечено.
Другой методикой лечения ЛЦ была постановка в его полость дренажа типа «pig tail», так как именно такая конструкция снабжена торцевыми и концевыми отверстиями, которые обеспечивают сворачивание рабочего конца и предупреждают его миграцию из полости. По данной методике было проведено лечение 8 больным.
После выбора траектории под местной анестезией производился небольшой разрез кожи и поверхностной фасции. Под контролем УЗИ, по ходу пункционной трассы или с помощью методики «свободной руки» в полость ЛЦ вводился дренаж типа «pig tail», расправленный на металлическом стилете размером 8Fr или 10Fr, с аспирацией содержимого. Далее система была на пассивном дренировании или подключалась к приспособлению для активной аспирации жидкости. После прекращения отделяемого по дренажу его перекрывали на сутки и проводили контрольное УЗИ. При отсутствии ультразвуковых признаков накопления жидкой части лимфы или повторного формирования ЛЦ в течение 2 сут дренаж удаляли.
В процессе наблюдения выявили необходимость в применении двух методик лечения (аспирационной пункции и дренировании) у 13 пациенток. Показанием служило отсутствие эффекта от аспирационных пункций, вследствие чего применяли методику дренирования полости ЛЦ.
В результате проведения инвазивного лечения под контролем УЗИ представленными способами практически во всех наблюдениях (97,5 %) результат был положительным, а именно, в процессе динамического наблюдения ни по данным ультразвукового исследования, ни по клинической картине не отмечалось признаков повторного формирования полости ЛЦ. Только у одной пациентки (2,5 %) при постановке дренажа был поврежден кровеносный сосуд малого диаметра, что явилось поводом для его перевязки во время лапаротомии. Контрольные исследования проводили с 4–5-го по 35–40-й день после операции. При инвазивном лечении ЛЦ и/или при показаниях динамического наблюдения за ЛЦ эхографические осмотры продолжались. Было от 3 до 20 (6 ± 3) УЗИ.
Проведенное исследование позволило нам определить понятие лимфоцеле как скопление лимфы в образовавшихся после операции сво- бодных пространствах вследствие выполнения лимфаденэктомии с иссечением жировой клетчатки. Учитывая разную ультразвуковую картину, целесообразно выделить три типа ЛЦ:
-
- I тип (рис. 1). ЛЦ с жидкостным содержимым. Появившееся в послеоперационном периоде образование с неровными контурами пониженной эхогенности и/или с тонкими единичными нитевидными гиперэхогенными включениями (перегородками). Последние формируются со 2-го дня после операции или удаления дренажа.
-
- II тип (рис. 2). ЛЦ с начальными признаками организации (начало формирования капсулы). Образование с четкими контурами пониженной эхогенности с тонкими единичными или множественными включениями (перегородками); формируется на 3–8-й день с момента появления ЛЦ.
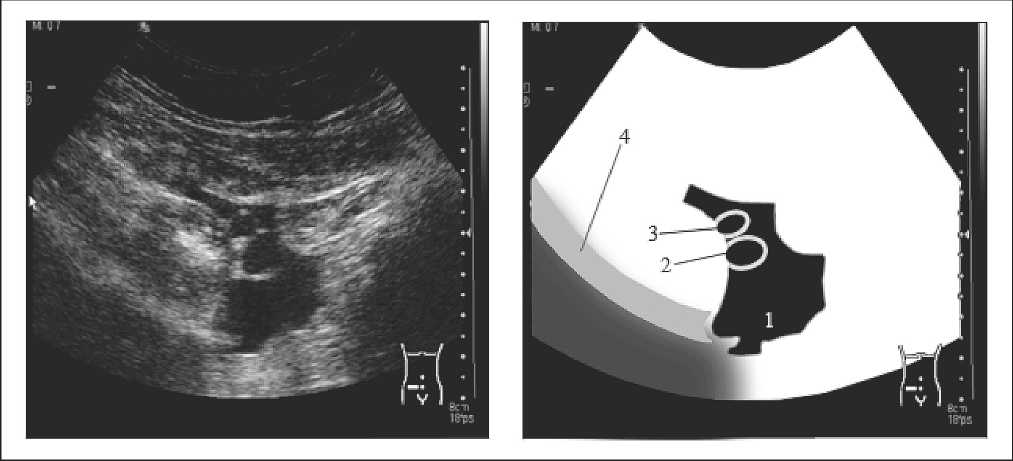
Рис. 1. Лимфоцеле I типа, расположенное в правой подвздошной области (1 – лимфоцеле, 2 – наружняя подвздошная вена, 3 – наружняя подвздошная артерия, 4 – подвздошная кость)
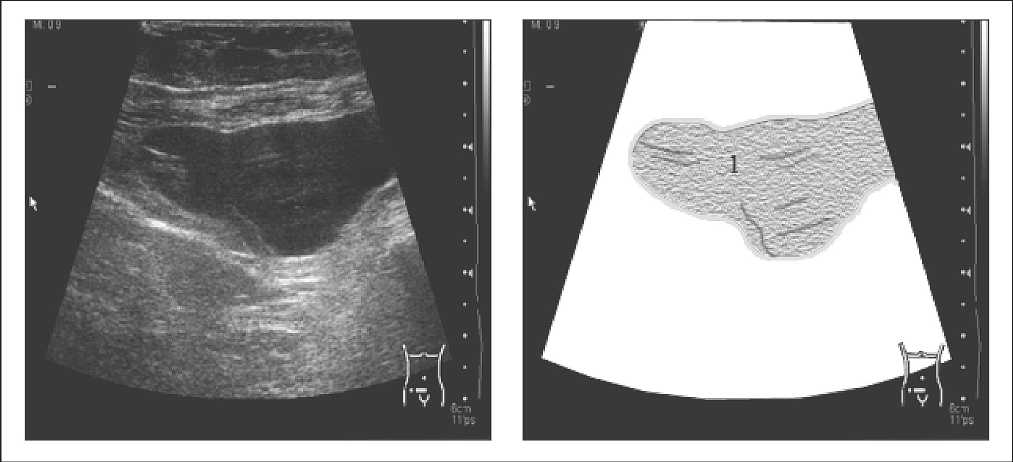
Рис.2. Лимфоцеле II типа, расположенное в предпузырной клетчатке (1 – лимфоцеле) СИБИРСКИЙ ОНКОЛОГИЧЕСКИЙ ЖУРНАЛ. 2009. №2 (32)
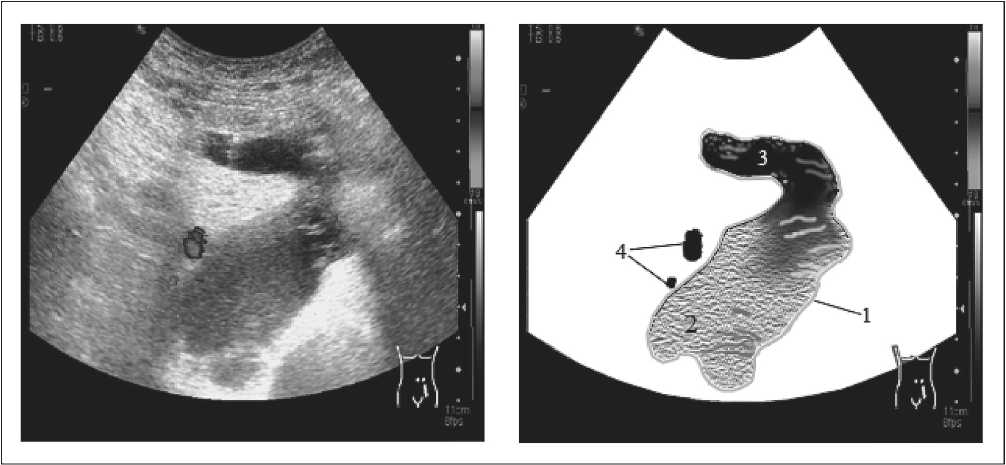
Рис. 3. Лимфоцеле III типа в левой подвздошной области (1 – лимфоцеле, 2 – нижний полюс образования с признаками организации, 3 – верхний полюс образования с продолжающимся поступлением лимфы, 4 – подвздошные сосуды)
-
- III тип (рис. 3). ЛЦ с признаками организации. Образование с четкими контурами, пониженной или слабопониженой эхогенности с множеством гиперэхогенных нитевидных перегородок разной толщины (тонких и толстых), которые объединяются или сливаются между собой, образуя сетчатую или губчатую структуру. Возможна и другая эхокартина данного типа, имеющая в вышеописанной структуре участок пониженной эхогенности, свидетельствующий о продолжающем поступлении лимфы. Подобный тип формируется после 6-го дня с момента появления ЛЦ.
Результаты проведенного исследования показали, что эффективность лечения ЛЦ непосредственно зависела от типа их развития.
При ультразвуковой картине ЛЦ I типа с предполагаемым объемом жидкости до 10 см3 следующий осмотр проводили через 3–5 дней. В случае нарастания объема, превышающего 30 см3, и даже не обнаруживая признаков урете-ропиелокаликулэктазии и венозного тромбоза, делали аспирационную пункцию с контрольным УЗИ на следующий день. Если вновь происходило наполнение жидкости до прежнего объема или больше, то выполнялась повторная пункция. Установив тенденцию к продолжающемуся поступлению лимфы, выполняли постановку дренажа.
Выявив ЛЦ II типа с объемом меньше 25 см3, повторяли УЗИ через 3–5 дней. Обнаружив постоянное увеличение образования с объемом больше 40 см3 и/или определив признаки уре- теропиелокаликулэктазии и венозного тромбоза, выполняли аспирационную пункцию с контрольным ультразвуковым осмотром на следующий день. При дальнейшем поступлении экссудата повторно эвакуировали содержимое. Пластиковый катетер применялся в случае не-прекращающегося накопления лимфы.
При эхограмме ЛЦ III типа, любого размера, с признаками организации, повторяли ультразвуковое наблюдение через 3–5 дней. Определив в образовании эхографические признаки накопления лимфы объемом меньше 50 см3, повторно осматривали пациентку через 3–5 дней. Увеличение объема жидкостной структуры служило показанием для аспирационной пункции и контрольного УЗИ в последующие 3 дня. Дренаж ставили при выявлении тенденции к продолжающемуся поступлению лимфы.
Наблюдения показали, что накопление лимфы прекращается к 38–60 дню с момента появления ЛЦ.
Ультразвуковая картина ЛЦ с воспалительными изменениями могла быть разнообразной. При его малых размерах наблюдали утолщение и отечность стенок, неоднородность внутреннего содержимого. В такой ситуации производили аспирационную пункцию, по возможности с полной эвакуацией содержимого. Эхографические признаки образования больших размеров могли быть типичными для ЛЦ, но бактериологический анализ обнаруживал присоединение патогенной микрофлоры. Случалось, что из зоны с незначительно неоднородной структу- рой получали мутный характер содержимого, при этом цитологическое исследование соответствовало воспалительным изменениям. В данных ситуациях устанавливали дренаж, при необходимости промывали полость растворами антисептиков, параллельно назначали терапию антибиотиками.
У части больных в послеоперационном периоде может происходить накопление экссудата в полости малого таза. Увеличиваясь в объеме, жидкость могла распространяться на области подвздошных сосудов и со временем «разделяться» на свободную жидкость в малом тазу и ЛЦ в подвздошных областях. В случае увеличения жидкостной структуры более 100 см3 производили ее удаление из полости малого таза. Для этого влагалище обрабатывали антисептическим раствором, затем стерильным корнцангом разводили культю с последующей эвакуацией содержимого. Далее проводили динамическое ультразвуковое наблюдение. Если все же происходило формирование ЛЦ, то лечение и/или динамическое наблюдение продолжали по предложенным выше методикам.
Таким образом, у 83 % пациенток после расширенных гинекологических операций в послеоперационном периоде формируется лимфоцеле; однако необходимость в лечении возникает в 23 % случаев. Благодаря применению разработанного алгоритма диагностики и применения усовершенствованных методик инвазивного лечения под контролем УЗИ (аспирационной пункции и/или дренирования) пациенткам удалось избежать повторных хирургических вмешательств для эвакуации ЛЦ. Исходя из результатов проведенных исследований, следует сделать заключение о том, что начинать ультразвуковое наблюдение за больными с тазовой лимфаденэктомией целесообразно с 6–7-го дня после операции.


