Уровень экспрессии генов лекарственной устойчивости в опухоли больных раком яичников после неоадъювантной химиотерапии
Автор: Полуднякова Людмила Викторовна, Долгова Динара Ришатовна, Антонеева Инна Ивановна, Абакумова Татьяна Владимировна, Колодий Ирина Олеговна
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Клиническая медицина
Статья в выпуске: 4, 2019 года.
Бесплатный доступ
Цель работы - оценка связи экспрессии генов лекарственной устойчивости в опухолевой ткани больных раком яичников после проведения неоадъювантной химиотерапии (НАХТ) с клинико-патологическими параметрами заболевания. Материалы и методы. В исследование вошли 2 6 больных раком яичников после НАХТ по схеме АР. Материал для исследования - парные образцы нормальной и опухолевой ткани яичников. Уровень экспрессии генов ABCB1, ERCC1 и TOP2A оценивали при помощи ПЦР в реальном времени. Результаты. Выявлено, что у больных до 60 лет уровень экспрессии гена ABCB1 выше, чем у больных старше 60 лет. Экспрессия ERCC1 и TOP2A в разных возрастных группах не отличалась. Не установлена связь изучаемых генов с размером опухоли и метастазированием. Уровень экспрессии генов TOP2A и ABCB1 у больных с рецидивами и без них достоверно не отличался. У больных с рецидивами уровень экспрессии ERCC1 выше, чем у больных без рецидивов. У больных с нормальным значением СА-125 уровень экспрессии ERCC1 ниже, чем у больных с высоким показателем. Анализ связи экспрессии исследуемых генов с общей и безрецидивной выживаемостью больных не дал значимых результатов. Выводы. Уровень экспрессии гена ABCB1 связан с возрастом пациентов, а уровень экспрессии ERCC1 - с рецидивом заболевания и СА-125. В целом экспрессия изучаемых генов слабо коррелирует с основными клинико-патологическими параметрами заболевания.
Рак яичников, неоадъювантная химиотерапия, экспрессия, гены лекарственной устойчивости abcb1, тор2а
Короткий адрес: https://sciup.org/14116403
IDR: 14116403 | УДК: 616-006.66:616-08-039.34 | DOI: 10.34014/2227-1848-2019-4-63-73
Текст научной статьи Уровень экспрессии генов лекарственной устойчивости в опухоли больных раком яичников после неоадъювантной химиотерапии
Введение. Рак яичников (РЯ) является одним из наиболее распространенных и лидирующим по показателям смертности онкогине-кологическим заболеванием [1, 2]. Одна из причин смерти при данной нозологии, обусловливающая летальный исход в 70 % случаев, – обнаружение злокачественной опухоли в распространённых стадиях [3].
Основным методом лечения РЯ является хирургическое вмешательство в сочетании с химиотерапией. При отсутствии условий для выполнения оптимальной первичной циторедуктивной операции возможно проведение неоадъювантной химиотерапии (НАХТ), позволяющей в дальнейшем достичь выполнения большего процента оптимальных циторедукций, меньшей кровопотери и улучшения качества жизни [4, 5].
Однако вопрос о значении НАХТ в лечении распространенных стадий РЯ остается нерешенным. Данные клинических исследований относительно эффективности применения НАХТ очень противоречивы [6]. В ряде работ авторы предлагают определять различные показатели для оценки эффективности НАХТ при РЯ, однако способов оценивания, основанных на комплексе клинических и молекулярно-генетических параметров, не обнаружено [7].
Основной причиной неэффективности стандартной химиотерапии рака является химиорезистентность опухолевых клеток. Она может быть первичной или формироваться в процессе лечения вследствие повышения экспрессии энергозависимых транспортёров лекарств, осуществляющих выброс цитостати- ческих препаратов из опухолевых клеток [8, 9]. Центральную роль в развитии множественной лекарственной устойчивости играет повышенный выход препарата на основе АТФ-связывающих кассетных белков-транспортеров (АВС-белков), что приводит к снижению накопления препаратов внутри раковых клеток и снижению эффективности воздействия [10]. ABCB1 отчетливо коррелирует с худшей чувствительностью к химиотерапии и временем до прогрессирования заболевания [11].
Существенную роль в формировании резистентности / чувствительности опухолевых клеток к отдельным химиопрепаратам играют гены монорезистентности, в частности ERCC1 и ТОР2А (топоизомераза 2-альфа) [12]. Однако данные относительно корреляции уровня экспрессии ERСС1, белка эксцизионной репарации, и клинической эффективности платиновых препаратов неоднозначны [13]. Авторы ряда работ доказывают, что препараты платины более эффективны при дефиците функции эксцизионной репарации [14, 15]. S. Lee et al. такую зависимость не выявили [16], C.H. Kang et al. показали обратное [17]. Прогнозирование эффективности химиотерапии РЯ с использованием уровня экспрессии ERCC1 остаётся до конца не решённой задачей, поэтому до настоящего времени этот маркер рутинно в клинике не используется [18].
Белковый продукт гена TOP2A – топоизомераза 2А – является ферментом, участвующим в изменении структуры хроматина в процессе репликации ДНК [19]. TOP2A играет ключевую роль в стабильности ДНК и представляет собой одну из мишеней химиотерапевтических агентов, таких как этопозид и ан-трациклины, которые связываются с комплексом «ДНК – топоизомераза 2А» и тем самым тормозят митотическую активность клеток [20, 21]. Данных о прогностической роли TOP2A при раке яичников мало, и они разнородные. Это в основном связано с использованием различных методов обнаружения экспрессии TOP2A, таких как иммуногистохимия, полимеразная цепная реакция в реальном времени и флуоресцентная гибридизация [22].
Цель исследования. Оценка связи экспрессии генов лекарственной устойчивости в опухолевой ткани больных раком яичников после проведения неоадъювантной химиотерапии с клинико-патологическими параметрами заболевания.
Материалы и методы. В исследование были включены 26 больных РЯ III–IV стадий с морфологически верифицированным диагнозом, которые находились на лечении в Областном клиническом онкологическом диспансере г. Ульяновска с 2015 по 2019 г. Больные давали письменное добровольное информированное согласие на проведение лечения; все исследования выполнялись в соответствии с этическими нормами Хельсинкской декларации (2013). Пациенткам проводилась неоадъювантная стандартная химиотерапия по схеме АР от 2 до 4 курсов с интервалом 3 нед., затем циторедуктивная операция и адъювантная химиотерапия.
Использовались пары зондов и праймеров (TaqMan®Gene Expression Assay) производства ThermoScientific (США). Для нормализации данных в качестве генов-рефери выбраны гены 18S (Hs99999901_s1) и GAPDH (Hs03929097_g1). Уровень экспрессии каждого целевого гена нормализовался по отношению к экспрессии генов-рефери и нормальной ткани. Относительная экспрессия генов рассчитывалась с помощью метода Pfaffl и вы- клинико-патологическим параметрам (табл. 1). ражалась в условных единицах [24]. В представленных группах оценивался уро
Больные были разделены на группы по вень экспрессии исследуемых генов.
Таблица 1
Table 1
Основные клинико-патологические параметры больных раком яичников Main clinical and pathological parameters of ovarian cancer patients
|
Клинико-патологический параметр Clinical and pathological parameters |
Количество больных (n=26), абс. (%) Number of patients (n=26), absolute value (%) |
|
|
Возраст Age |
≤60 лет ≤60 years old |
12 (46,2) |
|
>60 лет >60 years old |
14 (53,8) |
|
|
Размер опухоли Tumor size |
Т 3 |
18 (69,2) |
|
Т 4 |
8 (30,8) |
|
|
Отдаленное метастазирование Distant metastasis |
М 0 |
17 (65,4) |
|
М 1 |
9 (34,6) |
|
|
Безрецидивный период Relapse-free period |
≤12 мес. ≤12 months |
16 (62) |
|
>12 мес. >12 months |
10 (38,5) |
|
|
Уровень СА-125 после НАХТ CA-125 level after NAChT |
≤35 ед./мл ≤35 U/ml |
11 (42) |
|
>35 ед./мл >35 U/ml |
15 (58) |
|
Статистическая обработка данных проводилась с использованием программ STATISTICA 10.0 (StatSoft Inc., США). Для каждой выборки вычислялись среднее арифметическое и средняя квадратичная ошибка. Значимость различий между исследуемыми группами оценивалась с помощью критерия Вилкоксона–Манна–Уитни. Корреляционная связь между параметрами анализировалась с применением коэффициента Спирмена. Для анализа общей и безрецидивной выживаемости использовались кривые выживаемости по методу Каплана–Майера. Статистически значимыми считались различия при р≤0,05.
Результаты и обсуждение. Результаты оценки связи относительной экспрессии исследуемых генов с основными клинико-патологическими параметрами представлены в табл. 2. Установлена связь между уровнем экспрессии гена ABCB1 и возрастом пациентов: у больных до 60 лет уровень экспрессии этого гена оказался достоверно выше (р=0,03). C экспрессией АВС-транспортеров связан менструальный статус, который во многом является функцией возраста. В исследовании L. Moureau-Zabotto et al. отмечена более высокая экспрессия АВСВ1 у больных с сохраненным менструальным циклом [25]; Н.В. Литвя-ков наблюдал подобную зависимость у больных раком молочной железы [26]. Значимая связь между уровнем экспрессии генов ERCC1 и TOP2A и возрастом больных не выявлена.
Также не установлена связь изучаемых генов в опухоли с ее размером и отдаленным метастазированием. Уровень экспрессии генов TOP2A и ABCB1 у больных с рецидивами и без них достоверно не отличался. Достоверно выше оказался уровень экспрессии ERCC1 у больных с рецидивами, возникшими до года, по сравнению с безрецидивным течением. Это согласуется с клиническими исследованиями, в которых показано, что низкий уровень экс- прессии ERCC1 благоприятно влияет на показатели выживаемости. Препараты платины, используемые при химиотерапии, демонстрируют более высокую активность при дефиците функции эксцизионной репарации, т.е. при низком уровне ERCC1 [14, 15].
Таблица 2
Table 2
Уровень экспрессии генов в опухоли после НАХТ в зависимости от основных клинико-патологических параметров (M±m)
The level of gene expression in the tumor after NACT depending on the main clinical and pathological parameters (M±m)
|
Клинико-патологический параметр Clinical and path ological parameter |
ERCC1 |
TOP2A |
ABCB1 |
|
|
Возраст Age |
≤60 лет ≤60 years old |
1,90±0,64 |
1,95±0,62 |
2,22±0,76 |
|
>60 лет >60 years old |
1,33±0,46 |
1,20±0,45 |
1,05±0,69 |
|
|
p-value |
p=0,44 |
p=0,34 |
p=0,03 |
|
|
Размер опухоли Tumor size |
Т 3 |
1,48±0,47 |
1,21±0,39 |
1,59±0,65 |
|
Т 4 |
1,86±0,68 |
2,30±0,84 |
1,58±0,88 |
|
|
p-value |
p=0,66 |
р=0,33 |
p=0,87 |
|
|
Отдаленное метастазирование Distant metastasis |
М 0 |
1,56±0,49 |
1,25±0,41 |
1,55±0,69 |
|
М 1 |
1,66±0,63 |
2,12±0,77 |
1,68±0,78 |
|
|
p-value |
p=0,98 |
p=0,33 |
p=0,69 |
|
|
Безрецидивный период Relapse-free period |
≤12 мес. ≤12 months |
2,75±0,51 |
1,56±0,48 |
1,57±0,72 |
|
>12 мес. >12 months |
0,90±0,28 |
1,54±0,63 |
1,63±0,71 |
|
|
p-value |
p=0,01 |
p=0,62 |
p=0,3 |
|
|
Уровень СА-125 после НАХТ CA-125 level after NAChT |
≤35 ед./мл ≤35 U/ml |
0,56±0,28 |
0,67±0,5 |
0,71±0,35 |
|
>35 ед./мл >35 U/ml |
1,92±0,34 |
1,69±0,67 |
1,31±0,74 |
|
|
p-value |
p=0,04 |
p=0,28 |
p=0,77 |
|
Примечание. P-value – показатель достоверности различий данных в сравниваемых группах.
Note. P-value is a certainty index of data differences in compared groups.
При сравнении экспрессии исследуемых генов после НАХТ в группах больных с нормальным (до 35 ед./мл) и высоким уровнем СА-125 достоверное отличие обнаружено только по ERCC1. У больных с нормальным значением СА-125 уровень экспрессии
ERCC1 был ниже. Корреляционный анализ выявил достоверную положительную связь между уровнем онкомаркера СА-125 и экспрессией ERCC1 (по Спирмену; r=0,495). В исследовании I. Chebouti et al. установлена ко-экспрессия уровня ERCC1 в циркулирующих опухолевых клетках и CA-125, которая сопровождалась уменьшением безрецидивного периода [27]. В нашей работе уровень экспрессии ERCC1 у больных с ранними рецидивами также был выше, что может быть связано с устойчивостью к химиотерапии на основе препаратов платины [28].
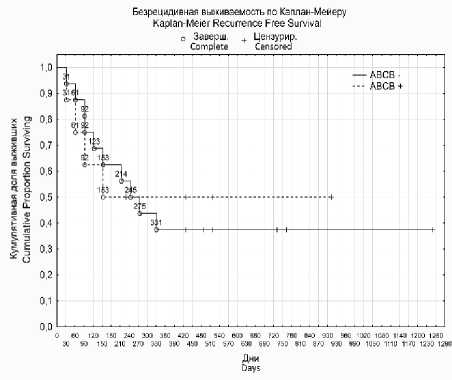
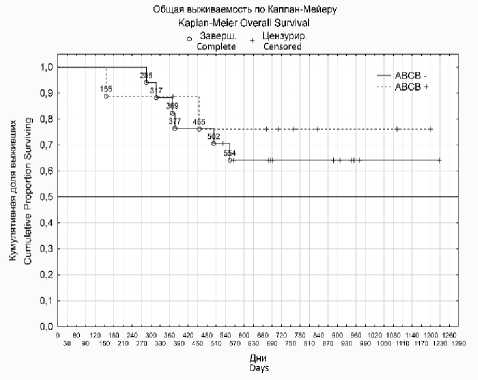
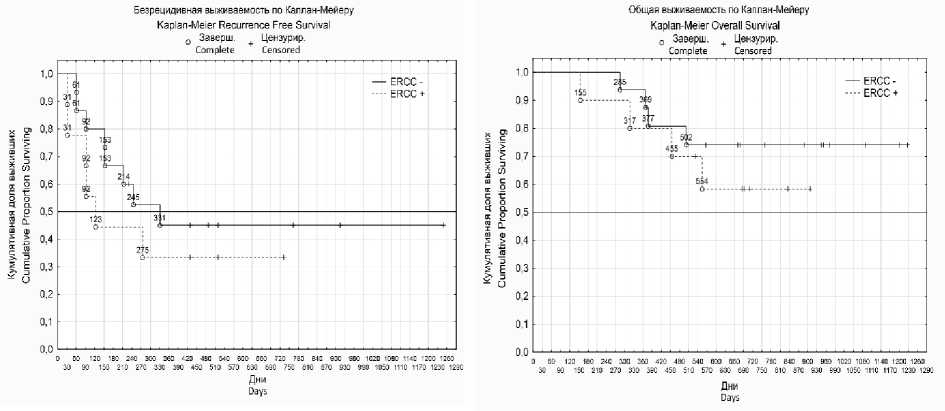
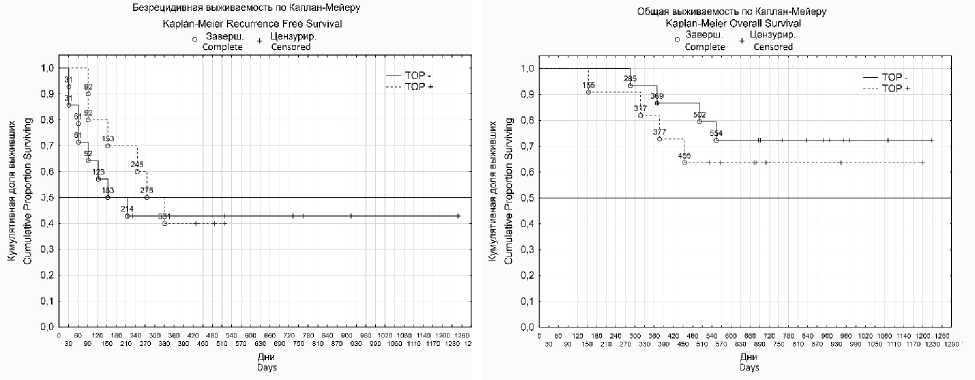
Также был проведен анализ связи экспрессии исследуемых генов с общей и безре-цидивной выживаемостью больных (рис. 1). Однако достоверной связи установлено не было.
А (p=0,89)
А (p=0,89)
Б (p=0,6)
B (p=0,6)
В (p=0,39)
C (p=0,39)
Г (p=0,45)
D (p=0,45)
Д (p=0,64)
Е (p=0,56)
F (p=0,56)
E (p=0,64)
Рис. 1. Графики общей и безрецидивной выживаемости больных с раком яичников после НАХТ с экспрессией (пунктирные линии) и без нее (сплошные линии) следующих генов: ABCB1 (А, Б), ERCC1 (В, Г), TOP 2A (Д, Е).
Примечание. р – уровень статистической значимости по log-rank test
Fig. 1. Graphs of the overall and relapse-free survival of patients with ovarian cancer after NAChT with expression (dashed lines) and without expression (solid lines) of the following genes: ABCB1 (A, B), ERCC1 (C, D), TOP 2A (E, F).
Note. P is the statistical significance level according to log-rank test
Заключение. В результате исследования установлено, что экспрессия генов лекарственной устойчивости в опухолевой ткани больных раком яичников после проведения неоадъювантной химиотерапии слабо коррелирует с основными клинико-патологическими параметрами. Статистически значимой оказалась лишь связь уровня экспрессии гена ABCB1 с возрастом пациентов и уровня экспрессии гена ERCC1 с рецидивом заболевания и уровнем СА-125.
Анализ связи экспрессии исследуемых генов с общей и безрецидивной выживаемостью больных достоверных различий не показал.
Существует мнение, что путь от экспрессии гена до синтеза белка длинный и может прерваться на различных этапах. По уровню экспрессии мРНК гена трудно судить об уровне белка в клетке и об активности развития лекарственной устойчивости к химиопрепаратам [13].
Работа выполнена при поддержке гранта Президента РФ (МК-3196.2018.7).
Список литературы Уровень экспрессии генов лекарственной устойчивости в опухоли больных раком яичников после неоадъювантной химиотерапии
- Momenimovahed Z., Tiznobaik А., Taheri S., Salehiniya H. Ovarian cancer in the world: epidemiology and risk factors. Int. J. Womens Health. 2019; 11: 287-299.
- Bray F., Ferlay J., Soerjomataram I., Siegel R.L., Torre L.A., Jemal A. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J. Clin. 2018; 68 (6): 394-424.
- Wenham R.M. Ovarian cancer: a bright future. Cancer Control. 2011; 18: 4-5.
- Morimoto A., Nagao S., Kogiku A. A preoperative low cancer antigen 125 level (Jpn. J. Clin. Oncol. 2016; 46 (6): 517-521.
- Ledermann J.A., Raja F.A. Newly diagnosed and relapsed epithelial ovarian carcinoma: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up 2013. Ann. Oncol. 2013; 24 (6): 24-32.
- Солопова А.Е., Чащин А.А., Солопова А.Г., Гуров С.Н., Макацария А.Д. Неоадъювантная химиотерапия рака яичников. Современные возможности и критерии отбора пациенток. Акушерство, гинекология и репродукция. 2016; 2: 44-54.
- Виллерт А.Б., Коломиец Л.А., Юнусова Н.В., Иванова А.А. Асцит как предмет исследований при раке яичников. Сибирский онкологический журнал. 2019; 18 (1): 116-123.
- Schinkel A.H., Jonker J.W. Mammalian drug efflx transporters of the ATP binding cassette (ABC) family: an overview. Adv. Drug Deliv. Rev. 2003; 55 (1): 3-29.
- Юмов Е.Ю., Цыганов М.М., Литвяков Н.В., Полищук Т.В. Экспрессия генов множественной лекарственной устойчивости и монорезистентности при немелкоклеточном раке легкого. Сибирский онкологический журнал. 2014; 61 (1): 16-22.
- Pan S.T., Li Z.L., He Z.X., Qiu J.X., Zhou S.F. Molecular mechanisms for tumour resistance to chemotherapy. Clin. Exp. Pharmacol. Physiol. 2016; 43 (8): 723-737.
- Seborova K., Vaclavikova R., Soucek P. Association of ABC gene profiles with time to progression and resistance in ovarian cancer revealed by bioinformatics analyses. Cancer Med. 2019; 00: 1-11.
- Цыганов М. М. Оценка прогностической значимости экспрессии генов монорезистентности в опухоли больных немелкоклеточным раком легкого после предоперационной химиотерапии. Вопросы онкологии. 2017; 1: 122-127.
- Богуш Т.А., Стенина М.Б., Богуш Е.А., Заркуа В.Т., Калюжный С.А., Мамичев И.А., Тюляндина А.С., Тюляндин С.А. Количественные показатели экспрессии ERCC1 в ткани серозного рака яичников и эффективность I линии химиотерапии с включением препаратов платины. Антибиотики и химиотерапия. 2018; (1-2): 24-31.
- D'Incalci M., Galmarini C.M. Predicting cisplatin and trabectedin drug sensitivity in ovarian and colon cancers. Mol. Cancer Ther. 2008; 7 (1): 10-18.
- Хохлова С.В., Черкасова М.В., Орел Н.Ф., Лимарева С.В., Базаева И.Я., Горбунова В.А. Каким больным раком яичника показана комбинация трабектедина с пегилированным липосомальным доксорубицином. Вестник РАМН. 2013; 11: 115-121.
- Lee S.M., Falzon M., Blackhall F. Randomized prospective biomarker trial of ercc 1 for comparing platinum and nonplatinum therapy in advanced non-small-cell lung cancer: ERCC1 trial (ET). J. Clin. Oncol. 2017; 35 (4): 402-411.
- Kang C.H., Jang B.G., Kim D.W. The prognostic significance of ERCC1, BRCA1, XRCC1, and betaIII-tubulin expression in patientswith non-small cell lung cancer treated by platinum- and taxane-basedneo-adjuvant chemotherapy and surgical resection. lung cancer. 2010; 68 (3): 478-483.
- Богуш Т.А., Попова А.С., Дудко Е.А., Богуш Е.А., Тюляндина А.С., Тюляндин С.А. ERCC1 как маркер резистентности рака яичников к препаратам платины. Антибиотики и химиотерапия. 2015; 60 (3-4): 42-50.
- Северин С.Е. Биологическая химия. Москва; 2011. 624.
- Li D., Yuan Z., Chen S., Zhang C., Song L., Gao C., Chen Y., Tan C., Jiang Y. Synthesis and biological research of novel azaacridine derivatives as potent DNA-binding ligands and topoisomerase II inhibitors. Bioorg. Med. Chem. 2017; 25 (13): 3437-3446.
- Konecny G.E., Pauletti C., Untch M., Wang H.-J., Modus V., Kulin W., Thomssen C., Harbeck N., Wang L., Apple S., Janicke F., Slamon D.J. Association between HER2, TOP2A, and response to antracycline-basedpreoperative chemotherapy in high-risk primary breast cancer. Breast Cancer Res. Treat. 2010; 120: 481-489.
- Ghisoni Е., Maggiorotto F., Borella F., eds. TOP2A as marker of response to pegylated lyposomal doxorubicin (PLD) in epithelial ovarian cancers. Journal of Ovarian Research. 2019; 12: 17.
- Chomczynski P., Sacchi N. The single-step method of RNA isolation by acid guanidinium thiocyanate-phenol-chloroform extraction: twenty-something years on. Nat. Protoc. 2006; 1 (2): 581-585.
- Pfaffl M.W. A new mathematical model for relative quantification in real-time RT-PCR. Nucleic acids research. 2001; 9 (9): 45.
- Moureau-Zabotto L., Ricci S., Lefranc J.P., Coulet F., Genestie C., Antoine M., Uzan S.,Lotz J.P., Touboul E., Lacave R. Prognostic impact of multidrug resistance gene expression on the management of breast cancer in the context of adjuvant therapy based on a series of 171 patien. Br. J. Cancer. 2006; 94 (4): 473-480.
- Литвяков Н.В. Регуляция экспрессии генов множественной лекарственной устойчивости в опухоли молочной железы при проведении неоадъювантной химиотерапии: дис.. д-ра биол. наук. Томск; 2014. 237.
- Chebouti I., Kuhlmann J.D., Buderath P. ERCC1-expressing circulating tumor cells as a potential diagnostic tool for monitoring response to platinum-based chemotherapy and for predicting post-therapeutic outcome of ovarian cancer. Oncotarget. 2017; 8 (15): 24303-24313.
- Du P., Wang Y., Chen L., Gan Y., Wu Q. High ERCC1 expression is associated with platinum-resistance, but not survival in patients with epithelial ovarian cancer. Oncol Lett. 2016; 12 (2): 857-862.


