Уровень продукции активных форм кислорода адипоцитами эпикардиальной жировой ткани у пациентов с выраженным коронарным атеросклерозом взаимосвязан с возрастанием постпрандиальной гликемии
Автор: Кошельская О.А., Нарыжная Н.В., Кологривова И.В., Суслова Т.Е., Харитонова О.А., Евтушенко В.В., Андреев С.Л., Горбунов А.С., Гудкова А.А.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 3 т.36, 2021 года.
Бесплатный доступ
До настоящего времени механизмы окислительного стресса адипоцитов локальных жировых депо у пациентов с кардиометаболическими заболеваниями исследованы в недостаточной степени.Цель исследования: изучить уровень продукции активных форм кислорода (АФК) в адипоцитах эпикардиальной (ЭЖТ) и подкожной жировых тканей (ПЖТ) у пациентов со стабильной ишемической болезнью (ИБС) и выраженным коронарным атеросклерозом, исследовать потенциальные связи уровней выработки АФК адипоцитами ЭЖТ и ПЖТ с показателями ожирения, накоплением ЭЖТ, гликемией, дислипидемией.Материал и методы. В исследование включены 19 пациентов (12 мужчин и 7 женщин, 6 пациентов (31,5%) с сахарным диабетом 2-го типа) в возрасте 53-72 лет со стабильной ИБС и выраженным коронарным атеросклерозом, у которых имелись показания для проведения хирургической операции аортокоронарного шунтирования. Материалом для исследования служили адипоциты ЭЖТ и ПЖТ, полученные ферментативным методом из интраоперационных эксплантов. Уровень АФК в адипоцитах определяли флуориметрически с помощью красителя 2,3-дигидродихлорфлуоресцеина диацетата. Оценивали антропометрические показатели ожирения и рассчитывали толщину ЭЖТ (тЭЖТ) с помощью эхокардиографии. Изучали состояние липидтранспортной функции крови и уровни базальной и поспрандиальной глюкозы (ППГ).Результаты. Уровни выработки АФК адипоцитами ЭЖТ и ПЖТ в общей группе пациентов значимо не различались и составили 1710 (1608; 2079) и 1876 (1374; 2215) усл. ед. соответственно. Уровень продукции АФК адипоцитами ПЖТ не имел корреляционных связей с показателями ожирения, тЭЖТ и содержанием в крови изученных биомаркеров. Уровень выработки АФК в адипоцитах ЭЖТ демонстрировал прямую корреляционную взаимосвязь со значениями ППГ (rs = 0,62; p function show_abstract() { $('#abstract1').hide(); $('#abstract2').show(); $('#abstract_expand').hide(); }
Активные формы кислорода, адипоциты, эпикардиальная жировая ткань, постпрандиальная гликемия, коронарный атеросклероз
Короткий адрес: https://sciup.org/149139354
IDR: 149139354 | УДК: 616.13-004.6:616.153.45:577.12 | DOI: 10.29001/2073-8552-2021-36-3-59-67
Текст научной статьи Уровень продукции активных форм кислорода адипоцитами эпикардиальной жировой ткани у пациентов с выраженным коронарным атеросклерозом взаимосвязан с возрастанием постпрандиальной гликемии
Как известно, окислительный стресс, характеризующийся чрезмерным образованием активных форм кислорода (АФК) и снижением антиоксидантной защиты, является ключевым звеном сердечно-сосудистой патологии, ассоциированной с метаболическими нарушениями, включая ожирение. Во многих клинических и экспериментальных исследованиях показано, что ожирение способствует развитию системного окислительного стресса [1, 2], однако лишь в единичных работах обсуждается взаимодействие последнего непосредственно с жировой тканью [3–5]. До настоящего времени механизмы окислительного стресса адипоцитов у пациентов с кардиомета-болическими заболеваниями окончательно не установлены; имеющиеся литературные сведения о способности адипоцитов эпикардиальной (ЭЖТ) и подкожной жировых тканей (ПЖТ) производить АФК у пациентов с хронической ишемической болезнью сердца (ИБС) очень ограничены и противоречивы. В эксперименте установлено возрастание уровня продукции АФК в изолированных адипоцитах мышей с метаболическим синдромом в присутствии высоких доз глюкозы [6].
Цель настоящего исследования: изучить уровень продукции АФК в адипоцитах ЭЖТ и ПЖТ у пациентов со стабильной ИБС и выраженным коронарным атеросклерозом, подвергнутых операции коронарного шунтирования; исследовать потенциальные связи уровней выработки АФК адипоцитами ЭЖТ и ПЖТ с антропометрическими показателями ожирения, выраженностью накопления ЭЖТ, базальной и постпрандиальной гликемией и состоянием липидтранспортной функции крови.
Материал и методы
В настоящее пилотное исследование включены 19 пациентов (12 мужчин и 7 женщин) в возрасте 53– 72 лет со стабильной ИБС и выраженным коронарным атеросклерозом, у которых имелись показания для проведения хирургической операции аортокоронарного шунтирования.
Исследование проведено в соответствии с Хельсинкской декларацией Всемирной медицинской ассоциации «Этические принципы проведения научных медицинских исследований с участием человека» с поправками 2000 г. и «Правилами клинической практики в Российской Федерации», утвержденными Приказом Министерства здраво- охранения Российской Федерации от 19.06.2003 г. № 266. Исследование было одобрено локальным этическим комитетом НИИ кардиологии Томского НИМЦ (протокол № 146 от 16.06.2016 г.). Все лица, включенные в исследование, подписали информированное согласие на участие.
Пациенты находились на регулярной медикаментозной терапии, приближающейся к оптимальной. Доля курильщиков и пациентов с метаболическими нарушениями, которые соответствовали критериям метаболического синдрома [7], была высокой. Клиническая характеристика пациентов представлена в таблице 1.
Критериями исключения являлись острые атеросклеротические осложнения в течение последних 6 мес., любое воспалительное заболевание, хроническая болезнь почек выше С3б, онкологические, гематологические и иммунные заболевания, а также изменение массы тела более чем на 3% за предыдущие 3 мес.
Таблица 1. Клиническая характеристика включенных в исследование пациентов ( n = 19)
Table 1. Clinical characteristics of patients ( n = 19)
|
Показатели Parameters |
Значение Value |
|
Пол (мужчины/женщины), n (%) Gender (m/f), n (%) |
12 (63,2)/ 7 (36,8) |
|
Возраст, лет Age, years |
61 (56; 66) |
|
Пациенты с инфарктом миокарда в анамнезе, n (%) History of myocardial infarction, n (%) |
8 (42,1) |
|
Пациенты с артериальной гипертонией, n (%) Hypertension, n (%) |
19 (100) |
|
Пациенты с сахарным диабетом 2-го типа , n (%) Type 2 diabetes mellitus, n (%) |
6 (31,5) |
|
Длительность артериальной гипертонии, лет Duration of hypertension, years |
14 (10; 20) |
|
Длительность ишемической болезни сердца, лет Duration of coronary artery disease, years |
2 (1; 7) |
|
Систолическое артериальное давление, мм рт. ст. Systolic blood pressure, mmHg |
136 (125;144) |
|
Диастолическое артериальное давление, мм рт.ст. Diastolic blood pressure, mmHg |
80 (73;85) |
|
Курильщики, n (%) Smoking, n (%) |
9 (47,3) |
Окончание табл. 1
End of table 1
|
Показатели Parameters |
Значение Value |
|
Индекс массы тела, кг/м2 Body mass index, kg/m2 |
30,2 (27,4; 31,5) |
|
Пациенты с ожирением, n (%) Obesity, n (%) |
9 (47,3) |
|
Окружность талии, см Waist circumference, cm |
104 (98; 110) |
|
Индекс Gensini, баллы Gensini score, points |
70,5 (33; 110) |
|
Толщина ЭЖТ, мм Epicardial adipose tissue thickness, mm |
4,7 (4,1; 5,6) |
Примечание: здесь и далее: количественные данные представлены медианой Me и межквартильным интервалом ( Q 25%; Q 75%).
Note: data are presented as median ( Me ) and interquartile interval ( Q 25%; Q 75%).
Материалом для исследования явились экспланты ЭЖТ и ПЖТ массой 0,2–1 г, полученные в ходе операции аортокоронарного шунтирования. Эксплантаты были взяты из ЭЖТ, окружающей проксимальные части правой коронарной артерии. Электрокоагуляция и другие виды теплового и волнового воздействия на ткани для биопсии не применялись. Образцы помещали в среду М199 и в течение 15 мин доставляли в лабораторию. Выделение клеток жировой ткани осуществляли энзиматически, стерильно в ламинарном шкафу II класса защиты (БАВп-01-«Ла-минар-с»-1,5, ЗАО «Ламинарные системы», Миасс, Россия) [8]. Ткань измельчали, инкубировали 35–40 мин при температуре 37 °С и постоянном мягком перемешивании (10 об./мин) в 5 мл стерильного раствора коллагеназы І типа («ПанЭко», Россия), 1 мг/мл в буфере Кребса – Рингера (2 mM D-глюкозы, 135 mM NaCl, 2,2 mM CaCl2·2H2O, 1,25 mM MgSO4·7H2O, 0,45 mM KH2PO4, 2,17 mM Na2HPO4, 25 mM HEPES, 3,5% BSA, 0,2 mM аденозина). Для нейтрализации коллагеназы добавляли буфер Кребса – Рингера в соотношении 1:1. Клеточную суспензию фильтровали через нейлоновый фильтр (Falcon™Cell strainer, диаметр пор 100 мкм) и трехкратно промывали теплым буфером Кребса – Рингера.
Жизнеспособность культуры адипоцитов верифицировали при окраске Hoechst 33,342 (Invitrogen, 5 мкг/мл, окрашивает ядра жизнеспособных клеток) и пропиди-ум йодидом (Sigma-Aldrich, 10 мкг/мл, окрашивает ядра мертвых клеток) на флуоресцентном микроскопе Axio Observer.Z1 (Carl Zeiss Surgical GmbH, Oberkochen, Germany), рисунок 1 [9]. Культура с жизнеспособностью ниже 90% исключалась из исследования. Образцы остальных клеток существенно не различались по процентному содержанию жизнеспособных клеток.
Для изменения количества активных форм кислорода в ячейки 96-луночного планшета добавляли по 5 × 105 адипоцитов в 200 µl раствора Кребса – Рингера (1,25 × 106 cell/ml), которые инкубировали в течение 30 мин в присутствии 125 µM 2,3-дигидродихлорофлуоресцеи-на диацетата (DCF-DA) в микропланшетном ридере при 37 °C (INFINITE 200M microplate spectrophotometer; Tecan, Austria) [5]. Измеряли свечение DCF при длинах волн воз-буждения/излучения λex = 500 и λem = 530 соответственно. Накопление активных форм кислорода адипоцитами верифицировали микроскопически (см. рис. 1).
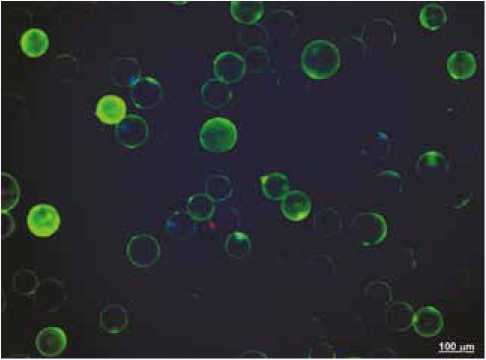
Рис. 1. Накопление активных форм кислорода и жизнеспособность адипоцитов в культуре клеток эпикардиальной жировой ткани Примечание: флуоресцентное окрашивание. Красители: зеленый – 2,3-дигидродихлорфлуоресцеин (АФК), красный – пропидия йодид (мертвые клетки), синий – Hoechst 33,342 (жизнеспособные клетки). Увеличение х 200.
Fig. 1. Accumulation of reactive oxygen species and viability of adipocytes in epicardial adipose tissue culture
Note: fluorescent staining. Dyes: green – 2,3-dihydrodichlorofluorescein (reactive oxygen species), red – propidium iodide (dead cells), and blue – Hoechst 33342 (viable cells). Magnification x 200.
Степень общего ожирения оценивали по уровню индекса массы тела (ИМТ), наличие и выраженность абдоминального ожирения определяли с помощью измерения окружности талии (ОТ).
Толщину ЭЖТ определяли с помощью эхокардиографии из парастернальной позиции по длинной оси левого желудочка в конце систолы [10]. Измерения проводили в течение трех сердечных циклов, за значение показателя тЭЖТ принимали среднее из трех последовательных величин.
Исследовали содержание общего холестерина, триглицеридов, холестерина липопротеинов высокой плотности (ХС-ЛВП), холестерина липопротеинов низкой плотности (ХС-ЛНП) (наборы ЗАО «Диакон-ДС», Россия). Концентрацию глюкозы определяли гексокиназным методом, процентное содержание HbA1c в крови иммунотур-бидиметрическим методом (DiaSys, Германия).
Статистический анализ полученных данных выполнялся с помощью пакета прикладных программ STATISTICA 10.0 (StatSoftInc., USA). Проверка нормальности распределения выборочных данных производилась по критерию Шапиро – Уилка. Для описания признаков с отличным от нормального распределением использовались медиана и межквартильный интервал. Категориальные данные описывались абсолютными ( n ) и относительными (%) частотами. Проверка значимости различий между количественными показателями в общей группе проводилась по критерию Уилкоксона. Для выявления статистически значимых различий в независимых группах использовался критерий Манна – Уитни для количественных показателей и хи-квадрат критерий Пирсона для категориальных показателей. Исследование корреляционных связей показателей проводилось с помощью коэффициента корреляции Спирмена. Все статистические гипотезы проверялись при критическом уровне значимости p = 0,05.
Результаты
В таблице 2 представлены изученные показатели гликемии и липидтранспортной функции крови в общей группе пациентов.
Таблица 2. Биохимические параметры в общей группе пациентов с хронической ишемической болезнью сердца и коронарным атеросклерозом ( n = 19)
Table 2. Biochemical parameters in the general group of patients with chronic coronary artery disease and coronary atherosclerosis ( n = 19)
|
Показатели Parameters |
Ме ( Q 25%; Q 75%) |
|
Базальная гликемия, ммоль/л Basal glycemia, mmol/L |
5,75 (5,15; 6,21) |
|
Постпрандиальная гликемия, ммоль/л Postprandial glycemia, mmol/L |
7,35 (5,70; 7,80) |
|
HbA1c, % |
6,35 (5,54; 6,92) |
|
Общий холестерол, ммоль/л Total cholesterol, mmol/L |
4,06 (3,22; 4,72) |
|
Триацилглицеролы, ммоль/л Triacylglycerols, mmol/L |
1,35 (1,09; 1,66) |
|
ХС-ЛНП, ммоль/л Low-density lipoprotein cholesterol, mmol/L |
2,12 (1,64; 2,67) |
|
ХС-ЛВП, ммоль/л High-density lipoprotein cholesterol, mmol/L |
1,05 (0,95; 1,23) |
Статистически значимых различий между уровнями продукции АФК адипоцитами ЭЖТ и ПЖТ не выявлено, медианы и межквартильные интервалы получились следующие: 1710 (1608; 2079) и 1876 (1374; 2215) усл. ед. соответственно (рис. 2).
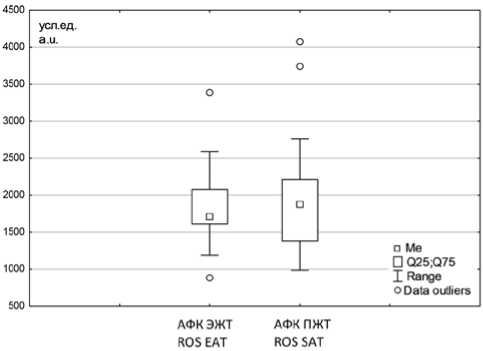
Рис. 2. Уровни продукции активных форм кислорода эпикардиальной и подкожной жировых тканей в общей группе пациентов с коронарным атеросклерозом ( n = 19)
Fig. 2. The levels of reactive oxygen species production by epicardial adipose tissue (EАT) and subcutaneous adipose tissue (SAT) in the general group of patients with coronary atherosclerosis ( n = 19)
Уровни продукции АФК адипоцитами ПЖТ не имели корреляционных связей с антропометрическими показателями ожирения, тЭЖТ и изученными биохимическими параметрами крови. Вместе с тем уровень выработки АФК адипоцитами ЭЖТ демонстрировал прямую корреляционную взаимосвязь с постпрандиальной гликемией
( r s = 0,62; p < 0,05, рис. 3), тогда как ассоциаций с ИМТ, ОТ, тЭЖТ и показателями липидтранспортной функции крови не определялось.
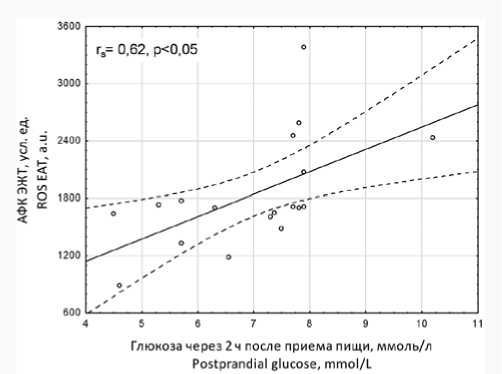
Рис. 3. Диаграмма рассеяния уровней продукции активных форм кислорода адипоцитами эпикардиальной жировой ткани относительно содержания в сыворотке крови постпрандиальной глюкозы у пациентов с коронарным атеросклерозом
Примечание: r s – коэффициент корреляции Спирмена.
Fig. 3. Scattering diagram of the level of ROS production by adipocytes of EAT relative to the serum level of postprandial glucose in patients with coronary atherosclerosis
Note: r s = Spearman’s correlation coefficient.
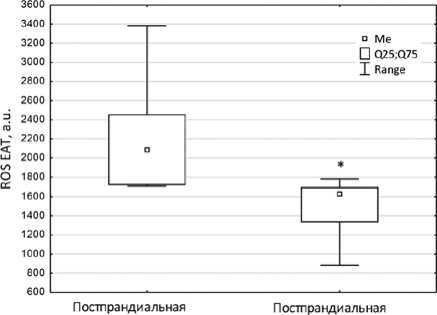
При индивидуальном анализе было установлено, что у пациентов с уровнем постпрандиальной гликемии выше 7,7 ммоль/л уровень продукции АФК адипоцитами ЭЖТ ( n = 9) статистически значимо превышал таковой у пациентов с более низкими значениями постпрандиальной гликемии ( n = 10) ( p = 0,015), рисунок 4.
е
глюкоза >7,7 ммоль/л
Postprandial glucose >7,7 тто1Д глюкоза <7,7ммоль/л Postprandial glucose <7,7 тто!Д
Рис. 4. Уровень продукции активных форм кислорода адипоцитами эпикардиальной жировой ткани у пациентов с коронарным атеросклерозом в зависимости от содержания в сыворотке крови постпранди-альной глюкозы более ( n = 9) и менее 7,7 ммоль/л ( n = 10): 2079 (1710; 2458) усл. ед. vs 1625,5 (1332; 1699) усл. ед. (* p = 0,015)
Fig. 4. The level of reactive oxygen species production by adipocytes of epicardial adipose tissue in patients with coronary atherosclerosis, depending on whether the content of postprandial glucose in the blood serum is more ( n = 9) or less than 7.7 mmol/L ( n = 10): 2079 (1710; 2458) vs. 1625.5 (1332; 1699) arbitrary units (* p = 0.015)
Среди пациентов с уровнем постпрандиальной глюкозы крови ≥ 7,7 ммоль/л имела место тенденция к более высокой доле больных сахарным диабетом 2-го типа, тог да как межгрупповых различий изученных нами показателей в зависимости от значений постпрандиальной гликемии выявлено не было (табл. 3).
Таблица 3. Сравнение клинических и биохимических характеристик пациентов с постпрандиальной гликемией более и менее 7,7 ммоль/л
Table 3. Comparison of clinical and biochemical characteristics in patients with postprandial glycemia of more and less than 7.7 mmol/L
|
Показатели Parameters |
Пациенты с постпрандиальной гликемией > 7,7 ммоль/л ( n = 9) Patients with postprandial glycemia >7.7 mmol/L ( n = 9) |
Пациенты с поспрандиальной гликемией < 7,7 ммоль/л ( n = 10) Patients with postprandial glycemia < 7.7 mmol/L ( n = 10) |
р |
|
Муж./жен., n (%) Gender (m/f), n (%) |
6 (66,7)/3 (33,3) |
8 (80)/2 (20) |
0,628 |
|
Возраст, лет Age, years |
66 (62; 67) |
59 (55; 64) |
0,173 |
|
Сахарный диабет, n (%) Diabetes mellitus, n (%) |
5 (83,3) |
1 (16,7) |
0,057 |
|
Индекс массы тела, кг/м2 Body mass index, kg/m2 |
31,3 (28,4; 33,3) |
29,1 (27,4; 31,2) |
0,374 |
|
Окружность талии, см Waist circumference, cm |
109 (102,5; 117) |
102,5 (92; 109) |
0,139 |
|
Толщина ЭЖТ, мм Epicardial adipose tissue thickness, mm |
4,9 (4,3; 5,6) |
4,53 (4,35; 5,10) |
0,374 |
|
Базальная гликемия, ммоль/л Basal glycemia, mmol/L |
6,0 (5,7; 6,6) |
5,5 (5,1; 5,8) |
0,208 |
|
Постпрандиальная гликемия, ммоль/л Postprandial glycemia, mmol/L |
7,85 (7,75; 7,90) |
6,30 (5,30; 7,30) |
< 0,001 |
|
Триацилглицеролы, ммоль/л Triacylglycerols, mmol/L |
1,37 (1,09; 1,78) |
1,17 (1,05; 1,32) |
0,214 |
|
ХС-ЛВП, ммоль/л High-density lipoprotein cholesterol, mmol/L |
1,02 (0,80; 1,23) |
1,05 (0,96; 1,18) |
0,859 |
|
ХС-ЛНП, ммоль/л Low-density lipoprotein cholesterol, mmol/L |
1,68 (1,60; 2,0) |
2,27 (1,75; 2,71) |
0,173 |
Обсуждение
Патогенетические механизмы окислительного стресса адипоцитов у пациентов с кардиометаболическими заболеваниями сложны, многокомпонентны и до настоящего времени изучены недостаточно. Аномальное образование АФК и окислительный стресс в жировой ткани рассматриваются в качестве одного из ключевых патологических звеньев в формировании и прогрессии сосудистой дисфункции и атеросклероза при ожирении.
В физиологических условиях АФК участвуют в гомеостатической передаче сигналов и опосредуют работу ключевых внутриклеточных сигнальных систем [11], а также обеспечивают постоянное обновление адипоцитов, принимая участие в процессах дифференцировки мультипотентных мезенхимальных стволовых клеток в зрелые адипоциты [12]. Имеются литературные данные и о двояком, разнонаправленном воздействии АФК в отношении функции и дисфункции адипоцитов у пациентов с сердечно-сосудистой патологией. Предполагается, что адипоциты способны приспосабливаться к динамическим изменениям уровней АФК и могут использовать их в качестве вторичных посредников. Так, например, пероксид водорода имитирует действие инсулина на адипоциты, что приводит к быстрой транслокации переносчиков глюкозы, увеличению поглощения глюкозы [13] и синтеза липидов [14], тогда как скорость липолиза снижается [15]. В исследовании K. Loh et al. (2009) сообщается о том, что АФК повышают чувствительность клеток к инсулину [16].
Связь ожирения и метаболического синдрома с развитием системного окислительного стресса продемонстрирована многими авторами в клинических и экспериментальных исследованиях [1–4]. Установлено, что уровень продукции АФК в адипоцитах висцерального жира пациентов с метаболическим синдромом был повышен в 5 раз в сравнении с группой контроля [3]. Авторы делают вывод о том, что метаболический синдром способствует окислительному стрессу в жировой ткани, главным образом, за счет активации уровня продукции АФК адипоцитами [3]. Вместе с тем установлено, что значительное возрастание интенсивности выработки АФК в изолированных адипоцитах мышей с метаболическим синдромом имеет место только в присутствии глюкозы. Этот факт не исключает того, что гипергликемия может являться одной из ведущих причин окислительного стресса клеток жировой ткани [5].
Предполагается, что вызванный ожирением окислительный стресс в жировой ткани имеет депо-специфи-ческие особенности, однако имеющиеся на этот счет ограниченные данные весьма противоречивы. Так, сообщается, что у пациентов с сердечно-сосудистыми заболеваниями ЭЖТ, без фасций прилежащая к коронарным артериям и миокарду, вырабатывает более высокий уровень АФК, чем ПЖТ [17]. В ходе протеомного анализа белков, участвующих в процессах окислительного стресса у пациентов с сердечно-сосудистыми заболеваниями, в адипоцитарной фракции ЭЖТ, в сравнении с таковой в ПЖТ, были обнаружены более высокий уровень продукции АФК и посттрансляционные модификации антиокси- дантных ферментов, тогда как различий между обеими стромально-сосудистыми фракциями в жировых депо обнаружено не было [17]. Вместе с тем E. Diozio et al. (2014) при использовании метода электронного парамагнитного резонанса и электронной спектроскопии установили, что и у пациентов с ИБС и у пациентов с патологией клапанов сердца уровень продукции АКФ был выше в ПЖТ, чем в ЭЖТ. А после коррекции данных на имеющиеся различия в зависимости от наличия ИБС уровень выработки АФК в ЭЖТ превышал таковой в ПЖТ только у пациентов с ИБС [18]. На основании генетического анализа ЭЖТ и ПЖТ, авторы установили, что увеличение интенсивности продукции АФК адипоцитами у пациентов с ИБС может иметь связь с транс-дифференцировкой от коричневой к белой жировой ткани.
Наше исследование показало, что интенсивность выработки АФК в ЭЖТ и ПЖТ у пациентов с выраженным коронарным атеросклерозом не имела существенных различий, однако именно в адипоцитах эпикардиального жирового депо уровень продукции АФК был взаимосвязан с ростом постпрандиальной гликемии, но не со степенью общего и абдоминального ожирения, а также с нарушениями липидтранспортной функции крови. Эти данные, впервые полученные нами в клинических условиях, подтверждаются результатами экспериментальных исследований. Так, I. Talior et al. (2003) установили, что в присутствии глюкозы уровень продукции АФК адипоцитами мышей с метаболическим синдромом почти в 2 раза превышал таковой у контрольных животных [5]. Продемонстрировано, что гипергликемия способствует продукции супероксиданио-на посредством активации метаболического пути внутри клетки, который включает диацилглицерол (ДАГ), протеин-киназу С и НАДФН-оксидазу (так называемый «опасный метаболический путь при диабете») [19]. Впоследствии супероксиданион, спонтанно или под влиянием супер- оксиддисмутазы, превращается в перекись водорода, приобретая способность проникать через клеточную мембрану и выделяться в окружающую среду [20].
Хотя в ряде исследований сообщается об участии АФК в формировании резистентности к инсулину и нарушений захвата глюкозы в культуре адипоцитов [21, 22], до настоящего времени причинно-следственная связь между уровнем продукции АФК адипоцитами жировой ткани и гипергликемией не изучена. В дальнейших клинических исследованиях представляется важным оценить потенциально благоприятное влияние коррекции постпран-диальной гипергликемии с помощью сахароснижающей терапии на интенсивность продукции АФК адипоцитами висцеральной жировой ткани у пациентов с документированным атеросклерозом независимо от наличия или отсутствия сахарного диабета 2-го типа, а также исследовать характер изменений метаболизма глюкозы и уровней продукции АФК адипоцитами под влиянием лечения антиоксидантами.
Заключение
Согласно полученным нами данным, у пациентов с хронической ИБС и выраженным коронарным атеросклерозом, подвергнутых операции коронарного шунтирования, интенсивность выработки АФК адипоцитами ЭЖТ и ПЖТ существенно не различается. Впервые показано, что уровень продукции АКФ адипоцитами ЭЖТ у пациентов с хронической ИБС и выраженным коронарным атеросклерозом имеет прямую связь с постпрандиаль-ной гликемией, но не с показателями общего, абдоминального ожирения и дислипидемией. Наиболее высокий уровень выработки АФК в адипоцитах ЭЖТ у пациентов с хронической ИБС и выраженным коронарным атеросклерозом имеет место при значениях постпрандиальной гликемии выше 7,7 ммоль/л.
Список литературы Уровень продукции активных форм кислорода адипоцитами эпикардиальной жировой ткани у пациентов с выраженным коронарным атеросклерозом взаимосвязан с возрастанием постпрандиальной гликемии
- Furukawa S., Fujita T., Shimabukuro M., Iwaki M., Yamada Y., Naka-jima Y. Increased oxidative stress in obesity and its impact on metabolic syndrome. J. Clin. Invest. 2004;114(12):1752-1761. DOI: 10.1172/ JCI21625.
- Wonisch W., Falk A., Sundl I., Winklhofer-Roob B.M., Lindschinger M. Oxidative stress increases continuously with BMI and age with unfavourable profiles in males. Aging Male. 2012;15(3):159-165. DOI: 10.3109/13685538.2012.66943.
- Hatami M., Saidijam M., Yadegarzari R. Peroxisome proliferator-ac-tivated receptor-ygene expression and its association with oxidative stress in patients with metabolic syndrome. Chonnam Med. J. 2016;52(3):201-206. DOI: 10.4068/cmj.2016.52.3.201.
- Prokudina E.S., Maslov L.N., Ivanov V.V., Bespalova I.D., Pismennyi D.S., Voronkov N.S. The role of reactive oxygen species in the pathogenesis of adipocyte dysfunction in metabolic syndrome. Prospects of pharmacological correction. Annals of the Russian Academy of Medical Sciences. 2017;72(1):11-16. DOI: 10.15690/vramn798.
- Maslov L.N., Naryzhnaya N.V., Boshchenko A.A., Popov S.V., Ivanov V.V., Oeltgen P.R. Is oxidative stress of adipocytes a cause or a consequence of the metabolic syndrome? J. Clin. Transl. Endocrinol. 2019;15:1-5. DOI: 10.1016/jjcte.2018.11.001.
- Talior I., Yarkoni M., Bashan N., Eldar-Finkelman H. Increased glucose uptake promotes oxidative stress and PKC-5 activation in adipocytes of obese, insulin-resistant mice. Am. J. Physiol. Endocrinol. Metab. 2003;285(2):E295-E302. DOI: 10.1152/ajpendo.00044.2003.
- Консенсус российских экспертов по проблеме метаболического синдрома в Российской Федерации: определение, диагностические критерии, первичная профилактика и лечение. Профилактическая медицина. 2010;13(5):27-32. Russian experts' consensus on metabolic syndrome problem in the Russian Federation: definition, diagnostic criteria, primary prevention, and treatment. Preventive Medicine. 2010;13(5):27-32 (In Russ.).
- Thalmann S., Juge-Aubry C.E., Meier C.A. Explant cultures of white adipose tissue. In: adipose tissue protocols. Methods Mol. Biol. 2008;456:195-199. DOI: 10.1007/978-1-59745-245-8_14.
- Suga H., Matsumoto D., Inoue K., Shigeura T., Eto H., Aoi N. et al. Numerical measurement of viable and nonviable adipocytes and other cellular components in aspirated fat tissue. Plast. Reconstr. Surg. 2008;122(1):103-114. DOI: 10.1097/PRS.0b013e31817742ed.
- Jacobellis G., Assael F., Ribaudo M.C. Epicardial fat from echocardiography: a new method for visceral adipose tissue prediction. Obes. Res. 2003;11(2):304-310. DOI: 10.1038/oby.2003.45.
- Sies H. Hydrogen peroxide as a central redox signaling molecule in physiological oxidative stress: oxidative eustress. Redox Biol. 2017;11:613-619. DOI: 10.1016/j.redox.2016.12.035.
- Lee H., Lee Y.J., Choi H., Ko E.H., Kim J. W. Reactive oxygen species facilitate adipocyte differentiation by accelerating mitotic clonal expansion. J. Biol. Chem. 2009;284(16):10601-10609. DOI: 10.1074/jbc. M808742200.
- Kono T., Robinson F.W., Blevins T.L., Ezaki O. Evidence that translocation of the glucose transport activity is the major mechanism of insulin action on glucose transport in fat cells. J. Biol. Chem. 1982;257(18):10942-10947. DOI: 10.1016/S0021-9258(18)33914-0.
- May J.M., de Haen C. Insulin-stimulated intracellular hydrogen peroxide production in rat epididymal fat cells. J. Biol. Chem. 1979;254(7):2214-2220. DOI: 10.1016/S0021-9258(17)30209-0.
- Little S.A., de Haen C. Effects of hydrogen peroxide on basal and hor-monestimulated lipolysis in perifused rat fat cells in relation to the mechanism of action of insulin. J. Biol. Chem. 1980;255(22):10888-10895. DOI: 10.1016/S0021-9258(19)70390-1.
- Loh K., Deng H., Fukushima A., Cai X., Boivin B., Galic S. et al. Re- 19. active oxygen species enhance insulin sensitivity. Cell Metab. 2009;10(4):260-272. DOI: 10.1016/j.cmet.2009.08.009.
- Salgado-Somoza A., Tejera-Fernández E., Luis Fernández Á., Ramón González-Juanatey J., Eiras S. Proteomic analysis of epicardial and 20. subcutaneous adipose tissue reveals differences in proteins involved in oxidative stress. Am. J. Physiol. Heart Circ. Physiol. 2010;299(1):H202-H209. DOI: 10.1152/ajpheart.00120.2010. 21.
- Dozio E., Vianello E., Briganti S., Fink B., Malavazos A.E., Scognami-glio E.T. et al. Increased reactive oxygen species production in epicardial adipose tissues from coronary artery disease patients is associat- 22. ed with brown-to-white adipocyte trans-differentiation. Int. J. Cardiol. 2014;174(2):413-414. DOI: 10.1016/j.ijcard.2014.04.045.
- Volpe C.M.O., Villar-Delfino P.H., dos Anjos P.M.F. Cellular death, reactive oxygen species (ROS) and diabetic complications. Cell Death Dis. 2018;9(2):119. DOI: 10.1038/s41419-017-0135-z.
- Han C.Y. Roles of reactive oxygen species on insulin resistance in adipose tissue. Diabetes Metab. J. 2016;40(4):272-279. DOI: 10.4093/ dmj.2016.40.4.272.
- Monickaraj F., Aravind S., Nandhini P. Accelerated fat cell aging links oxidative stress and insulin resistance in adipocytes. J. Biosci. 2013;38(1):113-122. DOI: 10.1007/s12038-012-9289-0.
- Houstis N., Rosen E.D., Lander E.S. Reactive oxygen species have a causal role in multiple forms of insulin resistance. Nature. 2006;440(7086):944-948. DOI: 10.1038/nature04634.


