Уровень тиамина плазмы крови и тиаминдефицитарные неврологические расстройства у пациентов, находящихся на программном гемодиализе
Автор: Хрулев А.Е., Шиянова Н.А., Голубева Д.В., Воробьева О.А., Мельникова Н.Б.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Нервные болезни
Статья в выпуске: 1 т.16, 2020 года.
Бесплатный доступ
Цель; исследовать уровень содержания тиамина в плазме крови пациентов, находящихся на длительном программном гемодиализе, и вариабельность диализ-ассоциированных потерь тиамина, изучить возможные тиаминдефицитарные неврологические расстройства у пациентов диализного периода. Материал и методы. Обследовано 85 пациентов, не принимавших витаминсодержащих препаратов в течение 1 года и более. Пациенты были разделены на основную группу и группу контроля. Основную группу составили 45 пациентов диализной стадии хронической болезни почек (стаж диализа 75,2±59,0 мес). Группа контроля (п=40) разделена на 2 подгруппы: 20 пациентов додиализного периода и 20 относительно здоровых лиц. Анализ уровня тиамина плазмы крови проводили методом высокоэффективной жидкостной хроматографии. Результаты. При анализе содержания тиамина в плазме крови пациентов основной группы обнаружены низкие уровни тиамина у всех пациентов. Исследуемый показатель не превышал 54% от нормы. Частота выявления выраженного дефицита тиамина составила 53,3%, умеренного дефицита 40% случаев, в 6,7% наблюдалась недостаточность тиамина плазмы крови. В 1-й контрольной подгруппе обнаруживалось менее выраженное снижение содержание тиамина, среднее значение составило 73,7±11,1%. Средний показатель содержания тиамина в плазме крови во 2-й контрольной подгруппе составил 92,2±4,1%. Заключение. Среди пациентов, находившихся на программном гемодиализе, отмечался дефицит тиамина и неврологический спектр нарушений, в том числе тиаминдефицитарная энцефалопатия и полиневропатия.
Витамин в1, полиневропатия, программный гемодиализ, тиамин, энцефалопатия
Короткий адрес: https://sciup.org/149135427
IDR: 149135427 | УДК: 616.892:616.8-009-616.61-78
Текст научной статьи Уровень тиамина плазмы крови и тиаминдефицитарные неврологические расстройства у пациентов, находящихся на программном гемодиализе
в проведении ЗПТ, из них 77,6% находятся на программном гемодиализе (ПГ).
При длительном диализном стаже в данной категории больных обсуждается вероятность развития дефицитарных нарушений витаминного и нутритивного статусов [2, 3]. В литературе описана возможность развития дефицитарных нарушений у диализных пациентов, которые обычно сопровождаются патологическими изменениями в периферической нервной системе (дистальная сенсомоторная поли- невропатия, мононевропатии, радикулопатии, плек-сопатии, миопатии) и в центральной (хронические дефицитарные энцефалопатии различной степени выраженности, энцефалопатия Вернике, центральный понтинный миелинолиз, фуникулярный миелоз).
Некоторые авторы считают, что во время процедуры ПГ происходит значительное увеличение потерь водорастворимых витаминов, в том числе тиамина [4, 5]. Дополнительные потери водорастворимых витаминов могут быть обусловлены их малой атомной массой (у тиамина 265,4 Дa) и свойством высокопоточных мембран диализаторов пропускать молекулы с атомной массой до 10000–15000 Да [6]. Другие авторы отрицают данный факт и сообщают о том, что потери водорастворимых витаминов, в том числе тиамина, во время процедуры ПГ не выявлялись или оказывались статистически незначимыми [2, 7]. Следовательно, вопрос о содержании водорастворимых витаминов в плазме крови диализных пациентов окончательно не решен и требует дальнейшего изучения.
Цель: исследовать уровень содержания тиамина в плазме крови пациентов, находящихся на длительном программном гемодиализе, и вариабельность диализ-ассоциированных потерь тиамина, изучить возможные тиаминдефицитарные неврологические расстройства у пациентов диализного периода.
Материал и методы. Набор пациентов осуществляли методом сплошной выборки среди больных, находившихся на амбулаторном лечении методом программного гемодиализа в 2018–2019 гг. в отделении гравитационной хирургии крови и гемодиализа Нижегородской областной клинической больницы им. Н. А. Семашко (ГБУЗ НОКБ им. Н. А. Семашко), а также в диализных центрах «Нефролайн-НН» и «Фесфарм-НН» (Нижний Новгород).
Критериями включения в исследование были: возраст от 18 до 85 лет; наличие терминальной стадии ХБП, корригируемой ПГ; стаж ПГ более 1 года. Критериями исключения участия пациентов в исследовании являлись: нахождение пациента и лечение ПГ менее 12 месяцев; самостоятельный прием тиамина (как в виде монотерапии, так и в составе поливитаминных комплексов) в течение предшествовавшего исследованию календарного года; неадекватная ЗПТ методом ПГ (Kt/V менее 1,2); наличие дисфункции сосудистого доступа и активного воспаления (СРБ более 7 мг/л); наличие активного злокачественного новообразования; неспособность обеспечить информированное согласие и данные о диетическом статусе.
В исследовании приняли участие 85 пациентов, из них 54 женщины (63,5%) и 31 мужчина (36,5%), не принимавших витаминсодержащих препаратов в течение 1 года и более. Пациенты были разделены на основную группу и группу контроля, сопоставимые по полу и возрасту. Основную группу составили 45 пациентов диализной стадии ХБП (31 женщина (68,9%) и 14 мужчин (31,1%)) в возрасте от 32 до 82 лет (средний возраст 58,3±13,3 года). Диализный стаж составил от 18 до 288 месяцев (75,2±59,0 мес.) (рис. 1).
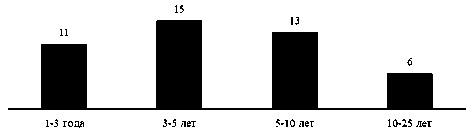
Рис. 1. Распределение пациентов основной группы по диализному стажу, абс.
Группа контроля (40 человек) в свою очередь разделена на 2 подгруппы: в 1-ю подгруппу контроля вошли 20 пациентов додиализного периода (ХБП 3–4-й стадии) (13 женщин (65%) и 7 мужчин (35%)) в возрасте от 33 до 70 лет (51,7±11,9 года); 2-ю подгруппу контроля составили 20 относительно здоровых лиц (10 мужчин, 10 женщин) в возрасте от 22 лет до 51 года (34,7±11,1 года), не имевших заболеваний почек.
Продолжительность сеанса ПГ составляла более 12 часов в неделю, скорость кровотока 280–300 мл/мин, диализата 420-450 мл/мин. Тип мембраны высокопоточный (коэффициент ультрафильтрации выше 40).
Образцы крови собирали непосредственно после сеанса ПГ в пробирки без добавок. Плазма была отделена посредством центрифугирования и проанализирована. Анализ уровня тиамина плазмы крови исследуемых проводили методом высокоэффективной жидкостной хроматографии (ВЭЖХ) на хроматографе LC-20 Prominance (Shimadzu, Japan) в обращенно-фазовом режиме с двухплунжерным насосом градиента низкого давления (LC-20AD), термостатом колонки (CTO-20AC), контроллером (CBM-20A) и матричным фотодиодным детектором УФ- и видимого спектров (SPD–M20A) (длины волн детектирования: 244, 270, 292, 360 нм) (температура 40°С, объем инжекции 20 мкл) [8].
На первом этапе работы (экспериментальная часть) проведена пробоподготовка, а именно: к 1 мл плазмы добавили 0,4 мл уксусной кислоты, 0,6 мл метанола, 0,05 мл трихлоруксусной кислоты. Образец центрифугировали в течение 5 минут при 3000 об/мин. После этого надосадочную жидкость пропускали через фильтр с диаметром пор 0,22 µm. Коэффициент, учитывающий разведение растворов, 2,05. Выполнены следующие условия хроматографирования: хроматографическая система, описанная выше; колонка Discovery® C18 HPLC Column, 5 μm particle size, length x I. D. 25 cm x 4.6 mm (Supelco); предколонка Discovery® C18 Supelguard™ Guard Cartridge Kit, 5 μm particle size, L x I. D. 2 cm x 4.0 mm (Supelco); обработка данных — Lcsolution; поток 0,7 мл/мин; подвижная фаза А30%-В70% v/v (А — метанол (200 мл), гексансульфоновая кислота 0,18 г, уксусная кислота 1 мл, В — вода); диодно-матричный детектор (длины волн детектирования: 244, 270, 292, 360 нм); температура 40°С; объем инжекции 20 мкл. Затем построен градуировочный график.
Приготовление стандартных растворов состояло из следующих этапов: А. 0,0207 г субстанции растворили в мерной колбе на 1 л; В. 2 мл раствора А развели в 2 раза водой; С. 1 мл раствора А развели в 4 раза водой (рис. 2).
Условия хроматографирования: колонка C18, 5 μm, 25 cm x 4.6 mm (Supelco); подвижная фаза А30%-В70% v/v (А — метанол (200 мл), гексансульфоновая кислота 0,18 г, уксусная кислота 1 мл, В — вода); скорость потока 0,7 мл/мин; температура 40°С; объем инжекции 20 мкл.
На втором этапе работы определена концентрация тиамина в плазме крови обследуемых лиц непосредственно после процедуры ПГ. Для тиамина гидрохлорида поправочный коэффициент (ПК) принят равным 0, 0005.
Проанализированы демографические и клинические данные (возраст, пол, стаж ПГ, наличие сопутствующей патологии). Данные факторы учитывались как влияющие на содержание тиамина в плазме крови. Данные анализов сравнивались с нормой содержания тиамина в плазме здорового человека: 1,7-11,4 нг/мл (6,6-43 нмоль/л).
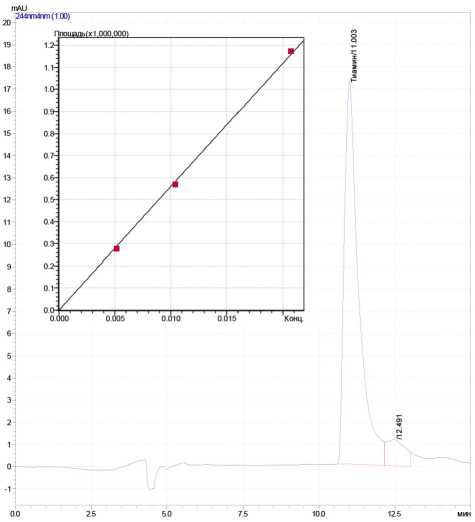
а) Хроматограмма стандартного образца тиамина гидрохлорида; время удерживания основного пика на хроматограмме — 11,03 мин, детектирование — 244 нм. На врезке представлена градуировочная зависимость площади пика (отн. ед.) от концентрации стандартной субстанции (мг/мл), уравнение градуировочной прямой y=56015670x, R2=0,9999
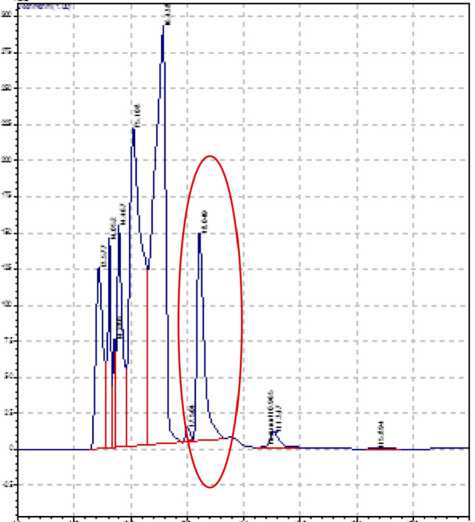
б) Типичная хроматограмма испытуемого образца плазмы после пробоподготовки (пациент З., 58 лет)
Рис. 2. Хроматографическое определение тиамина в плазме крови
Настоящее исследование проведено в соответствии с положениями Хельсинкской декларации и одобрено этическим комитетом Приволжского исследовательского медицинского университета. От каждого пациента получено информированное согласие.
Статистическую обработку данных проводили ретроспективно методом вариационной статистики с помощью компьютерных программ IBM SPSS Statistics и Microsoft Office Exсel. Для оценки статистической значимости различий между величинами использовали параметрический тест Колмогорова — Смирнова, непараметрический критерий Манна — Уитни, хи-квадрат Пирсона, Т-критерий Вил-коксона, t-критерий Стьюдента для малых выборок, признавая их статистически значимыми при p≤0,05. Для анализа номинальных данных использовались таблицы сопряженности. Числовые переменные выражены в виде абсолютных и относительных (%) чисел, а также как среднее арифметическое значение и стандартное отклонение, М±σ.
Результаты. Из 85 обследуемых только 17 пациентам (37,8%) когда-либо (в период более 1 года до включения в исследование) назначалась терапия тиамином (синоним витамин В1) или тиаминсодержащими препаратами. Остальные пациенты терапии тиамином и/или поливитаминными препаратами, нутрицевтиками никогда не получали.
При анализе содержания тиамина в плазме крови пациентов основной группы обнаружены низкие уровни витамина В1 у всех пациентов. Исследуемый показатель не превышал 54% от нормы (N=1,7-11,4 нг/мл). Частота выявления выраженного дефицита тиамина (менее 20% от нормы) у пациентов, получающих ПГ, составила 53,3% (24 человека), умеренного дефицита (от 20 до 50% от нормы) 40% случаев (18 человек), только у 3 пациентов (6,7%) наблюдалась недостаточность тиамина плазмы крови (данный показатель был выше 50% (в диапазоне от 50 до 54%)). Среди женщин, получавших ПГ (n=31), средний уровень тиамина составил 22,0±11,8%, у мужчин (n=14) из этой же группы 24,3±9,9%. Статистически значимых различий по половому признаку не выявлено, р>0,05.
В 1-й контрольной подгруппе (пациенты с ХБП 3–4-й стадии, сопоставимые по полу и возрасту с основной группой) также обнаруживалось снижение содержания тиамина, однако менее выраженное. В 100% случаев отмечался незначительный дефицит тиамина плазмы крови (показатели выше 50%), среднее значение составило 73,7±11,1%. Средний показатель содержания тиамина в плазме крови во 2-й контрольной подгруппе, в которую вошли относительно здоровые исследуемые более молодого возраста, составил 92,2±4,1%. При сравнении результатов содержания тиамина плазмы крови основной группы и подгрупп контроля выявлена статистическая значимая разница (p<0,001). Наглядное изображение содержания тиамина плазмы крови
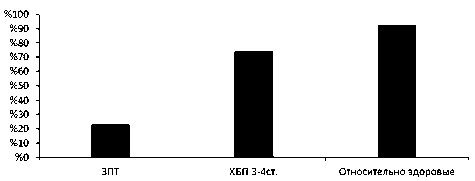
Рис. 3. Средние уровни (М) тиамина в исследованных группах, %:
ЗПТ — заместительная почечная терапия методом программного гемодиализа, основная группа; ХБП 3–4-й ст. — хроническая болезнь почек 3–4-й степени; 1-я подгруппа контроля; относительно здоровые — 2-я подгруппа контроля
Таблица 1
Частота недостаточности и дефицита тиамина в исследованных группах, абс. (%)
|
Уровень содержания тиамина плазмы крови |
Основная группа, n=45 |
1-я контрольная подгруппа, n=20 |
2-я контрольная подгруппа, n=20 |
|
Выраженный дефицит (<20% от нормы) |
24 (53,3%) |
– |
– |
|
Умеренный дефицит (20-49% от нормы) |
18 (40%) |
– |
– |
|
Недостаточность (50-99%) |
3 (6,7%) |
20 (100%) |
20 (100%) |
|
Таблица 2 |
|||
|
Средние значения (М) тиамина плазмы крови в исследованных группах |
|||
|
Уровень содержания тиамина плазмы крови |
Основная группа, n=45 |
1-я контрольная подгруппа, n=20 |
2-я контрольная подгруппа, n=20 |
|
Выраженный дефицит (<20% от нормы) |
14,8±3,3 |
– |
– |
|
Умеренный дефицит (20-49% от нормы) |
28,4±6,2 |
– |
– |
|
Недостаточность (50-99%) |
51,4±2,0 |
73,7±11,1 |
92,2±4,1 |
Таблица 3
Частота церебральных и периферических неврологических жалоб в основной группе, абс. и %
|
Показатель |
Отсутствие церебральных жалоб |
Наличие церебральных жалоб |
Отсутствие периферических неврологических жалоб |
Наличие периферических неврологических жалоб |
||||
|
абс. |
% |
абс. |
% |
абс. |
% |
абс. |
% |
|
|
Всего обследованных |
24 |
53,3 |
21 |
46,7 |
30 |
66,7 |
15 |
33,3 |
|
Женщины |
15 |
33,3 |
16 |
35,6 |
20 |
44,4 |
11 |
24,4 |
|
Мужчины |
9 |
20 |
5 |
11,1 |
10 |
22,2 |
4 |
8,9 |
и характеристик исследованных групп представлено на рис. 3. и в табл. 1, 2.
При анализе структуры причин развития ХБП в основной группе и 1-й подгруппе контроля установлено, что ведущими причинами являлись сахарный диабет (17 случаев (40%) в основной группе, 6 случаев (30%) в 1-й подгруппе), хронический гломерулонефрит (10 случаев (22,2%) и 5 случаев (25%) соответственно) и поликистоз почек (7 случаев (15,6%) и 3 случая (15%) соответственно).
При анализе частоты неврологических расстройств зафиксировано, что клинически выраженные церебральные жалобы (без использования прицельного нейропсихологического обследования, скрининговых когнитивных шкал и опросников) регистрировались в 46,7% случаев (n=21), жалобы со стороны периферической нервной системы (без использования дополнительных инструментальных методов обследования) регистрировались у 33,3% пациентов (n=15) (табл. 3).
Кроме того, необходимо отметить, что недостаточность тиамина и неврологические жалобы периферического характера чаще были ассоциированы с наличием у больных сахарного диабета (28,9%, n=13).
Обсуждение. В результате проведенного исследования выявлено значительное снижение уровня тиамина плазмы крови в группе пациентов, получавших ЗПТ методом ПГ В 93% исследованных случаев уровень тиамина плазмы крови непосредственно после процедуры диализа составил менее 50% от установленной нормы. Среди пациентов с ХБП 3–4-й ст. (1-я контрольная подгруппа) средний уровень тиамина составил более 73%. В группе относительно здоровых лиц (2-я контрольная подгруппа) данный показатель составил более 90%.
Механизмы выявленных диализ-обусловленных потерь тиамина недостаточно ясны. Возможно, они связаны с низкой молекулярной массой тиамина (266,4 Да), свойствами высокопоточных мембран диализаторов пропускать молекулы до 10–15 кДа и дополнительными потерями витамина В1 при его прохождении через диализную мембрану. Полученные результаты согласуются с наблюдениями в исследовании M. Jankowska et al. (2017) [9] . Кроме того, вероятный дефицит водорастворимых витаминов у больного, находящегося на ПГ, может быть объяснен особенностью диеты почечных больных, нарушениями всасывания тиамина в пищеварительном тракте и изменениями микробиома кишечника (например, вследствие использования фосфатсвязы-вающих препаратов для лечения гиперфосфатемии при ХБП), плохим аппетитом, депрессией и уремической анорексией, ограничением способности покупать и готовить пищу, а также потерями витаминов во время самой процедуры ПГ.
Отдельные немногочисленные исследования по содержанию витамина В1 у пациентов, находившихся на ЗПТ, сообщали об отсутствии тиаминдефи-цитарных расстройств в данной категории пациентов и/или о незначительном снижении концентрации витамина В1 в плазме крови [2, 7]. Данный факт может быть объяснен отличием дизайна и критериев вклю-чения/исключения в исследованиях, отличительными характеристиками тяжести пациентов (стаж диализа), анализируемых методов ЗПТ, взятием крови непосредственно после процедуры ПГ, исключением из исследования пациентов, ранее принимавших поливитаминные комплексы. Необходимо также отметить отсутствие в мировой литературе универсаль- ных подходов к определению пороговых значений для диагностики дефицита тиамина.
Настоящее исследование являлось малым одномоментным многоцентровым и имело ряд клинических, методологических и технических ограничений. В организме человека тиамин метаболизируется и существует в виде четырех форм: свободного тиамина, тиаминмонофосфата, тиаминдифосфата и тиаминтрифосфата. Тиамин и тиаминмонофосфат обнаруживаются вне- и внутриклеточно, тогда как тиаминдифосфат и тиаминтрифосфат обнаруживаются только внутриклеточно. В плазме крови присутствует только тиамин и тиаминмонофосфат. При ВЭЖХ плазмы крови и использовании диодно-матричного детектора, которые применялись в данном исследовании, тиамин и тиаминмонофосфат практически не разделяются, и в работе определялась именно их суммарная концентрация. Данные анализов сравнивались со следующей нормой содержания тиамина в плазме здорового человека: 1,7-11,4 нг/мл (6,6-43 нмоль/л). Другими высокочувствительными (альтернативными ВЭЖХ) методами диагностики ти-аминодефицита в плазме крови больных могут быть определение активности транкетолазы и тиаминдифосфата в эритроцитах крови [8].
Таким образом, в результате проведенного исследования показано низкое содержание витамина B1 в плазме крови пациентов, длительное время получавших лечение ПГ. В соответствии с данным выводом целесообразно рекомендовать дополнительный прием тиамина данной категории пациентов. Клиницисту необходимо учитывать, что период полувыведения тиамина составляет 9–18 дней, а потребление витамина В1 пациентами, получающими ПГ, составляет 300 мг/нед. в зависимости от пищевого рациона [3]. При этом водорастворимые витамины могут вводиться дополнительно как в конце процедуры ПГ, так и на ежедневной основе. Согласно Европейским практическим рекомендациям по питанию пациентов, получающих ПГ, данной категории пациентов необходимо дополнительно назначать 1,1–1,2 мг гидрохлорида тиамина в сутки [10].
Витамин В1 в нервной системе играет ключевую роль в метаболизме глюкозы и энергии. Известно, что в общей популяции длительный гиповитаминоз В1 может проявляться развитием дистальной сенсомоторной полиневропатии, мышечной дистрофии, когнитивных нарушений, энцефалопатии Вернике или корсаковского синдрома [3, 4], что было также косвенно подтверждено настоящим исследованием при анализе неврологических жалоб пациентов, длительное время находившихся на ПГ. Так как начальные признаки гиповитаминоза тиамина неспецифичны, особенно при наличии спектра коморбид-ных состояний (снижение аппетита, тошнота, апатия, утомляемость, раздражительность, нарушения сна), то вероятна клиническая целесообразность мониторинга уровня витамина В1 в плазме крови пациентов, находящихся на ПГ, с последующей его коррекцией.
Заключение. Среди пациентов с терминальной стадией ХБП, находящихся на ПГ, отмечается высокий риск развития дефицита различных водорастворимых витаминов и неврологических нарушений, в том числе дефицита витамина В1 и тиаминдефи-цитарной энцефалопатии и полиневропатии. Дефицит водорастворимых витаминов при терминальной стадии ХБП может развиваться на фоне традиционных ограничительных рекомендаций по питанию почечных больных в додиализном и диализном периодах, нарушений всасывания нутриентов в кишечнике и кишечного микробиоценоза, сопутствующих заболеваний, уремической анорексии, депрессии, ограничения способности покупать и готовить пищу, а также их чрезмерной потери с диализатом. Основываясь на проведенном исследовании, можно сделать вывод о необходимости пересмотра традиционных нутритивных подходов к данной категории пациентов с целью профилактики и лечения возможных неврологических нарушений. В Российской Федерации на сегодняшний день отсутствуют четкие рекомендации по оценке и коррекции дефицита витамина В1 у пациентов, получающих ЗПТ. Проведение дальнейших исследований в этой области поможет показать необходимость терапии препаратами витамина В1 данной группы пациентов, а также установить оптимальные дозы, режим и продолжительность лечения в этой популяции.
Список литературы Уровень тиамина плазмы крови и тиаминдефицитарные неврологические расстройства у пациентов, находящихся на программном гемодиализе
- Чепурина Н.Г., Кретов M.A. Оценка влияния кардоса на клиническое течение хронической сердечной недостаточности у больных с V стадией хронической болезни почек, находящихся на программном гемодиализе. Саратовский научно-медицинский журнал 2011; 7 (2): 422-6.
- Clase CM, Ki V, Holden RM. Water-Soluble Vitamins in People with Low Glomerular Filtration Rate or On Dialysis: A Review. Seminars in Dialysis 2013; 26 (5): 546-67.
- Tucker BM, Safadi S, Friedman AN. Is Routine Multivitamin Supplementation Necessary in US Chronic Adult Hemodialysis Patients?: A Systematic Review. Journal of Renal Nutrition 2015; 25 (3): 257-64.
- Kosmadakis G, Correia EC, Carceles O, et al. Vitamins in dialysis: who, when and how much? Renal Failure 2014; 36 (4): 638-50.
- Saka Y, Naruse T, Kato A, et al. Thiamine status in end-stage chronic kidney disease patients: a single center study. Int Urol Nephrol 2018; 50 (10): 1913-8.
- Oshvandi K, Kavyannejad R, Borzuo SR, Gholyaf M. High-flux and low-flux membranes: efficacy in hemodialysis. Nursing and midwifery studies 2014; 3 (3): e21764.
- Ubukata M, Amemiya N, Nitta K, Takei T. Serum thiamine values in end-stage renal disease patients under maintenance hemodialysis. International Journal or Vitamin and Nutrition Research 2016; 85 (56): 348-55.
- Таширова О.А., Раменская Г.В., Власов A.M., Хаитов М.Р. Разработка и валидация методики количественного определения тиамина в плазме крови методом жидкостной хроматографии с масс-детектором. Химико-фармацевтический журнал 2012; 46 (12): 46-8.
- Jankowska М, Rudnicki-Velasquez Р, Storoniak Н, et al. Thiamine Diphosphate Status and Dialysis-Related Losses in End-Stage Kidney Disease Patients Treated with Hemodialysis. Blood Purif 2017; 44: 294-300.
- Fouque D, Vennegoor M, Ter Wee P, et al. EBPG guidelines on nutrition 4: recommendation for vitamins, minerals and trace elements administration in MHD patients. Nephrol Dial Transplant 2007; 22 (2): 62-70.


