Ускорение регенерации костного дефекта глазницы путем модификации ксеногенного эластинового биоматериала
Автор: Лебедева А. И., Шангина О. Р., Нигматуллин Р. Т., Гареев Е. М., Кутушев Р. З.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Глазные болезни
Статья в выпуске: 2 т.17, 2021 года.
Бесплатный доступ
Цель: выявление морфологических аспектов замещения трансплантированных консервированных и модифицированных ксеногенных эластиновых биоматериалов в дефекте глазницы крысы. Материал и методы. Крысам породы Wistar наносили дефект верхней стенки глазницы размером 7х4 мм. В первой опытной группе (n=30) в зону дефекта помещен консервированный ксеногенный эластиновый биоматериал (кКЭБМ); во второй опытной группе (n=30) — модифицированный пористый ксеногенный эластиновый биоматериал (мКЭБМ). В контрольной группе (n=30) ушивали мягкие ткани. Иссечение тканей выполняли через 1, 3, 6 и 12 месяцев. Использовали гистологические методы. Результаты. Трансплантаты обладают остеоиндуктивными, остеокондуктивными свойствами и замещаются полноценным костным регенератом. После имплантации мКЭБМ замещался в 2 раза быстрее, чем кКЭБМ. В контрольной группе спустя 1 год костный дефект спонтанно не восстанавливался. Заключение. Ксеногенные биоматериалы на основе эластина являются полноценными биомиметиками. Пористость трансплантата значительно ускоряет течение процессов костной репарации.
Ксеногенный эластиновый биоматериал, регенерация, глазница, костная ткань
Короткий адрес: https://sciup.org/149135653
IDR: 149135653 | УДК: 611.018.; 43 616–003.935
Текст научной статьи Ускорение регенерации костного дефекта глазницы путем модификации ксеногенного эластинового биоматериала
1 Введение. Увеличение распространенности заболеваний костей, вызванных переломами, псевдоартрозами, остеопорозом и/или резекцией опухоли, порождает интерес к разработке новых биоматериалов с целью восстановления морфофункциональной целостности утраченной ткани и поиск терапевтических стратегий, направленных на стимулирование врожденного регенеративного потенциала разрушающихся тканей. Таким образом, тканевая инженерия представляет собой перспективную альтернативу реконструктивным хирургическим вмешательствам, особенно для восстановления костных дефектов, не регенерирующих спонтанно [1].
Биоматериалы на основе ксеногенного эластинового матрикса разработаны в качестве заменителей аутогенных трансплантатов из-за определенных противопоказаний последних (возможность повреждения донорского участка, риск инфекции и ограниченное количество доступного материала с удовлетворительными остеоиндуктивными свойствами). В этом контексте биомиметические костные заменители стали потенциальными материалами для клинического применения, поскольку они обладают хорошей биосовместимостью с окружающими тканями и химической стабильностью в жидкостных средах организма [2].
Очевидно, что эластиновый матрикс имеет высокий потенциал благоприятных клинических свойств ремоделирования с положительным биологическим ответом при репарации костной ткани. Однако пока недостает научных исследований, связанных с факторами роста, улучшением остеокондуктивных и остеоиндуктивных свойств.
Цель: выявление морфологических аспектов замещения трансплантированных ксеногенных эластиновых биоматериалов в дефекте верхней стенки глазницы крысы и определение способа оптимизации заживления раны путем модификации данного трансплантата.
Материал и методы. Для эксперимента использовали 90 крыс породы Wistar, которым наносили обширный дефект размером 7х4 мм в костях верхней стенки глазницы физиодиспенсером KaVo INTRASURG 1000 с наконечником 3 мм. Исследование выполнено в соответствии со стандартами Надлежащей клинической практики (Good Clinical Practice) и принципами Хельсинкской декларации. Протокол исследования одобрен этическим комитетом. В первой опытной группе (n=30) в зону дефекта помещен консервированный ксеногенный эластиновый биоматериал (кКЭБМ). Во второй опытной группе (n=30) в зону дефекта помещен модифицированный ксеногенный эластиновый биоматериал (мКЭБМ). Все дефекты были аналогичных размеров. Весь комплекс трансплантируемых тканей фиксировался к краям костного дефекта шелковой лигатурой диаметром 50 мкм. На кожу накладывались узловые швы. В контрольной группе (n=30) наносился аналогичный дефект, в котором послойно ушивали мягкие ткани. Иссечение аутопсийных тканей производили через 1, 3, 6 и 12 месяцев. КДЭМ изготовлен из
выйной связки (ligamentum nuchae (L. n.)) Bos taurus taurus L., 1758 и подвергался физико-химической обработке согласно разработанному протоколу (ТУ 42-2-537-87).
Для гистологического исследования ткани фиксировали в 10%-ном растворе нейтрального формалина, обезвоживали в серии спиртов возрастающей концентрации и заливали в парафин по общепринятой методике. Срезы готовили на микротоме LEICA RM 2145 (Германия), которые окрашивали гематоксилином и эозином, по Ван Гизону, по Маллори.
Для иммуногистохимического исследования парафиновые срезы толщиной 4 мкм окрашивали с помощью иммуногистостейнера Leica Microsystems Bond™ (Германия). В качестве первых антител применяли CD 68, c-kit, Thy-1, MMP-9, FGF-b, TGF-b, Col 3, Col 1, Pecam в разведении 1:300 (Santa Cruz Biotechnology, США). Для демаскировки использовали непрямую стрептавидин-биотиновую систему детекции Leica BOND (Novocastra™, Германия). Исследование и визуализацию препаратов выполняли с использованием светового микроскопа Leica DMD 108 (Германия).
Для электронно-микроскопического исследования из аутопсийных кусочков вырезали фрагменты тканей размером 1-2 мм 3 и фиксировали в 2,5%-ном растворе глютаральдегида, приготовленного на какодилатном буфере (рН 7,2–7,4) с дофиксацией в 1 %-ном растворе OsO4 на том же буфере. Материал обезвоживали в спиртах возрастающей концентрации и заливали в эпон-812 по общепринятой методике. Предварительно готовили полутонкие срезы на ультратоме ЕМ UС 7 (Leica, Германия) и окрашивали их раствором толуидинового синего на 2,5%-ном растворе безводной соды. На данных срезах выбирали участки для электронно-микроскопического исследования. Ультратонкие срезы контрастировали 2%-ным водным раствором уранил-ацетата, цитратом свинца по Рейнольдсу и изучали в трансмиссионном микроскопе JEM-1011 (Jeol, Япония).
Анализ данных осуществляли с использованием метода двухфакторного дисперсионного анализа и непараметрических методов: однофакторного дисперсионного анализа по Краскелу — Уоллесу и сравнения некоррелированных данных (при высокой аддитивности дисперсии) методом Манна — Уитни в программе Statistica 6,0 [3]. Производили подсчет медианы (Ме), (мин.; макс.) и квартилей (Q25; Q75).
Результаты. После физико-химической обработки кКЭБМ сохранял все структуры эластинового межклеточного матрикса, за исключением клеточных элементов. Они были элиминированы и не обнаруживались. Микрофибриллы и коллагеновые волокна, располагающиеся между центральными ядрами эластина, сохраняли поперечную периодическую исчерченность, что служило свидетельством сохранности четвертичной структуры белка. Волокна эластина имели одновекторное направление. Эластиновый фибриллин и коллагеновые волокна, заполняющие межволоконные пространства, окрашивались по Маллори в интенсивный синий цвет. Эластиновые волокна кКЭБМ имели гомогенную равномерную плотную консистенцию (рис. 1А).
С целью изучения динамики заместительной регенерации дефекта применена другая разновид-
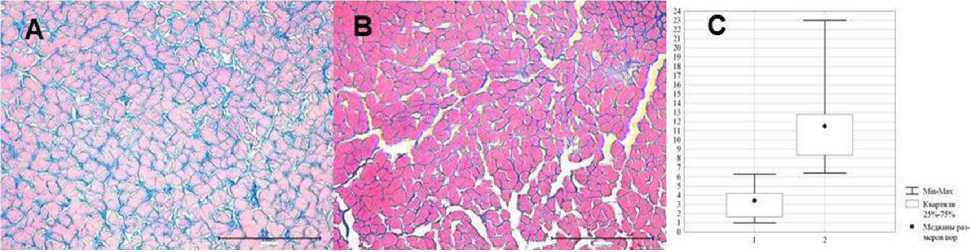
Рис. 1. Поперечный срез ксеногенного биоматериала:
А — консервированный ксеногенный эластиновый биоматериал; В — модифицированный ксеногенный эластиновый биоматериал. Окраска по Маллори; С — размер пор в биоматериале (поперечное сечение): по оси абсцисс: 1 — консервированный ксеногенный эластиновый биоматериал; 2 — модифицированный ксеногенный эластиновый биоматериал; по оси ординат — размер пор (мкм)
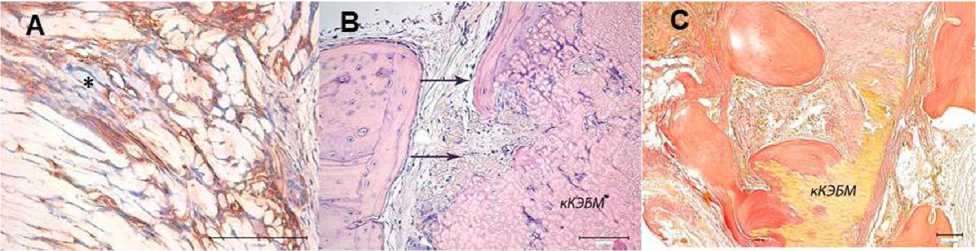
Рис. 2. Замещение консервированного ксеногенного эластинового биоматериала (кКЭБМ):
А — Pecam+ клетки в межволоконных пространствах и возле остеоидов (*) через 1 месяц. Непрямой иммунопероксидазный метод выявления Pecam с докраской гематоксилином; В — разрастание периоста и миграция клеток от материнской кости к биоматериалу (↑). Костная капсула вокруг кКЭБМ через 3 месяца. Окраска гематоксилином и эозином; С — фрагменты незамещенного кКЭБМ спустя 12 месяцев. Окраска по Ван Гизону
ность биоматериала, которая представляла собой аналогичную выйную связку крупного рогатого скота, но была подвергнута лиофилизации после предварительной гидратации. В результате получен пористый мКЭБМ с расширенными межволоконными пространствами в виде анастомозирующих между собой каналов одновекторного направления (рис. 1В).
Межволоконные пространства в кКЭБМ занимали: Ме=3,4 мкм (1–6,6; Q75<4,2 мкм. В мКЭБМ: Ме=11,5 мкм (6,4–23; Q 75>8,2мкм; Q 25>12,8 мкм; p<0,001; F=7,2; p<0,001; по критерию Манна — Уитни: Z=5,5; p<0,001) (рис. 1С).
Экспериментально проанализированы хронологические стадии замещения двух видов трансплантатов и охарактеризован характер восстановления дефекта стенки глазницы. Так, спустя 1 месяц после пересадки кКЭБМ в тканевом ложе отмечались признаки разрастания рыхлой волокнистой соединительной ткани в межволоконные пространства биоматериала в центростремительном направлении, в составе которых наблюдались незрелые коллагеновые волокна, относящиеся к коллагену III типа (Col 3), сеть гемокапилляров с Pecam+ позитивными эндотелиоцитами и макрофагально-фибробластические, остеогенные и малодифференцированные клетки. Лимфоциты встречались редко. Иммуногистохимически выявлялись MMP-9+, CD 68+, FGFb+, TGF-b+, c-kit+ и Thy-1+ клетки. В краевой зоне дефекта обнаруживались небольшие костные островки: остеоиды, окруженные остеобластами и Pecam+ клетками (рис. 2А).
Через 3 месяца после проведенной операции в ткани выявлялись признаки продолжающегося замещения кКЭБМ соединительнотканно-костным регенератом. Постепенно трансплантат лизировался, деградировал, фагоцитировался макрофагами. Со стороны материнской кости выявлялись признаки разрастания волокнистой соединительной ткани надкостницы и миграции периостальных остеогенных клеток в ее составе в сторону кКЭБМ (рис. 2В).
Новообразованная костная ткань в виде костной капсулы окружала биоматериал, он был инкрустирован костной тканью по периферии. Новообразованная кость постепенно разрасталась вглубь трансплантата и дифференцировалась. Определялась остеонная структура кости с наличием костных пластинок. Пластины формировали гаверсовы каналы, в которых выявлялась рыхлая волокнистая соединительная ткань и остеогенные клетки.
Спустя 12 месяцев после операции обнаруживался регенерат, состоящий из дифференцированной костной ткани, в которой присутствовали все ее составляющие структурные элементы: костные лакуны с замурованными остеоцитами, сеть гаверсовых и фолькмановских каналов с васкуляризированной рыхлой волокнистой соединительной тканью, полости с красным костным мозгом. Однако в костном регенерате определялись зоны сохранившегося незамещенного эластинового волокнистого матрикса (рис. 2С). Поэтому нельзя в полной мере утверждать, что в данном сроке состоялась завершенная полноценная реституция дефекта и остеогенез, индуцированный кКЭБМ.
В контрольной группе без применения биоматериала спустя 1 месяц после операции отмечались признаки оппозиционного остеогенеза со стороны материнской кости. Однако на протяжении всего экс-
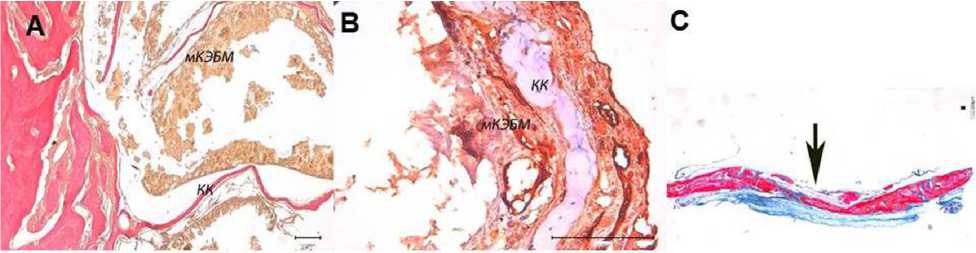
Рис. 3. Замещение модифицированного ксеногенного эластинового биоматериала (мКЭБМ):
А — грубоволокнистая костная ткань через 3 месяца. Костные каллусы (КК), деградированный мКЭБМ. Окраска по Ван Гизону; В — интенсивная инфильтрация СD68+ клетками (коричневое окрашивание цитоплазмы) мКЭБМ спустя 3 месяца. Непрямой иммунопероксидазный метод выявления CD68 с докраской гематоксилином; С — заполнение дефекта костной тканью (↑) спустя 6 месяцев после пересадки мКЭБМ. Окраска по Маллори
перимента дефект оставался открытым. Через 12 месяцев наблюдений костная ткань не формировалась на всей площади раны глазницы. В районе дефекта разрасталась волокнистая соединительная ткань.
Через 1 месяц после проведенной операции с применением мКЭБМ в зоне дефекта выявлялись признаки активного ремоделирования. Сам биоматериал подвергался интенсивному лизису и резорбции со стороны макрофагальных клеток и замещался волокнистой соединительной тканью с наличием большого количества фибробластических клеток. Наряду с формированием волокнистой соединительной ткани на месте трансплантата выявлялись признаки аппозиционного и апикального роста костной ткани со стороны краев костного дефекта.
Спустя 3 месяца в месте дефекта выявлялась грубоволокнистая костная ткань, представленная костными балками в виде утонченных длинных костных каллусов, которые отрастали от материнской кости и глубоко прорастали в межволоконные полости трансплантата. Каллусы находились в окружении рядов остеобластов (рис. 3А).
Прогениторные c-kit+ клетки обнаруживались как в периваскулярных зонах кровеносных сосудов, так и в непосредственной близости с костными трабекулами. Параллельно с процессом остеогенеза продолжались ферментативная деградация, лизис и фагоцитоз биоматериала макрофагами в большом количестве и разрастание грануляционной ткани (рис. 3В).
Через 6 месяцев фрагменты мКЭБМ не определялись. Параллельно с формированием новообразованной ретикулофиброзной костной ткани имеющиеся костные балки утолщались и трансформировались в плотные костные пластины с системой гаверсовых и фолькмановских каналов, содержащие рыхлую волокнистую соединительную ткань. Формировались костные полости, в которых определялся красный костный мозг. Новообразованная ретикуло-фиброзная костная ткань постепенно трансформировалась в губчатую кость. В конечном итоге костный регенерат заполнял всю площадь дефекта глазницы в данном сроке, включая центральную зону (рис. 3С).
При исследовании пропускной способности клеток c-kit и CD 68, участвующих в ремоделировании трансплантатов и инфильтрировавших в межволоконные промежутки обоих видов биоматериалов, выявлены определенные закономерности. Так, сравнение численности клеток c-kit+ с использованием непараметрического критерия Манна — Уитни показало следующее. В группе с кКЭБМ изменения
Min-Max
Квартили 25%-75%
Медианы группы кКЭБМ Min-Max
Квартили 25%-75%
Медианы группы мКЭБМ
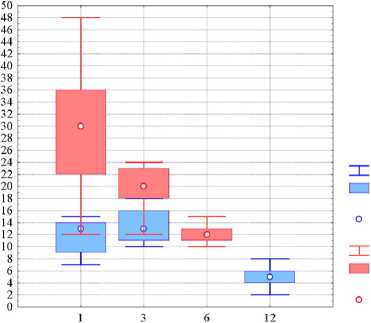
Рис. 4. Количество с-kit+ клеток в группах животных с использованием кКЭБМ и мКЭБМ в разные сроки наблюдения. По оси абсцисс — сроки наблюдения (месяцы); по оси ординат — численность c-kit+ клеток в полях зрения численности клеток через 1 и 3 месяца было статистически незначимо (р>0,05) Через 12 месяцев их количество значимо снижалось (p<0,001), что связано с затуханием реактивных клеточных процессов и формированием стабильного регенерата, представленного костной тканью и фрагментами незамещенного трансплантата.
После использования мКЭБМ численность c-kit+ клеток в течение 6 месяцев статистически значимо снижалась (для 1-го и 3-го месяца р<0,05), для 3-го и 6-го месяцев р<0,05). Между экспериментальными группами различия оказались статистически значимы по всем срокам наблюдения.
Через 1 месяц в группе мКЭБМ Ме=30 клеток (Q75>22 клеток), а в группе кКЭБМ Ме=13 клеток (Q75>15) (p<0,001). К 3-му месяцу в группе с мКЭБМ Ме=20 (Q75>18), а в группе кКЭБМ также Ме=13 (Q75%>18) при р<0,001. К 6-му месяцу в группе мКЭБМ Ме=12 клеток (10; 15). В группе кКЭБМ к 12-му месяцу Ме=5 клеток (2; 8) Так, в модифицированном трансплантате выявлено значительно большее количество искомых клеток в полях зрения (рис. 4).
Численность CD 68+ клеток также после применения мКЭБМ на всех сроках наблюдения оказывалась многократно выше, чем в группе с кКЭБМ. При этом в группе с мКЭБМ численность таких клеток к 3-му месяцу почти удваивалась, но к 6-му месяцу падала, что связано в полноценной резорбцией трансплантата в ткани. В группе с применением кКЭБМ чис-
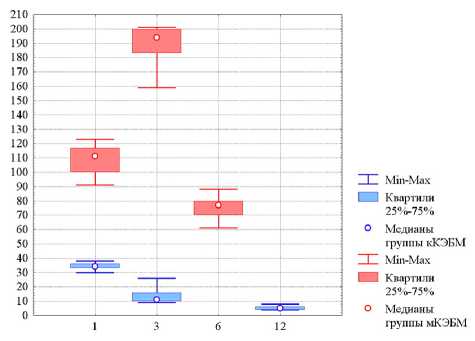
Рис. 5. Содержание CD 68+ клеток в группах животных с использованием кКЭБМ и мКЭБМ в разные сроки наблюдения. По оси абсцисс — сроки наблюдения (месяцы); по оси ординат — численность клеток в поле зрения ленность таких клеток значимо снижалась и к 12-му месяцу становилась в 7 раз ниже, чем в 1-й месяц (Ме=5 клеток против Ме=35 клеток) (рис. 5).
Следовательно, спустя 12 месяцев после операции трансплантации консервированного ксеногенного эластического биоматериала в дефект верхней стенки орбиты крысы обнаруживалась его неполноценная репарация костной тканью. В регенерате сохранялись фрагменты незамещенного биоматериала и незавершенный остеогенез.
Через 6 месяцев после трансплантации модифицированного ксеногенного эластического биоматериала замещение завершалось тотальным восстановлением всего дефекта глазницы органотипичным костным регенератом; мКЭБМ при прочих равных условиях замещался в 2 раза быстрее, чем кКЭБМ.
Обсуждение. Морфологически эластические волокна состоят из центрального ядра, представленного эластином, по периферии окруженного сетью микрофибрилл. Эта сеть состоит в основном из фибриллина, секреторного гликопротеина с молекулярной массой 350 кДа, который связывается или с самим собой, или с другими компонентами внеклеточного матрикса (ВКМ). Микрофибриллы служат, в частности, в качестве каркаса для отложения эластина и сборки эластических волокон. Микрофибриллы также влияют на доступность активного TGF-b во ВКМ [4].
В предыдущей работе рассмотрена экспериментальная модель трансплантации кКЭБМ направленного действия и изучены специфические физические и молекулярно-клеточные механизмы его замещения органотипичной костной тканью, а также отмечена способность стимулировать остеобластическую дифференцировку in vivo в дефекте верхней стенки глазницы крысы [5]. В настоящей работе представлена попытка оптимизировать условия репарации объемного повреждения костей глазницы и ускорить сроки ее восстановления путем модификации имеющегося трансплантата. В частности, основное внимание уделено оценке биоактивности продуктов деструкции эластинового биоматериала.
Все дефекты, заполненные биоматериалами, демонстрировали не хроническую воспалительную реакцию или реакцию на инородное тело, а биосов-местимые взаимодействия с молекулярными и клеточными процессами, происходящими в естествен- ном клеточном микроокружении. Этот факт может быть объяснен химическими процессами физико-химической обработки, используемой для изготовления эластинового матрикса, полученного из выйной связки крупного рогатого скота. Данный метод обработки позволяет удалять примеси и клетки, предотвращая тем самым любой тип иммунного отторжения коллагена при имплантации в ткань хозяина. Данное исследование показало, что все виды трансплантатов биодеградировали, вызывая интенсивную макрофагально-фибробластическую реакцию, результатом которой явилось формирование волокнистой соединительной ткани, представленной толстыми зрелыми пучками коллагеновых волокон. Так, эластолиз высвобождал эластиновые пептиды, которые являлись хемотаксическими для моноцитов/макрофагов CD 68+ и фибробластов.
Помимо этого, эластиновые биоматериалы были инфильтрированы клетками с профиброгенной и ангиогенной направленностью, активно участвовавшими в образовании и ремоделировании регенерата. Наличие ММР-9 требуется для эластиндеградации и кальцификации, а нокаутные ММРs были устойчивы к повреждению аорты и не развивали дегенерацию и кальцификацию эластина [6] Предполагают, что одновременная экспрессия MMPs и TGF-1 может способствовать кальцификации эластина через механизм положительной обратной связи [7].
В процессе заживления переломов костей FGFs участвует в ключевых стадиях последовательных клеточных и молекулярных каскадов. Эффекты FGFs в основном сосредоточены на пролиферации мезенхимальных клеток, он является мощным митогеном для фибробластов и преостеобластов [8].
В краевой зоне обнаруживались небольшие костные островки — остеоиды, окруженные остеобластами и Pecam+ эндотелиальными клетками. Можно предположить, что прогениторные c-kit+ и Thy-1+ клетки могли иметь либо гематогенное, костномозговое происхождение, либо являлись муральными клетками кровеносных сосудов. Плюрипотентные мезенхимальные стволовые клетки являются пластичными. Это позволяет им дифференцироваться в нескольких направлениях: остео-, хондро-, фибробласты, адипоциты и т. д. Формирование остеоидов обусловлено сложным взаимодействием как локальных, так и системных факторов, инициирующих повышенную активность остеобластов и преимущественную дифференциацию плюрипотентных мезенхимальных клеток в остеобласты, образующие кость. Сигналом для запуска этого процесса является травматическое повреждение. Для формирования эктопической кости, по теории J. Chalmers и соавт., необходимо наличие трех факторов: остеогенных предшественников, индуцирующего агента и подходящей среды [9]. Разрастание надкостницы и миграция остеогеннных клеток со стороны материнской кости в направлении эластинового биоматериала служило также одной из составляющих пула остеопрогениторных клеток. Прогениторные клетки надкостницы имеют выраженное направление дифференцировки в костную ткань [10]. Остеогенез происходил эндесмально, причем как центростремительно, от краев хирургической раны, так и центробежно из остеогенных островков, которые закладывались клетками соединительной ткани в дефектах, заполненных биоматериалом. В краевой зоне участки незрелой кости были выстланы остеобластами, в то время как в периферической зоне внешней границы тканевого ложа имелась зре- лая кость, формирующая хорошо разграниченный наружный трабекулярный край.
Остеоиндуктивным фактором также могли служить механические особенности биоматериала — упругодеформационные и прочностные свойства. Жесткий каркас часто индуцирует мезенхимные стволовые клетки и прогениторные костные клетки развиваться в направлении минерализации [11]. Как показано ранее, кКЭДМ имеет значительно более высокое значение модуля упругости, чем мКЭДМ [12]. Несмотря на это, модификация биоматериала и его пористость позволили значительно ускорить репаративное замещение костного дефекта стенки глазницы. Новообразованные коллагеновые волокна имели вектор направленности, ориентированный параллельно предшествующим эластиновым волокнам. Пористость мКЭБМ позволила увеличить пропускную способность для фагоцитарных и проге-ниторных клеток c-kit, что способствовало синхронизированию скорости биодеградации и остеогенеза, приведшему к полноценной и быстрой регенерации костного дефекта спустя 6 месяцев после пересадки. Несмотря на высокую скорость резорбции трансплантата, скорость остеогенеза (синтеза, пролиферации, миграции, индукции остеогенных клеток) оказалась адаптирована и сопряжена с деградацией биоматериала. В противовес этому можно заключить, что спустя 12 месяцев после трансплантации кКЭБМ незамещенные зоны эластина все еще сохранялись.
Можно предположить, что регенерирующая кость образуется не только из краев старой кости, а из элементов соединительной ткани, малодифференцированных клеток под влиянием веществ, выделяющихся из трансплантата. Л. В. Полежаев считал, что индуцирующий фактор не имеет видовой специфичности. Он ткане-, но не органоспецифичен [13]. Воспаление при повреждении костной ткани индуцирует выработку цитокинов, которые в свою очередь стимулируют ангиогенез и индуцируют остеопрогениторные клетки к высвобождению костных морфогенетических белков, способствующих остеогенной дифференцировке [14]. Однако в контрольной группе завершенного остеогенеза не произошло.
В этом контексте использование материалов, полученных из эластина, в качестве заменителя кости представляет интерес в тканевой инженерии из-за таких характеристик этого структурного белка, как способность к коацервации тропоэластина, высокая эластичность, механическая стабильность в хирургическом ложе и биологическая активность сигнализации и молекулярной индукции пептидов, полученных в результате деградации эластина [15]. Основным компонентом эластина является тропо-эластин, который состоит в основном из неполярных аминокислот, расположенных в чередующихся гидрофобных и гидрофильных доменах и усиливает остеобластную дифференцировку стромальных стволовых клеток [16].
Известно, что TGF-β1 в сочетании с эластиновыми пептидами дозозависимым образом индуцирует остеогенез в гладкомышечных клетках и фибробластах кожи путем активации специфического эластинламининового рецептора — 1 и сверхэкспрессии трех репрезентативных остеогенных маркеров, а именно RUNX2, ALP и OCN. Кроме того, эти компоненты также увеличивают клеточную продукцию ММР, что может еще больше усугубить деградацию эластина и высвобождение растворимых эластиновых пептидов. Известно, что эластин имеет сайты связывания кальция. Это, в свою очередь, может привести к эластин-специфической кальцификации [17].
Заключение. Таким образом, кКЭБМ и мКЭБМ обладают остеоиндуктивными, остеокондуктивными свойствами. Модификация трансплантата, его пористость позволяют двукратно сократить сроки заместительной регенерации дефекта верхней стенки глазницы крысы полноценным костным регенератом. Использование ксеногенных трансплантатов на основе эластинового матрикса является одним из перспективных направлений в регенеративной медицине. Направленная регенерация, доступность биоматериалов, управление скоростью замещения, хемоаттракция аутогенных прогениторных стволовых клеток и их остеогенная дифференциация, ангиогенез, биосовместимость с тканями реципиента позволяют рассматривать эластиновые биоматериалы как полноценные биомиметики для реконструктивных операций восстановления костных дефектов.
Список литературы Ускорение регенерации костного дефекта глазницы путем модификации ксеногенного эластинового биоматериала
- Echave MC, Burgo LS, Pedraz JL, et al. Gelatin as Biomaterial for Tissue Engineering. Curr Pharm Des 2017; 23: 3567–84. 10.2174 / 0929867324666170511123101.
- Munhoz MAS, Pomini KT, Plepis AMG, et al. Elastinderived scaffolding associated or not with bone morphogenetic protein (BMP) or hydroxyapatite (HA) in the repair process of metaphyseal bone defects. PLoS One 2020; 15 (4): e0231112. DOI: 10.1371 / journal. pone. 0231112.
- Benerji A. Medical statistics in clear language. M.: Practicheskaya medicina, 2007; 287 p. Russian (Бенержи А. Медицинская статистика понятным языком. М.: Практическая медицина, 2007; 287с.).
- Willeke FD, Quaglinob D. Signaling pathways in elastic tissues. Cellular Signalling 2019; 63: 109364. URL: https:// doi.org / 10.1016 / j. cellsig. 2019.109364.
- Lebedeva AI, Nigmatullin RT, Kutushev RZ. Morphological aspects of restoration of the rat eye socket defect by biomaterial based on elastin. Saratov Journal of Medical Scientific Research 2020; 16 (2): 614–8. Russian (Лебедева А. И., Нигматуллин Р. Т., Кутушев Р. З. Морфологические аспекты восстановления дефекта глазницы крысы биоматериалом на основе эластина. Саратовский научно-медицинский журнал 2020; 16 (2): 614–8).
- Basalyga DM, Simionescu DT, Xiong W, et al. Elastin degradation and calcification in an abdominal aorta injury model: role of matrix metalloproteinases. Circulation 2004; 110: 3480–7.
- Yu Q, Stamenkovic I. Cell surface-localized matrix metalloprotein-ase-9 proteolytically activates TGF-beta and promotes tumor invasion and angiogenesis. Genes Dev 2000; 14: 163–76.
- Komaki H, Tanaka T, Chazono M, et al. Repair of segmental bone defects in rabbit tibiae using a complex of betatricalcium phosphate, type I collagen, and fibroblast growth factor-2. Biomaterials 2006; 27: 5118–26.
- Chalmers J, Gray DH, Rush J. Observations on the induction of bone in soft tissues. J Bone Joint Surg Br 1975; 57 (1): 36–45.
- Ivanov AA, Danilova TI, Popova OP, et al. The periosteum as a source of progenitor osteogenic cells for the restoration of resorbed alveolar bone. Russian Journal of Stomatology 2016, 4: 39–42. Russian (Иванов А. А., Данилова Т. И., Попова О. П. и др. Надкостница как источник прогениторных стеогенных клеток для восстановления резорбированной альвеолярной кости. Российская стоматология 2016, 4: 39–42. DOI: 10.1711 6 / rosstomat20169439-42).
- Ngai D, Lino M, Bendeck MP. Cell-Matrix Interactions and Matricrine Signaling in the Pathogenesis of Vascular Calcification. Front Cardiovasc Med 2018; 5: 174.
- Kutushev RZ, Nigmatullin RT, Musina LA, et al. Anatomical and biomechanical justification of the graft for reconstructive surgery of the bone walls of the eye socket. Saratov Journal of Medical Scientific Research 2020; 16 (2): 610–4. Russian (Кутушев Р. З., Нигматуллин Р. Т., Мусина Л. А. и др. Анатомическое и биомеханическое обоснование трансплантата для восстановительной хирургии костных стенок глазницы. Саратовский научно-медицинский журнал 2020; 16 (2): 610–4).
- Polezhaev LV. Regeneration by induction. Moscow: Medicine, 1977; 184 p. Russian (Полежаев Л. В. Регенерация путем индукции. М.: Медицина, 1977; 184 с.).
- Crespo AR, Da Rocha AB, Jotz GP, et al. Increased serum sFas and TNFalpha following isolated severe head injury in males. Brain Inj 2007; 21 (4): 441–7. DOI: 10.1080 / 02699050701311125.
- Ragnoni E, Palombo F, Green E, et al. Coacervation of α-elastin studied by ultrafast nonlinear infrared spectroscopy. Phys Chem Chem Phys 2016; 18: 27981–90.
- McCarthy B, Yuan Y, Koria P. Elastin-like-polypeptide based fusion proteins for osteogenic factor delivery in bone healing. Biotechnol Prog 2016; 32 (4): 1029–37. DOI: 10.1002 / btpr. 2269.
- Sinha A, Vyavahare NR. High-glucose levels and elastin degradation products accelerate osteogenesis in vascular smooth muscle cells. Diab Vasc Dis Res 2013; 10 (5): 410–9. DOI: 10.1177 / 1479164113485101.


