Усовершенствование методики определения уровня имидаклоприда в кормах методом высокоэффективной жидкостной хроматографии
Автор: Хайруллин Д.Д., Ямалова Г.Р., Халикова К.Ф., Алеев Д.В., Егоров В.И., Шангараев Н.Г.
Статья в выпуске: 3 т.231, 2017 года.
Бесплатный доступ
Одним из главных мероприятий по обеспечению безопасности животноводческой продукции от загрязненности является необходимость разработки высокочувствительных и доказательных методов их определения в объектах ветнадзора. Авторами усовершенствован метод определения остаточного количества имидаклоприда в кормах растительного происхождения методом высокоэффективной жидкостной хроматографии.
Неоникотиноиды, имидаклоприд, высокоэффективная жидкостная хроматография
Короткий адрес: https://sciup.org/14288982
IDR: 14288982 | УДК: 543.544.054
Текст научной статьи Усовершенствование методики определения уровня имидаклоприда в кормах методом высокоэффективной жидкостной хроматографии
Одним из достижений химии пестицидов являются неоникотиноиды – перспективная группа инсектицидов, рекомендуемая как компонент схем ротации инсектицидов, имеющими сельскохозяйственное значение [8]. В токсикологическом отношении они являются нервно – паралитическими ядами и по классификации ВОЗ относятся к веществам II и III класса опасности [2]. По механизму токсического действия неоникотиноиды относятся к селективным агонистам никотиновых рецепторов постсинаптических мембран нейронов [4, 7].
В настоящее время одним из доступных методов физико-химического анализа признан метод высокоэффективной жидкостной хроматографии, который получил наибольшее применение в химикотоксикологических исследованиях отделов лабораторий [6].
В связи с увеличением ассортимента и масштабов применения пестицидов в сельскохозяйственной практике, а так же загрязнением окружающей среды промышленными и бытовыми отходами, актуальность проблемы безопасности продуктов питания с каждым годом возрастает [1, 4].
Известен способ определения имидаклоприда в яблоках, сливах и винограде, включающий экстракцию имидаклоприда хлороформом, последующую очистку экстрактов от коэкстрактивных веществ смесью ацетона с гексаном на колонке с оксидом алюминия, выпаривание, нанесение элюента ацетоном на пластинки для хроматографии «Силуфол» или «Сорбфил» с последующей разгонкой в разных системах подвижных растворителей, идентификацию реагентами ортотолидином либо раствором бромфенолового синего и лимонной кислоты. Диапазон определяемых концентраций 0,2-0,5 мкг, предел обнаружения 0,07 мг/кг. Процент определения составляет 73-84% [5].
Исходя из этого, целью наших исследований являлось усовершенствование способа определения остаточного количества имидаклоприда в кормах растительного происхождения методом высокоэффективной жидкостной хроматографии.
Материалы и методы. Для приготовления элюентов и растворов анализируемых соединений использовали: имидаклоприд, аналитический стандарт с содержанием 98% д.в., ацетон (о.с.ч., ТУ 6-09-3513-86), ацетонитрил для ВЭЖХ (х.ч., ТУ 6-09-3534-87), бидистиллированную воду, этилацетат (ГОСТ 8981), в качестве поглотителя влаги из экстракционных проб растительного материала использовали натрий сернокислый безводный (ч., ГОСТ 4166-76).
Усовершенствование метода индикации имидаклоприда проводилось на основе «МУК по определению количеств имидаклоприда в зеленой массе, зерне и соломе зерновых культур» (Утверждено 18. 01. 2005, № 4.1. 1949-05). Объектами исследования служили искусственно контаминированные образцы зерна овса. Экспериментальное конта-минирование испытуемого материала пестицидом проводили из расчета МДУ, что составило - 2 мкг/мл. Экстракцию и очистку экстрактов проводили по методике, разработанной в отделе токсикологии, с помощью патронов «Sep-Pak».
Определение остаточного количества имидаклоприда осуществляли в лаборатории химического анализа на жидкостном хроматографе «WATERS», оснащенный колонкой ReproSil-PurODS-AC18 250х4 мм с диаметром частиц 5 мкм; устройства ввода пробы до 50 мкл; термостата колонок, обеспечивающего температуру нагрева до 50°С; УФ – детек- тора, позволяющего регистрацию при длине волны 270 нм; блока сбора хроматографических данных; компьютера с установленным программным обеспечением.
Результаты исследований. С учетом базисных методик определения остаточного количества имидаклоприда в растительном материале применяли экстракцию с использованием ацетона и воды, которая характеризовалась недостаточной воспроизводимостью. В ходе экспериментов установили, что лучшие результаты при определении остаточного количества имидаклоприда в объектах растительного происхождения дает усовершенствованная нами методика, с применением патронов «Sep-Pak» и экстракции исследуемых проб ацетонитрилом.
Усовершенствование методики определения имидаклоприда в растительном материале с использованием высокоэффективной жидкостной хроматографии осуществляли следующим образом. Навеску измельченного зерна (овес) массой 10 г помещали в коническую колбу емкостью 100 см3 и экстрагировали 40мл ацетонитрила на ультразвуковой установке в течение 15 мин. Суспензию фильтровали через бумажный фильтр «красная лента». Экстракцию повторяли дважды порциями по 30 мл. Объединенные экстракты зерна промывали гексаном в делительных воронках дважды по 25 мл, встряхивая смесь каждый раз в течение 1-2 мин и собирали нижний органический слой.После этого экстракты выпаривали досуха на ротационном испарителе при температуре не вы- ше 40°С. Сухой остаток в колбе, полученный при упаривании, количественно переносили двумя порциями смеси гексан – этилацетат (60:40, по объему) по 2 мл каждая в подготовленный концентрирующий патрон «Sep-Pak». Промывали патрон 5 млэлюента № 1, который отбрасывали. Экстракт элюировали с 10 мл этилацетата со скоростью 2 см3/мин. Полученный раствор выпаривали досуха на вакуумном ротационном испарителе. Для определения оптимальных условий экстракции на ротационном испарителе проводили исследования при различных температурных режимах водяной бани в пределах от 40 до 50°С и отрицательном давлении в колбе испарителя 0,7- 0,8 атм. Соблюдение этих условий гарантирует минимальные потери определяемого пестицида. Сухой остаток растворяли в 2 мл подвижной фазы для ВЭЖХ и 20 мкл раствора вводили в жидкостный хроматограф.
Установлены условия хроматографирования методом ВЭЖХ:
Колонка: ReproSil-Pur ODS-AC18
250х4 мм, 5 мкм.
Температура колонки – 25оС.
Мобильная фаза: ацетонитрил: вода (30:70).
Объем пробы – 20 мкл.
Длина волны – 269 нм.
При этих условиях получали острые симметричные пики имидаклоприда. Время удерживания имидаклоприда составляет 8.38 мин. (рис.)
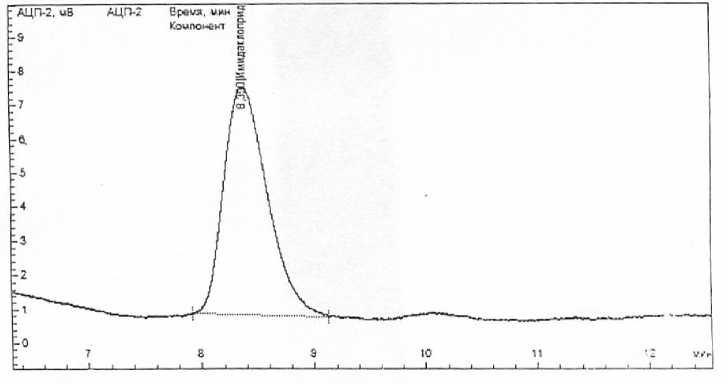
Рисунок – Хроматограмма имидаклоприда
Содержание имидаклоприда в образце С х (мкг/кг) определяли по формуле:
С х = C х ^ КО^ X 1000, где:
С i – концентрация по калибровочным графикам, мкг/мл;
V кон – конечный объем экстракта, мл;
g – навеска анализируемого образца, г;
1000 – коэффициент перевода с г на кг;
f – полнота извлечения имидаклоприда, %.
Заключение. Таким образом, усовершенствован способ определения имидаклоприда в растительном материале с примене-нением патрона «Sep-Pak» и экстракции исследуемых проб ацетонитрилом. Усовершенствованная методика легко воспроизводима и экономична в осуществлении. Степеньизвле-чения имидаклоприда при использовании данного метода составила 73,3%.
УСОВЕРШЕНСТВОВАНИЕ МЕТОДИКИ ОПРЕДЕЛЕНИЯ
Резюме
Одним из главных мероприятий по обеспечению безопасности животноводческой продукции от загрязненности является необходимость разработки высокочувствительных и доказательных методов их определения в объектах ветнадзора. Авторами усовершенствован метод определения остаточного количества имидаклоприда в кормах растительного происхождения методом высокоэффективной жидкостной хроматографии.
Список литературы Усовершенствование методики определения уровня имидаклоприда в кормах методом высокоэффективной жидкостной хроматографии
- Бойко, Т.В. Клиникоморфологические проявления острого отравления птиц неоникотиноидами/Т.В. Бойко, М.Н. Гонохова//Вестник ветеринарии. -2012. -№ 4. -С. 103-106.
- Еремина, О.Ю. Перспективы применения неоникотиноидов в сельском хозяйстве России и сопредельных стран/О.Ю. Еремина. Ю.В. Лопатина//Агрохимия. -2005. -№ 6. -С. 87-93.
- Илларионов, А.И. Токсичность и степень опасности неоникотиноидов для медоносной пчелы А.И. Илларионов//Агрохимия. -2008. -№ 10. -С. 74-81.
- Мандич, А.И. Определение инсектицида имидаклоприда в картофеле и луке методом высокоэффективной жидкостной хроматографии/А.И. Мандич. С.Д. Лазич, Ш.Н. Окреш, Ф.Ф. Гаал//Аналитическая химия. -2005. -№ 12. -С. 1273-1278.
- Методические указания по определению имидаклоприда в яблоках, сливах и винограде методом тонкослойной хроматографии. Сборник № 30. -Киев, 2001. -С.63-68.
- МУК 4.1. 1949-05. Определение количеств имидаклоприда в зеленой массе, зерне и соломе зерновых культур (Утверждено 18. 01. 2005). Availableat: http//www.iprosoft.ru.
- Рославцева, С.А. Неоникотиноиды -новая перспективная группа инсектицидов/С.А. Рославцева//Агрохимия. -2000. -№ 1. -С. 49-52.
- Вао Х. Determination of Imidacloprid and triazole mixture of HPLC//Veterinary journal London England. -2005. -№ 3. -P. 297-304.


