Усовершенствование технологии культивирования вирусов парагриппа-3 и инфекционного ринотрахеита для изготовления ассоциированных вакцин КРС
Автор: Каримуллина И.Г., Гумеров В.Г., Яруллин А.И., Мухаммадиев Р.С., Мингалеев Д.Н., Сорокина Д.А.
Статья в выпуске: 3 т.259, 2024 года.
Бесплатный доступ
Представлены сравнительные результаты исследований стационарного и роллерного культивирования вирусов инфекционного ринотрахеита (ИРТ) и парагриппа-3 (ПГ-3) на перевиваемых линиях культуры клеток МДВК (почка теленка) и ТР (трахея эмбриона коровы). Показано, что максимальный титр инфекционной активности исследуемых вирусов достигался при роллерном способе культивирования: для ИРТ на культуре клеток МДВК при использовании среды Игла МЭМ с добавлением 1 % глутамина, для ПГ-3 − на культуре клеток ТР с использованием среды, состоящей из 50 % ГЛА, 40 %, Игла МЭМ и 10 % среды 199. При этом инфекционная активность вирусов составила соответственно 7,9-8,3 lg ТЦД50/мл и 7,2-8,5 lg ТЦД50/мл.
Культура клеток, инфекционный ринотрахеит, парагрипп-3, крупный рогатый скот (КРС)
Короткий адрес: https://sciup.org/142242518
IDR: 142242518 | УДК: 619:57.085.23:578.825:578.831 | DOI: 10.31588/2413_4201_1883_3_259_78
Текст научной статьи Усовершенствование технологии культивирования вирусов парагриппа-3 и инфекционного ринотрахеита для изготовления ассоциированных вакцин КРС
Массовое выращивание вирусов животных в культуре клеток представляет собой центральное звено любого технологического процесса, основанного на использование клеток животных, и прежде всего производство вирусных препаратов [8]. Данная стадия обуславливает массу и качество клеток и, как следствие, технологию получения вирусного сырья. Выбор подхода выращивания вируса в существенной мере связан со способностью клеток размножаться на поверхности плотного субстрата или суспензии [6, 12].
Несмотря на последние достижения в развитии клеточной биотехнологии, получение вирусного сырья на перевиваемых линиях клеток для противовирусных препаратов к настоящему времени испытывает определенные трудности [6]. Широко распространенный способ пристеночного культивирования клеток в матрасах в связи с малой производительностью и большой трудоемкостью малопригоден для промышленного применения [4-7]. На сегодняшний день самым эффективным способом получения в больших объемах вирусной биомассы для изготовления биопрепаратов является использование суспензионной культуры клеток [8]. К высокопродуктивному суспензионному выращиванию приспособлено несколько клеточных линий животных (ВНК-21/13,
ПТП, ППК-66Б), спектр чувствительности которых весьма специфичен, поэтому они не всегда удовлетворяют имеющиеся требования [1, 6].
Последующие исследования были направлены на поиск способов получения вирусной суспензии, выращенных на микроносителях, позволяющие получать вирусную суспензию в короткие сроки, в больших объемах и с высокой инфекционной активностью [13]. Тем не менее, культивирование клеток на микроносителях обусловлено необходимостью использования весьма сложных методов пересева клеток, контроля за их ростом, подготовки носителей и освобождения от последних псевдосуспензии [1]. Все это снижает общую рентабельность производства, несмотря на незначительное повышение конечной плотности популяции клеток. В этом плане наиболее универсальным является роллерный способ выращивания клеток в круговом монослое. Однако он требует детальной отработки режимов выращивания для конкретных клеточных линий с целью обеспечения максимальной реализации их ростового потенциала [1, 3, 4, 6, 9, 11].
Цель исследования – изыскание наиболее эффективной технологии выращивания культур клеток для получения биомассы вирусов ПГ-3 и ИРТ с высокой инфекционной активностью.
Материал и методы исследований. Для создания ассоциированных вакцин, в состав которых входят антигены ПГ-3 и ИРТ КРС, требовалось, в первую очередь, изучить чувствительность первичных и перевиваемых линий культур клеток к штаммам «ТК-А (ВИЭВ)-В2» вируса ИРТ и «ПТК-45/86» вируса ПГ-3, полученных из государственной коллекции микроорганизмов ФГБНУ «ФЦТРБ-ВНИВИ». В предварительных опытах по выбору культуры клеток было установлено, что наиболее перспективными для репродукции указанных вакцинных штаммов вирусов являются перевиваемые клетки почки (МДВК) и трахеи (ТР) эмбриона коровы.
В экспериментах по отработке оптимального метода выращивания вирусов ИРТ и ПГ-3 КРС исследованы следующие параметры: время формирования получаемого монослоя, начальная посевная концентрация клеток, доза заражения, сроки проявления максимального цитопатического действия, состав питательной среды. Репродукцию штаммов вирусов проводили с применением перевиваемых линий культур клеток МДВК и ТР стационарным и роллерным методами. При этом осуществляли учет коэффициента заполнения роллерных бутылей, скорости их вращения, рН среды и температуры культивирования, продолжительности выращивания, количества пассажей клеток и вирусов.
При выращивании культур клеток животных в качестве ростовой среды применяли следующие питательные среды: ГЛА, 199, Игла MEM с внесением 1 % L-глютамина, 10 % сыворотки крови КРС и гентамицина в концентрации 50 мкг/мл. Для поддержания культур клеток после заражения использовали вышеуказанные среды без сыворотки. Для культивирования клеток и вирусов использовали матрасы объемом 1500 мл (стационарное выращивание) и бутыли объемом 2500 мл «типа четверть» (роллерное культивирование на промышленной установке). После каждого опыта инфекционную активность вирусной биомассы определяли методом микротитрации на 96-луночных планшетах, культуры клеток инкубировали в инкубаторе во влажной атмосфере с концентрацией СО 2 5 % в течение 48-96 ч (в зависимости от репродукции вирусов). Инфекционный титр вирусов рассчитывали методом Рида и Менча. Контроль культуры клеток и штаммов вирусов ИРТ и ПГ-3 на возможную контаминацию микоплазмами осуществляли высевом их на бульон, используя триптический перевар сердца КРС.
Результат исследований . В таблице 1 представлены результаты исследований по установлению оптимальных условий получения высокоактивной биомассы штаммов вирусов ИРТ и ПГ-3 КРС с целью изготовления ассоциированной вакцины.
Таблица 1 – Параметры, влияющие на накопление вирусов, при различных способах культивирования
|
Способ культивирования |
Концентрация клеток при посеве, тыс/см3 |
Время формирования получаемого монослоя, сут. |
Доза вируса для заражения, ТЦД 50 /мл на клетку |
Время выращивания вируса, час. |
|
Штамм вируса «ПТК-45/86» ПГ-3 на культуре клеток ТР |
||||
|
Стационарный |
110-120 |
2-3 |
0,2-0,4 |
96-110 |
|
Роллерный |
110-120 |
2-3 |
0,4-0,8 |
96-110 |
|
Штамм вируса «ТК-А (ВИЭВ)-В2» ИРТ на культуре клеток МДВК |
||||
|
Стационарный |
110-120 |
2-3 |
0,2-0,3 |
48-60 |
|
Роллерный |
110-120 |
2-3 |
0,3-0,5 |
48-64 |
Максимальный титр инфекционной активности исследуемых вирусов достигался методом роллерного культивирования и для вируса ПГ-3 составил 7,9-8,3 lg ТЦД50/мл и для вируса ИРТ – 7,2-8,5 lg ТЦД50/мл (Рисунок 1). При этом вирусы репродуцировали с коэффициентом заполнения сосудов 0,170,19 и скорости их вращения 10-11 об/ч. Для инфицирования клеточного монослоя использовали вирус ПГ-3 в дозе 0,6±0,2 ТЦД50/мл на клетку и вирус ИРТ - 0,4±0,1 ТЦД50/мл на клетку.
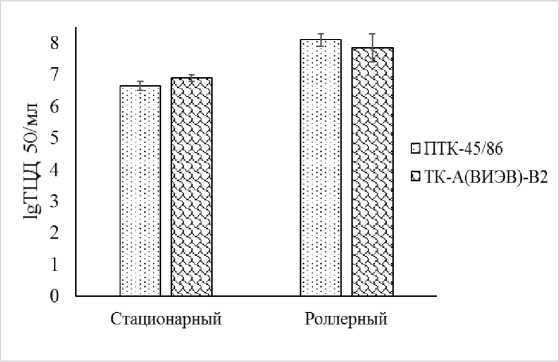
Рисунок 1 – Инфекционная активность штаммов вирусов ПГ-3 и ИРТ КРС при различных способах выращивания
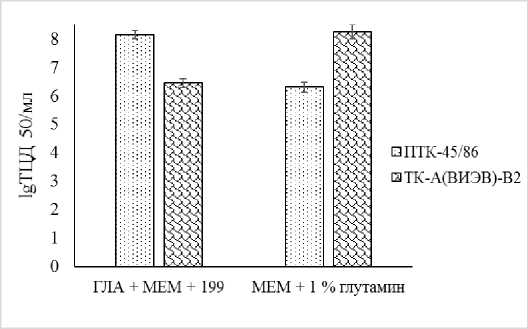
Рисунок 2 – Влияние состава питательной среды на репродукцию штаммов вирусов ПГ-3 и ИРТ КРС
Основными параметрами, которые определяют уровень накопления вирусов в монослое клеток, являются концентрация водородных ионов (рН) и температура культивирования. Наши исследования показали хорошую репродукцию вирусов ПГ-3 и ИРТ при температуре 37±0,5 ˚С и рН 7,2±0,2. При более низких или высоких значениях рН (5,0 и 9,0) и температуры (35 и 39 ˚С) активность вирусов была ниже на 0,3-1,24 lg ТЦД 50 /мл.
На жизнеспособность клеток линии ТР и выращивание в ней вируса ПГ-3 существенное влияние оказывал состав питательной среды (Рисунок 2).
Применение поддерживающей питательной среды, состоящей из 10 % среды 199,40 % Игла МЭМ и 50 % ГЛА, в культуре клеток линии ТР увеличивало урожайность вируса ПГ-3 до 8,0-8,3 lg ТЦД 50/мл, в то время как поддерживающая среда Игла МЭМ с добавлением 1% глутамина в культуре клеток МДВК не обеспечивало накопление титра вируса ПГ-3 на достаточно высоком уровне. При репродукции вируса ИРТ на культуре клеток МДВК с поддерживающей средой Игла МЭМ и добавлением 1 % глутамина наблюдали повышение инфекционного титра до 8,08,5 lg ТЦД 50/мл. Следует отметить, что замена вышеуказанной среды на смешанную среду (50 % ГЛА, 40 % Игла МЭМ и 10 % среды 199) снижала инфекционную активность на 1,35±0,15 lg ТЦД 50/мл.
Следует отметить, что присутствие в питательных средах смеси антибиотиков (пенициллина и стрептомицина) в рекомендуемой дозе предотвращало контаминацию культур клеток бактериальной микрофлоры и не оказывало влияния на конечный титр вирусов.
Заключение. Результаты изучения условий роллерного культивирования перевиваемых линий клеток МДВК и ТР, которые отобраны по признакам высокой чувствительности и репродуцирующей способности к штаммам вирусам ИРТ и ПГ-3, позволяют получить высокоактивные антигены для возможности конструирования ассоциированной вакцины.
Список литературы Усовершенствование технологии культивирования вирусов парагриппа-3 и инфекционного ринотрахеита для изготовления ассоциированных вакцин КРС
- Бабак, В. А. Оптимальные режимы культивирования линии клеток ВНК-21 (С-13) / В. А. Бабак, Ю. В. Ломако, А. А. Гусев [и др.] // Ученые записки учреждения образования Витебская ордена Знак почета государственная академия ветеринарной медицины. – 2011. – Т. 47. – № 2-1. – С. 7-11.
- Гумеров, В. Г. Факторы, влияющие на репродукцию вирусов в культуре клеток / И. Г. Каримуллина, А. К. Галиуллин, Э. М. Плотникова [и др.] // Ученые записки Казанской государственной академии ветеринарной медицины им. Н.Э. Баумана. – 2018. – Т. 234. – № 2. – С. 83-86.
- Демидчик, Г. А. Технология выращивания вакцинного штамма ТК-А вируса ИРТ КРС для изготовления инактивированной вакцины / Г. А. Демидчик // Ветеринария. Реферативный журнал. – 1999. – № 1. – С. 41.
- Закутский, Н. И. Разработка и совершенствование технологии изготовления инактивированной вакцины против инфекционного ринотрахеита крупного рогатого скота: дис. на соиск. учен. степ. канд. вет. наук: 06.02.02 / Закутский Николай Иванович; Всероссийский научно-исследовательский институт ветеринарной вирусологии и микробиологии РАСХН. − Покров, 1998. – 311 с.
- Закутский, Н. И. Технология выращивания вакцин штамма ТК-А вируса ИРТ КРС для изготовления инактивированной вакцины / Н. И. Закутский // Ветеринария. – 1997. – № 2. – С. 23-25.
- Каримуллина, И. Г. Оптимизация технологии культивирования вирусов парагриппа-3, инфекционного ринотрахеита и хламидий при разработке ассоциированной вакцины: дис. на соиск. учен. степ. канд. биол. наук: 03.00.07 / Каримуллина Ильсияр Габделгазизовна; Всеросс. науч.-исслед. вет. ин-т. – Казань, 2004. – 133 с.
- Каримуллина, И. Г. Исследование репродуктивных свойств вирусов инфекционного ринотрахеита и парагриппа-3 крупного рогатого скота на различных линиях культур клеток / И. Г. Каримуллина, В. Г. Гумеров, А. И. Яруллин [и др.] // Инновационные решения актуальных вопросов биобезопасности: сборник материалов Международной научно-практической конференции. – Казань: Издательство Альянс. – 2022. – С. 187-191.
- Колокольцова, Т. Д. Культуры клеток человека и животных: выделение, культивирование, криоконсервация и контроль / Т. Д. Колокольцова, И. Н. Сабурина, А. А. Кубатиев // Патогенез. – 2015. – Т. 13. – № 2. – С. 50-65.
- Осипова, Н. И Роллерная технология культивирования вируса парагриппа-3 (ПГ-3) / Н. И. Осипова // Ветеринария. Реферативный журнал. – 2002. – № 2. – С. 406.
- Самуйленко, А. Я. Оптимизация процесса промышленного культивирования культуры клеток ВНК-21/13-13 для производства вакцин против ящура, болезни ауески и бешенства / А. Я. Самуйленко, Н. В.Мельник, С. А. Гринь [и др.] // Ветеринарный врач. – 2018. – № 1. – С. 24-28.
- Юрков, С. Г. Универсальная роллерная технология культивирования перевиваемых клеток животных / С. Г. Юрков, А. Н. Курносов, С. А. Витина [и др.] // Ветеринария. − 1995. − № 9. − С. 29-34.
- Dill, V. Influence of cell type and cell culture media on the propagation of footand- mouth disease virus with regard to vaccine quality / V. Dill, B. Hoffmann, A. Zimmer [et al.] // Virology Journal. – 2018. – Vol. 15. - № 1. – Р. 46-57.
- Griffiths, B. Scale-up of suspension and anchorage-dependent animal cells / B. Griffiths // Molecular Biotechnology. – 2001. – Vol. 7. – № 3. – Р. 225-238.


