Успешное хирургическое лечение герминогенной опухоли средостения на фоне химиорезистентности
Автор: Хакимов Г.А., Хакимова Г.Г.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Клинический случай
Статья в выпуске: 3 т.13, 2023 года.
Бесплатный доступ
Тератома средостения является редкой первичной локализацией герминогенной опухоли. Мы представляем случай успешного хирургического лечения 24-летнего мужчины с гигантской незрелой тератомой средостения, осложненной выраженными кардиореспираторными расстройствами.
Средостение, незрелая тератома
Короткий адрес: https://sciup.org/140303413
IDR: 140303413 | DOI: 10.18027/2224-5057-2023-13-3-64-71
Текст научной статьи Успешное хирургическое лечение герминогенной опухоли средостения на фоне химиорезистентности
Внегонадные герминогенные опухоли (ВГО) встречаются редко и составляют 3–10% всех герминогенных новообразований гонадной локализации [1,2]. Наиболее часто они развиваются в медиастинальной и забрюшинной областях, поэтому диагноз ставится лишь после исключения метастазов в этих зонах. У больных первичными ВГО средостение поражается в 50% случаев, но от общего числа истинных герминогенных опухолей яичка и яичников первичная их локализация в средостении редка — всего 1–5% [3–5]. Внегонадные герминогенные новообразования средостения возникают в любом возрасте, однако пик заболеваемости приходится на возраст 20–35 лет [6–8]. ВГО средостения имеют те же гистопатологические характеристики, что и тестикулярный аналог; тем не менее, они обычно склонны к более агрессивному биологическому поведению и худшим показателям выживаемости [9,10]. Считается, что ВГО возникают в результате злокачественной трансформации герминогенных клеток, потерянных во время эмбриогенеза, являются пороком эмбрионального развития и содержат тканевые элементы и органоподобные структуры, которые в норме ни в средостении, ни в забрюшинном пространстве не встречаются. Злокачественные ВГО средостения, в отличие от доброкачественных, к моменту выявления, как правило, достигают больших размеров, сдавливают органы средостения, в результате чего развивается медиастинальный компрессионный синдром, что приводит к перикардиальному и плевральному выпоту, легочной гипоплазии и сердечной недостаточности [10,11].
КЛИНИЧЕСКИЙ СЛУЧАЙ
Пациент А., 1997 г. р., был экстренно госпитализирован в Nano Medical Clinic с жалобами на боли в левой половине грудной клетки, чувство нехватки воздуха, одышку при незначительной физической нагрузке, общую слабость.
При поступлении: общее состояние стабильно тяжелое. Сознание заторможенное, положение — полу-активное. Дыхание на фоне инсуфляции увлажненного кислорода. ЧДД — 26 в мин. Сатурация крови — 92 %. У больного отмечаются сильные боли по всему телу, преимущественно в грудной клетке, не купируемые наркотическими анальгетиками. В связи с этим больной введен в медикаментозный сон пропофолом на фоне наркотических анальгетиков.
Из анамнеза: считает себя больным с августа 2021 года, когда появились жалобы на одышку, боли в грудной клетке разлитого характера, нарастающую слабость, сухой кашель.
Проведено инструментальное обследование. По КТ ОГК (рис. 1) в проекции переднего верхнего и нижнего средостения слева кпереди от дуги аорты и легочного ствола с распространением на медиастинальную и переднюю части левого легкого определяется объемное образование неправильной формы с четкими неровными контурами размерами 13,0 × 10,0 × 18,0 см, структура неоднородная. Образование тесно прилежит к дуге аорты, легочному стволу и перикарду. Бронхопульмональные и перибронхиальные л /у до 1,0 см, подмышечные с 2-х сторон до 1,2 см. Органы средостения смещены вправо.
ПЭТ-КТ от 15.09.21 г.: патологически повышенный захват РФП наблюдается в гетерогенном объемном
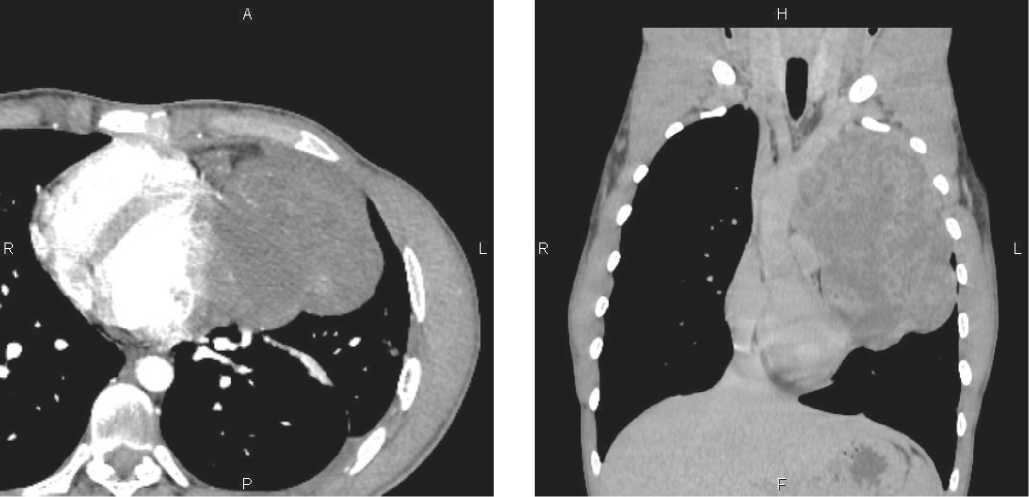
Рисунок 1. КТ органов грудной клетки с в/в контрастированием от 18.08.21 г.
образовании в левом легком, распространяющемся от верхушки диафрагмы до передней стенки, размерами 11,5 × 12,0 × 20,0 см в самой широкой части; границы с плеврой и средостением стерты (SUVmax = 10,8).
17 сентября 2021 года была выполнена биопсия образования в Республиканском специализированном научно-практическом медицинском центре онкологии и радиологии (РСНПМЦОиР). Патоморфологическое исследование № 3421В5310 от 22.09.21 г.: смешанная герминогенная опухоль (тератома + опухоль желточного мешка + эмбриональная карцинома). Иммуногистохимическое исследование: CDx2+ , Napsin A-, p40+ , TTF-1+ , SALL4+ , CD30+ , Glypican-3+ , OCT-3 / 4+ , AFP+ .
Онкомаркеры от 29.09.21: ЛДГ — 1036 МЕ/л, Б-ХГЧ — 1499 МЕ/мл, АФП — 3372 МЕ/мл. УЗИ органов мошонки от 27.09.21: эхокартина соответствует варикоцеле слева 1 ст., с двух сторон в строме яичек мелко и среднеточечные фиброзные включения, возможно,
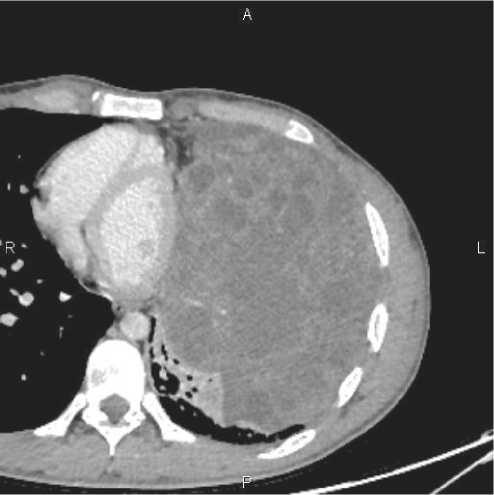
Рисунок 1А. КТ ОГК с в/в контр. от 08.12.21: отмечается увеличение размеров образования до 16,9 × 12,8 × 25,6 см с дислокацией органов средостения. Уровни опухолевых маркеров не были определены.
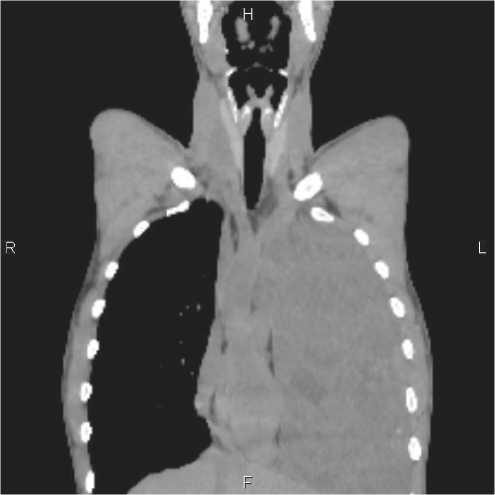
перенесенный орхит. ЭхоКГ от 30.09.21: сердце обычное, сдвинуто вправо (за счет огромного объемного образования в левом легком). Дилатация правого желудочка. Снижения локальной кинетики нет. Фракция выброса миокарда составляет 57 %. МРТ головного мозга от 28.09.21: патологических изменений головного мозга не выявлено.
05–10.10.21, 26–30.10.21 и 26–30.11.21 проведены 3 курса полихимиотерапии по схеме VIP (этопозид 75 мг / м 2 1–5 дни, цисплатин 20 мг /м 2 1–5 дни, ифосф-амид 1200 мг / м 2 1–5 дни, уромитексан 2400 мг, 1–5 дни на фоне Г-КСФ профилактики, каждые 3 нед. При контрольном обследовании в декабре 2021 г. выявлено прогрессирование заболевания ( рис. 1А).
Больной отказался от продолжения химиотерапии в связи с прогрессированием заболевания и субъективным ухудшением общего состояния (нарастание одышки, боль в грудной клетке). При неоднократном обращении в онкологические медицинские учреждения, в связи с массивным поражением переднего средостения и левой половины грудной клетки высоковаскулярной опухолью и дистопией сердечно-легочного комплекса больному отказано в хирургическом лечении.
05 февраля 2022 года пациент экстренно госпитализирован в Nano Clinic в тяжелом состоянии, обусловленном дыхательной недостаточностью III ст. (рис. 1Б).
Учитывая выраженную распространенность первичного образования, занимающего переднее средостение и левую плевральную полость, тотально смещающего сердечно-легочный комплекс вправо и вызывающего полный ателектаз левого легкого, дыхательную недостаточность, а также бесперспективность лекарственной терапии, по жизненным показаниям было запланировано удаление опухоли средостения.
09 февраля 2022 года выполнено радикальное удаление опухоли средостения, анатомическая ре- зекция 1, 2 и 3 сегментов левого легкого. Протокол операции: Произведена стернолапаротомия. Ревизия: переднее средостение занято опухолью гигантских размеров. Сердце смещено в правую половину грудной клетки, левое легкое находится позади опухоли средостения. Опухоль имеет солидно-кистозное строение. Выполнена пункция. Эвакуировано 2,5 литра серозногеморрагической жидкости. Опухоль интимно спаяна с костальной плеврой, перикардом, медиастинальной плеврой, аорта находится в правой половине грудной клетки. Опухоль мобилизована острым путем. Препарат удален. Левое легкое ателектазировано после подачи воздуха из левого главного бронха. Нижняя доля и язычковый сегмент левого легкого полностью расправлены. Ателектаз верхушечно-заднего и переднего сегментов левого легкого из-за длительной компрессии опухолью не разрешается. В связи с этим выполнена анатомическая резекция 1, 2 и 3 сегментов левого легкого. Макропрепарат: опухоль солидно-кистозного строения, размерами 30 × 30 × 45 см. Вес опухоли 6,6 кг. На разрезе опухоль мезенхимального происхождения, местами ячеистой структуры, с множественными кистозными образованиями и серозным содержимым. Резецированное левое легкое размером 5,0 × 7,0 × 9,0 см, на разрезе фиброзно изменено. Патоморфологическое заключение № 70935 / 22 от 17.02.22: образование размером 30 × 25 × 17 см, с неровными краями и кистозными очагами, плотной консистенции, неоднородной структуры, серо-коричневого и желтоватого цвета. Заключение: тератобластома (незрелая тератома) средостения. Послеоперационный период протекал без осложнений, отмечалась положительная динамика в виде регресса кардиореспираторных нарушений. В связи с развившейся пневмореей по плевральным дренажам, плевральные дренажи удалены на 13-е сутки послеоперационного периода. Показатели гемодинамики стабилизировались, и кардиотоническая поддержка
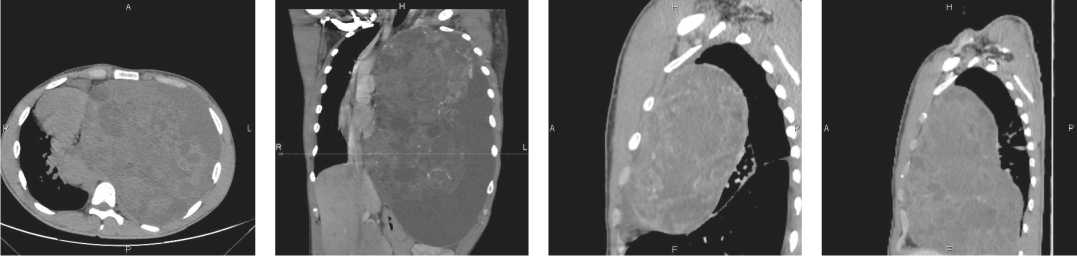
Рисунок 1Б. КТ ОГК с в/в контрастированием от 07.02.22: определяется крупное объемное образование неоднородной, солидно-кистозной структуры, исходящее из передне-верхнего средостения, занимающее всю половину левого гемиторакса, контуры нечеткие, неровные, размерами 20,0 × 24,0 × 39,4 см. Компрессионный ателектаз левого легкого. Фибробронхоскопия от 07.02.22: на расстоянии от карины 2,0 см слева дистальная часть левого главного бронха выраженно сдавлена. Прибор с диаметром 0,4 см проходим с эффектом бужирования. Признаков прорастания в слизистую не отмечается. Верхне-, нижнедолевые базальные бронхи аналогично сдавлены. Маркеры от 08.02.22: АФП — 1150 Ме/мл, РЭА — 1,56 Нг/мл, ХГЧ — 1560 мМЕ/мл, ЛДГ — 310 МЕ/ л.
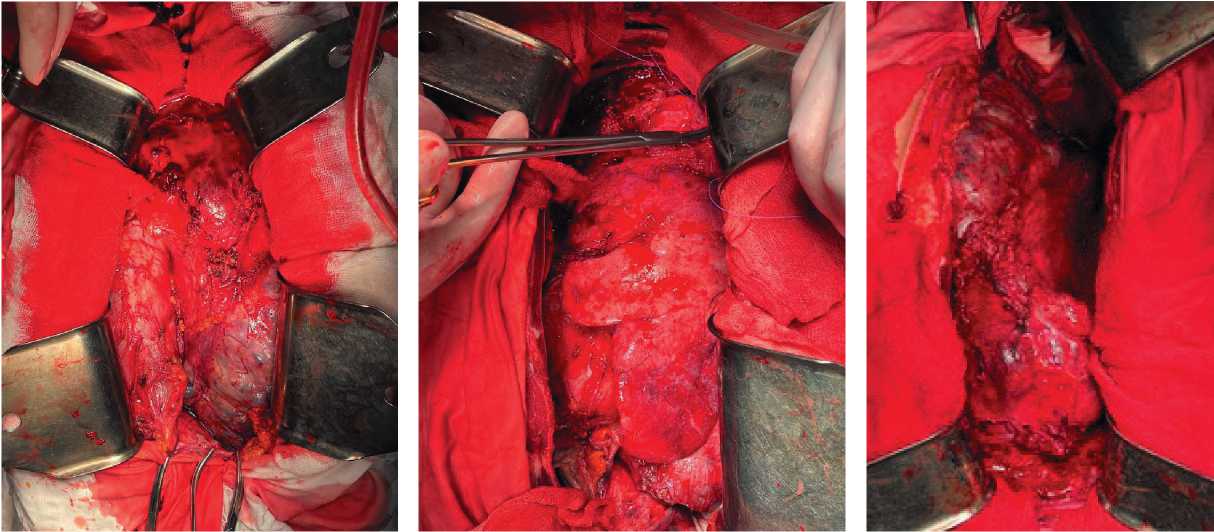
Рисунок 2. Установка ранорасширителей. Опухоль тотально замещает переднее средостение, левую грудную полость, оттесняя и сдавливая сердечно-легочный комплекс вправо. Левое легкое расположено позади опухоли.
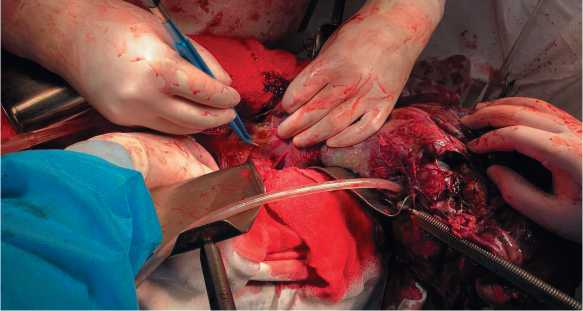
Рисунок 3. Этапы мобилизации опухоли.
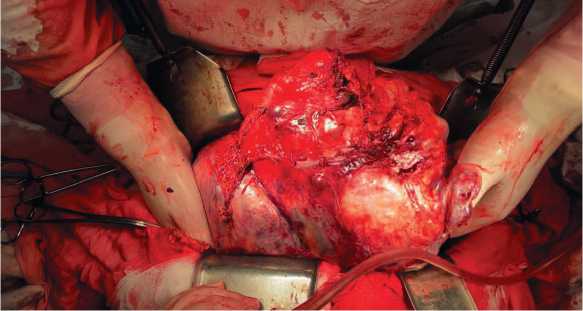
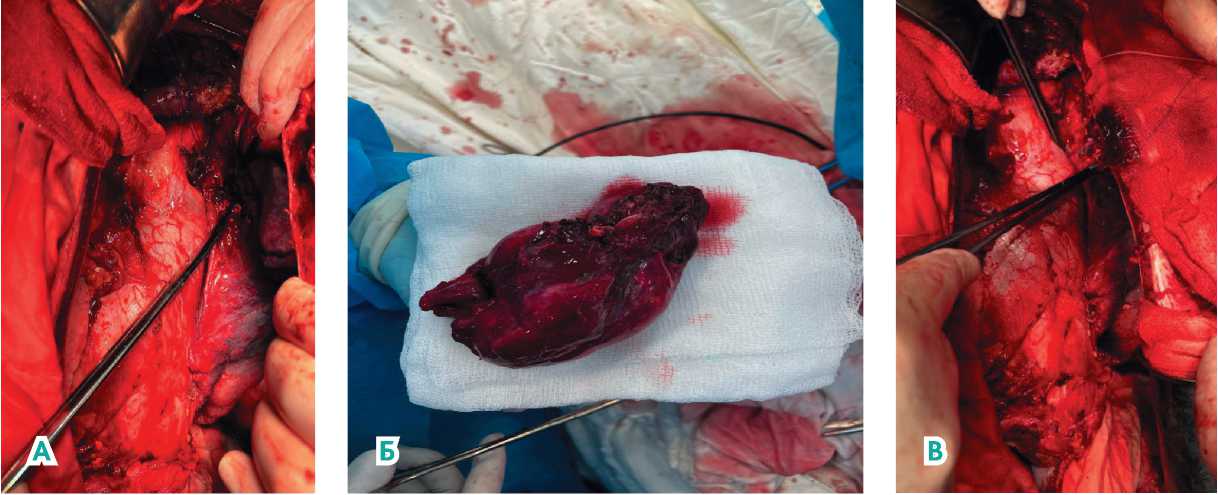
Рисунок 4. Этапы операции.А) Отделение опухоли от верхней доли левого легкого; Б) Резецированные 1–3 сегменты левого легкого; В) Расправленное левое легкое; ушивание линии резекции верхней доли левого легкого.
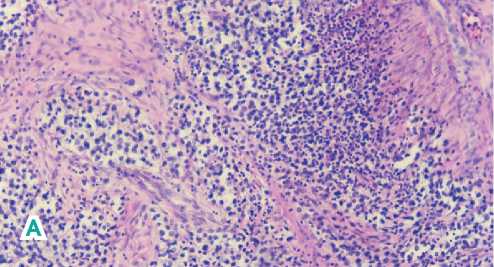
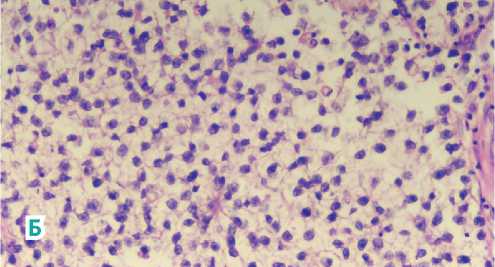
Рисунок 5. Микроскопическая картина. Многочисленные небольшие деформированные железистые структуры, покрытые многорядным эпителием с гиперхромными полиморфными ядрами с патологическими митозами. Опухоль представлена большими однотипными клетками полигональной или округлой формы, с хорошо выраженными границами, со светлой цитоплазмой; ядра крупные, округлые, с умеренным числом фигур митозов. (А). Пласты из увеличенных полиморфных клеток полигональной или округлой формы с четкими границами, светлой цитоплазмой; ядра крупные, округлые с большим числом митозов (клетки семиномы) (Б). Массивные очаги некрозов, кровоизлияний, гиперемия сосудов.
отменена на вторые сутки. 10 февраля 22 года пациент был экстубирован. Швы сняты на 15-е сутки после вмешательства — заживление операционной раны первичным натяжением.
Патоморфологическое заключение № 70935/22 от 17.02.22: незрелая тератома средостения, семинома.
Объективно: состояние пациента относительно удовлетворительное. Жалоб со стороны респираторной системы не отмечено. По органам и системам без отрицательной динамики. Сатурация 95 %. ЧДД — 18 в минуту, Пульс — 82 уд /мин. Маркеры от 10.02.22: АФП — 147 Ме / мл, ХГЧ — 92 мМЕ / мл, ЛДГ — 31 МЕ / л. На момент исследования в ноябре 2022 г. признаков прогрессирования по данным компьютерной томографии не выявлено. Маркеры от 27.08.22 г.: АФП — 56 Ме / мл, РЭА — 1,07 нг /мл, ХГЧ — 65 мМЕ/мл, ЛДГ — 44 МЕ/л. Маркеры от 28.11.2022 г.: АФП — 43 МЕ/мл, ХГЧ — 71 мМЕ/мл, ЛДГ — 48 МЕ /л. Время наблюдения — 16 месяцев.
ОБСУЖДЕНИЕ
Внегонадные опухоли средостения чаще встречаются у мужчин и обычно диагностируются в возрасте до 40 лет. Пятилетняя выживаемость больных с ВГО средостения составляет 30–45% [12]. Так, в мультицентровом исследовании Bokemeyer и соавторов было пролечено 635 больных (у 341 больных были ВГО средостения, у 283 — ВГО забрюшинного пространства); гистологически несеми-номные ГО (не-ГО) верифицированы у 524 больных (83%), семинома — у 105 больных (16%). Пациентам проведена индукционная химиотерапия с производными платины с или без хирургического вмешательства. Из них 141 пациент (49%) с ВГО средостения (медиана наблюдения 19 мес. (1–178 мес.) и 144 пациентов (63%) с ВГО забрюшинного пространства (медиана наблюдения 29 мес. (1–203 мес.) живы (р = 0,0006). Частота ОВ у пациентов с семиномой составила 88% вне зависимости от расположения (средостение, забрюшинное пространство) первичной опухоли (медиана наблюдения 49 мес. (4–193 мес.; медиана наблюдения — 70 мес. (1–211 мес.), соответственно. При этом 45% пациентов с не-ГО живы более 5 лет. Таким образом, процент вылечившихся пациентов с семиномой вне зависимости от расположения первичной опухоли составляет около 90%. В свою очередь, пациенты с ВГО средостения живы к 5 году наблюдения [13]. ВГО обычно химиочувстви-тельны, и первой линией терапии является химиотерапия на основе цисплатина, за которой следует хирургическое вмешательство [14]. У нашего пациента после трех курсов ХТ по схеме VIP (этопозид, цисплатин, ифосфамид, уро-митексан) по месту жительства наступило прогрессирование. Как правило, у пациентов на момент диагностики уже имеется массивная опухоль переднего средостения, как у нашего пациента, поэтому меньшая эффективность ХТ первой линии и практически отсутствующие шансы на излечение при рецидиве делают хирургическое лечение важнейшим этапом в лечении, и оно было показано нашему пациенту по жизненным показаниям [15–17]. Согласно опыту Университета Индиана, в наблюдении первичных ВГО средостения за счет отказа от блеомицин-содержащего режима химиотерапии (BEP) риска развития пульмонитов снижается [18]. Предположительно, это явилось показанием к проведению VIP в 1 линии химиотерапии. Несмотря на то, что гигантские размеры опухоли зачастую являются противопоказанием к проведению хирургического лечения на фоне химиорезистентности, нами выполнено радикальное удаление опухоли средостения. В работе K. Kesler и соавторов с 1981 по 2009 гг. у 5 пациентов c сердечно-легочной дисфункцией за счет сдавления органов средостения экстренно выполнено хирургическое лечение после прогрессирования на фоне полихимиотерапии. Гистологически у всех пациентов верифицирована зрелая тератома. В послеоперационном периоде 4 больным проведена химиотерапия. Общая выживаемость пациентов составила 14 лет. Интраоперационная смерть зафиксирована в 1 случае [19]. Время наблюдения нашего пациента составило 16 месяцев. В случае прогрессирования заболевания после цисплатин-содержащего режима химиотерапии пациентам с внегонадными опухолями возможно проведение высокодозной химиотерапии с трансплантацией аутологичных стволовых клеток. В исследовании N. Adra и соавторов отражен опыт лечения Университета Индиана за период 2004–2014 гг. на основании результатов лечения 364 больных с метастатическими гонадными опухолями с прогрессированием на фоне цисплатинсодер-жащей химиотерапии. По локализации преобладали ВГО забрюшинного пространства (344 больных) и средостения (20 пациентов). Гистологически несеминома представлена у 285 больных, семинома — у 79. Платиночуствительность зарегистрирована у 242 пациентов, платинорефрактер-ность — у 122. Медиана возраста больных составляла 32 года. Пациентам проводилась высокодозная химиотерапия (ВХТ) в режиме: карбоплатин 700 мг/м2, этопозид 750 мг/м2 в/в капельно 1–3 дни с поддержкой периферическими стволовыми клетками; 341 пациент получил 2 курса по вышеуказанной схеме, а 23 пациента — только 1 курс в связи с прогрессированием заболевания или токсичностью. Медиана наблюдения составила 29 мес. Из 364 больных, у 230 больных выявлен полный ответ без признаков прогрессирования. Из 302 пациентов, получавших ВХТ с поддержкой периферическими стволовыми клетками, и в качестве второй линии терапии у 195 больных признаков заболевания не отмечено. У 35 из 62 пациентов, получавших данную терапию в третьей и последующих линиях, признаков прогрессирования не было. Смерть от лечения наступила у 6 больных. Вторичная лейкемия развилась у 5 больных. Таким образом, пациенты с метастатическими гонадными опухолями являются курабель- ными даже во второй и последующих линиях терапии [20]. Обобщая результаты данных исследований, можно сделать вывод о возможности выполнения радикального хирургического вмешательства у большинства пациентов с ВГО средостения, что обеспечивает длительную выживаемость у половины из них. По данным отечественных авторов (А.А. Трякина и соавт.), из 919 больных с несеминомными ГО, получавших в НМИЦ онкологии им. Н. Н. Блохина первую линию ХТ, хирургическое вмешательство по поводу резидуальной опухоли выполнено у 417 (45%). Из них ВГО средостения были у 31 больного. R0/1 резекции удалось добиться у 27 больных (87%). Морфологически резидуальная опухоль была представлена некрозом у 15 больных (48%) больных, зрелой тератомой у 6 больных (19%), незрелой тератомой у 1 пациента (3%), злокачественной опухолью у 8 больных (26%), злокачественной не-ГО у 1 больного (3 %). Из этого следует, что высокая частота обнаружения злокачественной опухоли после химиотерапии (43%) обосновывает необходимость включения хирургического лечения в алгоритм лечения несеминомных опухолей средостения. Больные, подвергшиеся хирургическому удалению всех опухолевых очагов в объеме R0, имеют достоверно большую продолжительность жизни [18].
ЗАКЛЮЧЕНИЕ
Таким образом, тотальное замещение переднего средостения массивным опухолевым процессом с распространением на грудную полость, сопровождающееся дистопией сердечно-легочного комплекса, а также высокая васкулярность опухоли не являются основанием для отказа от хирургического вмешательства, а наоборот — демонстрируют необходимость его своевременного проведения.
Список литературы Успешное хирургическое лечение герминогенной опухоли средостения на фоне химиорезистентности
- Давыдов М. И., Полоцкий Б. Е., Мачаладзе З. О. и др. Лечение внегонадных герминогенных опухолей средостения // Высокие технологии в онкологии. Матер. 5 Всерос. съезда онкологов .- Казань, 2000 .- Т. 2 .- 19 c.
- Hainsworth J. D., Greco F. A. Germ cell neoplasms and other malignancies of the mediastinum // Cancer. Treat. Res .- 2001 .- Vol. 105 .- P. 303-325.
- Bokemeyer C., Hartmann J. T., Fossa S. D. et al. Extragonadal germ cell tumors: relation to testicular neoplasia and management options // APMIS .- 2003 .- Vol. 111, N 1 .- P. 49-59.
- Bokemeyer C., Nichols C. R., Droz J. P. et al. Extragonadal germ cell tumors of the mediastinum and retroperitoneum: results from an international analysis // J. Clin. Oncol .- 2002 .- Vol. 20, N 7 .- P. 1864-1873.
- Hsu Y. J., Pai L., Chen Y. C. et al. Extragonadal germ cell tumors in Taiwan: an analysis of treatment results of 59 patients // Cancer .- 2002 .- Vol. 15, N 4 .- P. 766-774.
- Матвеева Б. П. Клиническая онкоурология .- М., 2003 .- С. 617-684.
- Nichols C. Mediastinal germ cell tumors // In Germ Cell Tumors IV. The Proceeding of the IV Germ Cell Tumor Conference .- 1997 .- P. 197-201.
- Parkin D. M., Whelan S. L., Ferlay J. et al. Cancer incidence in Five Continents .- Vol. VII (IARC Scientific Publication no. 143) .- IARC Press, Lyon, 1997.
- Rosti G, Secondino S, Necchi A, Fornarini G, Pedrazzoli P. Primary Mediastinal Germ Cell Tumors. Semin Oncol (2019) 6 (2): 107-11. https://doi.org/10.1053/j.seminoncol.2019.04.001.
- Bokemeyer C, Nichols CR, Droz J, Schmoll HJ, Horwich A, Gerl A, et al. Extragonadal Germ Cell Tumors of the Mediastinum and Retroperitoneum: Results From an International Analysis. J Clin Oncol (2002) 20 (7): 1864-73. https://doi.org/10.1200/JCO.2002.07.062.
- Bokemeyer C, Droz J, Horwich A, Gerl A, Fossa SD, Beyer J, et al. Extragonadal Seminoma: An International Multicenter Analysis of Prognostic Factors and Long Term Treatment Outcome. Cancer (2001) 91 (7): 1394-401. https://doi.org/10.1002/1097-0142(20010401)91:73.0.CO ; 2-Y.
- Vallejo-Yepes C, Carvajal-Fierro CÁ, Brugés-Maya R, Beltrán J, Buitrago R, Beltrán-Jimenez R and Carreño-Dueñas JA (2022) Survival Outcomes of Patients With Mediastinal Germ Cell Tumors: Experience of a Cancer Center in South America. Front. Oncol. 11: 758496. https://doi.org/10.3389/fonc.2021.758496.
- Bokemeyer C, Nichols CR, Droz JP, Schmoll HJ, Horwich A, Gerl A, Fossa SD, Beyer J, Pont J, Kanz L, Einhorn L, Hartmann JT. Extragonadal germ cell tumors of the mediastinum and retroperitoneum: results from an international analysis. J Clin Oncol. 2002 Apr 1 ; 20 (7): 1864-73. https://doi.org/10.1200/JCO.2002.07.062. PMID : 11919246.
- Joel Anjana, Mathew Namrata, Andugala Shalom Sylvester, Daniel Sherin, Roy Gnanamuthu Birla, Oommen John Ajoy, Georgy Josh Thomas, Chacko Raju Titus, Irodi Aparna, Yadav Bijesh, John Subhashini, Singh Ashish (2021) Primary mediastinal germ cell tumours: real world experience in the low middle income (LMIC) setting ecancer 15 1186.
- Goss, P. Extragonadal germ cell tumors: a 14-year Toronto experience / P. Goss, L. Schwertfeger, M. Blackstein et al. // Cancer .- 1994 .- 73 .- P. 1971-9.
- Fizazi, K. Primary mediastinal nonseminomatous germ cell tumors: Results of modern therapy including cicplatin-based chemotherapy / K. Fizazi, S. Culine, J. Droz et al. // J Clin Oncol .- 1998 .- 16 .- P. 725-32.
- Walsh, G.L. Intensive chemotherapy and radical resections for primary nonseminomatous mediastinal germ cell tumors / G.L. Walsh, G.D. Taylor, J.C. Nesbitt, R.J. Amato // Ann Thorac Surg .- 2000 .- 69 .- P. 337-43.
- Stram AR, Kesler KA. Mediastinal Germ Cell Tumors: Updates in Diagnosis and Management. Surg Oncol Clin N Am. 2020 Oct ; 29 (4): 571-579. https://doi.org/10.1016/j.soc.2020.06.005. Epub 2020 Jul 20. PMID : 32883459.
- Kesler KA, Patel JB, Kruter LE, Birdas TJ, Rieger KM, Okereke IC, Einhorn LH. The “growing teratoma syndrome” in primary mediastinal nonseminomatous germ cell tumors: criteria based on current practice. J Thorac Cardiovasc Surg. 2012 Aug ; 144 (2): 438-43.
- Nabil Adra, Sandra Althouse, Mary J. Brames, Cheryl K Sullivan, Rafat Abonour, Nasser H. Hanna, Costantine Albany, and Lawrence H. Einhorn Journal of Clinical Oncology 2016 34: 15_suppl, 4505-4505.
- Трякин А.А. Лекарственное и комбинированное лечение несеминомных герминогенных опухолей у мужчин / диссертация. 2015


