Установление тест-культуры для изучения воздействия ионизирующего излучения на условно-патогенную и патогенную микрофлору пищевых продуктов
Автор: Семенова Ж.А., Левшенко М.Т., Колоколова А.Ю., Илюхина Н.В., Курбанова М.Н.
Журнал: Вестник Воронежского государственного университета инженерных технологий @vestnik-vsuet
Рубрика: Пищевая биотехнология
Статья в выпуске: 2 (80), 2019 года.
Бесплатный доступ
Учитывая особую значимость микробного обсеменения продуктов питания в возникновениях острых кишечных инфекционных заболеваний и пищевых отравлений, особое внимание уделяется мониторингу микробиологической чистоты продовольственного сырья и пищевых продуктов. Обработка пищевой продукции ионизирующим излучением - это перспективная технология борьбы с микроорганизмами порчи, с патогенными и условно-патогенными микроорганизмами, которые являются возбудителями опасных заболеваний. В исследованиях антибактериальной эффективности ионизационного облучения используются вегетативные формы микроорганизмов. Однако работа с такими формами микроорганизмов для изучения воздействия ионизирующего излучения затруднена ввиду необходимости использования в исследованиях только активно растущую культуру, чувствительную к ионизирующему излучению и различным факторам внешней среды, которые являются неотъемлемым условием процесса обработки модельных объектов. При изучении воздействия ионизирующего излучения на микрофлору пищевых продуктов в работе описано исследование возможности использования в качестве тест-культуры аскоспоры гриба Aspergillus fischeri вместо вегетативных форм патогенных и условно-патогенных культур...
Ионизирующее излучение, устойчивость микроорганизмов, тест-культура, патогенные микроорганизмы, условно-патогенные микроорганизмы
Короткий адрес: https://sciup.org/140246346
IDR: 140246346 | УДК: 621.384.6, | DOI: 10.20914/2310-1202-2019-2-245-249
Текст научной статьи Установление тест-культуры для изучения воздействия ионизирующего излучения на условно-патогенную и патогенную микрофлору пищевых продуктов
Проблема безопасности и качества продуктов питания является одним из основных факторов, определяющих здоровье человека, так как именно с пищей в организм наряду с питательными веществами могут попадать и патогенные микроорганизмы.
Обработка пищевых продуктов ионизирующим излучением позволяет улучшить их качество путем уничтожения патогенных и условно-патогенных микроорганизмов, а также снижения количества микроорганизмов, вызывающих порчу продуктов. По сравнению с традиционными методами обработки пищевых продуктов радиационные технологии более экономичные и безопасные, они исключают или уменьшают применение термического воздействия, пищевых консервантов, пестицидов и других химических препаратов [1–3].
Наиболее важным показателем, отвечающим за безопасность пищевой продукции, является микробиологическая чистота, регламентируемая нормативными документами, в частности техническими регламентами.
В настоящее время разработана нормативная база по применению радиационных технологий в пищевой отрасли. Однако перечень документации, регламентирующей применение подобных технологий, ограничен. В приложении 5 ТР ТС 021/2011 «О безопасности пищевой продукции» указано, что на таможенной территории Таможенного союза к обращению не допускается мясо птицы и некоторые виды другого продовольственного сырья, обработанные ионизирующим излучением / облучением. Следовательно, вся остальная пищевая продукция, кроме перечисленной, заслуживает изучения вопроса обработки ионизирующим излучением.
Ионизирующим излучением ежегодно в мире облучается более 700 тыс. т пищевой продукции в 69 странах мира [4].
Установлено, что при дозе облучения пищевой продукции от 1 до 5 кГр большинство микроорганизмов погибает. Дальнейшее увеличение дозы облучения отрицательно сказывается на органолептических показателях [5].
Проведенные исследования подтвердили перспективность метода обеззараживания с помощью гамма-излучения и ускоренных электронов. Обработка ионизирующим излучением в настоящее время международно признана в качестве эффективного метода обеззараживания для поддержания качества продуктов питания [4–7]. В разных странах мира максимально допустимая доза облучения продуктов питания различная. В 1981 г. объединенный комитет экспертов ФАО, МАГАТЭ и ВОЗ пришел к выводу о том, что облучение любого пищевого продукта с дозами, не превышающими 10 кГр, не вызывает токсического действия и не требуются дальнейшие токсикологические исследования обработанной продукции. А в 2011 г. Европейское агентство по безопасности пищевой продукции (EFSA) подтвердило эффективность радиационной обработки для обеспечения микробиологической безопасности продуктов питания и перспективность использования ионизирующих излучений в агробиотехнологиях [4]. Результаты исследований, проведенных в США и странах Европы, показывают, что облученные продукты безопасны и пригодны к употреблению (не содержат остаточной радиации). При такой обработке потери белков, жиров и углеводов не отличаются от потерь после других технологических обработок продуктов [8–9].
Проведенные нами исследования по обработке ягод показали целесообразность воздействия γ-излучением и ускоренными электронами для увеличения сроков хранения [6].
Механизм воздействия ионизирующего излучения связан с ионизацией молекул микроорганизмов, что приводит к подавлению их развития и даже гибели. При облучении пищевого продукта максимальная доза должна быть меньше той, при которой могла бы возникнуть опасность для потребителя или которая может отрицательно сказаться на функциональных или органолептических свойствах продукта.
Для подбора оптимальной дозы обработки ионизирующим излучением пищевых продуктов обычно используется их искусственное заражение патогенными или условно-патогенными микроорганизмами – тест-культурами [10–11]. Как правило, для заражения используется активная суточная культура этих микроорганизмов. Однако работа с такими культурами затруднительна, так как вегетативные клетки этих микроорганизмов чувствительны к воздействию различных факторов внешней среды, которые в ходе эксперимента не только могут размножаться, но и могут погибать. Поэтому для отработки параметров воздействия ионизирующего излучения на микрофлору пищевых продуктов мы проверили возможность замены вегетативных форм проверяемых культур более устойчивыми формами – аскоспорами. Для этого были использованы аскоспоры гриба A. fischeri , рекомендуемые как тест-культура для определения режимов пастеризации консервируемой плодоовощной продукции [12].
Цель работы – определить возможность замены суточных культур S. enterica, E. coli, L. monocytogenes аскоспорами тест – культуры A. fischeri при изучении воздействия ионизирующего излучения с различными дозами облучения на микрофлору пищевых продуктов.
Материалы и методы
Объектами исследования являлись культуры, нанесенные на поверхность модельных сред. В качестве вегетативных форм культур были выбраны музейные штаммы микроорганизмов: E. coli ATCC 8739 ВКПМ В-11419, полученный из ФГУП «ГосНИИгенетика», S. enterica subsp. Enterica serovar Typhimurium ATCC 14028 В-4922, полученный из ФБУН ГНЦ ПМБ, L. monocytogenes 766, полученный из ФБУН ФИЦВиМ, а в качестве споровой культуры использовали аскоспоры штамма A. fischeri BKMG-83, полученные из коллекции ИБФМ РАН.
Суспензии изучаемых вегетативных форм культур получали путем смыва активированной 24-часовой культуры, выросшей в пробирках на скошенном под углом в 30° мясопептонном агаре (МПА) объёмом 6 см3.
Для определения эффективности воздействия ионизирующего излучения на ингибирование вегетативных форм микроорганизмов использовали искусственные модельные среды, имитирующие свойства поверхности пищевого продукта. Исследования на искусственной модельной среде были выбраны с целью исключения попадания посторонней микрофлоры с поверхности растительного сырья, они позволяли выявить динамику ингибирования только внесенного вида микроорганизма. В качестве модельной среды использовали стандартный питательный мясопептонный агар (МПА), обладающий необходимым набором питательных веществ, способствующий поддержанию жизнеспособных микроорганизмов в процессе транспортировки и проведения экспериментальной работы. Заражение модельной среды проводили путем поверхностного нанесения 0,1 см3 суточных культур микроорганизмов в концентрации 108 КОЕ / см3 на заранее подготовленный и разлитый в чашки Петри и застывший МПА объемом 20 мл с дальнейшим распределением суспензии по поверхности чашки с применением стерильного шпателя.
Для получения споровой суспензии A. fischeri чашки Петри с агаром Сабуро (питательный агар для культивирования микроорганизмов, Россия) инокулировали 2–3 каплями взвеси созревших конидий культуры в стерильной воде и растирали стерильным шпателем по поверхности агара. Посевы термостатировали 10–14 сут при 30 °С, выдерживали 20 сут при комнатной температуре и затем, при необходимости, хранили до 1 месяца в холодильнике при 2–4 °С.
Непосредственно перед использованием аскоспоры смывали с поверхности агара в чашках Петри 10–15 см3 стерильной воды. Полученная смесь содержала не менее 108 аскоспор в 1 см3, ее использовали в течение 1–3 суток для определения параметров устойчивости спор к ионизирующему излучению. Суспензию аскоспор концентрацией 108 в 1 см3 среды наносили аналогично бактериальной на поверхность питательной застывшей среды Сабуро в количестве 0,1 см3 на 1–2 ч. За этот срок споровая суспензия на чашках Петри подсыхала. После этого зараженные чашки хранили при необходимости в холодильнике при температуре 2–4о С до 3 сут.
Проверка устойчивости суспензий изучаемых видов микроорганизмов, нанесенных на поверхность модельных сред, проводилась обработкой ионизирующим излучением с энергией пучка 10 МэВ с задаваемой дозой поглощения 0–0,8– 1,0–2,0–3,0–4,0–5,0 кГр на установке компании «Теклеор», (Россия, г. Обнинск).
Обработку экспериментальных данных для установления дозы поглощения энергии D, кГр, микроорганизмами проводили по формуле:
D = 8,64 • A1’027 , где A – оптическая плотность контрольной пленки.
Эффективность воздействия обработки проверяли путем определения количества начальной и остаточной микрофлоры в экспериментальных образцах. После обработки образцов проводили смыв микроорганизмов с поверхности чашки 10 см3 пептонный воды с последующим высевом с разведением или без на стандартную среду МПА. Чашки Петри, содержавшие после облучение небольшое количество микроорганизмов (менее 300, но более 15), помещались в термостат для образования колоний и последующего визуального их подсчета. Микробиологические исследования экспериментальных образцов проводили согласно действующей нормативной документации по определению количества мезофильно-аэробных и факультативно-анаэробных микроорганизмов по ГОСТ 10444.15–95 «Продукты пищевые. Методы определения количества мезофильных аэробных и факультативно-анаэробных микроорганизмов».
Подсчет количества микроорганизмов, выросших на плотной питательной среде, проводили способом прямого подсчета числа колоний по ГОСТ ISO 7218–2011 «Микробиология пищевых продуктов и кормов для животных. Общие требования и рекомендации по микробиологическим исследованиям». При этом рассчитывали число микроорганизмов N, присутствующих в пробе, как средневзвешенное значение из двух подсчетов последовательных разведений по формуле:
C лт = ^—, 1,1V ■ d где ∑C – сумма колоний, подсчитанных в 2 чашках Петри, выбранных для подсчета из 2 последовательных разведений; V – объем посевного материала, внесенного в каждую чашку Петри (см3);
d – коэффициент разведения, соответствующий первому выбранному разведению (в случае отсутствия разведения – d = 1). Результат вычисления округляли до 2 значащих цифр.
Результаты и обсуждение
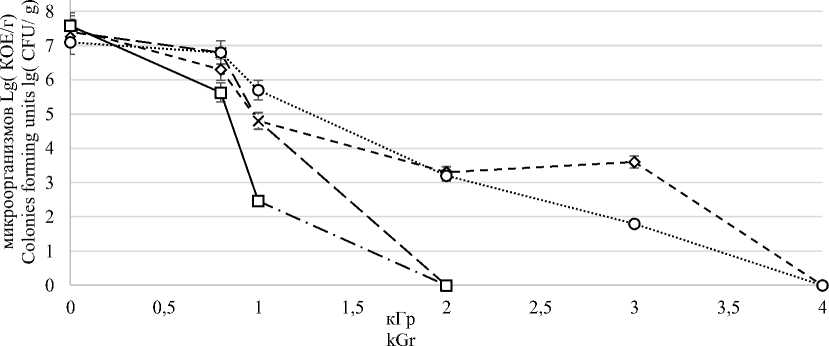
В результате исследований получены данные по эффективности обработки культур под воздействием ионизирующего излучения с различными дозами облучения (рисунок 1).
S. enterica L. monocytogenes E. coli A.fischeri
Рисунок 1. Динамика ингибирования микрофлоры под воздействием ионизирующего излучения с энергией пучка 10 МэВ
Figure 1. Dynamics of inhibition of microflora under energy of 10 MeV
Исследования показали, что наибольшей устойчивостью облученных бактерий обладают культура Salmonella и аскоспоры A. fischeri . Динамики ингибирования остальных изученных вегетативных культур фактически повторяют друг друга, полное ингибирование которых наступает при 1,5–2,0 кГр, в то время как для культуры Salmonella при облучении с интенсивностью 2–3 кГр появляется зона плато. Полное ингибирование устойчивых видов микроорганизмов наступает при 4 кГр.
Заключение
В результате проведенных исследований можно сделать вывод, что аскоспоры гриба A. fischeri и Salmonella enterica имеют более the influence of ionizing radiation with a beam высокую устойчивость к ионизирующему излучению в диапазоне от 1 до 5 кГр при мощности обработки 10 МэВ по сравнению с клетками Escherichia coli и Listeria monocytogenes. Изучение воздействия ионизирующего излучения на вегетативные формы микроорганизмов затруднено ввиду необходимости использования в исследованиях только активно растущую культуру, чувствительную к различным факторам внешней среды, которые являются неотъемлемым условием процесса обработки модельных объектов.
Исследования показали возможность замены устойчивых штаммов вегетативной формы микроорганизмов споровыми, которые рекомендуются для разработки режимов стерилизации ионизационным излучением пищевой продукции.
Список литературы Установление тест-культуры для изучения воздействия ионизирующего излучения на условно-патогенную и патогенную микрофлору пищевых продуктов
- Sundaralingam R. A Debate on Safety of the Irradiated Food // International Journal of Research Studies in Microbiology and Biotechnology. 2017. V. 3. № 4. P. 4-5. DOI: 10.20431/2454-9428.0304002
- Fellows P.J. Food Processing Technology: Principles and Practices. Elsevier, 2018. 1152 p.
- Barba F. et al. Innovative Technologies for Food Preservation: Inactivation of Spoilage and Pathogenic Microorganisms. Academic Press, 2018. 329 p.
- Санжарова Н.И. Перспективы применения радиационных технологий в агропромышленном комплексе Российской Федерации. Обнинск, 2016.
- Chiaravalle А., Mangiacotti М., Marchesani G., Vegliante G. Electrons pin resonance (ESR) detection of irradiated fish containing bone (gilthead sea bream, cod, and sword fish) // Vet Res Commun. 2010. № 34 (1). P. 149-152.
- Курбанова М.Н., Левшенко М.Т., Колоколова А.Ю., Семенова Ж.А. и др. Влияние ?- и уф- излучений на микробиальную обсемененность черной смородины и вишни // Известия Вузов. Пищевая технология. 2018. № 5-6. С. 64-66.
- Хабибуллина Р.Н., Дуборасова Т.Ю., Пономарев В.Я. Проблемы сохранения качества креветок мороженых в процессе хранения // Вестник Казанского технологического университета. 2013. Т. 16. № 7. С. 208-211.
- Robertson R.E. Food irradiation. Available Research Indicates That Benefits Outweigh Risks. 2000.
- Илюхина Н.В., Колоколова А.Ю. Закономерности ингибирования культуры Salmonella // Вестник ВГУИТ. 2018. Т. 80. № 4. C. 209-212.
- Илюхина Н.В., Колоколова А.Ю., Прокопенко А.В., Филипович В.П. Исследование эффективности облучения биологических объектов с применением пучка ускоренных электронов // Радиационные технологии в сельском хозяйстве и пищевой промышленности: состояние и перспективы: сборник докладов международной научно-практической конференции. 2018. С. 76-80.
- Бабарин В.П. Стерилизация консервов: Справочник. СПб: ГИОРД, 2006. 312 с.
- Polovka M., Suhaj M. Classification and prediction of ?-irradiation of ten commercial herbs and spices by multi-variate evaluation of properties of their extracts // Journal of Food and Nutrition Research. 2013. V. 52. № 1. P. 45-60.


