Устойчивые геометрические конфигурации основного и возбужденных состояний димеров воды
Автор: Лебедев Н.Г.
Журнал: Математическая физика и компьютерное моделирование @mpcm-jvolsu
Рубрика: Химическая физика
Статья в выпуске: 1 (14), 2011 года.
Бесплатный доступ
Проведено исследование геометрического и электронного строения димера воды, находя- щегося в основном и возбужденном состояниях, с помощью квантово-химических полуэмпири- ческих методов MNDO, AM1, PM3, RM1 и неэмпирических (ab initio) методов Хартри - Фока с использованием базисных наборов STO-3G, 6-31G*, 6-31++G**. Получены количественные ре- зультаты, описывающие геометрию, дипольный момент, энергии верхней занятой и нижней ва- кантной молекулярных орбиталей, удельную энергию и энергию связи димера воды.
Димер воды, квантовая химия, электронное строение
Короткий адрес: https://sciup.org/14968660
IDR: 14968660 | УДК: 54.12
Текст научной статьи Устойчивые геометрические конфигурации основного и возбужденных состояний димеров воды
Представления о том, что жидкости вовсе не являются бесструктурными субстанциями, сформировались в 30-е гг. прошлого столетия, когда стало очевидным, что непрерывная модель жидкого состояния, не делающая различий между газом и жидкостью, не в состоянии описать многие (в частности, критические) явления. Рентгеноструктурные исследования жидкостей, начавшиеся в это же время, показали, что в жидкостях существует некоторый порядок, заключающийся в том, что ближайшее окружение каждой молекулы напоминает, хотя и более рыхлую и подвижную, упаковку в кристаллах. Таким образом, возникает представление о ближнем структурном порядке в жидкостях. Такое понимание структуры справедливо даже для газов, которые (особенно плотные газы) тоже могут характеризоваться неким ближним порядком [1; 4; 6].
Все физические свойства воды объясняются строением ее молекулы и электронным строением атома кислорода. Шесть электронов на внешнем энергетическом уровне выступают как два неспаренных электрона, способных образовывать у-связь с атомом водорода, и две неподе-ленные пары электронов, образующих два отрицательно заряженных центра [там же].
В работе проведено исследование геометрического и электронного строения молекулы воды и молекулы димера воды, находящегося в основном и возбужденном состояниях. Для этого использованы квантово-химические полуэмпирические методы MNDO, AM1, PM3, RM1 и неэмпирические ( ab initio ) методы Хартри – Фока с использованием базисных наборов STO-3G, 6-31G*, 6-31++G** [2; 5].
Структурная модель и электронное строение молекулы воды
Молекула воды представляет собой маленький диполь, содержащий положительный и отрицательный заряды на полюсах. Около ядер водорода имеется недостаток электронной плотности, а на противоположной стороне молекулы, около ядра кислорода, наблюдается избыток электронной плотности. Именно такая структура и определяет полярность молекулы воды. Если со- единить прямыми линиями эпицентры положительных и отрицательных зарядов, получится объемная геометрическая фигура – правильный тетраэдр. Благодаря наличию дипольного момента каждая молекула воды образует водородную связь с четырьмя соседними молекулами, составляя ажурный сетчатый каркас в молекуле льда. Однако в жидком состоянии вода – неупорядоченная жидкость; эти водородные связи – спонтанные, короткоживущие, быстро рвутся и образуются вновь. Все это приводит к неоднородности в структуре воды [1; 4; 6].
Воду можно рассматривать как оксид водорода или как гидрид кислорода. Атомы водорода и кислорода в молекуле воды расположены в углах равнобедренного треугольника с длиной связи О-Н 0,957 нм. Валентный угол Н-О-Н составляет 104°27' (рис. 1) [1; 4; 6].
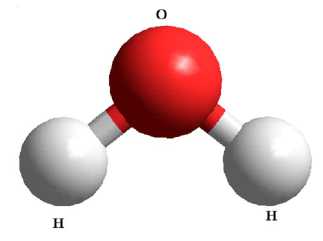
Рис. 1. Модель структуры молекулы воды
В работе проведено исследование геометрического и электронного строения молекулы воды, находящегося в основном состоянии. Проведены расчеты параметров равновесной геометрии, дипольного момента P , энергий верхней занятой ( E ВЗМО) и нижней вакантной ( E НВМО) молекулярных орбиталей, границы ультрафиолетового поглощения Es , колебательных частот инфракрасного спектров и удельной энергии Е уд молекулы воды. Оптимальная геометрия найдена методом сопряженных градиентов Полака-Рибейры с использованием функционалов энергии квантовохимических методов [3].
Значения длины связи R (O-H) и валентного угла H-O-H в молекуле воды, находящейся в равновесном состоянии, дипольного момента P и колебательных частот представлены в таблице 1. Значения энергий верхней занятой E ВЗМО и нижней вакантной Е НВМО молекулярных орбиталей, границы ультрафиолетового поглощения Es и удельной энергии Е уд молекулы воды представлены в таблице 2. Проведено сравнение полученных результатов с экспериментальными данными [1].
Таблица 1
Геометрические, дипольные и колебательные характеристики молекулы воды
|
Метод |
R (O-H), Е |
∠ H-O-H, ° P, Дб |
Колебательные частоты, см–1 |
|||
|
MNDO |
0,944 |
107,01 |
0,88 |
1 959 |
4 043 |
4 077 |
|
AM1 |
0,962 |
103,65 |
1,09 |
1 886 |
3 501 |
3 580 |
|
PM3 |
0,952 |
107,91 |
0,97 |
1 744 |
3 865 |
3 986 |
|
RM1 |
0,958 |
103,28 |
1,91 |
1 789 |
3 383 |
3 480 |
|
STO-3G |
0,989 |
100,02 |
1,71 |
2 170 |
4 139 |
4 390 |
|
6-31G** |
0,948 |
105,58 |
2,19 |
1 826 |
4 057 |
4 174 |
|
6-31++G** |
0,943 |
107,07 |
2,23 |
1 729 |
4 145 |
4 267 |
|
Эксперим. [1] |
0,957 |
104,27 |
1,82 |
1 595 |
3 567 |
3 756 |
Как следует из таблицы 1, лучшие геометрические параметры для длины связи и валентного угла и дипольного момента дает полуэмпирический метод RM1. Погрешность расчета составляет 0,1; 0,96 и 4,9 % соответственно. Для частот колебательного спектра наиболее близкие к эксперименту значения результаты получаются с помощью методов AM1, PM3 и RM1. Погрешность расчета по сравнению с экспериментом составляет 15,4; 1,9; 4,9; 8,5; 7,7; 5,8; 10,8; 5,4; 7,9 % соответственно.
Таблица 2
Энергетические характеристики молекулы воды
|
Метод |
E ВЗМО , эВ |
Е НВМО , эВ |
Е уд , эВ |
Es , эВ |
|
MNDO |
-12,2 |
5,4 |
-351,3 |
7,5 |
|
AM1 |
-12,5 |
4,4 |
-348,6 |
6,7 |
|
PM3 |
-12,3 |
4,1 |
-324,9 |
5,9 |
|
RM1 |
-12,2 |
4,1 |
-345,6 |
12,7 |
|
STO-3G |
-10,7 |
15,3 |
-2 039,9 |
12,5 |
|
6-31G** |
-13,6 |
6,0 |
-2 068,2 |
10,1 |
|
6-31++G** |
-13,9 |
1,2 |
-2 068,8 |
8,8 |
|
Эксперим. [1] |
-12,6 |
– |
– |
– |
Среди неэмпирических методов квантовой химии наилучшее согласие с экспериментом получено с помощью базиса 6-31G**.
Геометрическое и электронное строение димера воды в основном состоянии
Но поскольку оба водородных атома расположены по одну сторону от атома кислорода, электрические заряды в ней рассредоточиваются. Молекула воды полярная, что является причиной особого взаимодействия между разными ее молекулами. Атомы водорода в молекуле воды, имея частичный положительный заряд, взаимодействуют с электронами атомов кислорода соседних молекул. Водородная связь объединяет молекулы воды в своеобразные полимеры пространственного строения. В водяном паре присутствует около 1 % димеров воды. Расстояние между атомами кислорода – 0,3 нм [1; 4; 6].
На рисунке 2 изображена линейная конфигурация двух взаимодействующих молекул воды в газовой фазе. Равновесное расстояние О-Н-водородной связи равно 1,78 Е, а энергия разрыва водородной связи составляет примерно 5,5 ккал/моль–1, что на порядок меньше энергии ковалентных связей и на порядок больше энергии дисперсионных взаимодействий [1; 4; 6].
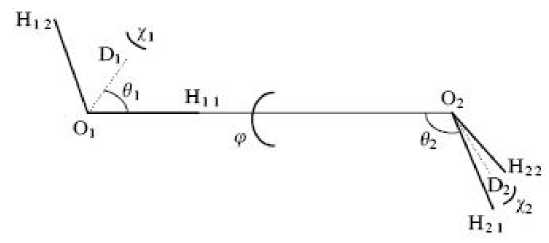
Рис. 2. Линейная конфигурация димера воды. Пять углов ( 9 1 , 9 2 , х 1 х 2, ф ) определяют относительную ориентацию между двумя молекулами.
Здесь r = 2,75 Е; 9 1 , = 57°; 9 2 = 135°; ф = 180°; х 1 = 90°; X 2 = 0°
Проведено исследование геометрического и электронного строения молекулы димера воды, находящегося в основном состоянии. Рассчитаны параметры геометрии, дипольный момент, энергии верхней занятой и нижней вакантной молекулярных орбиталей, удельная энергия Е уд и энергия связи NE молекулы димера воды. Равновесная геометрия димера воды найдена методом сопряженных градиентов Полака-Рибейры с использованием функционалов энергии квантово-химических методов [3].
В таблице 3 представлены геометрические параметры димера воды: длина связи в молекуле воды R (O1-H11), длина водородной связи R (H11-O2), расстояние между атомами кислорода R (O 1 -O 2 ) и угол водородной связи Z O 1 -H 11 -O 2 . Из таблицы 3 видно, что наилучшее совпадение с экспериментальными данными дают полуэмпирический метод PM3 и неэмпирический метод STO-3G.
Таблица 3
Геометрические характеристики димера воды в основном состоянии
|
Метод |
R (O 1 -H 11 ), Е |
R (H 11 -O 2 ), Е |
R (O 1 -O 2 ), Е |
Z O 1 -H 11 -O 2 , ° |
|
MNDO |
0,94 |
3,35 |
4,3 |
171,9 |
|
AM1 |
0,96 |
2,09 |
3,05 |
175,5 |
|
PM3 |
0,96 |
1,81 |
2,77 |
176,3 |
|
RM1 |
0,96 |
2,52 |
2,99 |
110,7 |
|
STO-3G |
0,99 |
1,75 |
2,74 |
179,6 |
|
6-31G** |
0,95 |
2,00 |
2,96 |
174,8 |
|
6-31++G** |
0,95 |
2,04 |
2,99 |
175,3 |
|
Эксперим. [1; 4] |
0,957 |
1,78 |
– |
180 |
Результаты расчета удельных энергий, дипольных моментов энергий верхней занятой (ВЗМО) и нижней вакантной (НВМО) молекулярных орбиталей димера воды представлены в таблице 4. Как видно из таблицы 4, значения энергий верхней занятой молекулярной орбитали E ВЗМО увеличиваются, а нижней вакантной молекулярной орбитали Е НВМО уменьшаются при образовании димера воды. Это свидетельствует об увеличении реакционной способности молекулы димера воды по сравнению с мономером.
Таблица 4
Электронно-энергетические характеристики димера воды в основном состоянии
|
Метод |
E ВЗМО , эВ |
Е НВМО , эВ |
Е уд , эВ |
Es , эВ |
P , Дб |
Д E , ккал/моль |
|
MNDO |
-11,9 |
5,2 |
-351,4 |
7,6 |
2,52 |
-0,9 |
|
AM1 |
-12,2 |
4,1 |
-348,6 |
6,9 |
2,9 |
-4,9 |
|
PM3 |
-11,7 |
3,4 |
-325,0 |
6,1 |
1,8 |
-3,5 |
|
RM1 |
-11,7 |
3,6 |
-345,6 |
6,4 |
3,9 |
-2,9 |
|
STO-3G |
-9,5 |
14,7 |
-2039,9 |
12,8 |
2,2 |
-5,9 |
|
6-31G** |
-12,8 |
5,2 |
-2068,4 |
10,4 |
2,01 |
-5,8 |
|
6-31++G** |
-13,1 |
0,9 |
-2068,9 |
9,1 |
3,1 |
-5,2 |
|
Эксперим. [4] |
– |
– |
– |
– |
– |
-5,5 |
Верхняя занятая молекулярная орбиталь димера сформирована электронами валентных оболочек атомов кислорода молекул воды, входящих в димер. Вклады каждой молекулы в эту орбиталь равнозначны, что свидетельствует о равновероятном нахождении электронов на каждой молекуле воды. Другими словами, в стационарном состоянии, соответствующем ВЗМО, электроны могут перемещаться от одной молекулы к другой.
Согласно квантово-химическим расчетам удельная энергия димера в целом оказывается больше по абсолютной величине, чем энергия молекулы. Это свидетельствует об энергетически более выгодном состоянии димера по сравнению с мономером.
Значение дипольного момента для димера сильно разнится с дипольным моментом молекулы в зависимости от использованного метода квантовой химии. Как показали результаты исследования молекулы воды, полуэмпирический метод RM1 дает наилучшее согласие с экспериментом.
Энергия связи D E димера воды наилучшим образом воспроизводится неэмпирическими методами 6-31G**, 6-31++G** по сравнению с экспериментальным значением.
Электронное строение заряженных димеров воды
Проведено исследование геометрического и электронного строения заряженных молекул димера воды. В качестве заряженных димеров исследовались положительные и отрицательные ионы. Равновесная геометрия димера найдена методом сопряженных градиентов Полака-Ри-бейры с использованием функционалов энергии квантово-химических методов. В качестве исходной использована геометрия основного состояния димера [3].
В таблице 5 представлены геометрические параметры положительного иона димера воды, полученные полуэмпирическими и неэмпирическими методами квантовой химии: длина связи в молеку- ле воды, длина водородной связи, расстояние между атомами кислорода и угол водородной связи. Из таблицы 5 видно, что практически все полуэмпирические и неэмпирические методы показывают образование энергетически устойчивого комплекса вида H3O...OH (рис. 3, а). Другими словами, происходит отрыв атома водорода и его перемещение к атому кислорода другой молекулы.
Таблица 5
Геометрические и энергетические характеристики положительного иона димера воды
|
Метод |
R (O 1 -H 11 ), Е |
R (H 11 -O 2 ), Е |
R (O 1 -O 2 ), Е |
∠ O 1 -H 11 -O 2 ,° |
E ВЗМО , эВ |
Е НВМО , эВ |
|
MNDO |
2,97 |
0,96 |
3,1 |
88,7 |
-17,6 |
-4,6 |
|
AM1 |
2,12 |
1,01 |
2,32 |
88,3 |
-18,7 |
-5,3 |
|
PM3 |
1,66 |
1,01 |
2,65 |
165,2 |
-19,3 |
-5,7 |
|
RM1 |
1,24 |
1,14 |
2,39 |
176,2 |
-20,1 |
-4,9 |
|
STO-3G |
1,27 |
1,10 |
2,37 |
178,4 |
-20,6 |
5,3 |
|
6-31G** |
1,48 |
1,06 |
2,47 |
153,6 |
-21,9 |
-1,6 |
|
6-31++G** |
1,58 |
1,00 |
2,57 |
174,2 |
-21,8 |
-3,8 |
В таблице 6 представлены геометрические параметры отрицательного иона димера воды, полученные полуэмпирическими и неэмпирическими методами квантовой химии. Из таблицы 6 видно, что практически все полуэмпирические и неэмпирические методы показывают удлинение одной из связей O-H до значения 1,3 Е и образование энергетически устойчивого комплекса вида H2O…OH…H (рис. 3, б ).
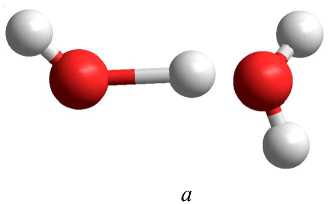
Рис. 3. Структуры положительно заряженного ( а ) и отрицательно заряженного ( б ) иона димера воды, рассчитанного с помощью метода ab initio 6-31++G**
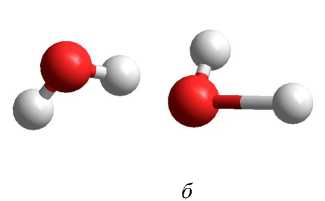
Таблица 6
Геометрические и энергетические характеристики отрицательного иона димера воды
|
Метод |
R (O 1 -H 11 ), Е |
R (H 11 -O 2 ), Е |
R (O 1 -O 2 ), Е |
∠ O 1 -H 11 -O 2 ,° |
E ВЗМО , эВ |
Е НВМО , эВ |
|
MNDO |
0,95 |
3,27 |
3,98 |
134,0 |
1,0 |
9,2 |
|
AM1 |
0,97 |
1,99 |
2,52 |
111,9 |
0,1 |
10,9 |
|
PM3 |
1,00 |
1,70 |
2,61 |
149,0 |
-1,6 |
10,0 |
|
RM1 |
1,10 |
1,31 |
2,41 |
172,8 |
-0,2 |
11,5 |
|
STO-3G |
1,1 |
1,26 |
2,36 |
177,7 |
1,7 |
25,4 |
|
6-31G** |
1,01 |
1,60 |
2,59 |
167,7 |
-2,8 |
12,1 |
|
6-31++G** |
0,95 |
1,99 |
2,93 |
166,4 |
0,7 |
4,6 |
Электронное строение возбужденных состояний димеров воды
Проведено исследование геометрического и электронного строения молекулы димера воды, находящегося в возбужденном состоянии. Изучено электронное строение димера воды в возбужденных состояниях с мультиплетностью χ = 3; 5. Проведены расчеты параметров геометрии, энергий верхней занятой и нижней вакантной молекулярных орбиталей димера воды. Равновесная геометрия димера воды в возбужденном состоянии найдена методом сопряженных градиентов Полака-Рибейры с использованием функционалов энергии квантово-химических методов. В качестве исходной использована геометрия основного состояния димера [3].
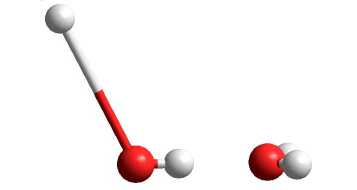
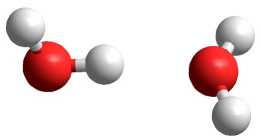
В таблице 7 представлены геометрические параметры димера воды, находящегося в возбужденном состоянии с мультиплетностью χ = 3: длина связи в молекуле воды R (O1-H11), длина водородной связи R (H11-O2), расстояние между атомами кислорода R (O1-O2) и угол водородной связи ∠ O1-H11-O2. Как видно из анализа геометрических параметров, практически все использованные неэмпирические методы квантовой химии (за исключением 6-31G**) показывают разрушение структуры димера (рис. 4, а ), то есть образование комплекса H2O…OH с отрывом одного атома водорода. Все использованные полуэмпирические методы сохраняют структуру димера с удлинением двух O-H связей до 1,1 Е в одной из молекул воды (рис. 4, б ).
а
Рис. 4. Структура димера воды с мультиплетностью χ = 3, рассчитанная методом ab initio 6-31++G** ( а ) и MNDO/PM3 ( б )
б
Таблица 7
Геометрические характеристики димера воды, находящегося в возбужденном состоянии с мультиплетностью χ = 3
|
Метод |
R (O 1 -H 11 ), Е |
R (H 11 -O 2 ), Е |
R (O 1 -O 2 ), Е |
∠ O 1 -H 11 -O 2 ,° |
E ВЗМО , эВ |
Е НВМО , эВ |
|
MNDO |
0,94 |
3,67 |
4,25 |
122,0 |
-8,3 |
-0,8 |
|
AM1 |
0,96 |
2,17 |
3,12 |
165,9 |
-7,8 |
-1,24 |
|
PM3 |
0,96 |
1,8 |
2,79 |
172,0 |
-8,3 |
-1,7 |
|
RM1 |
0,96 |
2,64 |
3,12 |
111,7 |
-8,2 |
-1,2 |
|
STO-3G |
1,01 |
1,77 |
2,78 |
176,6 |
-8,8 |
8,6 |
|
6-31G** |
0,95 |
2,11 |
3,05 |
167,1 |
-13,3 |
2,7 |
|
6-31++G** |
0,96 |
1,98 |
2,94 |
180,0 |
-13,2 |
0,8 |
В таблице 8 представлены геометрические параметры димера воды, находящегося в возбужденном состоянии с мультиплетностью χ = 5: длина связи в молекуле воды R (O1-H11), длина водородной связи R (H11-O2), расстояние между атомами кислорода R (O1-O2) и угол водородной связи ∠ O1-H11-O2. Как видно из анализа геометрических параметров, все использованные неэмпирические методы квантовой химии показывают разрушение структуры димера (рис. 5, а ), то есть образование комплекса HO…OH с отрывом двух атомов водорода от каждой молекулы. Все использованные полуэмпирические методы сохраняют структуру димера с удлинением двух O-H связей до 1,1 Е в обеих молекулах воды (рис. 5, б ).
Таблица 8
Геометрические характеристики димера воды, находящегося в возбужденном состоянии с мультиплетностью χ = 5
|
Метод |
R (O 1 -H 11 ), Е |
R (H 11 -O 2 ), Е |
R (O 1 -O 2 ), Е |
∠ O 1 -H 11 -O 2 ,° |
E ВЗМО , эВ |
Е НВМО , эВ |
|
MNDO |
0,94 |
3,67 |
4,25 |
122,0 |
-8,3 |
-0,8 |
|
AM1 |
1,05 |
2,40 |
3,4 |
163,1 |
-7,4 |
-1,0 |
|
PM3 |
0,95 |
1,83 |
2,78 |
172,6 |
-8,4 |
-1,9 |
|
RM1 |
1,05 |
2,77 |
3,02 |
66,3 |
-7,5 |
-0,8 |
|
STO-3G |
1,01 |
1,89 |
2,9 |
174,3 |
-10,8 |
8,2 |
|
6-31G** |
0,96 |
2,14 |
3,08 |
166,1 |
-13,3 |
2,1 |
|
6-31++G** |
0,96 |
2,14 |
3,10 |
176,0 |
-13,3 |
0,3 |
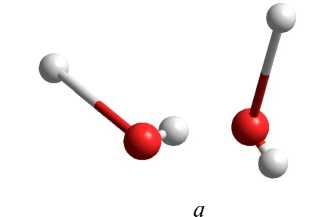
Рис. 5. Структура димера воды с мультиплетностью χ = 5, рассчитанная методами ab initio 6-31G** ( а ) и AM1 ( б )
Уровень энергии ВЗМО возбужденного состояния димера, рассчитанный полуэмпирически-ми методами, оказывается лежащим выше по сравнению с основным состоянием. Это свидетельствует об увеличении реакционной способности возбужденного димера.
Уровень энергии ВЗМО возбужденного состояния димера, рассчитанный неэмпирическими методами, оказывается лежащим ниже по сравнению с основным состоянием. Это является следствием разрушения молекулы и свидетельствует об уменьшении реакционной способности возбужденного димера.
Заключение
-
1. Проведено исследование геометрического и электронного строения молекулы воды, находящегося в основном состоянии, с помощью квантово-химических полуэмпирических методов и неэмпирических методов Хартри – Фока. Сравнение с экспериментальными данными показало, что наилучшее согласие результатов дает полуэмпирический метод RM1.
-
2. Проведено исследование димера воды, находящегося в основном и возбужденном состояниях. Получены геометрические и электронные характеристики равновесного состояния димера.
-
3. Показано, что практически все использованные методы квантовой химии дают образование энергетически устойчивого положительно заряженного комплекса H3O…OH и устойчивого отрицательно заряженного комплекса вида H2O…OH…H с удлинением одной O-H-связи в одной из молекул воды.
-
4. Получено, что в случае триплетного состояния димера практически все использованные неэмпирические методы квантовой химии (за исключением 6-31G**) показывают разрушение структуры димера, то есть образование комплекса H2O…OH с отрывом одного атома водорода. Все использованные полуэмпирические методы сохраняют структуру димера с удлинением двух O-H связей до 1,1 Е в одной из молекул воды.
-
5. Получено, что в случае состояния димера с мультиплетностью 5 все использованные неэмпирические методы квантовой химии показывают разрушение структуры димера, то есть образование комплекса HO…OH с отрывом двух атомов водорода от каждой молекулы. Все использованные полуэмпирические методы сохраняют структуру димера с удлинением двух O-H связей до 1,1 Е в обеих молекулах воды.
Список литературы Устойчивые геометрические конфигурации основного и возбужденных состояний димеров воды
- Зацепина, Г. Н. Физические свойства и структура воды/Г. Н. Зацепина. -М.: Изд-во МГУ, 1987. -171 с.
- Минкин, В. И. Теория строения молекул/В. И. Минкин, Б. Я. Симкин, Р. М. Миняев. -Ростов н/Д: Феникс, 1997. -560 с.
- Пономарева, Ю. В. Электронное строение и физико-химические свойства планарных кластеров воды: дис. магистра/Ю. В. Пономарева. -Волгоград: Изд-во ВолГУ, 2010. -97 с.
- Саркисов, Г. Н. Структурные модели воды/Г. Н. Саркисов//УФН. -2006. -Т. 176, № 8. -С. 833-845.
- Степанов, Н. Ф. Квантовая механика и квантовая химия/Н. Ф. Степанов. -М.: Мир, 2001. -519 с.
- Стехин, А. А. Структурированная вода: нелинейные эффекты/А. А. Стехин, Г. В. Яковлева. -М.: Изд-во ЛКИ, 2008. -320 с.


