Увеальная меланома: значение молекулярногенетического тестирования для раннего выявления метастатической болезни. Клинический случай
Автор: Яровая В.А., Голанов А.В., Назарова В.В., Зарецкий А.Р., Левашов И.А., Кулагина А.К., Мельникова Т.В., Матяева А.Д., Яровой А.А.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Клинический случай
Статья в выпуске: 1 т.14, 2024 года.
Бесплатный доступ
На сегодняшний день остается актуальным вопрос не только своевременной диагностики и лечения пациентов с увеальной меланомой (УМ), но и прогнозирования этой патологии. Технология тонкоигольной аспирационной биопсии (ТИАБ) позволяет оценивать риск развития метастатической болезни на материале опухоли у пациентов, которым проводится органосохраняющее лечение, путем исследования цитологических и молекулярно-генетических прогностических маркеров в материале первичной опухоли. Представленный клинический случай описывает впервые выявленную местнораспространенную (T3a) УМ, показывает возможности органосохраняющего лечения с использованием стереотаксической радиохирургии «Гамма-Нож», а также демонстрирует целесообразность проведения комплексного прогностического тестирования, включающего анализ морфологических и молекулярногенетических факторов прогноза. Результаты данного тестирования позволили рекомендовать более частый режим мониторинга метастатической болезни, что в конечном счете привело к раннему обнаружению метастатических очагов в печени с последующим успешным их лечением.
Увеальная меланома, тонкоигольная аспирационная биопсия, молекулярно-генетическое тестирование, прогностические классы, стереотаксическая радиохирургия
Короткий адрес: https://sciup.org/140305812
IDR: 140305812 | DOI: 10.18027/2224-5057-2024-14-1-83-91
Текст научной статьи Увеальная меланома: значение молекулярногенетического тестирования для раннего выявления метастатической болезни. Клинический случай
АКТУАЛЬНОСТЬ
Залогом успешного лечения увеальной меланом (УМ) (не только внутриглазной формы, но и диссеминированной) в настоящее время является тесное взаимодействие офтальмологов, радиотерапевтов, морфологов, генетиков и онкологов. В основе такого междисциплинарного подхода лежит выраженная органосохраняющая направленность в лечении УМ [1], что связано с отсутствием различий в выживаемости пациентов при сохранении глаза и при его удалении, а также новые принципы ведения пациентов, базирующиеся на возможности определения индивидуального риска развития метастазов УМ, их раннего выявления и лечения. Основой для определения раннего риска развития метастазов, в первую очередь, служит развитие прогностических генетических тестов [2], проведение которых возможно на материале опухоли, полученном при хирургическом удалении или тонкоигольной аспирационной биопсией (ТИАБ).
ЦЕЛЬ
Представить значение генетического тестирования УМ, проведенного на материале ТИАБ, для раннего выявления и лечения метастазов на примере одного клинического случая.
КЛИНИЧЕСКИЙ СЛУЧАЙ
Пациент Г., 52 лет, в феврале 2021 года обратился в МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова с жалобами на «шторку» перед левым глазом, появившуюся около 1 месяца назад. При этом острота зрения слева составляла 1,0. При осмотре глазного дна на средней периферии нижне-наружного квадранта визуализирован бугристый темно-серый очаг с вторичной отслойкой сетчатки на склонах (рис. 1, a).
По данным УЗИ, максимальная высота очага составила 9,5 мм, максимальная протяженность основания — 11,8 мм, высота отслойки сетчатки — 3,5 мм (рис. 1, c).
С учетом клинических и инструментальных методов исследования диагностирована УМ (хориоидеи) левого глаза стадии Т3а, согласно American Joint Committee on Cancer, AJCC (категория Т). Для исключения возможной диссеминации опухоли проведено МРТ органов брюшной полости с контрастированием «Примовист» (Гадоксетовая кислота, BAYER, Германия) и КТ легких, по результатам которых патологических очагов не выявлено.
Единственным возможным методом органосохраняющего лечения явилась стереотаксическая радиохирургия «Гамма-нож», проведенная по технологии, описанной нами ранее [1]. Предписанная доза составила 30 Гр по 50% изодозе (рис. 2). На следующий день после облучения с прогностической целью выполнена трансвитреальная ТИАБ, на материале которой цитологически определена веретеноклеточная УМ (рис. 3, a-c), а методом ПЦР-РВ выявлена характерная для УМ драйверная мутация — c. 626A > T, p. (Gln209Leu, Q209L) в экзоне 5 гена GNA11. Также на материале ТИАБ методом FISH были выявлены признаки делеции короткого плеча хромосомы 3 (3p) и амплификации длинного плеча хромосомы 8 (8q), что позволило установить у данного пациента крайне высокий риск развития метастазов УМ (4-й прогностический класс) [2]. В связи с полученными результатами пациенту было рекомендовано проведение МРТ брюшной полости с внутривенным контрастированием 1 раз в 3 месяца и КТ грудной клетки 1 раз в 4 месяца в рамках предложенного ранее режима мониторинга метастатической болезни при УМ с учетом прогностического класса [3].
Первое скрининговое МРТ органов брюшной полости с внутривенным контрастированием (через 3 месяца после установленного диагноза, май 2021 года) не показало никаких изменений. Повторное МРТ, проведенное с интервалом в 3 месяца (сентябрь 2021 года), выявило появление очага в S7 (рис. 4).
По результатам дополнительно проведенной позитронно-эмиссионной томографии, совмещенной с компьютерной томографией (ПЭТ-КТ) всего тела ( 18 F-фтор-дезоксиглюкоза) с контрастированием, были определены очаги патологического накопления в печени, без четкой дифференцировки узлов: в S7 до 31 мм, SUVmax 36,28
и в S8 — до 16 мм, SUVmax 19,48. Для морфологической и иммуноцитохимической верификации очагов в печени выполнена core-биопсия, подтвердившая меланоцитарную природу образований.
В ноябре 2021 г. выполнена изолированная химиогипер-термическая перфузия печени мелфаланом. В марте 2022 г.
при проведении повторного ПЭТ-КТ выявлена положительная динамика со стороны ранее пролеченных очагов в виде уменьшения их размеров и активности (в S7 размером 11 × 11 мм, SUVmax 5,5 и в S8 размером 8 × 9 мм, SUVmax 5,79), а также появление нового очага в S4 размером 13 мм, SUVmax 7,3, который, по результатам цитологического
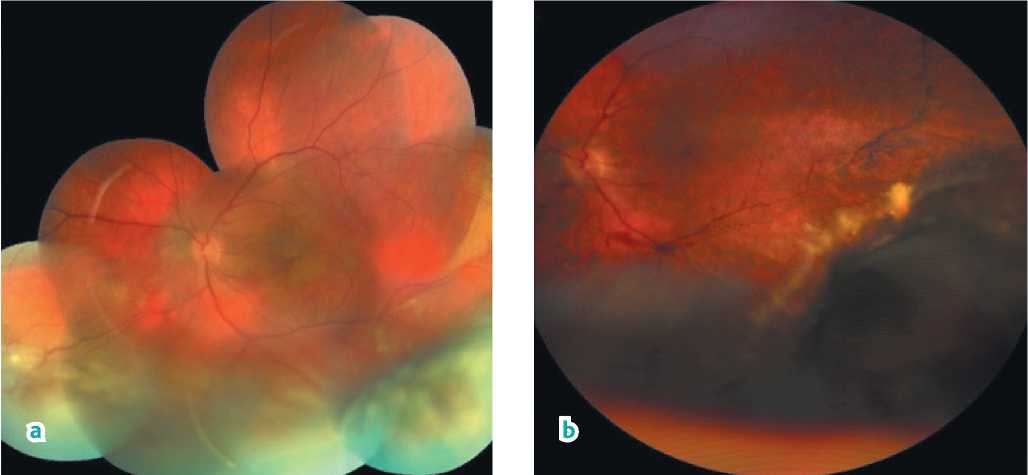
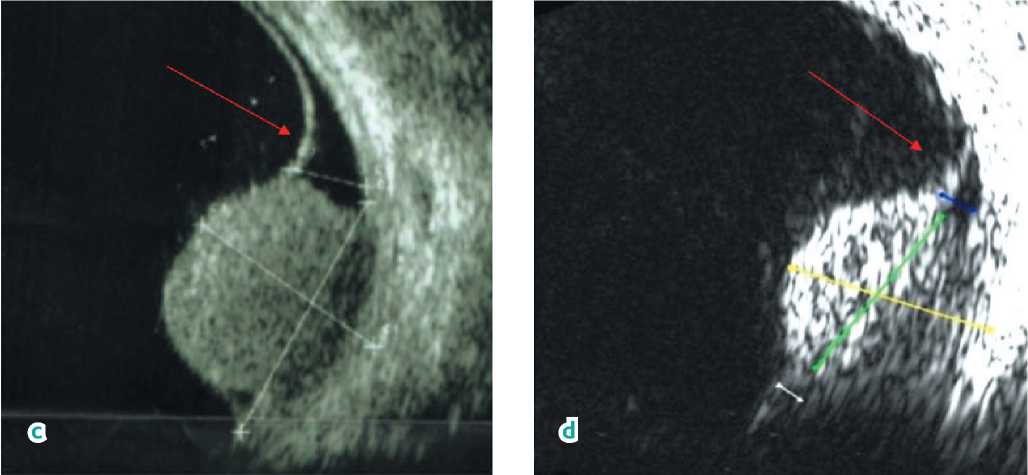
Рисунок 1. Картина глазного дна. a) До лечения: проминирующий пигментированный очаг в нижне-наружном сегменте, отслойка сетчатки в нижнем и наружном сегментах. b) После лечения: девитализированная опухолевая ткань с вторичными экссудативными и геморрагическими признаками. c) Ультразвуковое В-сканирование до начала лечения: проминирующий очаг 9,5 × 11,8 мм с локальной отслойкой сетчатки (красная стрелка). d) Ультразвуковое В-сканирование через 23 месяца от начала лечения: отмечается положительная динамика регрессии очага до 5,6 × 10,0 мм, локальная отслойка сетчатки уменьшилась (красная стрелка)
Figure 1. Ocular fundus picture. a) Before treatment: prominent pigmented lesion in the lower outer segment, retinal detachment in the lower and outer segments. b) After treatment: devitalized tumor tissue with secondary exudative and hemorrhagic signs. c) B-scan ultrasound before treatment: prominent lesion 9.5 × 11.8 mm with local retinal detachment (red arrow). d) B-scan ultrasound 23 months from the treatment start: regression of the lesion to 5.6 × 10.0 mm, local retinal detachment has decreased (red arrow)
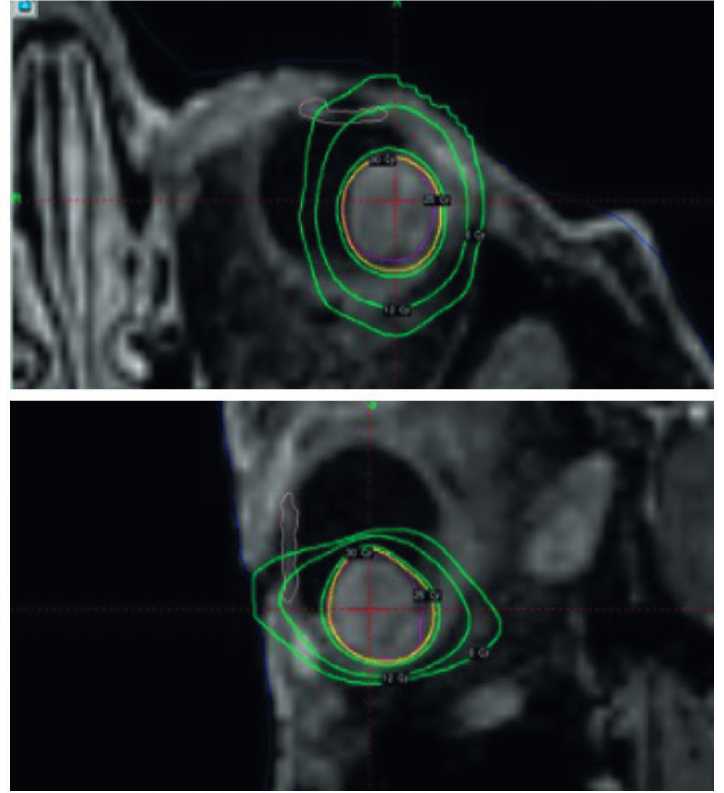
Рисунок 2. Планирование стереотаксической радиохирургии «Гамма-нож»
Figure 2. Planning for Gamma Knife stereotactic radiosurgery
исследования, соответствовал метастазу УМ. Выполнена криоабляция очага с последующим его полным регрессом по данным ПЭТ-КТ от июля 2022 г. Пациент находится под наблюдением без признаков прогрессии в течение 10 месяцев с момента последнего лечения.
При сроке наблюдения в 19 месяцев выявлена клинически полная регрессия внутриглазной меланомы: клинически определяется остаточный пигментированный опухолевый детрит, окруженный нежной зоной хориоретинальной атрофии без явлений отслойки сетчатки (рис. 1, b).
По результатам УЗИ на момент последнего осмотра максимальная высота образования составляет 5,6 мм, максимальная протяженность основания — 10,0 мм. При этом степень редукции опухоли определена на уровне 25% (рис. 1, d).
Купирование лучевых осложнений, а именно лучевой ретинопатии, возникшей на 3 месяц наблюдения, путем трехкратного интравитреального введения ингибиторов ангиогенеза «Луцентис» (Ранибизумаб, NOVARTIS
PHARMA, Швейцария) позволило сохранить зрение пациента на уровне 0,2 (рис. 5).
ОБСУЖДЕНИЕ
Средняя частота встречаемости УМ составляет 4,3 случаев на миллион, что примерно в 50 раз реже, чем встречаемость, например, кожной меланомы [4]. Так как патология является редкой, скрининг населения даже в развитых странах не проводится, а треть всех пациентов с диагнозом УМ имеют бессимптомный характер течения заболевания, что объясняет выявление УМ у представленного пациента на поздней стадии [5].
Большие размеры внутриглазного образования нередко являются показанием к энуклеации, считавшейся стандартным и единственным методом лечения до 1970-х годов [6]. Энуклеация и сейчас занимает важное место среди методов лечения УМ, однако современный вектор ведения пациентов критически сместился в пользу органо-
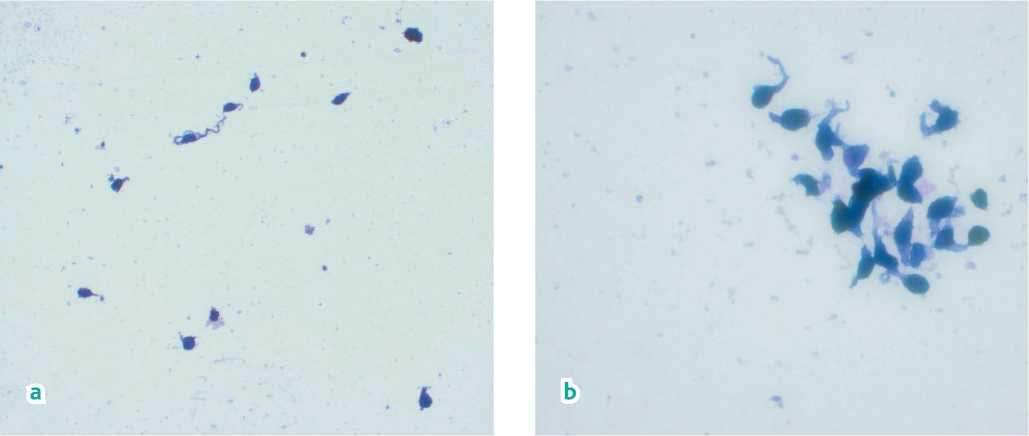
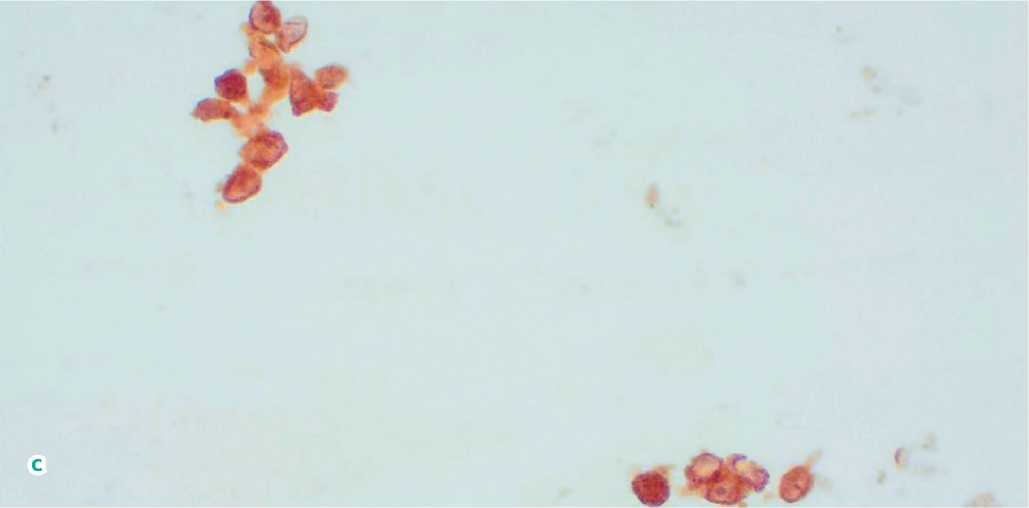
Рисунок 3. Цитологическое исследование биоптата. a) Увеальная меланома, преобладание клеток веретенообразной формы, выраженная пигментация цитоплазмы. Окрашивание азуром и эозином. Увеличение 20×. b) Увеальная меланома, преобладание клеток веретенообразной формы, выраженная пигментация цитоплазмы, клеточный полиморфизм.
Окрашивание азуром и эозином. Увеличение 40×. c) Увеальная меланома. Единичные клетки округлой формы с интенсивной ядерной экспрессией BAP1, преобладание клеток веретенообразной формы с потерей ядерной экспрессии BAP1 и наличием выраженной цитоплазматической экспрессии. Иммуноцитохимическое исследование. Окрашивание диаминобензидином. Увеличение 40×
-
Figure 3. Cytological examination of the biopsy specimen. a) Uveal melanoma, predominance of spindle-shaped cells, pronounced cytoplasmic pigmentation. Azure and eosin staining. Magnification 20×. b) Uveal melanoma, predominance of spindle-shaped cells, pronounced cytoplasmic pigmentation, cellular polymorphism. Azure and eosin staining. Magnification 40×. c) Uveal melanoma. A few round-shaped cells with intense nuclear expression of BAP1, predominance of spindle-shaped cells with loss of nuclear expression of BAP1 and the presence of pronounced cytoplasmic expression. Immunocytochemical study. Diaminobenzidine staining. Magnification 40×
сохраняющих методик благодаря полученным данным, свидетельствующим об отсутствии различий в выживаемости пациентов при проведении органосохраняющего и ликвидационного лечения. Так, 5-, 10- и 12-летняя смерт- ность у пациентов с гистологически подтвержденными метастазами УМ при проведении брахитерапии йодом-125 составила 10%, 18% и 21 % соответственно, а при проведении энуклеации — 11 %, 17% и 17% [6].
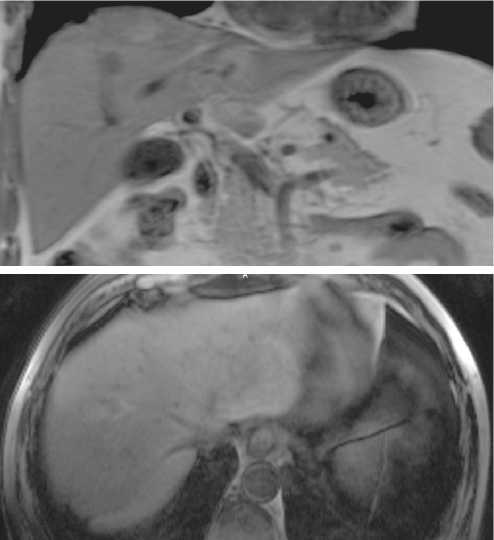
Рисунок 4. Магнитно-резонансная томография органов брюшной полости с внутривенным контрастированием с очагом метастазирования в S7 (26 × 29 мм) печени
-
Figure 4. Magnetic resonance imaging of the abdominal organs with intravenous contrast with metastasis in S7 (26 × 29 mm) of the liver
В настоящее время даже опухоли больших размеров могут быть успешно пролечены с использованием хирургических подходов и методов лучевой терапии, позволяя нередко сохранить не только глаз, но и зрение пациента. Так, брахитерапия с Ru-106 при УМ возможна в случае максимальной высоты образования до 8–10 мм [7], а эндорезекция (хирургическое удаление опухоли) позволяет сохранить глаза в случаях «грибовидных» центрально расположенных УМ на малом основании [8]. Для сохранения глаза при лечении «больших» УМ используются методы наружного облучения, такие как протонная терапия и стереотаксическая радиохирургия «Гамма-нож» [9]. Технология протонной терапии для лечения УМ, по данным имеющейся литературы, в РФ в настоящее время не представлена — последний пациент пролечен с использованием данной методики в 2011 году [10]. При этом стереотаксическая радиохирургия «Гамма-нож» активно и успешно применяется для лечения УМ, а опыт ее использования в РФ — с 2012 года [1,11]. Предписанные в представленном случае 30 Гр являются стандартными и соотносятся со средней дозой облучения УМ, описанной в самом крупном мета-анализе по стереотаксической радиохирургии «Гамма-нож», включающем 1010 пациентов из 52 медицинских центров [12]. Согласно тому же исследованию, контроль опухоли удается достичь в 96% (94–97%) случаев, регрессию — в 81 % (70–90%), а осложнения встречаются у 43% (30–57%) пролеченных пациентов [12]. При этом сохранение неактивного опухолевого детрита, а также наличие лучевой ретинопатии,
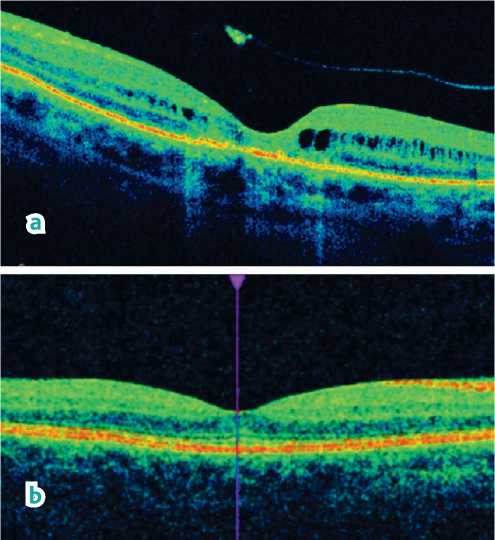
Рисунок 5. Данные оптической когерентной томографии.
a) До лечения: кистозный отек в макулярной зоне, отслойка нейроэпителия сетчатки. b) После трехкратного ИВВ ингибитора ангиогенеза: профиль сетчатки сохранен
Figure 5. Optical coherence tomography data. a) Before treatment: cystoid edema in the macular zone, retinal neuroepithelial detachment. b) After three-time intravenous angiogenesis inhibitor: the retinal profile is preserved как в представленном случае, являются закономерными при любом лучевом лечении УМ больших размеров.
Большие размеры внутриглазной опухоли в представленном клиническом случае — высота 9,5 мм — являются неблагоприятным фактором риска развития метастазов УМ. Shields C.L. с соавт. было доказано, что с каждым миллиметром увеличения проминенции опухоли риск развития метастазов увеличивается, в частности вероятность дис-семинации УМ при опухолях 8–9 мм и более 10 мм составляет 50% и 51% соответственно [3].
Риск развития метастазов УМ обусловлен не только клиническими факторами, но и в первую очередь генетическими, выявить которые удалось при проведении ТИАБ 25G. Для проведения ТИАБ УМ в отечественной практике используются тонкостенные биопсийные иглы, позволяющие получить информативный как цитологический, так и генетический материал [5]. Несмотря на цитологически верифицированный веретеноклеточный вариант УМ и имеющиеся данные об относительно «благоприятном» прогнозе такого морфологического типа УМ, примесь округлых клеток (3–5%), а также свидетельства о цитологической гетерогенности опухоли [13], заставляют относиться к данному прогностическому фактору несколько осторожно. При этом выявленные делеция 3р и амплификация 8q путем анализа маркерных регионов являются значимыми факторами прогноза, неоднократно валидированными в различных исследованиях. Так, выживаемость пациентов при делеции хромосомы 3 варьирует от 42% до 54% при сроках наблюдения от 2 до 8 лет, а при увеличении копийности 8q составляет 21% при 3-летнем сроке наблюдения [14]. Известным является факт резкого ухудшения прогноза при комбинации двух таких изменений [2]. Именно это стало основанием для «усиленного», отличного от стандартного [15], общепринятого обследования пациента, позволившего выявить единичные метастатические очаги в печени малых размеров, лечение которых на ранних этапах развития может иметь большую эффективность [16] на фоне общих цифр 1-летней выживаемости, не превышающей 15% [3]. Такой низкий уровень выживаемости стабилен на протяжении последних 30 лет [17]. По данным авторов, используемые методы лечения не сказываются на повышении выживаемости пациентов с метастатической формой
УМ, а стабилизация процесса расценивается как успех. Проведенная у представленного пациента изолированная химиоперфузия печени, а также абляция метастатических опухолей, позволили добиться регрессии очагов в печени с последующей длительной стабилизацией, что лишний раз доказывает возможность увеличения выживаемости при комплексном лечении пациентов с единичными метастатическими очагами небольшого размера [4,18].
ЗАКЛЮЧЕНИЕ
Описанный клинический случай демонстрирует возможности и ценность молекулярно-генетического тестирования УМ, проведенного на материале ТИАБ первичной опухоли, для раннего выявления и лечения метастатической болезни.
Список литературы Увеальная меланома: значение молекулярногенетического тестирования для раннего выявления метастатической болезни. Клинический случай
- Яровой А.А., Голанов А.В., Ильялов С.Р. и соавт. Стереотаксическая радиохирургия «Гамма-нож» как альтернатива энуклеации у пациентов с увеальной меланомой (первые результаты). Офтальмохирургия 2014;2:74-80.
- Яровой А.А., Демидов Л.В., Зарецкий А.Р., Яровая В.А., Назарова В.В., Чудакова Л.В. и др. Способ определения тактики ведения пациентов с увеальной меланомой: Патент № 2019136524. 2019
- Singh A.D., Bergman L., Seregard S. Uveal melanoma: epidemiologic aspects. Ophthalmol Clin North Am 2005;18(1):75- 84. https://doi.org/10.1016/j.ohc.2004.07.002
- Damato E.M., Damato B.E. Detection and time to treatment of uveal melanoma in the United Kingdom: an evaluation of 2384 patients. Ophthalmology 2012;119(8):1582-9. https://doi.org/10.1016/j.ophtha.2012.01.048
- Яровой А.А., Малюгин Э.Б., Яровая В.А. и соавт. Тонкоигольная аспирационная биопсия внутриглазных образований. Офтальмохирургия 2020;1:51-56. https://doi.org/10.25276/0235-4160-2020-1-51-56.
- Margo C.E. The collaborative ocular melanoma study: an overview. Cancer Control 2004;11(5):304-309. https://doi.org/10.1177/107327480401100504
- Яровой А.А. Органосохраняющее и функционально-сберегающее лечение меланомы хориоидеи на основе брахитерапии с рутением-106 и лазерной транспупиллярной термотерапии. Дис. ... д-ра мед. наук. М., 2010.
- Shah A.A., Bourne T.D., Murali R. BAP1 protein loss by immunohistochemistry: a potentially useful tool for prognostic prediction in patients with uveal melanoma. Pathology 2013;45(7):651-6. https://doi.org/10.1097/PAT.0000000000000002
- Damato B., Kacperek A., Errington D., Heimann H. Proton beam radiotherapy of uveal melanoma. Saudi J Ophthalmol 2013;27(3):151-157. https://doi.org/10.1016/j.sjopt.2013.06.014
- Саакян С.В., Бородин Ю.И., Ширина Т.В. Оценка эффективности лечения и выживаемости больных увеальной меланомой после лечения медицинским узким протонным пучком. Радиология-практика 2012;6:49-53
- Синявский О.А., Трояновский Р.Л., Иванов П.И. и соавт. Пятилетний опыт резекции увеальных меланом после стереотаксической радиохирургии с использованием гамма-ножа. Современные технологии в офтальмологии 2018;1:316-319.
- Parker T., Rigney G., Kallos J., et al. Gamma knife radiosurgery for uveal melanomas and metastases: a systematic review and meta-analysis. Lancet Oncol 2020;21(11):1526-1536. https://doi.org/10.1016/S1470-2045(20)30459-9
- Shields C.L., Say E.A. T., Hasanreisoglu M., et al. Personalized prognosis of uveal melanoma based on cytogenetic profile in 1059 patients over an 8-year period: the 2017 Harry S. Gradle Lecture. Ophthalmology 2017;124(10):1523- 1531. https://doi.org/10.1016/j.ophtha.2017.04.003
- Cicinelli M.V., Nicola M.D., Gigliotti C.R., et al. Predictive factors of radio-induced complications in 194 eyes undergoing gamma knife radiosurgery for uveal melanoma. Acta Ophthalmol 2021;99(8):e1458-e1466. https://doi.org/10.1111/aos.14814
- Яровая В.А. Прогностическая тонкоигольная аспирационная биопсия увеальной меланомы. Дис. ... канд. ме. наук. М., 2020.
- Kilic E., Naus N.C., van Gils W., et al. Concurrent loss of chromosome arm 1p and chromosome 3 predicts a decreased disease-free survival in uveal melanoma patients. Invest Ophthalmol Vis Sci 2005;46(7):2253-7. https://doi.org/10.1167/iovs.04-1460
- Singh N., Bergman L., Seregard S., Singh A.D. Uveal melanoma: epidemiologic aspects. Clinical Ophthalmic Oncology. Uveal Tumors 2014:75-88. https://doi.org/10.1007/978-3-642-54255-8_6
- Carvajal R.D., Schwartz G.K., Tezel T., et al. Metastatic disease from uveal melanoma: treatment options and future prospects. Br J Ophthalmol 2017;101(1):38-44. https://doi.org/10.1136/bjophthalmol-2016-309034


