Увеличение содержания каротиноидов в биомассе Vischeria punctatа Vischer при культивировании в лабораторном биореакторе
Автор: Кузнецова Т.А., Мустафакулов М.Х.
Журнал: Вестник Воронежского государственного университета инженерных технологий @vestnik-vsuet
Рубрика: Пищевая биотехнология
Статья в выпуске: 4 (102) т.86, 2024 года.
Бесплатный доступ
Микроводоросли Vischeria punctata Vischer, штамм IPPAS H-242 (ИФР РАН им. К.А. Тимирязева) культивировали в лабораторном фотобиореакторе, наилучшей средой для выхода биомассы стала среда Болда. Внесение в среду Болда цианокоболамина и тиамина не привели к увеличению выхода биомассы. Для увеличения содержания каротинидов в биомассе микроводорослей было использовано дозированное воздействие различных концентраций перекиси водорода: от 0,1 до 0,3 мл/л суспензии микроводорослей. Одновременно с перекисью водорода в суспензию вносили пиридоксин в концентрации 50 мг/л. Перекись и пиридоксин вносились каждые двое суток при культивировании V. punctata, которое продолжалось 10 суток. Добавки перекиси водорода приводят к снижению продолжительность экспоненциальной фазы роста в вариантах с внесением перекиси водорода 0,1 и 0,2 мл/л на 1 сутки, с внесением перекиси водорода 0,3 мл/л на 2 суток. Также в ответ на стрессовое воздействие отмечено уменьшение средних размеров клеток в популяции. В варианте с концентрацией перекиси водорода 0,3 мл/л происходит снижение популяционной емкости и содержания суммы каротиноидов в воздушно-сухой биомассе. В вариантах с внесением перекиси водорода 0,1 и 0,2 мл/л отмечено увеличение доли каротиноидов в пигментном комплексе по сравнению с контролем на 18,12±0,20 и 18,92±0,14 % соответственно. Наилучшим вариантом эксперимента стало внесение 0,2 мл перекиси водорода на 1 л суспензии микроводорослей, при этом выход биомассы достоверно не отличался от контрольного варианта, содержание суммы каротиноидов возрастает на 23,1 % по сравнению с контролем и достигает 5,97±0,27 мг/г воздушно-сухой биомассы.
Микроводоросли, Vischeria punctata, культивирование, перекись водорода, каротиноиды
Короткий адрес: https://sciup.org/140309670
IDR: 140309670 | УДК: 581.6 | DOI: 10.20914/2310-1202-2024-101-75-83
Текст научной статьи Увеличение содержания каротиноидов в биомассе Vischeria punctatа Vischer при культивировании в лабораторном биореакторе
Микроводоросли относятся к важнейшим возобновляемым ресурсам, источникам биологически активных веществ, таких как белок, углеводы, липиды, антиоксиданты, в том числе и каротиноиды [1]. Метаболизм многих штаммов микроводорослей лабилен. В ответ на дозированное
стрессовое воздействие в биомассе микроводорослей накапливаются липиды, углеводы и антиоксиданты. УФ-излучение [2], изменение кислотности среды, снижение температуры культивирования [3] приводит к накоплению каротиноидов.
Основной способ получения каротиноидов в промышленности – химический синтез [4].
This is an open access article distributed under the terms of the Creative Commons Attribution 4.0 International License
Биотехнологическое получение каротиноидов из микроводорослей связано с недостаточным изучением каротиногинеза и факторов позволяющих увеличить содержание каротиноидов в биомассе без уменьшения ее выхода.
Синтез каротиноидов описан в строме хлоропластов и на мембранах тилакоидов [5, 6], а также в цитоплазме микроводорослей [6]. Большое внимание обращено на микроводоросли (например, Chloromonas reticulata Gobi, Dunaliella salina, Haematococcus pluvialis, Scenedesmus almeriensis [7]), накапливающие вторичные каротиноиды вне хлоропластов – нефотосинтетические пигменты, локализованные во внетилакоидных структурах (липидных глобулах) [1]. В стрессовых условиях накопление вторичных каротиноидов связано с накоплением липидов [7,19]. Каротиноиды выполняют важную светособирающую, структурную функцию [8]. Ксантофиллы виолаксантинового цикла в присутствии активных форм кислорода защищают хлорофиллы и липиды от разрушения и обеспечивают устойчивость тилакоидных мембран при высокой интенсивности света [9].
Активные формы кислорода постоянно генерируются в электронно-транспортных цепях митохондрий и хлоропластов [8]. Молекулы Н 2 О 2 не заряжены, имеют низкую реакционную способность, в водных растворах они на расстояниях до 1 мкм. В небольших концентрациях молекулы перекиси являются внутриклеточными мессенджерами, в концентрациях от 1 до 50 мМ они токсичны для клеток [2]. Частью антиоксидантных систем являются ферментативные системы, удаляющие активные формы кислорода (супероксиддисмутаза, каталаза и др.), а также полиеновые соединения, к которым относятся каротиноиды [10,18]. Их антиоксидантная активность определяется наличием двойных связей в молекуле. Антиоксидантная активность каротиноидов in vitro зависит от содержания активных форм кислорода в среде [8].
Vischeria punctata Vischer – пресноводная микроводоросль, обитатель почв [10], неприхотлива при культивировании [11]. Штаммы этой микроводоросли перспективны, так как способны накапливать липиды, незаменимые жирные кислоты [12,20], например эйкозопентоеновую кислоту [11, 13]. Биомасса микроводоросли рассматривается как субстрат для получения биогаза [12]. При культивировании ее на бедных питательными средах эта микроводоросль накапливает экзо- и эндополисахариды [13]. Однако особенности культивирования и метаболизм V. punctata до конца не изучены. Биомасса V. punctata описана как источник β-каротина
Цель работы – определение режима направленного культивирования микроводорослей V. punctata для увеличения содержания каротиноидов в биомассе.
Материалы и методы
Образцы микроводоросли V. Punctate Vischer (штамм IPPAS H-242) была получена из коллекции Балтийского федерального университета им. Иммануила Канта.
Маточную культуру микроводоросли хранили при температуре от 3 до 4 ºС. После шести месяцев хранения маточная культура обновлялась, культивировалась на среде Болда [12] до фазы замедленного роста.
Для культивирования микроводоросли использовали лабораторный биореактор, представляющий собой барботажную колонну объемом 500 мл. Барботирование воздухом в режиме 1,5 л/мин. позволяет перемешивать клеточную суспензию. Определение концентрации клеток при культивировании проводили нефелометрически каждые сутки [5], предварительно суспензию перемешивали. Оптическую плотность определяли спектрофотометром ЮНИКО 1201, при длине волны 750 нм, в кювете сравнения ˗ питательная среда. Для определения оптической плотности каждые сутки отбирали аликвоту (10 мл), до необходимого объема доливали питательную среду. Применение сливно-долиной системы при культивировании микроводорослей позволяет удлинить период экспоненциального роста и увеличить плотность клеток на конец культивирования. Начальная концентрация клеток микроводоросли в питательной среде составляла не более 5 млн кл/мл. Режим освещенности день – 16 часов, ночь – 8 часов, лампа дневного света (ФАР), интенсивность освещенности – 20 кЛк на м2, Т(К) – 400. Культивирование проводили до фазы стабилизации, когда прекращается рост клеток в популяции микроводорослей. Удельную скорость роста находили по формуле:
Ц = ln ( x2 /x1 )/( t 2 - t 1 ) , (1)
где х 1 и х 2 – концентрация клеток, млн клеток на мл в момент времени t 1 и t 2 , соответственно.
Полученную при культивировании суспензию микроводорослей отстаивали в течение двух суток. После отделения питательной среды, сконцентрированную биомассу микроводорослей центрифугировали в режиме – 6000 об/мин в течение 5 минут. Надосадочную жидкость декантировали. Осадок высушивали на воздухе в тёмном месте при Т от 20 до 25 °С до постоянного веса. Хранили воздушно-сухую биомассу в закрытых стерильных ёмкостях при температуре 4–5 °С.
Экстракцию фотосинтетических пигментов проводили 96%-ным этанолом при ультразвуковом облучении на приборе «WiseClean WUC-A06H». Навеску воздушно-сухой биомассы 0,025 г. заливали 10 мл 96%-ного этанола (ГОСТ 5962–2013) и облучали на ультразвуковой ванне «WiseClean WUC-A06H» в режиме 35 кГц, при температуре 40 °С в течение 30 минут. Экстракт отделяли от биомассы центрифугированием в режиме 3500 об/мин в течение 5 минут на приборе СМ-6МТ. Содержание фракций фотосинтетических пигментов в этанольных экстрактах определяли спектрофотометрическим методом [14], определяли оптическую плотность при длинах волн 470 нм (сумма каротиноидов), 649 нм (хлорофилл b), 664 нм (хлорофилл а).
Для оценки состояния популяции клеток при культивировании в разных режимах проводили микроскопрование прижизненных препаратов при увеличении в 640 раз (микроскоп МикМед-6). Микрофотографии делали цифровой камерой IS-500 при использовании компьютерной программы МС-foto. Анализировали не менее 10 полей зрения в каждом варианте, измеряли не менее 50 клеток с помощью программы Le-venhuk. Пересчет в микрометры проводили с помощью коэффициента пересчета, для которого проводили измерения объект-микрометра (ОМП, 0,01 мм, ГОСТ 7513–55).
Полученные результаты статистически обрабатывались: находили среднее значение и ошибку средней. Достоверность отличий определяли, пользуясь критерием Стьюдента.
Результаты
Подбор оптимальной питательной среды для наращивания биомассы V. punctata. В известных базах данных по микроскопическим водорослям рекомендовано для культивирования V. punctata среды Прата и Болда (ВВМ 3N) [11] и модифицированы среда Болда (ВВМ 3N + V) [10], которая отличается наличием витаминов – цианокобаламина и тиамин гидрохлорида. Среда Болда и ее модифицированный вариант по сравнению со средой Прата, богаты нитратами, дополнительно включают соли цинка, кобальта и молиб- дена. Для определения оптимальной среды культивирования был проведен опыт с использованием трех рекомендованных сред (рисунок 1).
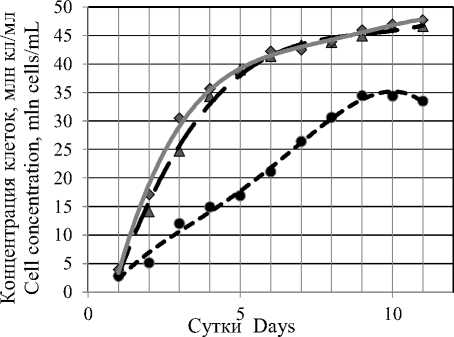
▲ Среда Прата ♦ BBM 3N+V • BBM 3N
Рисунок 1. Кривые культивирования Vischeria punctata в различных питательных средах
Figure 1. Cultivation curves of Vischeria punctata in different nutrient media
Лаг-фаза в вариантах не превышала суток, что характеризует высокую метаболическую активность популяции микроводоросли в маточной культуре. Максимальный скорость роста в среде Болда и ее модифицированном варианте наблюдали в первые 6 суток культивирования, далее она снижалась и к 9 ˗ 10 суткам наступала фаза стабилизации. Концентрация клеток в суспензии достигала 47,0 ± 4,5 млн кл/мл, при этом существенных различий в росте популяции V. punctata в среде Болда и ее модифицированном варианте не наблюдалось (таблица 1).
Среда Прата оказалась менее продуктивной, прирост биомассы наблюдался до 10 суток культивирования, при этом концентрация клеток в суспензии достигала 35,0 ± 3,0 млн кл/мл. На 11 сутки культивирования начинается фаза истощения.
Значение рН в питательных средах находилось в пределах 4,7–5,0. При культивировании V. punctata в течение 10–11 суток происходило увеличение значений рН до 9,88 в среде Прата, до 10,27 и в среде Болда и 10,02 в модифицированной среде Болда, что связано с усвоением нитрат-ионов из среды. Защелачивание среды способствует флокуляции клеток, при этом их метаболическая активность снижается, рост популяции замедляется.
Выход воздушно-сухой биомассы достигает 2,32 ± 0,21 и 2,26 ± 0,11 г/л (среда ВВМ 3N и ВВМ 3N + V соответственно), что выше, чем в среде Прата (1,15 ± 0,20 г/л).
Таблица 1.
Выход воздушно-сухой биомассы после культивирования Vischeria punctata в рекомендованных средах
Table 1.
Yield of air-dried biomass after cultivation of Vischeria punctata in recommended media
|
Питательная среда Nutrient medium |
Удельная скорость роста в экспоненциальную фазу, μ Specific growth rate in exponential phase, μ |
Популяционная емкость, К, млн кл/мл Population capacity, K, mln cl/mL |
рН на конец культивирования pH at the end of cultivation |
Выход биомассы, г/л Biomass yield, g / l |
|
Среда Прата |
0,279 |
33,49 |
9,88 |
1,15 |
|
ВВМ 3N |
0,543 |
46,60 |
10,27 |
2,32 |
|
ВВМ 3N + V |
0,442 |
47,69 |
10,02 |
2,26 |
Таким образом, наиболее эффективной для наращивания биомассы V. punctata оказалась среда ВВМ3N, добавка витаминов не имела существенного значения для накопления биомассы.
Исследование влияния добавки пиридоксина и различных концентраций перекиси водорода на показатели культивирования V. punctata. Дозированное внесение перекиси водорода и пиридоксина в питательную среду Болда проводили в первые сутки культивирования V. punctata, и каждые двое суток до конца культивирования, при этом суспензию микро-водорослей хорошо перемешивали. Перекись водорода в вариантах вносили в концентрациях от 0,1 до 0,3 мл/л суспензии микроводорослей. Совместно с перекисью в питательную среду вносили пиридоксин в концентрации 50 мг/л суспензии микроводорослей среды во всех вариантах (таблица 2). В контрольный вариант перекись и пиридоксин не вносили. Остальные условия культивирования (режим освещенности, температура) были такими же, как и в предыдущем эксперименте.
Таблица 2.
Схема эксперимента (базовая среда Болда)
Table 2.
Experimental design (Bold's base environment)
|
Вариант Option |
V питательной среды, мл V of nutrient medium, ml |
V H 2 O 2 , мл на 500 мл V H 2 O 2 , ml per 500 ml |
М пиридоксина, мг на 500 мл M pyridoxine, mg per 500 ml |
|
контроль control |
500 |
0 |
0 |
|
2 |
500 |
0,05 |
25 |
|
3 |
500 |
0,10 |
25 |
|
4 |
500 |
0,15 |
25 |
Продолжительность лаг-фазы в экспериментальных вариантах и в контроле не превышала суток. Экспоненциальная фаза роста в контрольном варианте на шестые сутки переходила в фазу замедленного роста (при концентрации 35,68 млн кл/мл). В вариантах с внесением перекиси водорода 0,1 и 0,2 мл/л суспензии микроводорослей экспоненциальная фаза завершалась на пятые сутки культивирования (при концентрации 39,31 и 36,86 млн кл/мл соответственно). В варианте со снесением перекиси водорода 0,3 мл/л суспензии микроводорослей экспоненциальная фаза завершалась на четвертые сутки культивирования (при концентрации 29,13 млн кл/мл) (рисунок 2).
Продолжительность культивирования V. punctata составляла 10 суток, при этом максимальная концентрация клеток достигала в вариантах с внесением перекиси водорода 0,1 и 0,2 мл/л (47,47 и 47,58 млн кл/мл соответственно). В варианте с добавлением перекиси водорода 0,3 мл/л суспензии микроводорослей концентрация клеток достигала 42,34 млн кл/мл, что ниже значений в контрольном варианте.
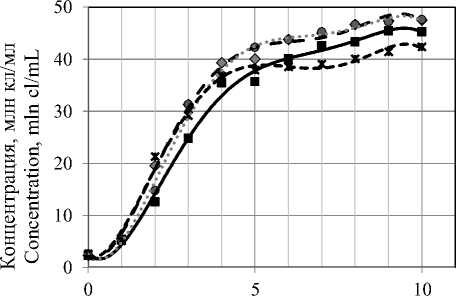
Сутки Days
V Н2О2, мл/л: ■ контроль (0) ♦0,1 о 0,2 ж 0,3
Рисунок 2. Кривые культивирования суспензий водорослей в среде (ВВM3N) с добавлением перекиси водорода разной концентрации
Figure 2. Curves of cultivation of algae suspensions in a medium (BBM3N) with the addition of hydrogen peroxide of different concentrations
В фазу стабилизации оценивали состояние популяции микроводорослей по микроскопической картине прижизненных неокрашенных препаратов. Наиболее информативным показателем, характеризующим средний размер клеток в популяции, стала площадь проекции клеток (таблица 3). При увеличении объема вносимой перекиси водорода площадь проекции уменьшается пропорционально количеству вносимой добавки.
В вариантах с внесением перекиси водорода 0,1 и 0,2 мл/л (варианты 2 и 3) отмечена тенденция к увеличению популяционной емкости по сравнению с контролем, что связано со стимулирующим влиянием фактора роста пиридоксина, увеличивался выход воздушно-сухой биомассы.
В варианте 4 происходит снижение популяционной емкости, что расцениваем как следствие неблагоприятного влияния наивысшей концентрации вносимой перекиси водорода (0,15 мл на 500 мл) на ростовые характеристики популяции микроводоросли.
Содержание пигментов в биомассе V. punctata , полученной при влиянии добавок пиридоксина и различных концентраций перекиси водорода. Спектрофотометрическим методом определяли содержание фракций пигментного комплекса (хлорофилла а, хлорофилла б и суммы каротиноидов) и их соотношения (таблица 4).
Таблица 3.
Выход воздушно-сухой биомассы после культивирования микроводоросли Vischeria punctata при добавлении перекиси водорода и пиридоксина
Table 3.
Yield of air-dried biomass after cultivation of microalgae Vischeria punctata with the addition of hydrogen peroxide and pyridoxine
|
Вариант | Option |
Удельная скорость роста в экспоненциальную фазу, μ Specific growth rate in exponential phase, μ |
Популяционная емкость, К, млн кл/мл Population capacity, K, million cells / ml |
Площадь проекции клеток, мкм2 Projection area of cells, µm2 |
Выход биомассы, г/л Biomass yield, g/l |
|
Контроль | control |
0,549 |
45,42 |
15,54 ± 0,84 |
2,32 |
|
2 |
0,572 |
47,47 |
15,58 ± 1,02* |
2,52 |
|
3 |
0,556 |
47,58 |
14,69 ± 1,11 |
2,66 |
|
4 |
0,667 |
42,34 |
14,46 ± 0,90 |
2,30 |
Примечание: ± доверительный интервал; *достоверные отличия с вероятностью 95%.
Note: ± confidence interval; * significant differences with a probability of 95%.
Таблица 4.
Сводная таблица содержания пигментов в биомассе в различных вариантах эксперимента
Table 4.
Summary table of pigment content in biomass in different experimental variants
|
Содержание пигментов, мг/г сухой биомассы The pigment content, mg/g dry biomass |
Образцы биомассы, полученные в различных условиях культивирования Biomass samples obtained under various cultivation conditions |
|||
|
Контроль Control |
Концентрация Н 2 О 2 мл/л суспензии V. punctata Concentration of H 2 O 2 ml/l of V. punctata suspension |
|||
|
0,1 |
0,2 |
0,3 |
||
|
Хлорофилл а | Chlorophyll a |
16,17 ± 0,69 |
18,35 ± 1,1** |
17,50 ± 0,76* |
17,73 ± 0,81* |
|
Хлорофилл б | Chlorophyll b |
7,04 ± 0,54 |
8,09 ± 0,588** |
8,09 ± 0,54* |
8,61 ± 0,39** |
|
Сумма каротиноидов | Sum of carotenoids |
4,85 ± 0,08 |
5,84 ± 0,29** |
5,97 ± 0,27** |
4,36 ± 0,29* |
|
Сумма пигментов | Pigment amount |
28,06 ± 1,24 |
32,28 ± 1,79** |
31,56 ± 1,47** |
30,70 ± 0, 1, 27* |
|
Доля каротиноидов от суммы пигментов, % The proportion of carotenoids from the amount of pigments, % |
17,32 ± 0,59 |
18,12 ± 0,49* |
18,92 ± 0,34** |
14,20 ± 0,539** |
|
Соотношение хлорофиллов а/б The ratio of chlorophyll a/b |
2,30 ± 0,12 |
2,27 ± 0,12 |
2,17 ± 0,10 |
2,06 ± 0,10* |
|
Хл (а + б)/Кар | Ch(a + b)/car |
4,78 ± 0,20 |
4,52 ± 0,15 |
4,29 ± 0,10 |
6,04 ± 0,22* |
Примечание: ± доверительный интервал; • достоверные отличия с вероятностью 95%, ** – достоверные отличия с вероятностью 99%
Note: ± confidence interval; • significant differences with a probability of 95%, ** significant differences with a probability of 99%
По результатам эксперимента было определено достоверное увеличение содержания суммы фотосинтезирующих пигментов в биомассе микроводорослей в вариантах с дозированным внесением перекиси водорода и пиридоксина, что связано с активирующим влиянием пиридоксина. Самая большая прибавка содержания суммы пигментов (на 15,0% по сравнению с контролем) отмечена в варианте с минимальной концентрацией вносимой перекиси 0,1 мл/л суспензии микроводорослей. Увеличение добавки перекиси снижает нарастание содержания пигментов: в варианте с добавкой 0,2 мл/л суспензии – на 12,5%, в варианте с добавкой 0,3 мл/л суспензии – на 9,4%.
Также отмечаем, что с увеличением доли вносимой перекиси происходит снижения содержания фракции хлорофилла а и увеличение содержания хлорофилла б, что связано с окислением хлорофилла а. Эта закономерность отражена в изменении отношения фракций хлорофиллов (таблица 4).
В вариантах с концентрацией вносимой перекиси 0,1 и 0,2 мл/л достоверно увеличивается содержание суммы каротиноидов по сравнению с контролем, на 20,4 и 23,1% соответственно. В этих вариантах проявился адаптационный потенциал популяции V. punctata . В варианте с внесением перекиси водорода 0,3 мл/л суспензии микроводорослей адаптационные возможности популяции микроводорослей недостаточны для преодоления стрессового воздействия. В этом варианте мы видим значимое уменьшение содержания суммы каротиноидов на 10,1% по сравнению с контролем.
В вариантах происходит изменение содержания различных видов пигментов, поэтому мы определили относительную величину: долю каротиноидов от суммы фотосинтезирующих пигментов. В вариантах с добавлением перекиси в концентрациях 0,1 и 0,2 мл/л происходит достоверное увеличение доли каротиноидов в пигментном комплексе по сравнению с контролем на 4,6 и 9,2% соответственно. А в варианте с внесением перекиси 0,3 мл/л доля каротиноидов существенно снизилась, на 18,0%, что предположительно связано с высокой стрессовой нагрузкой на антиоксидантные системы микроводорослей.
Обсуждение
Известно, что в хлоропластах образуются активные формы кислорода (АФК), в том числе и перекись водорода, которые при определенных условиях негативно влияют на мембраны тилакоидов [16]. Перекись водорода способна вызывать широкий спектр повреждений, в том числе связанных с перекисным окислением липидов (ПОЛ) [2, 3]. Перекись водорода также способна к окислению сульфгидрильных групп белков в клетках, эта характеристика может объяснять ингибирующее воздействие перекиси на ферменты цикла Кельвина [17].
Важное значение для осуществления фотосинтеза имеет как общее содержание фотосинтезирующих пигментов, так и соотношение различных видов пигментов. Внесение перекиси водорода в суспензию микроводорослей при культивировании в концентрациях от 0,1 до 0,3 мл/л совместно с пиридоксином (25 мг/л) один раз в двое суток, не приводит к уменьшению содержания суммы пигментов, но приводит к существенному изменению их соотношения, что характеризует значимое влияние на метаболизм фотосинтезирующих пигментов.
У высших растений в стрессовых условиях снижение показателя отношения суммы хлорофиллов к сумме каротиноидов в пигментном комплексе «Ch(a + b)/car» является следствием ПОЛ, которое сопровождается накоплением в фотосинтезирующих тканях малонового диальдегида (МДА) [16]. В нашем исследовании этот показатель снижается в вариантах с внесением перекиси водорода 0,1 и 0,2 мл/л по сравнению с контролем, однако учитывая отсутствие снижения суммы пигментов, фракций хлорофиллов и высокую интенсивность нарастания биомассы при культивировании, мы можем говорить о компенсированном стрессе.
В варианте с внесением 0,3 мл/л перекиси водорода происходит снижение содержания суммы каротиноидов в биомассе, что приводит к увеличению соотношения «Ch(a + b) / car», учитывая сниженные ростовые характеристики, мы характеризуем состояние этой популяции как стрессовое без оптимальной его компенсации.
Заключение
По результатам исследования можно сделать следующие выводы:
Наилучшее нарастание биомассы V. punctata (IPPAS H-242) отмечено в среде Болда. Среда Прада менее продуктивна и скорее подходит для сохранения культуры при холодильном хранении. Добавки витаминов в модифицированной среде Болда не привели к увеличению выхода биомассы V. punctata при культивировании.
Внесение перекиси водорода в концентрациях от 0,1 до 0,3 мл/л и 50 мг/л пиридоксина каждые двое суток в течение всего периода культивирования привело к уменьшению продолжительности экспоненциальной фазы роста. В контроле она длилась до 6 суток, в вариантах с внесением перекиси водорода 0,1 и 0,2 мл/л она укорачивается до 5 суток, а в варианте с внесением 0,3 мл/л перекиси водорода она длится до 4 суток. Выход биомассы и популяционная емкость в вариантах с внесением перекиси водорода 0,1 и 0,2 мл/л увеличивается по сравнению с контролем.
Анализ микроскопической картины показал, что в вариантах с внесением перекиси водорода наблюдается тенденция к уменьшению средних размеров клеток в популяции пропорционально доле вносимой перекиси.
Влияние добавки перекиси водорода разной концентрации в сочетании с пиридоксином не привело к уменьшению суммарного содержания фотосинтезирующих пигментов, однако отразилось на соотношении различных видов пиментов в исследуемом комплексе. Перекись водорода способствует окислению хлорофилла а, что отразилось в уменьшении соотношения хлорофилла а к хлорофиллу б. В вариантах с внесением перекиси водорода 0,1 и 0,2 мл/л отмечено увеличение доли каротиноидов в пигментном комплексе по сравнению с контролем на 18,12 ± 0,20 и 18,92 ± 0,14% соответственно. Усиленный каротиногенез отражает компенсаторные реакции на дозированное стрессовое воздействие, которое связано с ПОЛ. В варианте с внесением перекиси водорода 0,3 мл/л содержание каротиноидов снижается по сравнению с контрольным вариантом, что характеризует некомпенсированное стрессовое состояние популяции микроводорослей.
Максимальное содержание каротиноидов отмечено в варианте с внесением перекиси водорода 0,2 мл/л и составляет 5,97 ± 0,27 мг на г воздушносухой биомассы микроводоросли, что достоверно выше этого показателя в контроле на 41,3%.
Рекомендованный способ направленного культивирования V. punctata (штамм IPPAS H-242) позволит получить биомассу с увеличенным содержанием каротиноидов, без уменьшения выхода биомассы при культивировании. Полученную биомассу можно использовать для получения не только каротиноидов, но и других ценных биоактивных соединений для применения в пищевой, косметической и фармацевтической промышленности.


