Узловая терапия - новая возможность лечения коморбидных заболеваний
Автор: Ширинский Валерий Степанович, Ширинский Иван Валерьевич
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Обзоры и лекции
Статья в выпуске: 4 т.29, 2014 года.
Бесплатный доступ
В обзоре данных литературы и материалах собственных исследований обcуждаются некоторые аспекты проблемы терапии синтропных коморбидных заболеваний. Приводится патогенетическое обоснование использования препаратов, направленных на центральные межмолекулярные узлы, регулирующие процессы воспаления, липидного обмена, иммунные реакции у больных некоторыми аутоиммунными заболеваниями, характеризующимися высоким риском развития атеросклероза и его осложнений. На примерах использования фармакологического агониста PPARα фенофибрата, ингибитора ГМГ Ко А-редуктазы симвастатина у больных ревматоидным артритом (РА), остеоартритом (ОА), псориазом показана их клиническая эффективность и безопасность. Противовоспалительное действие в большинстве случаев ассоциировалось с липидкорригирующим и иммуномодулирующим эффектом. Обсуждаются данные о возможности применения селективных модуляторов NF-κB, обладающих плейотропными фармакологическими свойствами, в лечении коморбидной патологии при некоторых аутоиммунных ревматических заболеваниях. Анализируются данные литературы об использовании ингибитора фосфодиэстеразы-4 рофлумиласта в лечении коморбидной патологии у больных хронической обструктивной болезнью легких (ХОБЛ). Делается вывод, что использование лекарственных препаратов, направленных на межмолекулярные узлы-мишени, - один из перспективных, патогенетически обоснованных подходов фармакотерапии синтропных коморбидных заболеваний.
Коморбидность, синтропии, симвастатин, фенофибрат, ревматоидный артрит, остеоартрит, псориаз, рофлумиласт
Короткий адрес: https://sciup.org/14919974
IDR: 14919974 | УДК: 616-085:
Текст научной статьи Узловая терапия - новая возможность лечения коморбидных заболеваний
Согласно данным ВОЗ, 89% бремени болезни (индекс DALY) приходится на 15 основных заболеваний человека (сердечно-сосудистые, опухолевые, респираторной системы и др.), большинство которых являются заболеваниями хроническими неинфекционными, мультифак-ториальной природы (ВОЗ) [63]. Преобладающие причины смерти населения (96%) также вызваны этими заболеваниями, что в итоге наносит громадный экономический ущерб обществу. Так, по подсчетам специалистов, потери валового внутреннего продукта (ВВП) в России из-за высоких показателей DALY составили в 2011 г. 491 млрд долларов [9]. Сложность проблемы заключается в том, что у современного больного с хроническим мультифакториальным заболеванием типичной клинической картиной считается полипатия (коморбидность) [20].
Число пациентов с коморбидной патологией неуклонно растет во всем мире (с 42% в 1988–1994 гг. до 58% в 2003–2008 гг.) [63]. У 80% пожилых людей имеется 3 и более заболеваний, и это приводит к еще большему увеличению смертности, бремени болезни, финансовых затрат [1].
Особое место среди коморбидных заболеваний принадлежит синтропиям – “семейству” болезней, отличительной чертой которых являются наличие общих генов предрасположенности к заболеваниям, сходные эпигенетические и патогенетические механизмы [10]. Так, у больных с наиболее распространенными заболеваниями суставов (ОА и РА) число коморбидных заболеваний в возрасте 40 лет и старше превышает 3–4, а в структуре преобладают ишемическая болезнь сердца (ИБС), артериальная гипертензия, сахарный диабет и метаболичес- кий синдром [8, 39]. Есть основания считать, что сочетание перечисленных заболеваний относится к синтроп-ным коморбидным болезням [10, 20]. Неизбежная полипрагмазия синтропий обосновывает необходимость разработки новых подходов к их лечению. Одним из таких подходов является применение препаратов, способных модулировать центральные метаболические узлы (hub), участвующие в регуляции воспаления, липидного и углеводного обмена и др. [20]. В обзоре будут представлены материалы собственных исследований и данные литературы, посвященные научному и экспериментальному обоснованию, результатам клинического применения препаратов, обладающих плейотропным фармакологическим действием при некоторых синтропиях.
Некоторые общие патогенетические характеристики синтропий
Характерной чертой синтропий является определенное этиологическое и патогенетическое сходство [10, 20]. Можно предположить, что общность звеньев патогенеза, присущая синтропным коморбидным заболеваниям, носит универсальный характер и соответствует основным принципам общей патологии и системной биологии [11, 43]:
– возникновение, развитие и исходы заболеваний человека, их сочетания подчиняются общим закономерностям – типовым патологическим процессам (острое и хроническое воспаление, дистрофии и др.), их взаимным комбинациям; морфологической основой полипатий чаще всего является хроническое системное воспаление [2];
– патогенез одного заболевания, коморбидных заболеваний связан с изменениями универсальных сетевых процессов, происходящих на геномном, молекулярном, клеточном уровнях, которые приводят к поражению различных органов-мишеней;
– новые свойства сложных биологических систем (эмерджентность), характерные для полипатий, невозможно объяснить только с точки зрения их составляющих (отдельных болезней).
Эти положения являются ключевыми в системной биологии и медицине и считаются фундаментальной основой понимания развития синтропий. При этом следует помнить, что метаболические сети – это группы физически взаимодействующих белков, углеводов, липидов и др., которые функционируют совместно и координированно, контролируя взаимосвязанные процессы в организме. Графически сети могут быть представлены в виде совокупности узлов (hub), связанных друг с другом ориентированными (фермент – субстрат, ген – белок и др.) и неориентированными ребрами [4]. Выделяют центральные, имеющие большее количество связей, и периферические, имеющие меньшее количество связей, узлы сети.
Хорошо изучены такие центральные узлы межмолекулярных взаимодействий, как глюкокортикоидные рецепторы, рецепторы витамина D, метилтрансфераза ДНК, NF – кB, PPAR и ряд других [20]. Узлы разнородны по своей структуре: рецепторы клеточной поверхности, внутриклеточные рецепторы, ферменты, ионные каналы и др., однако все они обладают некоторыми сходными свойствами:
– центральные межмолекулярные узлы регулируют взаимосвязь различных путей метаболизма, воспаления, иммунных реакций и др.;
– изменение активности центральных узлов способствует развитию коморбидной патологии;
– узлы являются потенциальной терапевтической мишенью, и их модуляция может обеспечить многоцелевые эффекты, в том числе при коморбидной патологии.
Результатом вмешательств на такие узловые элементы при использовании агонистов или антагонистов является плейотропное фармакологическое действие (противовоспалительное, иммуномодулирующее, липидкор-ригирующее, антиангиогенное, противоостеопоретичес-кое и др.), приводящее в итоге к формированию клинического улучшения не только основного, но и сопутствующих заболеваний. Приведем примеры обоснования узловой фармакотерапии и ее эффективности при некоторых аутоиммунных заболеваниях с высоким риском развития атеросклероза и его последствий.
Актуальность проблемы аутоиммунных заболеваний и атеросклероза
Распространенность таких органонеспецифических аутоиммунных заболеваний, как РА, ОА и псориаз, достигает 14% населения [22, 29, 44]. Несмотря на большое число предложенных методов лечения, включая биологические препараты, у значительной части больных они не приводят к улучшению качества жизни, снижению риска ранней нетрудоспособности и смертности. Так, показано, что пятилетняя выживаемость больных РА сопоставима с выживаемостью пациентов, страдающих ишемической болезнью сердца и лимфогранулематозом [49].
Основной причиной высокой смертности больных аутоиммунными заболеваниями является раннее формирование и ускоренное прогрессирование коморбидной патологии – атеросклеротического поражения сосудов, обусловливающего развитие инфаркта миокарда, инсульта, застойной сердечной недостаточности и внезапной смерти [25, 35, 52]. РА, ОА и псориаз являются независимыми предикторами сердечно-сосудистых заболеваний [36, 41, 64]. Очевидно, что поиск методов профилактики и лечения кардиоваскулярных осложнений является не менее актуальной проблемой, чем разработка новых эффективных методов фармакотерапии самих болезней. Тем более, существующие в настоящее время методы системной терапии РА, ОА и псориаза не способны в достаточной мере снижать риск развития сердечно-сосудистых заболеваний или повышают его.
Установлено, что при хроническом воспалении изменения в иммунной системе сопряжены с изменениями липидного обмена в крови, печени, жировой и других тканях. Обсуждаются различные механизмы интеграции метаболизма липидов и иммунного ответа, в частности, связанные с активностью гидроксиметилглутарил-КоА-редуктазы (ГМГ Коэ А-редуктазы), синтезом холестерина, продуктов его промежуточного обмена [37] и актив- ностью ядерных рецепторов, активируемых пероксисомным пролифератором (peroxisome proliferator-activated receptors (PPAR) [61]. Предполагается, что эта взаимосвязь лежит в основе общности патогенеза аутоиммунных заболеваний и атеросклероза (синтропия), а ГМГ Коэ А-ре-дуктаза и PPAR являются потенциальными терапевтическими мишенями [18, 55].
Противовоспалительные и иммуномодулирующие свойства статинов обосновывают их применение у больных РА и псориазом
Липидкорригирующее действие статинов, их профилактическое и лечебное действие известно давно в результате большого числа хорошо проведенных клинических исследований, представленных в оригинальных статьях и обзорах [21, 26, 51]. Мы кратко охарактеризуем только холестериннезависимые, открытые совсем недавно свойства статинов, сославшись на основополагающие обзоры данных литературы [18].
Установлено, что в основе холестериннезависимого действия статинов лежит снижение синтеза промежуточных продуктов метаболизма холестерина, в частности, геранил-геранил пирофосфата (GGPP) и фарнезил пирофосфата (FPP). Присоединение гидрофобных молекул GGPP и FPP к белкам называется прениляцией (изопре-ниляцией). Прениляции подвержены белки, содержащие карбокситерминальную последовательность CaaX (где С – цистеин, а – алифатическая аминокислота и Х – любая аминокислота). В геноме человека содержатся гены более 100 известных и гипотетических СааХ-содержащих протеинов. Из них около 40 принадлежат к семейству малых ГТФаз, которые выполняют функцию внутриклеточных молекулярных переключателей. К ним относятся белки cell division cycle 42 (CDC42), RAC и гомолог RAS. Благодаря ГТФазам, статины способны оказывать противовоспалительное действие, изменять содержание и функциональные свойства фагоцитирующих клеток, различных субпопуляций Т-лимфоцитов, влиять на хемотаксис и молекулы клеточной адгезии. Помимо этого, пренили-рованные протеины оказывают иммуномодулирующее действие, влияя на подвижность лейкоцитов, захват, процессинг и презентацию антигена, активацию, пролиферацию и цитокинпродуцирующую функцию Т-лимфоцитов и др.
Следует отметить, что несмотря на противоречивость некоторых данных о противоспалительных и иммуномодулирующих свойствах статинов вследствие использования различных препаратов статинов и различных моделей, в целом выявляется их противовоспалительное и умеренное имуносупрессивное действие. Эти данные послужили основой для проведения ряда работ, в которых изучалась эффективность статинов при экспериментальных моделях аутоиммунных заболеваний у животных (аутоиммунные артриты, энцефаломиелиты и др.) [18]. В большинстве исследований было показано как профилактическое, так и лечебное противовоспалительное действие статинов, и это побудило инициировать работы, посвященные изучению эффективности и безопасности применения статинов у больных с различными аутоим- мунными заболеваниями, в частности РА.
Эффективность и безопасность применения статинов у больных РА
McCarey et al. провели рандомизированное, плацебо-контролируемое, 6-месячное исследование эффективности и безопасности аторвастатина у больных с активным РА. Было выявлено умеренное снижение индекса активности болезни (Disease Activity Index with 28 joint count, DAS28) на 0,5 [48].
Нами были проведены исследования клинической эффективности и безопасности симвастатина при активном РА [16, 57]. В исследование было включено 49 пациентов с активным РА, из которых 33 больных принимали симвастатин, а 16 – плацебо. Прием больными РА симвастатина в дозе 40 мг ежедневно на фоне стандартных DMARD уменьшал к концу 12-й недели лечения выраженность воспаления в суставах: число припухших суставов и острофазовые показатели, что свидетельствовало о клинической эффективности препарата. Клинический эффект симвастатина ассоциировался со снижением спонтанной и коллаген II индуцированной пролиферации МНК ПК, сывороточного ИЛ-17 [15, 16]. Показано, что модулирующее действие статинов на антигенспецифичес-кую продукцию ряда цитокинов обусловлено уменьшением содержания промежуточных продуктов синтеза холестерина изопреноидов [15]. Важно отметить, что противовоспалительное действие симвастатина при РА сопровождалось повышением содержания в ПК холестерина антиатерогенных субфракций липопротеинов, уменьшением содержания холестерина проатерогенных субфракций липопротеинов, иммунологических маркеров атеросклероза – С-реактивного белка (СРБ) и интерлейкина-6 (ИЛ-6), что свидетельствует об антиатерогенном действии препарата [17].
Эффективность и безопасность применения симвастатина у больных псориазом
В пилотное открытое исследование было включено 27 пациентов с умеренным и тяжелым вульгарным псориазом, 15 из которых принимали ежеденевно симвастатин в дозе 40 мг в течение 8 недель [19, 56]. Контрольная группа из 12 больных получала местное лечение. Обе группы были сопоставимы по полу, возрасту, длительности заболевания и показателю распространенности и тяжести псориаза PASI.
На 8-й неделе терапии в опытной группе выявлено статистически значимое улучшение PASI по сравнению с группой контроля. У 40% больных, принимавших симвастатин, на 8-й неделе лечения врачом было зарегистрировано полное/почти полное очищение кожи, в то время как в контрольной группе частота этого события достигала 15%.
Препарат хорошо переносился больными. Один больной преждевременно выбыл из исследования из-за выраженной головной боли, которая была расценена как следствие приема симвастатина.
Клинический эффект от приема симвастатина был ассоциирован с достоверным повышением уровня циркулирующего IL-10, но не IL-17 и IL-1. Важно отметить, что в опытной группе пациентов к концу лечения зарегистрировано повышение в сыворотке крови холестерина ряда субфракций липопротеинов высокой плотности.
Изменений содержания холестерина других субфракций липопротеинов в динамике после лечения симвастатином не выявлено [19].
Таким образом, полученные данные демонстрируют эффективность узловой терапии при использовании симвастатина – ингибитора ключевого фермента синтеза холестерина ГМГ Коэ А-редуктазы у больных РА и псориазом. Важно отметить, что селективное влияние препарата приводило к многоцелевым фармакологическим эффектам: противовоспалительно- му, иммуномодулирующему и липидкорриги-рующему только вследствие того, что фермент выполняет функцию центрального узла межмолекулярных взаимодействий. Механизм плейотропного действия симвастатина обусловлен снижением уровня промежуточных продуктов синтеза холестерина изопреноидов.
Другая перспектива лечения аутоиммунных заболеваний с высоким риском развития атеросклероза связана с применением агонистов PPAR- α фибратов, в частности – фенофибрата.
Противовоспалительные, липидкорриги-рующие свойства агонистов PPAR-α фибратов
PPAR – субсемейство ядерных рецепторов, отвечающих за внутриклеточную передачу сигналов от гормонов и других молекул. Они напрямую связываются с дезоксирибонуклеиновой кислотой (ДНК), регулируют экспрессию генов, выполняя роль факторов транскрипции белков, участвующих в реализации воспалении, липидном обмене, ангиогенезе и др. Фибраты и фенофибрат, относящийся к последнему поколению этой группы соединений, представляют собой фармакологические агонисты PPAR α . Ли-пидмодулирующие, противовоспалительные и иммуномодулирующие свойства фибратов описаны нами ранее [55], здесь мы ограничимся лишь основополагающими сведениями.
Липидмодулирующие свойства фибратов, выявленные у больных с традиционными факторами риска сердечно-сосудистых заболеваний, предполагают возможность улучшения липидного профиля при назначении препаратов и у больных РА. Хотя содержание триглицеридов в меньшей степени ассоциировано с риском сердечно-сосудистых заболеваний у больных РА, чем у людей без РА [53], можно предположить, что индуцированное фено-фибратом снижение уровня триглицеридов способно улучшать прогноз. Более того, в одном исследовании было показано, что при терапии фибратами снижение уровня адо№№М№№«№Шй^
Агонисты PPARo
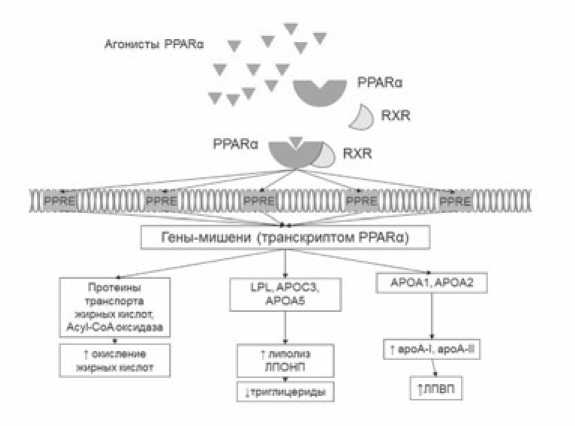
Рис. 1. PPARα и метаболизм липидов (адаптировано из: Shirinsky I.V., Shirinsky V.S. Targeting Nuclear hormone receptors: PPARalpha agonists as potential disease-modifying drugs for rheumatoid arthritis // Int. J. Rheumatol. – 2011. – Vol. 2011. – P. 937843)
k^j
- й а 1«-в ыигрещ* NF-cB
япиихе«к-в
Агонисты PPARa
AP.1
Трое крипто PW генсе еодируюи^и
гм I
Воспаление и разрушение сустава
Moneeww тмоч«й «V»
MW*i(CaX 2 NOowreie i
OOM1 VCAM-1)
•Ускоренный атеросклероз
Рис. 2. Гипотетическая модель PPARα-индуцированных противовоспалительных эффектов при РА (адаптировано из: Shirinsky I.V., Shirinsky V.S. Targeting nuclear hormone receptors: PPARalpha agonists as potential disease-modifying drugs for rheumatoid arthritis // Int. J. Rheumatol. – 2011. – Vol. 2011. – P. 937843)
триглицеридов является единственным параметром, ассоциированным с уменьшением риска коронарной болезни сердца [59]. Другой липидной мишенью фибратов являются липопротеиды высокой плотности (ЛПВП), содержание которых снижено при РА [45] и, по данным множества исследований, является предиктором сердечно-сосудистых катастроф [42].
Действие агонистов PPARα на провоспалительные маркеры изучалось в ряде экспериментальных моделей. Было показано, что агонисты PPARα подавляют активность индуцибельной синтазы оксида азота в макрофа- гах мыши [28] и экспрессию VCAM-1 в эндотелиальных клетках [47]. В клетках гладких мышц аорты человека агонисты PPARα уменьшают IL-1-индуцированную продукцию IL-6, простагландина и экспрессию циклооксигеназы-2 (ЦОГ-2) [58]. Помимо этого, лиганды PPARα приводят к TNF-α и IFN-γ индуцированному апоптозу макрофагов человека [27].
Первые доказательства противовоспалительного действия агонистов PPAR α in vivo у человека получены в исследованиях на пациентах с гиперлипидемией и метаболическим синдромом. Терапия фенофибратом приводит к уменьшению содержания в плазме IL-6, фибриногена и СРБ у пациентов с гиперлипидемией [58]. В исследовании, проведенном на больных с гиперлипопротеинеми-ей IIb и атеросклерозом, лечение микронизированным фенофибратом вызывало уменьшение содержания сывороточных TNF- α и IFN- γ [46]. Эти результаты были подтверждены данными плацебо-контролируемого исследования, показавшего уменьшение содержания СРБ и IL-6 после терапии фенофибратом [24]. Важно отметить, что противовоспалительные эффекты фенофибрата были независимы от его влияния на метаболизм липидов и глюкозы.
В некоторых работах изучались молекулярные механизмы противовоспалительного действия агонистов PPAR α . Показано, что PPAR α подавляет воспаление, уменьшая активность AP-1 и NF-кB в клетках гладкой мышцы аорты человека [32, 58]. Другим молекулярным механизмом противовоспалительных эффектов агонистов PPAR α является индукция экспрессии ингибитора NF-кB, выявленная в культурах гладких мышц аорты человека и гепатоцитах человека [33]. Обобщенные фармакологические эффекты фенофибрата, послужившие обоснованием применения препарата у больных РА и ОА, схематично представлены на рисунках 1, 2.
PPAR α образует гетеродимеры с ретиноидным RXR. Эти гетеродимеры связываются с PPRE, что приводит к повышению экспрессии ряда генов, участвующих в метаболизме липидов. Результатом является увеличение окисления жирных кислот, уменьшение содержания триглицеридов и повышение уровня ЛПВП. RXR – ретиноидный рецептор X; PPRE – элементы ответа на пероксисомный пролифератор; ЛПВП – липопротеин высокой плотности.
PPAR α уменьшает транскрипционную активность NFкB напрямую, индуцируя транскрипцию IкB или ингибируя миграцию NFкB в ядро. PPAR α также подавляет активность фактора транскрипции AP-1. Уменьшение активности NFкB и AP-1 приводит к уменьшению синтеза различных медиаторов, участвующих в поддержании воспаления в суставах и формировании атеросклеротической бляшки. NFкB: нуклеарный фактор кB, IкB: ингибитор кB, AP-1: активирующий протеин-1
Эффективность и безопасность применения фенофибрата у больных РА
В открытое плацебо-контролируемое исследование было включено 50 больных активным РА. Опытная груп- па состояла из 33 больных, контрольная группа – из 17 пациентов [14]. Базовые характеристики больных опытной и контрольной группы (пол, возраст, продолжительность болезни, препараты базисной терапии) не отличались. Пациенты основной группы получали помимо базисной терапии микроионизированный фенофибрат в суточной дозе 145 мг в течение 12 недель, пациенты группы контроля – только базисные препараты и плацебо. Первичная конечная точка – DAS28, вторичная ACR 20,50,70 – ответ.
Показано, что у пациентов, принимавших фенофиб-рат, начиная с 8-й недели лечения, регистрировалось достоверно более выраженное снижение интегрального показателя активности болезни DAS28. При анализе клинических компонентов DAS28 выявлено статистически значимое уменьшение всех параметров – числа припухших и болезненных суставов, общей оценки состояния здоровья пациентом. В группе фенофибрата умеренный ответ по критериям EULAR был зарегистрирован у 15 (60%) пациентов, ACR20, ACR50 и ACR70 – у 10 (40%), 4 (16%) и 1 (4%) больного соответственно. В контрольной группе умеренный EULAR-ответ развился у 3 (18,7%), ACR20, ACR50 и ACR70 – у 2 (12,5%), 0 (0%) и 0 (0%) пациентов, и эти показатели между группами статистически значимо отличались. Лечение фенофибратом было ассоциировано с достоверным уменьшением содержания биомаркеров активности воспаления и атеросклероза: сывороточного СРБ, IL-6, общего холестерина и триглицеридов. Зарегистрировано статистически значимое повышение уровня холестерина ЛПВП. Прием фенофибра-та не влиял на содержание циркулирующих эндотелиальных клеток-предшественников, IL-1, TNF- α , IL-17, IL-10, адипонектина и резистина. Серьезных нежелательных событий при приеме фенофибрата зарегистрировано не было.
Таким образом, результаты исследования демонстрируют другую эффективную возможность узловой терапии РА с высоким риском развития атеросклероза – применение агониста PPAR α фенофибрата, обладающего сходными со статинами плейотропными фармакологическими свойствами: противовоспалительными, липид-корригирующими и иммуномодулирующими. Мы провели исследование эффективности и безопасности фено-фибрата при другой воспалительной артропатии – эрозивном остеоартрите (ЭОА).
Эффективность и безопасность применения фенофибрата у больных ЭОА
ЭОА является субтипом генерализованного остеоартрита, сопровождающегося развитием системного воспаления, в развитии которого определенную роль играют провоспалительные цитокины и адипокины [23]. Учитывая тот факт, что противовоспалительное, липидкорри-гирующее и антиатерогенное действие агониста PPAR α фенофибрата было показано ранее, представлялось обоснованным изучить эффективность и безопасность фе-нофибрата в лечении больных и ЭОА [54].
В исследование “до–после” было включено 14 женщин с ЭОА, медиана возраста – 61,5 лет, которые получа- ли микронизированный фенофибрат в дозе 145 мг ежедневно в течение 12 недель. Первичной конечной точкой исследования был уровень боли, оцениваемый с помощью визуальной аналоговой шкалы ВАШ.
Установлено, что терапия фенофибратом приводит к статистически значимому уменьшению уровня боли и активности болезни, оцениваемой пациентом. Число припухших суставов к концу лечения не изменилось, наблюдалась тенденция к уменьшению количества болезненных суставов. Обращало на себя внимание достоверное снижение биомаркеров воспаления – содержания сывороточного СРБ и скорости оседания эритроцитов (СОЭ) в динамике после терапии фенофибратом. К концу терапии у 8 (57,14%) пациентов был зарегистрирован клинический ответ в соответствии с критериями OMERACT-OARSI.
Клинический эффект фенофибрата был сопряжен с уменьшением содержания в сыворотке крови общего холестерина и триглицеридов, IL-10. Другие лабораторные параметры не претерпели изменений. В динамике наблюдения пациентов не зарегистрировано нежелательных явлений.
Итак, прием фенофибрата больными ЭОА оказывает болеутоляющее действие. Анальгетический эффект фе-нофибрата ассоциирован с уменьшением лабораторных признаков системного воспаления. Применение фено-фибрата вызывает липидкорригирующий и иммуномодулирующий эффекты.
Таким образом, результаты исследований свидетельствуют о том, что у больных различными воспалительными артропатиями, псориазом – заболеваниями с высоким риском развития атеросклероза – терапия, направленная на изменение активности фермента ГМГ Коэ А-редуктазы, ядерного рецептора PPAR α , выполняющих функции центральных узлов межмолекулярных взаимодействий, эффективна и безопасна. Эффективность достигается в результате многоцелевого фармакологического действия, влияющего как на патогенез основного заболевания, так и на риск развития атеросклероза. Несмотря на то, что проведенные исследования являются предварительными, их результаты внушают оптимизм и определяют перспективу проведения более крупных рандомизированных испытаний эффективности узловой терапии при синтропных коморбидных заболеваниях, поиска новых межмолекулярных узлов – потенциальных терапевтических мишеней. К числу последних в последние годы относят ингибиторы NF-кB, фосфодиэстеразы 4, модуляторы метилирования ДНК, ацетилазы гистонов и др.
Примеры узловой терапии синтропных комор-бидных заболеваний другими препаратами
В этом разделе будут приведены примеры обоснования узловой терапии на основе других мишеней – нуклеарный фактор кB, ингибиторы фосфодиэстеразы 4, находящихся в различных стадиях разработки.
Нуклеарный фактор кB (NF-кB) является одним из главных транскрипционных факторов, отвечающих за адаптивные реакции клеток [5, 7, 30, 60], представляет собой семейство цитоплазматических белков, которые при стимуляции переходят в свободное состояние, перемещаясь в ядро, где проявляют активность, связываясь с промоторными участками более, чем 100 генов. NF-кB, являясь центральным узлом межмолекулярных взаимодействий, опосредует воспалительный и иммунный ответ, реакцию на вирусные инфекции, деление клеток и регуляцию апоптоза и др. [60].
Очевидно, что NF-кB играет важную роль в нормальном функционировании клетки, а нарушение функции NF-кB лежит в основе патогенеза многих воспалительных и опухолевых заболеваний, таких как РА, ОА, системная красная волчанка, спондилоартрит, атеросклероз, заболевания кишечника, астма, диабет 2-го типа, рак, болезнь Альцгеймера и др. и их сочетаний с другими заболеваниями [3, 31].
Большое количество исследований было посвящено изучению модуляции сигнальных путей NF-кB фармакологическими средствами. Оказалось, что многие давно применяемые препараты, включая нестероидные противовоспалительные и глюкокортикоиды, влияют на NF-кB [3, 5]. Необходимо помнить, что NF-кB играет важную физиологическую роль, и попытки подавлять активность фактора сопряжены с проблемой серьезных нежелательных эффектов. В настоящее время разрабатываются молекулы, способные селективно влиять на отдельные белки в сложном сигнальном каскаде с участием NF-кB, а также стратегии с антисенсной ДНК-терапией и влиянием на рибонуклеимновую кислоту (РНК; в этом направлении уже достигнуты определенные успехи. Использование селективных модуляторов NF-кB является отдаленной перспективой для лечения таких ревматических заболеваний, как ОА, РА, их сочетаний с атеросклерозом и другими заболеваниями [3].
По данным А.Л. Верткина [2] и других авторов [6], ХОБЛ часто сочетается с другими заболеваниями, в частности: с артериальной гипертонией в 85% случаев, атеросклерозом – в 64%, избыточным весом – в 39%. Есть основания считать, что патогенез некоторых коморбидных заболеваний при ХОБЛ сходен, и они относятся к числу синтропий [6]. Патогенетической основой синтропий при ХОБЛ является хронический воспалительный процесс, вовлекающий все структуры легочной ткани, в ряде случаев выходящий за рамки локального воспаления и приобретающий системный характер, при котором меняется клеточный и внеклеточный ансамбль воспаления. Напомним, что, по мнению В.А. Черешнева [13], хроническое системное воспаление (ХСВ) – это типовой, мульти-синдромный, патологический процесс, развивающийся при системном повреждении и характеризующийся тотальной воспалительной реактивностью эндотелиоцитов, плазменных и клеточных факторов крови, соединительной ткани, микроциркуляторными расстройствами в жизненно важных органах и тканях. Поэтому комплексная терапия коморбидных больных ХОБЛ включает в себя известные лекарственные средства, обладающие противовоспалительным эффектом, однако для уменьшения выраженности воспаления, протекающего в бронхах и склонного к системности, их назначения недостаточно. В последние годы разрабатываются и разрешены к при- менению новые более мощные противовоспалительные препараты, направленные на различные патогенетические мишени ХОБЛ. Они способны замедлить воспаление не только в бронхах и легких, но и приостановить вовлечение в системный воспалительный процесс других органов. Среди таких препаратов: ингибиторы фосфодиэстеразы-4, ингибиторы матриксной металлопротеазы-9, антагонисты хемокинов и цитокинов, ингибиторы ядер-ного фактора каппа-В, ингибиторы фактора некроза опу-холи-α и другие [40]. Нетрудно заметить, что среди перечисленных мишеней некоторые выполняют роль центральных узлов межмолекулярных взаимодействий (ФДЭ-4, NFkB).
Одним из препаратов этой группы является хорошо исследованный и зарегистрированный в Европе, США и РФ противовоспалительный препарат для перорального приема, ингибитор фосфодиэстеразы 4-го типа – роф-лумиласт (Даксас). Препарат обладает высокой селективностью действия и плейотропным фармакологическим эффектом. Многоцелевое действие достигается путем влияния на аденилатциклазную систему, которая осуществляет контроль над клеточными и гуморальными факторами воспаления, регулирует микробицидную активность, изменяет содержание сахара крови и др. [12, 38, 50, 62]. В ряде клинических исследований рофлумиласт продемонстрировал эффективность в отношении снижения частоты среднетяжелых и тяжелых обострений ХОБЛ, увеличения ОФВ1, снижения многих биомаркеров системного воспаления, в частности ФНО- α , ИЛ-1, ИЛ-6, С-РБ, ММП-9 и фибриногена [2, 12], что позволило включить препарат в обновленные рекомендации глобальной инициативы по обструктивному заболеванию легких (GOLD). Кроме того, в некоторых исследованиях при использовании рофлумиласта показана положительная клиническая динамика течения коморбидной патологии [2, 34, 38, 62], которая ассоциировалась с улучшением ряда лабораторных показателей, что в конечном итоге приводило к значительному улучшению качества жизни больных ХОБЛ.
Результаты этих исследований позволяют считать, что противовоспалительная терапия ХОБЛ у коморбидных пациентов с частыми обострениями и маркерами хронического системного воспаления может включать роф-лумиласт – современный препарат, профилактирующий развитие очередного обострения, снижающий риск декомпенсации не только основной, но и сопутствующей патологии, присутствующей у коморбидного больного ХОБЛ.
Заключение
Итак, одна из эффективных возможностей фармакотерапии синтропных коморбидных заболеваний – использование патогенетически обоснованных лекарственных препаратов, направленных на межмолекулярные узлы-мишени. Клиническая эффективность, многоцелевое действие, безопасность, фармакоэкономическое преимущество такой терапии является альтернативой полипрагмазии, неизбежной при полипатиях. Приведенные примеры результатов успешной узловой терапии комор- бидных заболеваний оптимистичны, однако потребуется еще досточно много времени и сил для проведения масштабных, рандомизированных клинических испытаний, которые позволят определить место такой терапии в лечении синтропной коморбидной патологии.
Список литературы Узловая терапия - новая возможность лечения коморбидных заболеваний
- Арьева Г.Т., Советкина Н.В., Овсянникова Н.А. и др. Коморобидные и мультиморбидные состояния в гериатрии (обзор)//Успехи геронтологии. -2011. -№ 4. -С. 612-619.
- Верткин А.Л., Скотников А.С., Губжокова О.М. Коморбидность при хронической обструктивной болезни легких: роль хронического воспаления и клинико-фармакологические ниши рофлумиласта//Лечащий врач. -2013. -№ 9. -С. 10-23.
- Головач И.Ю. Ядерный фактор κВ (NF-κB) как важный патогенетический фактор и новая мишень в лечении ревматических заболеваний//Рациональная фармакотерапия. -2012. -№ 3. -С. 45-51.
- Евин И.А. Сложные сети -новый инструмент изучения сложных систем//Сложные системы. -2013. -№ 2. -С. 66-74.
- Кайдашев И.П. NF-κB-сигнализация как основа развития системного воспаления, инсулинорензистентности, липотоксичности, сахарного диабета второго типа, атеросклероза//Международный эндокринологический журнал. -2011. -№ 3. -С. 35-42.
- Куценко М.А.,Чучалин А.Г. Парадигма коморбидности: синтропия ХОБЛ и ИБС//Российский медицинский журнал. -2014. -№ 5. -С. 389-392.
- Маянский А.Н., Маянский Н.А., Заславская М.И. Нуклеарный фактор κB и воспаление//Цитокины и воспаление. -2007. -№ 2. -С. 3-8.
- Мендель О.И., Наумов А.В., Верткин А.Л. и др. Остеоартроз и сердечно-сосудистые заболевания у лиц пожилого возраста: клинические и патогенетические взаимосвязи//Успехи геронтологии. -2010. -№ 2. -С. 304-313.
- Мосейко Е.Е. Оценка социальных и экономических потерь российского общества вследствие низкого уровня накопления капитала здоровья: методика QALY/DALY//Управление экономическими системами. -2013. -№ 5. -С. 34.
- Пузырев В. Генетический взгляд на феномен сочетанной патологии у человека//Мед. генетика. -2008. -№ 9. -С. 3-9.
- Саркисов Д.С., Пальцев М.А., Хитров Н.К. Общая патология человека. -М.: Медицина, 1997. -608 с.
- Синопальников А.И., Романовских А.Т. Рофлумиласт: новые возможности лечения ХОБЛ//Российский медицинский журнал. -2012. -№ 26. -С. 339.
- Черешнев В.А., Гусев Е.Ю., Юрченко Л.Н. Системное воспаление -миф или реальность?//Вестник Российской академии наук. -2004. -№ 3. -С. 219-227.
- Ширинский В.С., Половникова О.А., Калиновская Н.Ю. и др. Клиническая эффективность и безопасность применения агонистов рецепторов, активируемых пероксисомным пролифератором альфа, у больных ревматоидным артритом: открытое контролируемое исследование//Медицинская иммунология. -2014. -№ 1. -С. 71-80.
- Ширинский И.В., Желтова О.И., Соловьева Н.Ю. и др. Влияние статинов на пролиферацию лимфоцитов при ревматоидном артрите//Аллергология и иммунология. -2007. -№ 4. -С. 380-383.
- Ширинский И.В., Желтова О.И., Соловьева Н.Ю. и др. Эффективность и безопасность симвастатина при ревматоидном артрите -открытое контролируемое исследование//Медицинская иммунология. -2007. -№ 4-5. -С. 477-482.
- Ширинский И.В., Желтова О.И., Ширинский В.С. и др. Влияние симвастатина на активность болезни и содержание холестерина субфракций липопротеинов сыворотки крови у больных ревматоидным артритом//Терапевтический архив. -2008. -№ 3. -С. 63-65.
- Ширинский И.В., Козлов В.А., Ширинский В.С. Использование статинов -новый подход к терапии аутоиммунных заболеваний//Вестник РAМН. -2009. -№ 2. -С. 26-32.
- Ширинский И.В., Козлов В.А., Ширинский В.С. Коррекция липидного обмена и псориатического поражения кожи при использовании симвастатина//Российский журнал кожных и венерических болезней. -2007. -№ 6. -С. 29-31.
- Ширинский И.В., Ширинский В.С. Коморбидные заболевания -актуальная проблема клинической медицины//Сибирский медицинский журнал. -2014. -№ 1. -С. 7-12.
- Randomised trial of cholesterol lowering in 4444 patients with coronary heart disease: the Scandinavian Simvastatin Survival Study (4S)//Lancet. -1994. -Vol. 344. -P. 1383-1389.
- Abdel-Nasser A.M., Rasker J.J., Valkenburg H.A. Epidemiological and clinical aspects relating to the variability of rheumatoid arthritis//Semin. Arthritis Rheum. -1997. -Vol. 27. -P. 123140.
- Anandarajah A. Erosive osteoarthritis//Discov. Med. -2010. -Vol. 9. -P. 468-477.
- Belfort R., Berria R., Cornell J. et al. Fenofibrate reduces systemic inflammation markers independent of its effects on lipid and glucose metabolism in patients with the metabolic syndrome//J. Clin. Endocrinol. Metab. -2010. -Vol. 95. -P. 829-836.
- Boehncke W.H., Boehncke S. Cardiovascular morbidity in psoriasis: epidemiology, pathomechanisms, and clinical consequences//G. Ital. Dermatol. Venereol. -2008. -Vol. 143. -P. 307-313.
- Chapman M.J. Are the effects of statins on HDL-cholesterol clinically relevant?//Eur. Heart J. -2004. -Vol.6. -P. C58-C63.
- Chinetti G., Griglio S., Antonucci M. et al. Activation of proliferator-activated receptors alpha and gamma induces apoptosis of human monocyte-derived macrophages//J. Biol. Chem. -1998. -Vol. 273. -P. 25573-25580.
- Colville-Nash P.R., Qureshi S.S., Willis D. et al. Inhibition of inducible nitric oxide synthase by peroxisome proliferator-activated receptor agonists: correlation with induction of heme oxygenase 1//J. Immunol. -1998. -Vol. 161. -P. 978-984.
- Das S.K., Farooqi A. Osteoarthritis//Best Pract. Res. Clin. Rheumatol. -2008. -Vol. 22. -P. 657-675.
- De Siervi A., De Luca P., Moiola C. et al. Identification of new Rel/NFkappaB regulatory networks by focused genome location analysis//Cell Cycle. -2009. -Vol. 8. -P. 2093-2100.
- De Winther M.P., Kanters E., Kraal G. et al. Nuclear factor kappaB signaling in atherogenesis//Arterioscler. Thromb. Vasc. Biol. -2005. -Vol. 25. -P. 904-914.
- Delerive P., De Bosscher K., Besnard S. et al. Peroxisome proliferator-activated receptor alpha negatively regulates the vascular inflammatory gene response by negative cross-talk with transcription factors NF-kappaB and AP-1//J. Biol. Chem. -1999. -Vol. 274. -P. 32048-32054.
- Delerive P., Gervois P., Fruchart J.C. et al. Induction of IkappaBalpha expression as a mechanism contributing to the anti-inflammatory activities of peroxisome proliferator-activated receptor-alpha activators//J. Biol. Chem. -2000. -Vol. 275. -P. 36703-36707.
- Field S.K. Roflumilast, a novel phosphodiesterase 4 inhibitor, for COPD patients with a history of exacerbations//Clin. Med. Insights. Circ. Respir. Pulm. Med. -2011. -Vol. 5. -P. 57-70.
- Gabriel S.E. Cardiovascular morbidity and mortality in rheumatoid arthritis//Am. J. Med. -2008. -Vol. 121. -P. S9-14.
- Gelfand J.M., Neimann A.L., Shin D.B. et al. Risk of myocardial infarction in patients with psoriasis//JAMA. -2006. -Vol. 296. -P. 1735-1741.
- Greenwood J., Steinman L., Zamvil S.S. Statin therapy and autoimmune disease: from protein prenylation to immunomodulation//Nat. Rev. Immunol. -2006. -Vol. 6. -P. 358-370.
- Growcott E.J., Spink K.G., Ren X. et al. Phosphodiesterase type 4 expression and anti-proliferative effects in human pulmonary artery smooth muscle cells//Respir. Res. -2006. -Vol. 7. -P. 9.
- Gullick N.J., Scott D.L. Co-morbidities in established rheumatoid arthritis//Best Pract. Res. Clin. Rheumatol. -2011. -Vol. 25. -P. 469-483.
- Hakim A., Adcock I.M., Usmani O.S. Corticosteroid resistance and novel anti-inflammatory therapies in chronic obstructive pulmonary disease: current evidence and future direction//Drugs. -2012. -Vol. 72. -P. 1299-1312.
- Jonsson H., Helgadottir G.P., Aspelund T. et al. Hand osteoarthritis in older women is associated with carotid and coronary atherosclerosis: the AGES Reykjavik study//Ann. Rheum. Dis. -2009. -Vol. 68. -P. 1696-1700.
- Kapur N.K., Ashen D., Blumenthal R.S. High density lipoprotein cholesterol: an evolving target of therapy in the management of cardiovascular disease//Vasc Health Risk Manag. -2008. -Vol. 4. -P. 39-57.
- Kholodenko B.N., Bruggeman F.J., Sauro H.M. Mechanistic and modular approaches to modeling and inference of cellular regulatory networks//Systems biology. -Berlin: Springer, 2005. -P. 143-159.
- Kurd S.K., Gelfand J.M. The prevalence of previously diagnosed and undiagnosed psoriasis in US adults: results from NHANES 2003-2004//J. Am. Acad. Dermatol. -2009. -Vol. 60. -P. 218-224.
- Lakatos J., Harsagyi A. Serum total, HDL, LDL cholesterol, and triglyceride levels in patients with rheumatoid arthritis//Clin. Biochem. -1988. -Vol. 21. -P. 93-96.
- Madej A., Okopien B., Kowalski J. et al. Effects of fenofibrate on plasma cytokine concentrations in patients with atherosclerosis and hyperlipoproteinemia IIb//Int. J. Clin. Pharmacol. Ther. -1998. -Vol. 36. -P. 345-349.
- Marx N., Sukhova G.K., Collins T. et al. PPARalpha activators inhibit cytokine-induced vascular cell adhesion molecule-1 expression in human endothelial cells//Circulation. -1999. -Vol. 99. -P. 3125-3131.
- McCarey D.W., McInnes I.B., Madhok R. et al. Trial of Atorvastatin in Rheumatoid Arthritis (TARA): double-blind, randomised placebo-controlled trial//Lancet. -2004. -Vol. 363. -P. 2015-2021.
- Pincus T., Brooks R.H., Callahan L.F. Prediction of long-term mortality in patients with rheumatoid arthritis according to simple questionnaire and joint count measures//Ann. Intern. Med. -1994. -Vol. 120. -P. 26-34.
- Sabatini F., Petecchia L., Boero S. et al. A phosphodiesterase 4 inhibitor, roflumilast N-oxide, inhibits human lung fibroblast functions in vitro//Pulm. Pharmacol. Ther. -2010. -Vol. 23. -P. 283-291.
- Sacks F.M., Pfeffer M.A., Moye L.A. et al. The effect of pravastatin on coronary events after myocardial infarction in patients with average cholesterol levels. Cholesterol and Recurrent Events Trial investigators//N. Engl. J. Med. -1996. -Vol. 335. -P. 1001-1009.
- Salmon J.E., Roman M.J. Subclinical atherosclerosis in rheumatoid arthritis and systemic lupus erythematosus//Am. J. Med. -2008. -Vol. 121. -P. S3-8.
- Semb A.G., Kvien T.K., Aastveit A.H. et al. Lipids, myocardial infarction and ischaemic stroke in patients with rheumatoid arthritis in the Apolipoprotein-related Mortality RISk (AMORIS) Study//Ann. Rheum. Dis. -2010. -Vol. 69. -P. 1996-2001.
- Shirinsky I.V., Shirinsky V.S. Treatment of erosive osteoarthritis with peroxisome proliferator-activated receptor alpha agonist fenofibrate: a pilot study//Rheumatol. Int. -2014. -Vol. 34. -P. 613-616.
- Shirinsky I.V., Shirinsky V.S. Targeting nuclear hormone receptors: PPARalpha agonists as potential disease-modifying drugs for rheumatoid arthritis//Int. J. Rheumatol. -2011. -Vol. 2011. -P. 937-843.
- Shirinsky I.V., Shirinsky V.S. Efficacy of simvastatin in plaque psoriasis: a pilot study//J. Am. Acad. Dermatol. -2007. -Vol. 57. -P. 529-531.
- Shirinsky I.V., Zheltova O.I., Solovyova N.Y. et al. Changes in disease activity, cytokine production, and proliferation of peripheral blood mononuclear cells in patients with rheumatoid arthritis after simvastatin treatment//Scand. J. Rheumatol. -2009. -Vol. 38. -P. 23-27.
- Staels B., Koenig W., Habib A. et al. Activation of human aortic smooth-muscle cells is inhibited by PPARalpha but not by PPARgamma activators//Nature. -1998. -Vol. 393. -P. 790-793.
- Straczek C., Tafflet M., Barberger-Gateau P. et al. Do lipids and apolipoproteins predict coronary heart disease under statin and fibrate therapy in the primary prevention setting in community-dwelling elderly subjects? The 3C Study//Atherosclerosis. -2011. -Vol. 214. -P. 426-431.
- Vallabhapurapu S., Karin M. Regulation and function of NF-kappaB transcription factors in the immune system//Ann. Rev. Immunol. -2009. -Vol. 27. -P. 693-733.
- Varga T., Nagy L. Nuclear receptors, transcription factors linking lipid metabolism and immunity: the case of peroxisome proliferator-activated receptor gamma//Eur. J. Clin. Invest. -2008. -Vol. 38. -P. 695-707.
- Vollert S., Kaessner N., Heuser A. et al. The glucose-lowering effects of the PDE4 inhibitors roflumilast and roflumilast-N-oxide in db/db mice//Diabetologia. -2012. -Vol. 55. -P. 2779-2788.
- Wong C.Y., Chaudhry S.I., Desai M.M. et al. Trends in comorbidity, disability, and polypharmacy in heart failure//Am. J. Med. -2011. -Vol. 124. -P. 136-143.
- Van Halm V.P., Peters M.J., Voskuyl A.E. et al. Rheumatoid arthritis versus diabetes as a risk factor for cardiovascular disease, a cross sectional study. The CARRE Investigation.//Ann. Rheum. Dis. -2009. -Vol. 68(9). -P. 1395-1400.


