Валидация молекулярно-генетических маркеров гена восстановления Rfo у рапса селекции ВНИИМК
Автор: Гучетль С.З., Челюстникова Т.А., Стрельников Е.А.
Рубрика: Селекция, семеноводство и биотехнология сельскохозяйственных растений
Статья в выпуске: 1 (201), 2025 года.
Бесплатный доступ
Перспективы современной селекции рапса направлены на создание гибридов, которые могут давать прибавку урожайности и увеличение сбора масла до 50 %. Для промышленного производства гибридов используются технологии с привлечением линий с цитоплазматической мужской стерильностью (ЦМС) и линий, обладающих геном восстановления фертильности (Rfо), которые обеспечивают контролируемую гибридизацию. Использование маркеров гена Rfо может способствовать сокращению времени и стоимости получения гибрида. В связи с этим актуальна валидация маркеров гена восстановления фертильности для внедрения в селекционную практику. Для валидации маркеров гена Rfо испытали четыре пары праймеров и изофермент PGI2 на линияхвосстановителях фертильности пыльцы рапса и линиях с ЦМС, а также 103 растениях, фенотипированных по признаку фертильность – стерильность по наличию или отсутствию пыльцы в период цветения. Подобрана оптимальная буферная система для разделения изоферментов PGI2 в крахмальном геле. Аллель, обозначенный как Pgi2 FF, показал ассоциацию с геном Rfо. Однако визуализация маркера сложна, трудозатратна, дорога, в связи с чем использование белкового маркера неэффективно. Анализ линий рапса с помощью аллельспецифичных праймеров выявил ассоциацию трех ДНКмаркеров с признаком восстановления фертильности пыльцы. Их валидирование на фенотипированных растениях рапса, показало амплификацию ожидаемых маркерных фрагментов у растенийносителей гена Rfо в среднем в 96 % случаев. Обсуждаются возможные причины несоответствия фенотипического проявления признака и аллельного состояния маркера. С помощью ПЦР в режиме реального времени был оптимизирован процесс отбора носителей гена Rfо.
Рапс, Brassica napus, гибриды, ДНК-маркеры, восстановление фертильности, Rfо, валидация, маркер-ассоциированная селекция
Короткий адрес: https://sciup.org/142244403
IDR: 142244403 | УДК: 631.527:633.853.494 | DOI: 10.25230/2412-608X-2025-1-201-41-49
Текст научной статьи Валидация молекулярно-генетических маркеров гена восстановления Rfo у рапса селекции ВНИИМК
Введение. Рапс ( Brassica napus L.) – одна из значимых культур в агрокомплексе РФ. Содержание масла в семенах рапса достигает 50 %, содержание белка – до 30 %. Рапсовое масло используется как продукт питания и техническое сырье для изготовления смазочных материалов и биотоплива. Оставшийся после отделения масла шрот востребован в качестве добавки к комбикормам животных. Востребованность культуры влечет за собой расширение зон выращивания и увеличение сортового разнообразия. Перспективы современной селекции рапса направлены на создание гибридов. Сравнительные исследования традиционных сортов и гибридов показывают, что гетерозисный эффект дает прибавку урожайности на 34–48 % и увеличение сбора масла на 50 % [1]. Кроме того, переход от сортовой селекции к гибридной делает культуру коммерчески более выгодной для оригинатора.
Для промышленного производства гибридов культурных растений используются технологии с привлечением линий с цитоплазматической мужской стерильностью (ЦМС) и линий, обладающих геном восстановления фертильности (Rf), которые обеспечивают контролируемую гибридизацию. Для рапса известны более 10 ЦМС-систем. Каждая система характеризуется определенным уровнем стабильности восстановления фертильности в зависимости от условий среды. Для практического использования стабильность проявления признака восстановления фертильности в различных экологических условиях очень важна. В гибридной селекции рапса в основном используют системы ЦМС ogu , ЦМС pol , ЦМС MSL и ЦМС inap [2].
Основой гибридной селекции рапса ВНИИМК является система ЦМСogu. Тип цитопламатической мужской стерильности Ogura (ЦМСogu) в 1968 г. описан у не-идентифицированного сорта японского подвида редиса (Raphanus sativus L.) – дайкона [3]. Этот тип ЦМС является одним из самых распространенных и наиболее часто использующихся для производства гибридов F1 у сельскохозяйственных культур семейства Brassicaceae во всем мире [4]. Фертильность пыльцы при ЦМСogu восстанавливается в присутствии доминантного ядерного гена Rfo [5]. Ядерные гены восстановления фертильности (Rfо) супрессируют признак мужской стерильности. Стерильная цитоплазма Ogura и восстановитель фертильности Rfо были перенесены в рапс от одного из сортов редиса [6; 7; 8]. В коллекцию ВНИИМК доноры гена Rfо получены из Национального института сельскохозяйственных исследований (INRA, Франция). У растений рапса, несущих данный ген, преодолены нежелательные признаки (хлороз, низкая завязы-ваемость семян, высокое содержание глю-козинолатов) [9]. Процесс создания стерильных аналогов и линий-восстановителей фертильности включает многократные насыщающие скрещивания с оценкой и отборами при полевых испытаниях. Ранняя дифференциация растений, несущих ген Rfо, может устранить необходимость в тестировании родителей по потомству и способствовать значительному сокращению времени и стоимости получения гибрида. Для решения этой задачи эффективны ДНК-маркеры, ассоциированные с признаком восстановления фертильности. Исследования молекулярно-генетической основы цитоплазматической мужской стерильности и восстановления фертильности позволили разработать маркерные системы для диагностики признака фертильности, связанной с геном Rfo, например, аллель-специфические ДНК-маркеры, которые картированы в группе сцепления N 19 на одной из хромосом генома С [10]. Обнаружена совместная сегрегация признака восстановления мужской фертильности и изоферментных маркеров. Выявлено, что ген Rfо из генома редиса интро-грессирован в рапс с сегментом хромосомы, несущим маркер изофермента глюкозофосфатизомеразы (PGI-2). Уровень рекомбинации оценен в 0,25 ± 0,02 %. По фенотипическим проявлениям маркера PGI-2 дифференцированы гомозиготные и гетерозиготные по гену RfO растения рапса [11].
Оптимизирован процесс выявления растений с фертильной и стерильной пыльцой по изоферментным маркерам PGI- 2 с использованием вертикального электрофореза в полиакриламидном геле [12] .
Во ВНИИМК изучение рапса началось ещё в 1972 г. и в 1983 г. по 32 областям страны был районирован первый отечественный сорт безэрукового рапса ярового (тип «0») Кубанский. А с 1983 г. была начата полномасштабная селекционная работа с озимыми и яровыми формами рапса, направленная на создание безэруковых и низкоглюкозинолатных сортов («тип 00»). В настоящее время в селекции рапса ярового, как и озимого, практически во всех селекционных программах в мире перешли к созданию межлинейных гибридов на основе ЦМС. Во ВНИИМК также ведется работа по созданию отечественных гибридов ярового рапса. В качестве исходного материала для получения линий используются лучшие сорта отечественной и зарубежной селекции, а также внутривидовые гибриды. Создаются и изучаются аналоги родительских линий и экспериментальные гибриды [13]. С использованием системы ЦМС ogu в 2000–2020 гг. создан первый отечественный простой межлинейный гибрид рапса озимого Дебют [14]. В связи с этим актуальна валидация уже известных маркеров гена Rfo и системы ЦМС на исходном материале для гибридной селекции рапса ВНИИМК, а также разработка системы маркеров для внедрения в селекционную практику по отбору растений рапса с требуемыми признаками.
Материалы и методы. Для валидации маркеров гена Rfо в качестве материала исследования использованы 10 линий-восстановителей фертильности пыльцы рапса озимого и 10 линий рапса с ЦМС и отобранные в фитотронно-тепличном комплексе во время цветения 103 растения линий рапса, представляющие собой материнские стерильные А-формы гибридов, растения-закрепители стерильности (Б-формы) и фертильные отцовские формы с геном Rfо, восстанавливающие фертильность гибридов, полученные из отдела селекции рапса и горчицы ВНИИМК. Для каждого из этих растений определен фенотип по признаку фертильность – стерильность по наличию или отсутствию пыльцы в период цветения. ДНК выделяли из молодых листьев рапса с использованием набора для выделения нуклеиновых кислот Экстран-3 (Синтол, РФ). Концентрацию и качество (А260/280 и А260/230) выделенной ДНК определяли на спектрофотометре Micro-Spectrophotometer Nano-300 (Allsheng, КНР). Для маркирования гена Rfо у рапса использовали четыре пары праймеров, разработанных на аллель-специфичные маркеры к гену Rfo BnRFO-F1/BnRFO-AS1; BnRFO-AS2F/BnRFO-AS2R; BnRFO-F1/BnRFO-DL2R; BnRFO-F3/BnRFO-R3 [12] и одну изоферментную систему PGI-2 (глюкозо-6-фосфат изомеразу) [11].
ПЦР проводили в 25 мкл реакционной смесь включающей: 2,5 мкл 10-кратного Taq ДНК полимеразного буфера, 3 мM MgCl 2 , по 0,2 мM каждого дезоксирибонуклеозидфосфата, по 10 пМ праймеров, 1 ед. рекомбинантной термостабильной ДНК полимеразы (Сибэнзим, Москва) и 10 нг матричной ДНК. ПЦР проводили в ампли-фикаторе MiniAmp (Thermo Scientific, США). Разделение продуктов амплификации осуществляли в 1,8 % агарозном и в 8 % полиакриламидном геле с использованием камер для горизонтального и вертикального электрофореза SE-20 и VE-20 (Хели-кон, Россия) соответственно. Ампликоны окрашивали бромистым этидием. Визуализацию и документирование результатов проводили с использованием гель-доку-ментирующей системы Geno-Senc Touch (Clinx Science Instruments, КНР). ПЦР в режиме реального времени проводили в ам-плификаторе QuantStudio5 (Thermo Fisher Scientific, США) с использованием набора реагентов для ПЦР-РВ в присутствии SYBR Green I (Синтол, РФ).
Результаты и обсуждение. Поиск и анализ литературных источников о маркировании гена-восстановителя фертильности (Rfо) позволил найти способы маркирования искомого гена с использованием методов анализа ДНК [2; 10]. На наборе 20 генотипов с Rfо и ЦМС-линий нами проведено апробирование четырех пар праймеров, сконструированных к интрогрессированной в геном рапса последовательности Rfо редиса (BnRFO-F1/BnRFO-AS1; BnRFO-AS2F/BnRFO-AS2R; BnRFO-F1/BnRFO-DL2R; BnRFO-F3/
BnRFO-R3) [10]. К данным парам праймеров экспериментальным путем были подобраны оптимальные температуры отжига при ПЦР. Апробирование температуры отжига праймеров проводилось при температурах 55 °С, 58 °С и 60 °С (табл. 1).
Таблица 1
Характеристика маркеров гена Rfo, апробированных на 20 линиях с ЦМС и Rf отдела селекции рапса и горчицы ВНИИМК
|
Комбинация праймеров |
Температура отжига (°С) |
% соответствия признак – маркер |
||
|
BnRFO-F1/ BnRFO-AS1 |
55 |
58 |
60 |
80 |
|
BnRFO-AS2F/ BnRFO-AS2R |
55 |
58 |
60 |
70 |
|
BnRFO-F1/ BnRFO-DL2R |
55 |
58 |
60 |
84 |
|
BnRFO-F3/ BnRFO-R3 |
55 |
58 |
60 |
нет полиморфизма |
Для пар праймеров BnRFO-F1/BnRFO-DL2R температура отжига составила 55 °С, а BnRFO-F1/BnRFO-AS1, BnRFO-AS2F/Bn-RFO-AS2R и BnRFO-F3/BnRFO-R3 – 58 °С.
Анализ линий рапса с помощью аллель-специфичных праймеров показал ассоциацию трех ДНК-маркеров (BnRFO-F1/BnRFO-AS1; BnRFO-AS2F/BnRFO-AS2R; BnRFO-F1/BnRFO-DL2R) с геном Rfо (рис. 1).
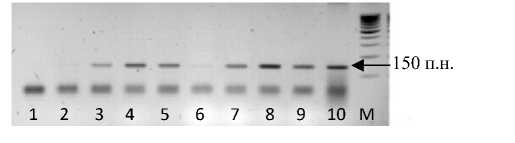
Рисунок 1 – Электрофореграмма продуктов ПЦР с праймерами BnRFO-
AS2F/BnRO-AS2R.
Дорожки: 1–2 – линии рапса, не восстанавливающие фертильность; 3–10 – линии-восстановители фертильности рапса; М – маркер молекулярного веса 100 bp
Как видно из рисунков 1 и 2, линии-восстановители фертильности Rfо рапса несут фрагмент ДНК, который отсутствует у линий, не восстанавливающих фертильность. Маркеры являются доминантными и не позволяют выявить гетерозиготные по искомому гену генотипы рапса.
Маркер BnRFO-F3/BnRFO-R3 не выявил полиморфизма между генотипами, контрастными по наличию гена-восстановителя фертильности, и исключен из дальнейших исследований (табл. 1). Пара праймеров BnRFO-F3/BnRFO-R3, согласно авторам маркера, амплифицировала фрагмент ДНК ожидаемого размера и у линий-восстановителей фертильности, и у линий с отсутствием гена Rfo [10], что подтверждено и в нашем исследовании. Однако данный маркер применялся исследователями для высокопроизводительного генотипирования и выявления гетерозиготного состояния гена Rfo по технологии Invader® (Third Wave Technologies, USA) [10]. Остальные три маркера были полиморфны в коллекции использованных линий, однако не показали 100 %-го соответствия признаку в коллекции изученных образцов (табл. 1). Это может быть связано тем, что начальный этап работы проведен на растениях, не прошедших индивидуальное фе-нотипирование. Поэтому следующий этап исследований – валидация маркеров на растительном материале от отдельных вегетирующих фенотипированных стерильных и фертильных растений.
Известно, что ген-восстановитель фертильности из генома редиса интрогрессиро-ван в рапс с сегментом хромосомы, несущим изофермент глюкозофосфат изомеразу (PGI - 2) [11; 12]. Нами была подобрана оптимальная буферная система для разделения изоферментов в крахмальном геле (гистидин-цитрат, рН 5,7). Аллель, обозначенный нами как Pgi-2 FF, у большинства образцов показал ассоциацию с искомым признаком (рис. 2).
Однако визуализация этого маркера сложна и неоднозначна, процесс экстракции белка и его дальнейший электрофорез и окрашивание занимает много времени, а стоимость анализа высока. В связи вышеизложенными причинами дальнейшее валидирование белкового маркера признано неэффективным.
Следующий этап валидации маркеров BnRFO-F1/BnRFO-AS1, BnRFO-AS2F/ BnRFO-AS2R и BnRFO-F1/BnRFO-DL2R проводили на наборе из 103 растений рапса, включающем материнские стерильные А-формы гибридов, закрепители стерильности (Б-формы) и линии-восстановители фертильности пыльцы (отцовские формы гибридов). Фенотип каждого растения определен во время вегетации.
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17
Рисунок 2 – Схема электрофореграммы PGI-2 образцов рапса.
Дорожки: 1–8 – линии рапса, не восстанавливающие фертильность; 9–16 – линии-восстановители фертильности рапса; 17 – подсолнечник
Продуктом реакции с ДНК растений рапса – носителей гена Rfo с парой аллель-специфичных праймеров BnRFO-
F1/BnRFO-AS являлся мажорный фрагмент размером около 150 п.н. Для ДНК стерильных растений с невосстановленной ЦМС характерно наличие минорного фрагмента на том же уровне. Идентичную картину получили от электрофоретического разделения продуктов амплификации ДНК от растений Б-формы, которые не несут генов ЦМС и Rfо (рис. 3).
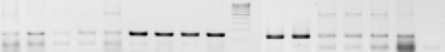
1 2 3 4 5 6 7 8 9 M 10 11 12 13.14 15 К
Рисунок 3 – Электрофореграмма продуктов амплификации образцов ДНК рапса с парой праймеров BnRFO-F1/BnRFO-AS. Дорожки: 1–5 – материнские стерильные А-формы гибридов рапса; 6–11 – фертильные отцовские формы-восстановители фертильности; 12–15 – растения-закрепители стерильности (Б-формы);
М – маркер молекулярного веса 100 bp DNA Ladder; к – отрицательный контроль
С парой праймеров BnRFO-F1/BnRFO-AS проведены реакции на 103 образцах рапса. Несоответствие между фенотипом образца и амплификацией ожидаемого маркерного фрагмента наблюдали у трех образцов (около 3 %).
Валидацию пары праймеров BnRFO-AS2F/BnRFO-AS2R проводили на том же растительном материале. На ДНК растений, несущих ген Rfo , амлифицировался фрагмент размером около 250 п.н., который на электрофореграмме с использованием 1,8 % агарозного геля проявляется четким мажорным фрагментом. На ДНК растений, не обладающих геном Rfo , ам-плифицировались продукты того же размера, которые на электрофореграмме образуют минорный фрагмент (рис. 4).
12 3 4 М 5 6 78
Рисунок 4 – Электрофореграмма продуктов амплификации образцов ДНК рапса с парой праймеров BnRFO-AS2F/BnRFO-AS2R.
Дорожки: 1, 2, 5, 6 – фертильные отцовские формы-восстановители фертильности; 3, 4 – материнские стерильные А-формы гибридов рапса; 7, 8 – растения-закрепители стерильности (Б-формы); М – маркер молекулярного веса 100 bp DNA Ladder
С парой праймеров BnRFO-AS2F/BnRFO-AS2R проведены ПЦР на 103 фенотипированных образцах. Несоответствие между фенотипом образца и амплификацией ожидаемого маркерного фрагмента наблюдали у восьми образцов (около 8 %). У четырех фенотипически стерильных растений амплифицировался маркерный фрагмент гена Rfo , у трех фертильных образцов, предположительно носителей гена Rfo , данный фрагмент отсутствовал, у одного фертильного образца Б-формы ампли-фицировался маркерный фрагмент гена Rfo.
На фореграммах продуктов амплификации вышеописанных двух пар праймеров (рис. 3 и 4) можно видеть, что на ДНК растений, не обладающих геном восстановления фертильности Rfо, также амлифициру-ется некоторое количество продукта ожида- емого размера, что на электрофореграммах выражено наличием минорных фрагментов. Возможно, это является следствием неспецифичного отжига праймеров на гомологичных участках, связанных с особенностью структуры локуса с геном Rfo. Цитоплазматическая мужская стерильность Ogura у редиса (Raphanus sativus) регулируется митохондриальным локусом orf138. Мужская фертильность может быть восстановлена, когда накопление продукта гена orf138 подавляется ядерным локусом Rfo, который состоит из трех генов, предположительно кодирующих очень похожие пен-татрикопептидные повторяющиеся белки (PPR-A, -B и -C). Ген, кодирующий PPR-B, был генетически определен как ген-восстановитель фертильности [5; 15]. Белок PPR-A обладает более длинным C-концевым хвостом и делецией четырех аминокислот в третьем повторе PPR по сравнению с PPR-B; в целом, два белка на 87 % идентичны на уровне аминокислот. Кодирующая способность PPR-C не ясна, поскольку ген содержит делецию 17 п.н. по сравнению с PPR-A и PPR-B, что приводит к сдвигу рамки считывания и преждевременному стоп-кодону примерно в середине гена [16]. Таким образом, гены, кодирующие PPR-A и PPR-C белки, имея сходную с PPR-B геном структуру, не обеспечивают фенотипического восстановления фертильности. При этом могут быть причиной неспецифичного отжига аллель-специфичных праймеров.
Для пары праймеров BnRF-DL2R/BnRFO-F1 ожидаемые фрагменты амплификации ДНК для линий-восстановителей фертильности и линий, не являющихся восстановителями, отличаются по длине [10]. В набор образцов для валидиро-вания данного маркера взяты как линии-восстановители с геном Rfo , так и линии, не являющиеся восстановителями фертильности. На рисунке 5 представлена электрофореграмма продуктов амплификации ДНК линий, контрастных по искомому признаку. Образцы 1–11 представлены растениями, фенотипически фертильными (носители гена Rfo ); образцы 12–22 – растениями, фенотипически стерильными.
У растений-носителей гена Rfo амплифи-цированы фрагменты размером около 170 п.н. У растений, не обладающих геном Rfo , – фрагменты размером около 160 п.н. (рис. 5).
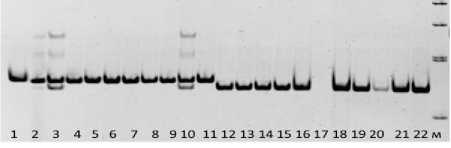
Рисунок 5 – Электрофореграмма продуктов амплификации ДНК рапса с парой праймеров BnRF-DL2R/BnRFO-F1.
Дорожки: 1–11 – растения с геном Rfo ; 12–22 – растения без гена Rfo ; М – маркер молекулярного веса 100 bp DNA Ladder
Несоответствие между фенотипом и наличием ожидаемого фрагмента наблюдали у двух растений из 103 (менее 2 %). У части образцов, несущих ген Rfo , ампли-фицировались два фрагмента, как у образцов 3 и 10. Возможно, двойная фракция является следствием амплификации локусов, кодирующих PPR-A и PPR-C белки.
Для оптимизации детекции гена Rfo использовали амплификацию ДНК с парами праймеров BnRFO-F1/BnRFO-AS и BnRFO-AS2F/BnRFO-AS2R в режиме реального времени (рис. 6).
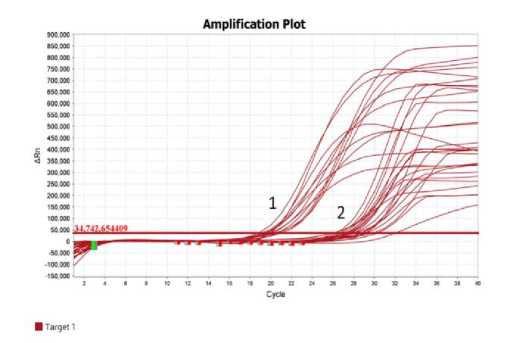
Рисунок 6 – Результаты ПЦР в режиме реального времени с парой праймеров BnRFO-AS/BnRFO-F1:
1 – растения рапса с геном Rfо ;
2 – растения рапса без гена Rfо
На рисунке 6 представлены результаты ПЦР в режиме реального времени с парой праймеров BnRFO-AS/BnRFO-F1. Цифрой 1 обозначен пучок кривых накопления флуоресцентного сигнала для растений-восстановителей фертильности ( Rfo) . Цифрой 2 -пучок кривых накопления флуоресцентного сигнала для растений материнских стерильных А-форм гибридов рапса (без гена Rfo ). Накопительные кривые, объединенные в пучок 1, пересекают пороговую линию в интервале 19–21 цикла, а кривые, объединенные в пучок 2, пересекают пороговую после 26 цикла. При специфичном отжиге праймеров возрастает эффективность амплификации, вследствие чего кривые пересекают пороговую линию на более ранних циклах. На более поздних циклах ПЦР, от 30 и выше, интенсивно накапливаются оба типа продуктов, и анализ становится нерезультативным. Таким образом, анализ динамики прохождения ПЦР позволяет избежать субъективной оценки специфичности амплификации по конечной точке. Соответственно, анализ наличия маркерной нуклеотидной последовательности к гену Rfo в режиме реального времени минимизирует ошибку идентификации признака, ускоряет и удешевляет процесс за счет отсутствия этапа оценки в агарозном геле.
Молекулярные маркеры, тесно связанные с Rfo, весьма полезны для маркер-ассо-циированной селекции гибридов рапса. Данные маркеры разработаны на основе различий последовательностей между линиями-восстановителями и линиями, не восстанавливающими фертильность пыльцы, и являются аллель-специфичными. Валидация трех полиморфных маркеров к гену-восстановителю фертильности рапса Rfo на наборе из 103 растений рапса, включающих стерильные формы с ЦМС, формы Б - закрепители стерильности и формы-восстановители фертильности с геном Rfo, показала амплификацию ожидаемых маркерных фрагментов у растений-восстановителей фертильности в среднем в 96 % случаев. Несоответствия между фенотипом и маркером могут быть обусловлены перекрестным загрязнением пыльцой растений, которые не являются восстановителями, попаданием в делянки фертильных растений падалицы, не обладающей геном Rfo, и их использованием для последующей селекционной работы. Также нельзя исключать возможность возникновения таких несоответствий в случае ложного положительного результата ПЦР. Разработчики данных маркеров отмечали, что при валидации маркеров у четырех растений из 168, представляющих расщепляющуюся популяцию рапса по присутствию гена Rfo на стерильном фоне CMS, результаты ПЦР и фенотипирования по наличию пыльцы не совпадали. Они предложили несколько причин возникновения таких отклонений, среди которых ложноотрицательные результаты ПЦР, перекрестное загрязнение пыльцой растений, не являющихся восстановителями, а также нерегулярная передача гена Rfo от фертильного растения, используемого в скрещивании [10].
Поскольку маркер является доминантным, на момент проверки генотипов рапса в теплице невозможно было отличить гомозиготное по признаку растение от гетерозиготного. Проверка восстановительной способности маркированных растений отцовских линий-восстановителей фертильности с геном Rfo , фенотипированных в теплице, показала, что в полевых условиях 2024 г. фертильность пыльцы растений 20 тест-гибри-дов рапса озимого от межлинейных скрещиваний была восстановлена в различной степени в зависимости от предполагаемого состояния гена. Показатели фертильности пыльцы растений у 12 тест-гибридов рапса при предположительно доминантном гомозиготном состоянии гена варьировали от 99 до 100 %, тогда как при предположительно гетерозиготном состоянии у восьми гибридов они составляли от 76 до 98 %.
Использованные пары праймеров ампли-фицируют специфичные фрагменты в линиях-восстановителях и могут использоваться в качестве маркера для отбора на восстановление фертильности. Однако маркеры являются доминантными и, следовательно, не пригодны для дифференциации гетерозиготных и гомозиготных растений.
Заключение. Экспериментальным путем были подобраны оптимальные условия амплификации фрагментов ДНК, ассоциированных с геном-восстановителем фертильности рапса ( Rfо ). Для четырех аллель-специфичных пар праймеров BnRFO-F1/BnRFO-DL2R температура отжига составила 55 °С, а BnRFO-F1/BnRFO-AS1, BnRFO-AS2/BnRFO-AS2R и BnRFO-F3/BnRFO-R3 – 58 °С. Анализ показал ассоциацию только трех ДНК-маркеров (BnRFO-F1/BnRFO-AS1; BnRFO-AS2/BnRFO-AS2R; BnRFO-F1/BnRFO-DL2R) с геном Rfо . Валидация трех пар праймеров к гену-восстановителю фертильности рапса Rfо на наборе из 103 фенотипи-рованных растений рапса, включающих стерильные формы с ЦМС, формы Б – закрепители стерильности и формы-восстановители фертильности с геном Rfo , показала амплификацию ожидаемых маркерных фрагментов у растений-восстановителей фертильности в среднем в 96 % случаев. Проведение ПЦР с парами праймеров BnRFO-AS/BnRFO-F1 и BnRFO-AS2F/BnRFO-AS2R в режиме реального времени позволило оптимизировать процесс отбора носителей гена Rfо . Подобрана оптимальная буферная система для разделения изоферментов PGI-2 в крахмальном геле (гистидин-цитрат, рН 5,7). Аллель, обозначенный как Pgi-2 FF, показал ассоциацию с геном Rfо . Однако визуализация маркера сложна, трудозатратна, дорога, в связи с чем дальнейшее валидирование белкового маркера признано неэффективным.


