Валидация тест-системы для серодиагностики африканской чумы свиней методом иммуноблоттинга
Автор: Дубровская О.А., Середа А.Д., Казакова А.С., Иматдинов А.Р., Стрижакова О.М., Васильев А.П., Ногина И.В., Власов М.Е., Балышев В.М., Колбасов Д.В.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Вирусология
Статья в выпуске: 2 т.53, 2018 года.
Бесплатный доступ
Вследствие отсутствия вакцины в борьбе с африканской чумой свиней (АЧС, возбудитель - вирус африканской чумы свиней, African swine fever virus, ASFV, семейство Asfarviridae, род Asfivirus ) полагаются на быструю и раннюю диагностику и осуществление жестких ветеринарно-санитарных мероприятий. В восточноевропейских странах, где в настоящее время эта болезнь распространилась, как правило, выделяют высоковирулентные изоляты (J.M. Sanchez-Vizcaino с соавт., 2013). В лабораторной диагностике преимущественно используют полимеразную цепную реакцию (ПЦР) и метод прямой иммунофлуоресценции. Однако с 2012 года у некоторых изолятов ASFV стали отмечать изменения биологических и генетических свойств. Поэтому доминирующими в лабораторной диагностике, как это было в период эпизоотии АЧС в 1960-1990-х годов на Пиренейском полуострове, могут стать серологические методы. Ранее мы сообщали о разработке тест-системы для серодиагностики болезни методом иммуноблоттинга (Rec p30-IB) на основе рекомбинантного структурного белка р30 ASFV. В этой работе представлены результаты ее валидации. Диагностическая чувствительность Rec p30-IB составила 99,3 %, специфичность - 100 %. Антитела к р30 обнаруживали в сыворотке крови и органах домашних свиней и диких кабанов независимо от сероиммунотиповой принадлежности и вирулентности штамма ASFV. В пробах сывороток крови домашних свиней, зараженных гетерологичными вирусами, ложноположительных результатов не регистрировали. В сыворотке крови домашних свиней, выживших после внутримышечного введения аттенуированных штаммов ASFV ЛК-111, КК-262/С, МК-200, ФК-135, PSA-1-NH, СКА 2015 ВНИИВВиМ (103-104 ГАЕ50/ЦПД50), антитела к р30 выявляли на 7-10-е сут. В органах домашних свиней, павших от АЧС через 5-10 сут после внутримышечного заражения высоковирулентными штаммами Лиссабон-57, Мозамбик-78, Ставрополь 01/08 (103 ГАЕ50), антитела к р30 выявили у 30 % особей. Результаты валидации свидетельствуют, что предложенную тест-систему для серодиагностики африканской чумы свиней методом иммуноблоттинга можно использовать в лабораторной практике и при мониторинге образцов крови и органов домашних свиней и диких кабанов при АЧС.
Африканская чума свиней, рекомбинантный белок p30 asfv, серодиагностика, иммуноблоттинг, валидация
Короткий адрес: https://sciup.org/142214143
IDR: 142214143 | УДК: 636.4:619:578:612.017.1:57.083 | DOI: 10.15389/agrobiology.2018.2.430rus
Текст научной статьи Валидация тест-системы для серодиагностики африканской чумы свиней методом иммуноблоттинга
Из-за отсутствия вакцины в стратегии борьбы с болезнью упор делается на быструю и раннюю диагностику и жесткие ветеринарно-санитарные мероприятия. Однако диагностика ASFV осложняется множественностью форм патогенеза и эпизоотических сценариев, а также сходством клинических и патоморфологических признаков болезни с другими геморрагическими инфекционными заболеваниями — классической чумой свиней (КЧС), острым пастереллезом, рожистым воспалением, сальмонеллезом. В восточноевропейских странах, на территории которых в настоящее время распространена АЧС, как правило, выделяют высоковирулентные изоляты ASFV (6). Поэтому для лабораторной диагностики преимущественно используют различные варианты полимеразной цепной реакции (ПЦР) и метод прямой иммунофлуоресценции. Однако с 2012 года у некоторых изолятов, выделенных на территориях России, Польши, прибалтийских стран, стали отмечать вариабельность биологических и генетических свойств (7-10). Это дает основания предполагать, что патогенность циркулирующего на востоке Европы ASFV изменяется в сторону снижения вирулентности. Поэтому доминирующими в лабораторной диагностике, как это было в период эпизоотии АЧС в 1960-1990-х годах на Пиренейском полуострове, могут стать серологические методы. Известно, что при АЧС антитела в сыворотках крови и органах иммунной системы выявляют с 7-10-х сут после заражения и далее в течение длительного времени (11). Их наличие служит убедительным свидетельством для постановки диагноза. На сегодня арсенал диагностических средств для обнаружения антител представлен в основном наборами для реакции непрямой иммунофлуоресценции (РНИФ), иммуноферментного анализа (ИФА) и иммуноблоттинга (ИБ). Международное эпизоотическое бюро (МЭБ — World Organisation for Animal Health, OIE, Франция) рекомендует подтверждать ИФА+ пробы методом ИБ, так как образцы полевых сывороток крови теряют реактивность в ИФА раньше, чем в ИБ, поскольку последний позволяет распознавать линейные эпитопы (12). К преимуществам ИБ относится простота и объективность интерпретации результатов, а нитроцеллюлозные полоски с сорбированными на них вирусоспецифическими полипептидами можно хранить до полугода при комнатной температуре в сухой атмосфере (13, 14).
В рекомендованных МЭБ тестах ИФА и ИБ используют цитоплазматический растворимый антиген, который получают из инфицированной ASFV клеточной линии почки обезьяны, выращенной в присутствии свиной сыворотки (14, 15). Для обеспечения биобезопасности производства диагностических тест-систем разрабатываются вирусоспецифические антигены на основе рекомбинантных (химерных) иммунодоминатных белков ASFV (16-22). Такие антигены позволяют повысить чувствительность и специфичность диагностики, снижая частоту ложноположительных реакций, обусловленных веществами клеточной культуры, которыми неизбежно контаминированы антигены, приготавливаемые на ее основе (15).
Ранее мы сообщали о разработке тест-системы для серодиагностики африканской чумы свиней методом иммуноблоттинга, приготовленной на основе рекомбинантного белка р30 вируса АЧС (23). В настоящей работе впервые представлены результаты ее валидации.
Методика. Экспериментальный материал получали от домашних свиней породы крупная белая (живая масса 30-50 кг; сектор подготовки животных ФИЦВиМ) и диких кабанов из охотничьего хозяйства «Покровское» (Владимирская обл.). Штаммы ASFV были получены из Государственной коллекции микроорганизмов ФИЦВиМ: вирулентные — Лиссабон-57 (Л-57, I сероиммунотип), Конго-49 (К-49, II сероиммунотип), Мозамбик-78 (М-78, III сероиммунотип), Ставрополь 01/08 (VIII сероимму-нотип); аттенуированные — КК-262/С (II сероиммунотип), МК-200 (III сероиммунотип), ФК-135 (IV сероиммунотип), PSA-1-NH (IV сероимму-нотип), СКА 2015 ВНИИВВиМ (VIII сероиммунотип) (24, 25; Патент России ¹ 2439152, 2012 год).
Свиные антисыворотки против возбудителей КЧС, трансмиссивного гастроэнтерита (ТГС), болезни Ауески получали в лаборатории Диагностики и мониторинга ФИЦВиМ. Референс-отрицательные пробы сывороток крови включали 28 от домашних свиней и диких кабанов из Смоленской, Воронежской, Тверской, Псковской, Ростовской, Волгоградской областей, 25 — от здоровых домашних свиней и диких кабанов из вивариев ФИЦВиМ, 480 — от домашних свиней из свободных от АЧС свиноводческих хозяйств Воронежской области. Референс-положительные пробы сывороток крови включали 42 — от домашних свиней из хозяйств Волгоградской и Тверской областей, 59 — от экспериментально инфицированных в ФИЦВиМ домашних свиней и диких кабанов (получены в разные сроки после внутримышечной инокуляции вирулентными или аттенуированными штаммами ASFV I-IV, VIII сероиммунотипов). ASFV+ сыворотки крови также получали из референтной лаборатории CISA-INIA (Centro de Investigaciуn en Sanidad Animal, Instituto Nacional de Investigaciуn y Tecnologнa Agraria y Alimentaria, Испания). В качестве референс-отрицательных проб органов отобрали 18 образцов селезенки от диких кабанов из Смоленской области, референс-положительными были 11 образцов селезенок от диких кабанов из Смоленской области, 18 — от домашних свиней из Тульской области и 10 — от экспериментально инфицированных животных (ФИЦВиМ). Во всех референс-отрицательных или референс-положительных пробах отсутствие или наличие антител к ASFV подтверждали в РНИФ (референс-тест, рекомендованный МЭБ). Пробоподготовку сывороток крови и 10 % суспензий органов, постановку реакции гемадсорбции, определение вирусоспецифических антител в РНИФ и методом ИФА проводили согласно ГОСТ 28573-90 (M., 2005). При необходимости сыворотки крови перед исследованием инкубировали 30 мин при 56 °С для инактивации инфекционного вируса.
РНИФ выполняли с коммерческим набором для дифференциальной иммунофлуоресцентной диагностики африканской чумы свиней, классической чумы свиней, болезни Ауески (ФИЦВиМ). Тест-препарат готовили, используя культуру клеток почки африканской зеленой мартышки CV-1 (Коллекция культур клеток ФИЦВиМ), зараженную авирулентным негемадсорбирующим ASFV (штамм 691/88, Государственная коллекция микроорганизмов ФИЦВиМ). Для учета результатов применяли люминесцентную микроскопию (микроскоп Eclipse E200, «Nikon Co.», Япония).
ИФА проводили с коммерческим набором ВНИИВВиМ АЧС-ИФА Ат/Аг (26). Для сравнения использовали тест-системы для обнаружения антител к ASFV в ИФА — Ingezim PPA Compac 1.1.PPA.K.3 («Inmunologia y Genetica Aplicada S.A.», Испания) на основе вирусного белка vp73 и моноклональных антител к нему, а также ID Screen® African Swine Fever Indirect («IDvet Genetics», Франция) на основе смеси рекомбинантных белков р32, р62 и р72.
ИБ проводили с тест-системой для серодиагностики африканской чумы свиней методом иммуноблоттинга (Rec p30-IB) (пять экспериментальных серий, произведенных в ФИЦВиМ).
При статистической обработке результатов определяли средние ( M ) и стандартные ошибки средних (±SEM). Статистические показатели эффективности диагностического теста (чувствительность и специфичность) определяли согласно описанию (26) при доверительном интервале 95-99 %.
Результаты. Разработанная тест-система Rec p30-IB включает иммунострипы, положительную и отрицательную контрольные сыворотки, конъюгат протеина А с пероксидазой хрена, хромогенный субстрат и необходимые для анализа концентраты растворов.
Диагностическую чувствительность оценивали по доле истинных положительных случаев, которые были правильно идентифицированы Rec p30-IB, используя панель проб сывороток крови и проб органов, содержащих антитела против ASFV по результатам РНИФ (тест «золотого стандарта»). Диагностическую специфичность определяли по доле истинных отрицательных случаев, правильно идентифицированных с Rec p30-IB, для панели проб сывороток крови и проб органов, отрицательных в РНИФ в отношении анти-ASFV антител. О воспроизводимости судили на основа- нии сравнения результатов, полученных двумя исследователями, которые работали с двумя экспериментальными сериями Rec p30-IB. В исследованиях использовали пробы сывороток крови и органов домашних свиней и диких кабанов, полученные в полевых и лабораторных условиях.
1. Сравнительное тестирование биоматериала от зараженных африканской чумой и здоровых свиней методом иммуноблоттинга (ИБ) и в реакции непрямой иммунофлуоресценции (РНИФ) (лабораторный опыт)
|
Анализируемые образцы |
РНИФ |
Всего |
|
положительные отрицательные |
Зараженные (ИБ положительные):
|
сыворотка крови органы |
100 39 |
0 0 |
139 |
|
Здоровые (ИБ отрицательные): сыворотка крови |
1 |
53 |
72 |
|
органы |
0 |
18 |
|
|
Всего |
140 |
71 |
211 |
Из 101 пробы крови, положительной в РНИФ, 100 (в том числе 42 полевых образца и 58 полученных от экспериментальных животных), были положительными и в ИБ. Из 39 РНИФ+ проб органов все 39 оказались ИБ+. Следовательно, диагностиче- ская чувствительность Rec p30-IB составила 99,3 % (доверительный интервал от 95 до 99 %). Антитела к р30 обнаруживали в пробах сывороток крови домашних свиней и диких кабанов независимо от сероиммунотиповой принадлежности и вирулентности штаммов ASFV. Из 53 проб крови, отрицательных в РНИФ, 53 были ИБ-; из 18 РНИФ- проб органов все были ИБ-, то есть диагностическая специфичность Rec p30-IB составила 100 %
(табл. 1). Кроме того, из 480 отрицательных проб сывороток крови домашних свиней (по результатам исследования с валидированным коммерческим набором ВНИИВВиМ АЧС-ИФА Ат/Аг) все были ИБ - при использовании тест-системы Rec p30-IB. В 12 пробах сывороток крови домашних свиней, зараженных гетерологичными вирусами (ТГС, КЧС, болезни Ауески), антитела методом ИБ не выявлялись, то есть ложноположительных результатов не зарегистрировали. Для сравнения: чувствительность и специфичность ИФА и иммуноблоттинга с использованием бакуловирусного рекомбинантного р30 и полевых сывороток европейских домашних свиней находились в пределах 96-99 % (18, 27). То есть результаты валидации тест-системы Rec p30-IB свидетельствуют о высокой достоверности выявления антител к ASFV в пробах сывороток крови и органов домашних свиней и диких кабанов.
Сравнение эффективности Rec p30-IB и предлагаемых на рынке коммерческих тест-систем по выявлению специфических антител к ASFV («Inmunologia y Genetica Aplicada S.A.», Испания; «IDvet Genetics», Франция) выполняли с 10 отрицательными пробами сывороток крови: 9 — от интактных (незараженных и клинически здоровых) домашних свиней, одна — от дикого кабана, а также с 10 положительными пробами сывороток крови: 9 — от домашних свиней, одна — от дикого кабана, эксперимен- тально инокулированных аттенуированными и вирулентными штаммами ASFV. Кроме того, использовали 4 образца положительных сывороток крови, полученных из референтной лаборатории CISA-INIA (Мадрид). Результаты показали, что диагностические чувствительность и специфичность Rec p30-IB составила 100 %.
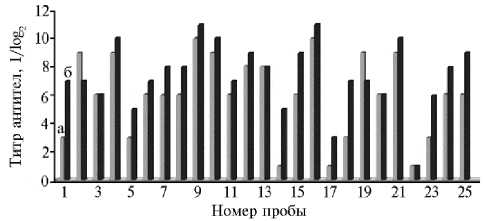
Рис. 1. Сравнение аналитической чувствительности определения анти-ASFV антител в сыворотке крови в реакции непрямой иммунофлуоресценции (РНИФ, а) и методом иммуноблоттинга (ИБ, б) в разные сроки после инокуляции ASFV: 1-7, 10, 17-25 — штамм СКА 2015 ВНИИВВиМ; 8, 9 — МК-200; 11, 12 — КК-262/С; 13 — ФК-135 (домашние свиньи); 14-16 — МК-200 (дикий кабан) (лабораторный опыт).
Для оценки аналитической чувствительности Rec p30-IB сравнили результаты титрования 2-кратными разведениями выбранных для исследования положительных проб сывороток крови домашних свиней и дикого кабана, инокулированных аттенуированными штаммами ASFV II-IV, VIII се-роиммунотипов, использовав ИБ и РНИФ (рис. 1) Из исследованных 25 положительных проб в 19 ти- тры антител, определяемые в ИБ, превышали полученные в РНИФ, в 4 они совпадали, в 2 — были ниже.
В 10 исследованных пробах органов домашних свиней, инокулированных штаммом МК-200, титры антител, определяемые с использованием тест-системы Rec p30-IB, в 4-8 раз превышали таковые по результатам РНИФ, что также свидетельствует о более высокой аналитической чувствительности ИБ по сравнению с РНИФ.
При оценке воспроизводимости (тестирование независимыми специалистами либо с использованием разных серий Rec p30-IB) оба специалиста получили совпадающие результаты для 4 отрицательных и 4 положительных проб. То же совпадение показало сравнение результатов исследования 8 отрицательных и 19 положительных сывороток крови домашних свиней и диких кабанов двумя сериями Rec p30-IB.

7-е сут 15-е сут 28-е сут
Рис. 2. Блоттограммы титрования (1:8-1:128) антител против вируса африканской чумы свиней (ASFV) в сыворотке крови домашней свиньи в разные сроки после внутримышечной инокуляции штамма СКА 2015 ВНИИВВиМ (106 ГАЕ 50 ) (лабораторный опыт).
В сыворотке крови домашних свиней, выживших после инокуляции аттенуированными штаммами ЛК-111, КК-262/С, МК-200, ФК-135, PSA-1-NH, СКА 2015 ВНИИВВиМ в дозах 103-104 ГАЕ50/ЦПД50, антитела к р30 выявляли на 7-10-е сут. На 15-е и 28-е сут титры антител возрастали, а интенсивность полос, выявляемых в ИБ, усиливалась (рис. 2).
В образцах органов домашних свиней, павших от АЧС через 7-10 сут после внутримышечного заражения высоковирулентными штаммами Л-57, М78 и Ставрополь 01/08 в дозе 103 ГАЕ50 антитела в ИБ выявляли у 30 % особей.
Известно, что при хронической форме АЧС происходят периодические обострения и ремиссии болезни. Поэтому важно оценить, всегда ли объективны результаты серодиагностики при АЧС. Мы смоделировали обострение АЧС у свиней, которым первоначально внутримышечно вводили аттенуированный штамм КК-262/С (106 ГАЕ50), а по прошествии 28 сут тех же животных внутримышечно заражали вирулентным штаммом К-49 (103 ГАЕ50). Если на 3-и и 5-е сут после заражения домашних свиней штаммом К-49 еще обнаружили антитела, ин- дуцированные штаммом КК-262/С, то на 7-е сут их не выявили (табл. 2). С 12-х по 17-е сут (срок наблюдения) титры антител в ИБ составляли от 1:16 до 1:256. Эти результаты свидетельствуют, что в периоды ремиссии у хронически больных АЧС животных антитела могут не обнаруживаться, а результат серодиагностики окажется ложноотрицательным. Поэтому в случае появления низковирулентных изолятов лабораторная диагностика должна включать как серологические методы, так и ПЦР.
-
2. Результаты иммуноблоттинга сывороток крови домашних свиней, инокулированных аттенуированным штаммом КК-262/С ASFV, при последующем заражении гомологичным вирулентным штаммом К-49 ( n = 3, M ±SEM, лабораторный опыт)
Время после заражения штаммом К-49, сут
Титр антител, log 2
животное ¹ 1
животное ¹ 2
животное ¹ 3
животное ¹ 4
3
6,7±0,6
5,7±0,3
6,3±0,3
6,3±0,6
5
6,3±0,3
5,7±0,6
5,7±0,3
6,3±0,3
7
0,0
0,0
0,0
0,0
12
5,3±0,6
6,3±0,6
5,3±0,3
7,3±0,3
17
6,7±0,3
6,7±0,6
3,7±0,6
7,7±0,6
Отметим, что коллекция ФИЦВиМ насчитывает более 100 образцов ASFV из Африки, Латинской Америки, Европы (за рубежом — 500). Исследование сывороток крови от домашних свиней и диких кабанов, инфицированных вирулентными, слабовирулентными, аттенуированными, гемад-сорбирующими и негемадсорбирующими штаммами и изолятами ASFV, относящимися к 5 сероиммунотипам из известных 9, не выявило случаев, когда положительные сыворотки не реагировали с рекомбинантным р30.
Таким образом, проведенная валидация свидетельствует, что предложенную тест-систему для серодиагностики африканской чумы свиней методом иммуноблоттинга можно использовать при лабораторной серодиагностике и мониторинге сывороток крови и проб органов домашних свиней и диких кабанов при африканской чуме свиней (АЧС). К преимуществам метода иммноблоттинга (ИБ) относится отсутствие необходимости в сложном техническом оборудовании и объективность при оценке результатов. С учетом рекомендаций Международного эпизоотического бюро (OIE — World Organisation for Animal Health, Paris, France) метод ИБ следует включить в схему диагностики АЧС в Российской Федерации.
Список литературы Валидация тест-системы для серодиагностики африканской чумы свиней методом иммуноблоттинга
- Dixon L.K., Costa J.V., Escribano J.M., Rock D.L., Vinuela E., Wilkinson P.J. Family Asfarviridae/M.H.V.V. Regenmortel (ed.). London Academic Press, 2000: 159-165.
- Середа А.Д., Балышев В.М. Антигенное разнообразие вируса африканской чумы свиней. Вопросы вирусологии, 2011, 4: 38-42.
- Malogolovkin A., Burmakina G., Titov I., Sereda A., Gogin A., Baryshnikova E., Kolbasov D. Comparative analysis of African swine fever virus genotypes and serogroups. Emerg. Infect. Dis., 2015, 21(2): 312-315 ( ) DOI: 10.3201/eid2102.140649
- Gogin A., Gerasimov V., Malogolovkin A., Kolbasov D. African swine fever in the North Caucasus region and the Russian Federation in years 2007-2012. Virus Res., 2013, 173: 198-203 ( ) DOI: 10.1016/j.virusres.2012.12.007
- Abrahantes J.C., Gogin A., Richardson J., Gervelmeyer A. Epidemiological analyses on African swine fever in the Baltic countries and Poland. EFSA Journal, 2017, 15(3): 4732 ( ) DOI: 10.2903/j.efsa.2017.4732
- Sanchez-Vizcaino J.M., Mur L., Martinez-Lopez B. African swine fever (ASF): five years around Еurope. Vet. Microbiol., 2013, 165: 45-50 ( ) DOI: 10.1016/j.vetmic.2012.11.030
- Gallardo C., Fernández-Pinero J., Pelayo V., Gazaev I., Markowska-Daniel I., Pridotkas G., Nieto R, Fernández-Pacheco P., Bokhan S., Nevolko O., Drozhzhe Z., Pérez C., Soler A., Kolvasov D., Arias M. Genetic variation among African swine fever genotype II viruses, Eastern and Central Europe. Emerg. Infect. Dis., 2014, 20(9): 1544-1547 ( ) DOI: 10.3209/eid2009.140554
- Vlasova N.N., Varentsova A.A., Shevchenko I.V., Zhukov I.Yu., Remyga S.G., Gavrilova V.L., Puzankova O.S., Shevtsov A.A, Zinyakova N.G., Gruzdev K.N. Comparative analysis of clinical and biological characteristics of African swine fever virus isolates from 2013 year Russian Federation. British Microbiology Research Journal, 2015, 5(3): 203-215 ( ) DOI: 10.9734/BMRJ/2015/12941
- Goller K.V., Malogolovkin A.S., Katorkin S., Kolbasov D., Titov I., Hoper D., Beer M., Keil G.M., Portugal R., Blome S. Tandem repeat insertion in African swine fever virus. Russia, 2012. Emerg. Infect. Dis., 2015, 21(4): 731-732 ( ) DOI: 10.3201/eid2104.141792
- Frączyk M., Woźniakowski G., Kowalczyk A., Bocian Ł., Kozak E., Niemczuk K., Pejsak Z. Evolution of African swine fever virus genes related to evasion of host immune response. Vet. Microbiol., 2016, 25(193): 133-44 ( ) DOI: 10.1016/j.vetmic.2016.08.018
- Reis A.L., Parkhouse R.M.E., Penedos A.R., Martins C., Leitão A. Systematic analysis of longitudinal serological responses of pigs infected experimentally with African swine fever virus. J. Gen. Virol., 2007, 88(9): 2426-2434 ( ) DOI: 10.1099/vir.0.82857-0
- Arias M., Escribano J.M., Sánchez-Vizcaíno J.M. Persistence of African swine fever antibody reactivity on ELISA and immunoblotting assays. Vet. Rec., 1993, 133(8): 189-190.
- Pastor M.J., Laviada M.D., Sanchez-Vizcaino J.M., Escribano J.M. Detection of African swine fever virus antibodies by immunoblotting assay. Can. J. Vet. Res., 1989, 53(1): 105-107.
- World Organization for Animal Health (OIE), 2012. African swine fever. Chapter 2.8.1. In: Ma-nual of diagnostic tests and vaccines for terrestrial animals (mammals, birds and bees). Режим доступа: http://www.oie.int/fileadmin/Home/eng/Health_standards/tahm/2.08.01_ASF.pdf. Без даты.
- Escribano J.M., Pastor M.J., Sánchez-Vizcaino J.M. Antibodies to bovine serum albumin in swine sera: implications for false-positive reactions in the serodiagnosis of African swine fever. Am. J. Vet. Res., 1989, 50: 1118-1122.
- Alcaraz C., Rodriguez F., Oviedo J.M., Eiras A., De Diego M., Alonso C., Escribano J.M. Highly specific confirmatory western blot test of African swine fever virus antibody detection using the recombinant virus protein p54. J. Virol. Methods, 1995, 52(1-2): 111-119 ( ) DOI: 10.1016/0166-0934(94)00150-F
- Kollnberger S.D., Gutierrez-Castaneda B., Foster-Cuevas M., Corteyn A., Parkhouse R.M. Identification of the principal serological immunodeterminants of African swine fever virus by screening a virus cDNA library with antibody. J. Gen. Virol., 2002, 83(6): 1331-1342 ( ) DOI: 10.1099/0022-1317-83-6-1331
- Gallardo C., Reis A.L., Kalema-Zikusoka G., Malta J., Soler A., Blanco E., Parkhouse R.M., Leitão A. Recombinant antigen targets for serodiagnosis of African swine fever. Clin. Vaccine Immunol., 2009, 16(7): 1012-1020 ( ) DOI: 10.1128/CVI.00408-08
- Gallardo C., Dufton M.M., Macharia J.M., Arias M., Taracha E.A., Soler A., Okoth E., Martin E., Kasiti J., Bishop R.P. Enhanced discrimination of African swine fever virus isolates through nucleotide sequencing of the p54, p72, and pB602L (CVR) genes. Virus Genes, 2009, 38: 85-95 ( ) DOI: 10.1007/s11262-008-0293-2
- Oviedo J.M., Rodríguez F., Gómez-Puertas P., Brun A., Gómez N., Alonso C., Escribano J.M. High level expression of the major antigenic African swine fever virus proteins p54 and p30 in baculovirus and their potential use as diagnostic reagents. J. Virol. Methods, 1997, 64(1): 27-35 ( ) DOI: 10.1016/S0166-0934(96)02140-4
- Pérez-Filgueira D.M., González-Camacho F., Gallardo C., Resino-Talaván P., Blanco E., Gómez-Casado E., Alonso C., Escribano J.M. Optimization and validation of recombinant serological tests for African swine fever diagnosis based on detection of the p30 protein produced in Trichoplusia ni larvae. J. Clin. Microbiol., 2006, 44 (9): 3114-3121 ( ) DOI: 10.1128/JCM.00406-06
- Kazakova A.S., Imatdinov I.R., Dubrovskaya O.A., Imatdinov A. R., Sidlik M.V., Balyshev V.M., Krasochko P.A., Sereda A.D. Recombinant protein p30 for serological diagnosis of African swine fever by immunoblotting assay. Transbound. Emerg. Dis., 2017, 64: 1479-1492 ( ) DOI: 10.1111/tbed.12539
- Sereda A.D., Dubrovskaya O.A., Imatdinov A.R., Strizhakova O.M., Vasil’ev A.P., Sindryako-va I.P., Lunitsin A.V. Laboratory diagnostics of chronic and asymptomatic forms of African swine fever. Agricultural Biology, 2016, 51(4): 459-466 ( ) DOI: 10.15389/agrobiology.2016.4.459eng
- Прудникова Е.Ю. Адаптация вируса африканской чумы свиней, выделенного на территории Российской Федерации, к перевиваемым культурам клеток и изучение его биологических свойств. Канд. дис. Покров, 2013. Режим доступа: http://search.rsl.ru/ru/record/01005543218. Без даты.
- Балышев В.М., Калантаенко Ю.Ф., Болгова М.В., Прудникова Е.Ю. Сероиммуноло-гическая принадлежность вируса африканской чумы свиней, выделенного в Российской Федерации. Доклады РАСХН, 2011, 5: 52-53.
- Стрижакова О.М., Лыска В.М., Малоголовкин А.С., Новикова М.Б., Сидлик М.В., Ногина И.В., Шкаев А.Э., Балашова Е.А., Куриннов В.В., Васильев А.П. Валидация ИФА-набора для обнаружения антител к вирусу африканской чумы свиней в крови и селезенке домашних свиней и диких кабанов. Сельскохозяйственная биология, 2016, 51(6): 845-852 ( ) DOI: 10.15389/agrobiology.2016.6.845rus
- Cubillos C., Gómez-Sebastian S., Moreno N., Nuñez M.C., Mulumba-Mfumu L.K., Quembode C.J., Heath L., Etter E.M.C., Jori F., Escribano J.M., Blanco E. African swine fever virus serodiagnosis: a general review with a focus on the analyses of African serum samples. Virus Res., 2013, 173: 159-167 ( ) DOI: 10.1016/j.virusres.2012.10.021


