Вариации содержания сателлита III (1Q12) и рибосомного повтора в ДНК лейкоцитов крови детей с расстройствами аутистического спектра в процессе терапии
Автор: Ершова Е.С., Чудакова Ю.М., Вейко Н.Н., Мартынов А.В., Костюк С.Э., Костюк С.В., Балакирева Е.Е., Шушпанова О.В., Никитина С.Г., Блинова Т.Е., Шалина Н.С., Коваль-зайцев А.А., Иванов М.В.
Журнал: Сибирский вестник психиатрии и наркологии @svpin
Рубрика: Биологические исследования
Статья в выпуске: 4 (125), 2024 года.
Бесплатный доступ
Актуальность. Известно, что обострение хронических психических заболеваний сопровождается высоким уровнем психоэмоционального стресса, а также связано с активацией неспецифического воспаления и усилением окислительного стресса. Дети с РАС более подвержены неблагоприятному влиянию стресса, чем нормотипичные дети, в связи с высоким уровнем коморбидности РАС с другими расстройствами. В более ранних работах описана взаимосвязь между окислительным стрессом и повторяющимися последовательностями ДНК (повторы), составляющими большую часть генома человека. Содержание сателлита III (1q12) в геномах детей с РАС и влияние терапии на этот показатель не определяли. В данном исследовании впервые установлено количество рибосомного повтора и сателлита III (1q12) в ДНК лейкоцитов крови детей с РАС, которые обращались в отдел детской психиатрии в связи с ухудшением психического состояния (нарастание сопутствующих расстройств поведения и/или настроения), и проанализировано влияние терапии на содержание этих повторов.
Расстройства аутистического спектра, дети, вариации содержания, сателлит iii (1q12), рибосомный повтор, днк лейкоцитов крови, психофармакотерапия
Короткий адрес: https://sciup.org/142243736
IDR: 142243736 | УДК: 616.896-053.2,465?4/?12,:611.018.53:577.213 | DOI: 10.26617/1810-3111-2024-4(125)-17-26
Текст научной статьи Вариации содержания сателлита III (1Q12) и рибосомного повтора в ДНК лейкоцитов крови детей с расстройствами аутистического спектра в процессе терапии
Известно, что обострение хронических психических заболеваний сопровождается высоким уровнем психоэмоционального стресса, а также связано с активацией неспецифического воспаления и усилением окислительного стресса [1]. Дети с РАС чаще, чем нормотипичные дети, подвержены неблагоприятному воздействию стресса в связи с высоким уровнем коморбидности РАС с другими расстройствами, в частности с тревожными расстройствами, ОКР, эмоциональными нарушениями. Кроме того, трудности социализации, замкнутость, стеснительность, сенсорные особенности, отсутствие благополучной среды для развития также в значительной степени усиливают дистресс. Высокая степень тревожности у детей с РАС связана с повышенным уровнем гормонов стресса, что было показано в недавнем исследовании [2]. В более ранних работах была описана взаимосвязь между окислительным стрессом и повторяющимися последовательностями ДНК (повторы), которые составляют большую часть генома человека [3]. Многие повторы организованы по типу «голова-хвост» и относятся к типу тандемных повторов [4]. При исследовании геномов пациентов с шизофренией ранее нами обнаружены значительные изменения в содержании двух тандемных повторов у пациентов выборки по сравнению со здоровым контролем ‒ рибосомного повтора и сателлита III (1q12) [5] (рис. 1).
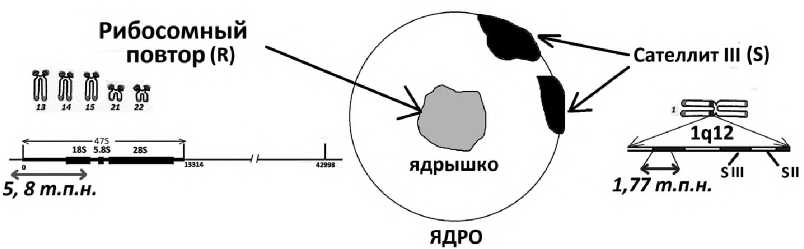
Р и с у н о к 1. Схема анализируемых тандемных повторов генома человека
Показаны используемые для гибридизации ДНК-зонды.
Рибосомный повтор локализован в р-районах 5 пар акроцентрических хромосом и кодирует РНК рибосом [6]. Сателлит III (1q12) входит в состав прицентромерного гетерохроматина первой хромосомы. В условиях стресса и при старении этот повтор транскрибируется [7]. Транскрипция сателлита может приводить к амплификации повтора. В процессе задействована обратная транскриптаза [8]. Кровь пациентов с шизофренией содержит повышенные количества рибосомного повтора и низкие количества сателлита III (1q12) [5]. Содержание сателлита III (1q12) коррелирует с тяжестью психического состояния пациентов [9]. Было показано, что содержание рибосомного повтора в геномах детей с шизофренией статистически значимо повышено по сравнению с геномами детей с РАС и здоровых детей, что потенциально может быть использовано в дифференциальной диагностике этих заболеваний [10]. Однако содержание сателлита III (1q12) в геномах детей с РАС и влияние терапии на этот показатель не определяли. В настоящем исследовании нами впервые установлено количество рибосомного повтора и сателлита III (1q12) в лейкоцитах крови детей с РАС, которые были госпита- лизированы в связи с ухудшением психического состояния, и проанализировано влияние терапии на содержание этих повторов.
ЦЕЛЬ ИССЛЕДОВАНИЯ
Анализ содержания повторов генома (рибосомного, сателлита III ‒ 1q12) в образцах ДНК лейкоцитов крови детей с РАС и сопутствующими расстройствами в стадии обострения с целью анализа влияния терапии на содержание этих повторов.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование выполнено на базе отдела детской психиатрии (ФГБНУ «Научный центр психического здоровья») и лаборатории молекулярной биологии (ФГБНУ «Медико-генетический научный центр им. академика Н.П. Бочкова».
Основная выборка исследования (основная группа) включала 35 детей в возрасте от 4 до 12 лет (средний возраст 7,2±2,2 года), обратившихся в отдел детской психиатрии ФГБНУ НЦПЗ в связи с обострением психического состояния. Для отбора и включения пациентов в исследование использовали клинико-психопатологический метод, который предполагает психопатологическую оценку поведения пациента в различных ситуаци- ях, анализ эмоциональных и когнитивных реакций и особенностей социального поведения. Состояние пациентов количественно оценивалось по следующим шкалам: тяжесть заболевания ‒ по шкале оценки тяжести (CGI-ADHD-Severity), выраженность клинических проявлений аутистических расстройств ‒ по шкале оценки детского аутизма (Childhood Autism Rating Scale – CARS [11]), выраженность когнитивных нарушений ‒ по шкале оценки развития, психологопедагогический профиль (PEP-3) [10].
Состояние пациентов оценивалось при поступлении, через 2, 4 и 6 недель терапии. Также были взяты пробы венозной крови: проба 1 (n=35) – образцы ДНК детей до начала новой терапии, пробы 2 (n=32), 3 (n=28) и 4 (n=26) – соответственно образцы ДНК, полученные через 2, 4 и 6 недель терапии. Часть детей (n=9) выбыла из эксперимента в силу различных причин.
Критерии включения: пациенты с верифицированными диагнозами по МКБ-10: основной диагноз – детский аутизм (F84.0), атипичный аутизм (F84.1), сопутствующий диагноз – другие тревожные расстройства (F41), реакция на тяжелый стресс и нарушения адаптации (F43), умственная отсталость со значительными нарушениями поведения (F7x.1), смешанные расстройства поведения и эмоций (F92), наличие подписанной формы информированного согласия законных представителей ребенка на участие в исследовании.
Критерии невключения: пациенты с синдро-мальными формами атипичного аутизма (врожденные дефекты обмена веществ, хромосомные аномалии), прогрессирующие дегенеративные заболевания, органические заболевания ЦНС, эпилепсия, наличие клинических признаков обострения аллергических, воспалительных и аутоиммунных заболеваний, проведение вакци-нопрофилактики в течение предшествующих обследованию 2 месяцев, медикаментозная или иная интоксикация, гиперчувствительность к любому из компонентов применяемых в исследовании препаратов, участие в других клинических исследованиях в течение 4 недель перед включением в данное исследование.
Терапия
Все пациенты получали терапию нейролептическими препаратами с целью снятия избыточной раздражительности, психомоторного возбуждения, а также в качестве тимостабилизирующих средств. Были использованы следующие препараты в таблетированной или жидкой форме в качестве монотерапии или аугментации: рисперидон до 2 мг/сут, арипипразол до 15 мг/сут, палипери-дон до 9 мг/сут, перфеназин до 30 мг/сут, хлорпромазин до 100 мг/сут, перициазин до 15 мг/сут, хлорпротиксен до 75 мг/сут, алимемазин до 20
мг/сут. Было получено информированное согласие на применение лекарств off-label от законных представителей пациентов, а также получено разрешение врачебной комиссии ФГБНУ НЦПЗ. В процессе лечения проводилась коррекция доз препаратов для достижения оптимального лечебного эффекта, которая окончательно завершалась к выписке из стационара, при этом все пациенты продемонстрировали стабильную положительную динамику в виде улучшения настроения, снижения тревоги и агрессии.
Группы контроля
В исследовании использовались образцы ДНК жителей Москвы и Московской области (n=191) в возрасте от 5 до 30 лет. Эти образцы были выделены из лейкоцитов крови ранее и хранились при -80°С в коллекции образцов ДНК лаборатории Молекулярной биологии Медикогенетического центра. 91 образец ДНК был выделен из крови детей в возрасте от 3 до 12 лет. 100 образцов ДНК выделены из крови здоровых людей в возрасте от 20 до 30 лет. У участников исследования отсутствовали явные психические или генетические нарушения и не было родственников с генетической патологией.
Лабораторные исследования
Количественный анализ тандемных повторов генома представляет значительные трудности. Метод ПЦР мало применим для этой цели [16]. Биоинформатический подход, основанный на анализе данных секвенирования генома, дает плохо воспроизводимые для одних и тех же образцов ДНК результаты. Авторы связывают этот факт с техническими особенностями метода приготовления библиотек для секвенирования, который включает использование ПЦР [17]. Кроме того, тандемные повторы незначительно представлены в базах данных, поэтому до сих пор составляют «серые зоны» генома [3, 4]. В МГНЦ для количественного анализа тандемных повторов разработан метод нерадиоактивной количественной гибридизации (NQH [14]). Метод положительно зарекомендовал себя при анализе рибосомного и сателлитного повторов [5, 9, 13, 14, 16]. Новый метод секвенирования, который не предполагает создание библиотек (оксфордская нанопора), полностью подтвердил данные для рибосомного повтора, полученные ранее с использованием метода NQH [18]. Метод NQH был применен в данном исследовании для количественного анализа двух повторов. Выделение ДНК из лизированной лейкоцитарной массы после обработки РНКазой А и протеиназой К (метод экстракции органическими растворителями), измерение концентрации ДНК в растворе (флуоресцентная микроскопия, краситель PicoGreen) и анализ содержания повторов в ДНК методом NQH подробно описаны в наших предыдущих публикациях [13, 14] и проводились без изменений. Для анализа рибосомного повтора применяли ДНК-зонд, который содержал EcoRI фрагмент транскрибируемой области повтора (5836 п.н., позиции от -515 до 5321 п.н.; GenBank № U13369), клонированный в плазмиду pBR322 (рис. 1). Зонд на сателлит III ‒ клонированный в плазмиду EcoRI фрагмент области 1q12 длиной 1,77 т.п.н. ‒ известен как pUC1.77 [15]. ДНК-зонды метили ник-трансляцией с использованием biotin-11-dUTP.
Статистические методы
В рамках одного NQH-опыта на фильтр наносили по 3 параллельных пробы каждого образца ДНК. Опыт повторяли 2 раза. Для определения содержания повторов по результатам гибридизации использовали программу Image 6.0 (Медикогенетический центр). Для анализа результатов применяли методы непараметрической статистики Манна-Уитни (сравнение выборок по содержанию повторов, вероятность р) и Колмогорова-Смирнова (сравнение распределений образцов ДНК по содержанию повторов, параметры D и α). Для анализа корреляций между величинами применяли статистику Спирмена. Данные анализировали с использованием пакета StatPlus2007 Professional software (http://www. .
Этический аспект
От участников старше 16 лет получено информированное согласие. Родители участников в возрасте от 5 до 16 лет подписывали информированное согласие на обследование, лечение, отбор венозной крови (6 мл) и проведение научноисследовательских экспериментов с биоматериалом, взятым у ребенка (анализ ДНК).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
До начала терапии в клинической картине заболевания, помимо аутистического симптомо-комплекса, отмечались психомоторное возбуждение, импульсивность, негативизм, эпизоды агрессивного поведения, аффективная патология от непродуктивных гипоманий до депрессивных расстройств с незавершенной депрессивной триадой, раздражительностью и тревогой, нарушения ночного сна с частыми пробуждениями, когнитивный дефицит различной степени выраженности, сопровождаемый нарушением речевой функции. По данным анамнеза изменения в психическом состоянии происходили спонтанно или под влиянием внешней провокации (переезд, посещение новой группы или класса).
По результатам комплексного динамического психологического обследования с использованием стандартизированных методик по шкалам PEP выявлено отставание по количественным показателям РЕР в сферах подражания и коммуникации в сочетании с выраженной диссоциацией указан- ных сфер. Исследование тонкой моторики, зрительно-двигательной координации и вербальной сферы показало небольшое снижение относительно значений нормы. Крупная моторика и восприятие отставали от нормы незначительно. Обследуемые демонстрировали низкую толерантность к нагрузкам, быструю истощаемость психической деятельности (внимания), непоследовательность в выполняемых действиях и, следовательно, низкую продуктивность работы. Наблюдалась небольшая тенденция в зоне ближайшего развития зрительно-двигательной координации. По шкале CARS существенного изменения общего балла не обнаружено. По шкале CGI-S тяжесть психического состояния на фоне проводимой терапии снизилась у всех пациентов основной группы за счет стабилизации настроения, снижения уровня психомоторного возбуждения и купирования агрессии и раздражительности.
На рисунке 2А приводятся данные о содержании рибосомного повтора (параметр R) и сателлита III (1q12) (параметр S) в образцах ДНК, выделенной из лейкоцитов крови детей с РАС. Первоначальная выборка включала 35 детей, госпитализированных в НЦПЗ в связи с обострением психического состояния. Пробы 1 (n=35) – образцы ДНК детей до начала новой терапии, пробы 2 (n=32), 3 (n=28) и 4 (n=26) – соответственно образцы ДНК, полученные через 2, 4 и 6 недель терапии. Часть детей выбыла из эксперимента в силу различных причин.
Содержание рибосомного повтора в ДНК детей варьирует от 211 до 601 копии на диплоидный геном (среднее 419±78, медиана 408 копий, коэффициент вариации 0,19). Пробы 2, 3 и 4 содержали такое же количество повтора, что и проба 1 (рис. 2). Варьирование параметра R в каждой точке не превышало стандартную ошибку опыта (рис. 3А). Таким образом, мы еще раз подтвердили стабильность содержания рибосомного повтора в геноме и независимость этого генетического параметра от терапии антипсихотиками и хронического стресса.
Распределение параметра R в группе обследуемых не отличалось от распределения в группе контроля детей того же возраста (рис. 2Б), что полностью воспроизводит ранее полученный результат [10]. Геномы детей с РАС содержат аналогичное количество копий рДНК, что и геномы здоровых детей.
Содержание сателлита III в ДНК детей с РАС до начала терапии (точка 1) варьирует от 10,2 до 45,5 пг/нг ДНК (среднее 14,4±2,0, медиана 13,6 пг/нг ДНК, коэффициент вариации 0,41). В контрольной выборке детей параметр S варьирует от 11 до 23,3 пг/нг ДНК (среднее 16,9±6,5, медиана 14,1 пг/нг ДНК, коэффициент вариации 0,14).
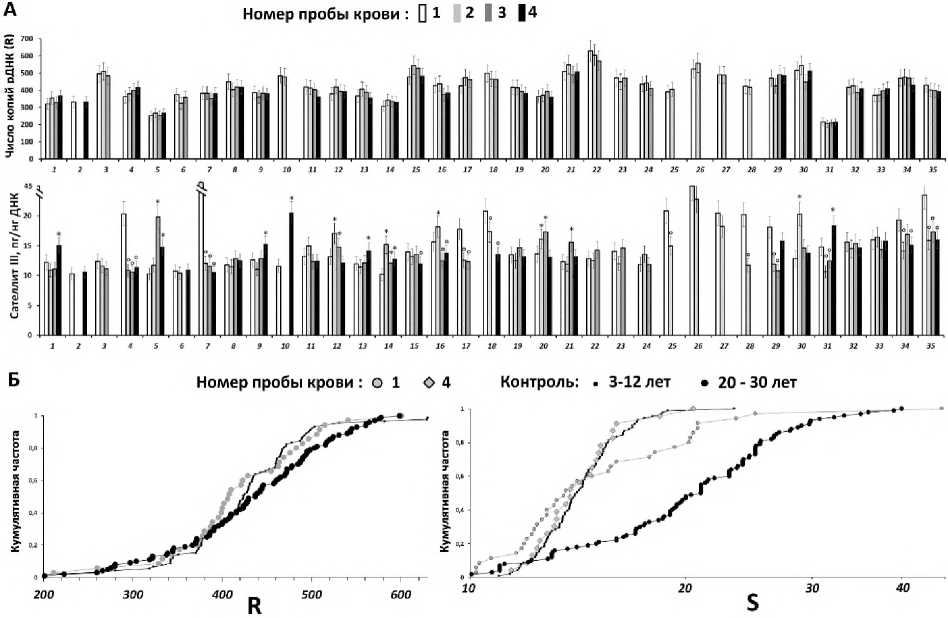
Р и с у н о к 2. Содержание рибосомного и сателлитного повторов в ДНК лейкоцитов крови детей с РАС
А. Экспериментальные данные, отражающие содержание рДНК (верхний график) и сателлита III (нижний график) в образцах ДНК, выделенных из лейкоцитов крови детей. Для каждого пациента проводили от 2 до 4 заборов крови в течение нескольких недель (номера проб от 1 до 4). Ось Х: указан порядковый номер обследованного. Приводятся средние значения и стандартное отклонение. Значки (*) и (°) отражают статистически значимые различия (соответственно увеличение или снижение, p<0,05) в содержании повтора в пробах пациента 2, 3 и 4 по сравнению с пробой 1 (до начала терапии).
Б. Сравнение распределений содержания рДНК (слева) и сателлита III (справа) в образцах ДНК, выделенных из лейкоцитов крови пациентов и здоровых детей группы контроля. Приводится также распределение параметров R и S в более старшей возрастной группе (20-30 лет, n=100). Ось Х: количество копий рибосомной ДНК на диплоидный геном (слева), содержание сателлита III в ДНК пг/нг (справа). Ось Y: кумулятивная частота.
Выборка здоровых детей (группа контроля) статистически значимо отличается от выборки здоровых взрослых меньшими значениями параметра S (рис. 2Б), что подтверждает ранее опубликованные данные [14]. Выборки детей с РАС до терапии и здоровых детей не различаются по значениям параметра S (p>0,5), однако различаются (рис. 2Б) по характеру распределений (D=0,28, α=0,03). Распределения пересекаются в точке 15 пг/нг ДНК. 40% образцов ДНК детей с РАС (точки 1) содержат повышенное количество сателлита III. Вместе с тем 60% образцов, напротив, содержат меньшее количество сателлита III по сравнению с группой контроля. Коэффициент вариации параметра S в основной группе обследуемых был в 3 раза выше, чем в выборке здоровых детей. Более высокое содержание сателлита III в ДНК ассоциировано с накоплением в клеточной популяции клеток с большими блоками сателлита III. Эти клетки не отвечают на различные стимулы, не способны к развитию адаптивного ответа на стресс и демонстрируют низкую устойчивость к окислительному стрессу [19]. Количество таких клеток существенно возрастает при старении культивируемых клеток, в лейкоцитах крови пожилых людей и в условиях окислительного стресса [14, 19]. В то время как накопление таких клеток в лейкоцитах детей с РАС свидетельствует о снижении эффективности их элиминации из кровотока путем апоптоза и/или об усилении процессов, приводящих к накоплению сателлита III в клетках [20].
В отличие от параметра R, параметр S существенно варьировал у большинства пациентов в процессе терапии. Содержание сателлита Ⅲ в ДНК возрастало в ходе терапии в 1,1-2 раза у 18 пациентов (51%), снижалось в 1,1-4,3 раза у 12 пациентов (34%) и оставалось неизменным у 5 пациентов (рис. 2А и рис. 3А).
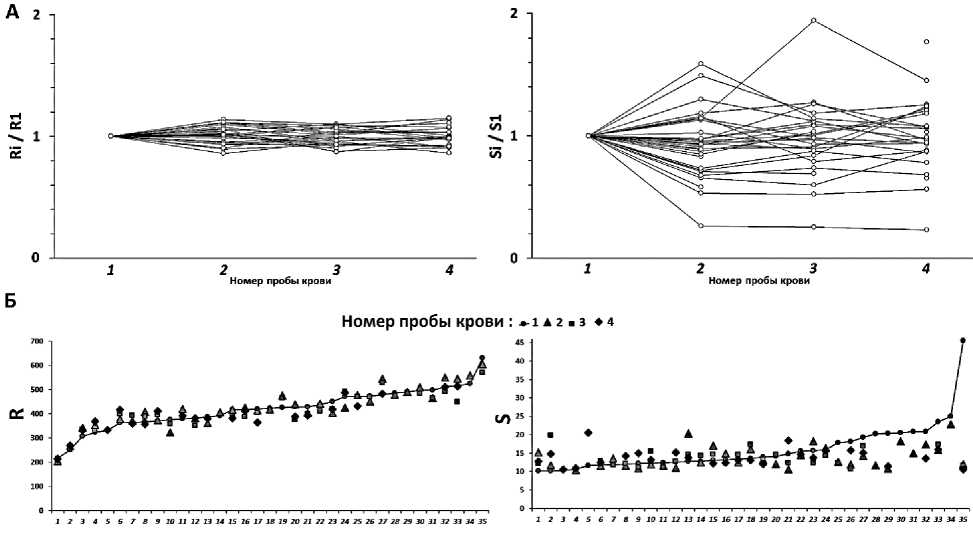
Р и с у н о к 3. Анализ изменений в содержании двух повторов в образцах ДНК, выделенной из лейкоцитов крови детей с РАС
А. Изменения параметров R и S относительно первоначальных значений до терапии (точка 1).
Б. Иллюстрация изменений в параметрах R и S в зависимости от значений в точке 1. Значения, определенные в пробе 1, ранжированы.
Показано, что изменения параметра S отрицательно коррелируют со значениями в точке 1 (до начала терапии). Содержание сателлита возрастает в случае исходно низкого уровня повтора и снижается в случае исходно высокого уровня (рис. 3Б). В точке 4 распределение для значений S практически не отличается от распределения в группе контроля (рис. 2Б). Таким образом, терапия нейролептиками оказывает модулирующее действие на содержание сателлита III в лейкоцитах крови детей с РАС. Ранее аналогичный результат был продемонстрирован на материале выборки взрослых пациентов с шизофренией, которые впервые проходили курс терапии нейролептиками [9]. Также ранее на модельной системе (культивируемые фибробласты кожи) было показано, что нейролептики снижают содержание сателлита в ДНК клеток. Снижение происходит как за счет блокирования процесса амплификации сателлита, так и за счет ускорения процесса гибели и элиминации клеток с большими блоками сателлита из популяции [20].
Значения параметра S в конце терапии (точка 4) положительно коррелируют с показателями шкал CGI-S (коэффициент Спирмена r=0,45, p=0,025) и BFCRS (r=0,52, p=0,012). Изменения параметра S в течении 2 и 4 недель отрицательно коррелируют с показателем шкалы CGI-S (r=-0,44, p=0,027). Можно предположить, что повышенные значения параметра S в точке 4 ассоциированы с более тяжелым психическим состоянием пациентов на фоне проводимой терапии.
Применение анализа содержания сателлита III (1q12) и рибосомного повтора в ДНК детей с психическими нарушениями перспективно с точки зрения постановки дифференциального диагноза (шизофрения или РАС), оценки состояния детей с РАС и оценки эффективности терапии нейролептиками или другими препаратами, что может лечь в основу будущих исследований. Ограничениями данного исследования являлись малое количество участников выборки, отсутствие оценки влияния каждого из препаратов в отдельности.
ВЫВОДЫ
Вне зависимости от первоначальных значений содержание сателлита III (1q12) в крови детей с РАС и обострением сопутствующей симптоматики стабилизируется на уровне группы контроля на фоне проводимой терапии антипсихотическими препаратами. Вероятно, данные изменения связаны с улучшением психического состояния и снижением общего уровня стресса. Параметр R (рибосомный повтор) на протяжении данного исследования не изменялся.
Список литературы Вариации содержания сателлита III (1Q12) и рибосомного повтора в ДНК лейкоцитов крови детей с расстройствами аутистического спектра в процессе терапии
- Ghaemi Kerahrodi J, Michal M. The fear-defense system, emotions, and oxidative stress. Redox Biol. 2020 Oct;37:101588. doi: 10.1016/j.redox.2020.101588. Epub 2020 Jul 17. PMID: 32739155; PMCID: PMC7767737.
- Ogawa S, Lee YA, Yamaguchi Y, Shibata Y, Goto Y. Associations of acute and chronic stress hormones with cognitive functions in autism spectrum disorder. Neuroscience. 2017 Feb 20;343:229-239. doi: 10.1016/j.neuroscience.2016.12.003. Epub 2016 Dec 10. PMID: 27956063.
- de Koning AP, Gu W, Castoe TA, Batzer MA, Pollock DD. Repetitive elements may comprise over two-thirds of the human genome. PLoS Genet. 2011 Dec;7(12):e1002384. doi: 10.1371/journal.pgen.1002384. Epub 2011 Dec 1. PMID: 22144907; PMCID: PMC3228813.
- Warburton PE, Hasson D, Guillem F, Lescale C, Jin X, Abrusan G. Analysis of the largest tandemly repeated DNA families in the human genome. BMC Genomics. 2008 Nov 7;9:533. doi: 10.1186/1471-2164-9-533. PMID: 18992157; PMCID: PMC2588610.
- Ershova ES, Malinovskaya EM, Golimbet VE, Lezheiko TV, Zakharova NV, Shmarina GV, Veiko RV, Umriukhin PE, Kostyuk GP, Kutsev SI, Izhevskaya VL, Veiko NN, Kostyuk SV. Copy number variations of satellite III (1q12) and ribosomal repeats in health and schizophrenia. Schizophr Res. 2020 Sep;223:199-212. doi: 10.1016/j.schres.2020.07.022. Epub 2020 Aug 6. PMID: 32773342.
- Hall AN, Morton E, Queitsch C. First discovered, long out of sight, finally visible: ribosomal DNA. Trends Genet. 2022 Jun;38(6):587-597. doi: 10.1016/j.tig.2022.02.005. PMID: 35272860; PMCID: PMC10132741.
- Enukashvily NI, Donev R, Waisertreiger IS, Podgornaya OI. Human chromosome 1 satellite 3 DNA is decondensed, demethylated and transcribed in senescent cells and in A431 epithelial carcinoma cells. Cytogenet Genome Res. 2007;118(1):42-54. doi: 10.1159/000106440. PMID: 17901699.
- Bersani F, Lee E, Kharchenko PV, Xu AW, Liu M, Xega K, MacKenzie OC, Brannigan BW, Wittner BS, Jung H, Ramaswamy S, Park PJ, Maheswaran S, Ting DT, Haber DA. Pericentromeric satellite repeat expansions through RNA-derived DNA intermediates in cancer. Proc Natl Acad Sci U S A. 2015 Dec 8;112(49):15148-53. doi: 10.1073/pnas.1518008112.
- Ershova ES, Agafonova ON, Zakharova NV, Bravve LV, Jestkova EM, Golimbet VE, Lezheiko TV, Morozova AY, Martynov AV, Veiko RV, Umriukhin PE, Kostyuk GP, Kutsev SI, Veiko NN, Kostyuk SV. Copy number variation of satellite Ⅲ(1q12) in patients with schizophrenia. Front Genet. 2019 Nov 22;10:1132. doi: 10.3389/fgene.2019.01132. PMID: 31850056; PMCID: PMC6902095.
- Способ дифференциальной диагностики детской шизофрении и детского аутизма по количеству копий генов, кодирующих рибосомную РНК, в геноме ребенка с психическими нарушениями. Патент на изобретение RU 2816043 C1, 26.03.2024.
- Schopler E, Reichler RJ, DeVellis RF, Daly K. Toward objective classification of childhood autism: Childhood Autism Rating Scale (CARS). J Autism Dev Disord. 1980 Mar;10(1):91-103. doi: 10.1007/BF02408436. PMID: 6927682.
- Schopler E, Lansing M, Reichler R, Marcus L. Psychoeducational profile: TEACCH Individualized Psychoeducational Assessment for Children with Autism Spectrum Disorders. Third edition (PEP-3). Austin, TX: Pro-Ed, 2005.
- Ershova ES, Jestkova EM, Martynov AV, Shmarina GV, Umriukhin PE, Bravve LV, Zakharova NV, Kostyuk GP, Saveliev DV, Orlova MD, Bogush M, Kutsev SI, Veiko NN, Kostyuk SV. Accumulation of Circulating Cell-Free CpG-Enriched Ribosomal DNA Fragments on the Background of High Endonuclease Activity of Blood Plasma in Schizophrenic Patients. Int J Genomics. 2019 Aug 5;2019:8390585. doi: 10.1155/2019/8390585. PMID: 31467866; PMCID: PMC6701307.
- Ershova ES, Malinovskaya EM, Konkova MS, Veiko RV, Umriukhin PE, Martynov AV, Kutsev SI, Veiko NN, Kostyuk SV. Copy Number Variation of Human Satellite III (1q12) With Aging. Front Genet. 2019 Aug 7;10:704. doi: 10.3389/fgene.2019.00704. PMID: 31447880; PMCID: PMC6692473.
- Cooke HJ, Hindley J. Cloning of human satellite III DNA: different components are on different chromosomes. Nucleic Acids Res. 1979 Jul 25;6(10):3177-97. doi: 10.1093/nar/6.10.3177. PMID: 573470; PMCID: PMC327928.
- Chestkov IV, Jestkova EM, Ershova ES, Golimbet VE, Lezheiko TV, Kolesina NY, Porokhovnik LN, Lyapunova NA, Izhevskaya VL, Kutsev SI, Veiko NN, Kostyuk SV. Abundance of ribosomal RNA gene copies in the genomes of schizophrenia patients. Schizophr Res. 2018 Jul;197:305-314. doi: 10.1016/j.schres.2018.01.001. Epub 2018 Jan 12. PMID: 29336872.
- Hall AN, Turner TN, Queitsch C. Thousands of high-quality sequencing samples fail to show meaningful correlation between 5S and 45S ribosomal DNA arrays in humans. Sci Rep. 2021 Jan 11;11(1):449. doi: 10.1038/s41598-020-80049-y. PMID: 33432083; PMCID: PMC7801704.
- Hori Y, Shimamoto A, Kobayashi T. The human ribosomal DNA array is composed of highly homogenized tandem clusters. Genome Res. 2021 Nov;31(11):1971-1982. doi: 10.1101/gr.275838.121. Epub 2021 Aug 18. PMID: 34407983; PMCID: PMC8559705
- Konkova MS, Ershova ES, Savinova EA, Malinovskaya EM, Shmarina GV, Martynov AV, Veiko RV, Zakharova NV, Umriukhin P, Kostyuk GP, Izhevskaya VL, Kutsev SI, Veiko NN, Kostyuk SV. 1Q12 loci movement in the interphase nucleus under the action of ROS is an important component of the mechanism that determines copy number variation of satellite Ⅲ(1q12) in health and schizophrenia. Front Cell Dev Biol. 2020 Jun 5;8:386. doi: 10.3389/fcell.2020.00386. PMID: 32714923; PMCID: PMC7346584.
- Ershova ES, Savinova EA, Kameneva LV, Porokhovnik LN, Veiko RV, Salimova TA, Izhevskaya VL, Kutsev SI, Veiko NN, Kostyuk SV. Antipsychotics affect satellite Ⅲ(1q12) copy number variations in the cultured human skin fibroblasts. Int J Mol Sci. 2023 Jul 10;24(14):11283. doi: 10.3390/ijms241411283. PMID: 37511043; PMCID: PMC10380077.


