Важная роль изменений микроРНК в эволюции homo neanderthalensis и homo denisova
Автор: Гунбин К.В., Афонников Д.А., Колчанов Н.А., Деревянко А.П.
Журнал: Археология, этнография и антропология Евразии @journal-aeae-ru
Рубрика: Палеоэкология. Каменный век
Статья в выпуске: 3 (51), 2012 года.
Бесплатный доступ
Гены микроРНК играют важную роль в регуляции транскрипции белоккодирующих генов, модуляции эмбрионального развития, дифференциации эмбриональных стволовых клеток, образовании тканей и т.д. В настоящей работе проведено комплексное исследование наиболее быстро эволюционировавших микроРНК Homo neanderthalensis и Homo denisova, геномы которых были недавно секвенированы. На основании анализа функций генов-мишеней этих микроРНК и изменений во вторичной структуре их предшественников показано, что мутации генов микроРНК могли играть выдающуюся роль в эволюции H. neanderthalensis и H. denisova, в особенности в развитии и функционировании их мозга.
Микрорнк, молекулярная эволюция
Короткий адрес: https://sciup.org/14522936
IDR: 14522936 | УДК: 572.1/4
Текст научной статьи Важная роль изменений микроРНК в эволюции homo neanderthalensis и homo denisova
В 2010 г. были секвенированы ядерные геномы Homo neanderthalensis (H. n.) [Green et al., 2010] – первого представителя архаичных людей, которые еще в середине XIX в. стали известны науке, – и Homo denisova (H. d.) [Reich et al., 2010] – древнего человека, обитавшего, согласно датировке останков из Денисовой пещеры на Алтае, 50–45 тыс. л.н. [Деревянко, 2011]. Анализ генома H. d., расселявшихся в Южной Сибири и Центральной Азии, позволил отнести их к одной из популяций древних людей, непосредственно участвовавших в формировании человека современного анатомического и генетического облика [Там же]. Обшир- ные материалы, полученные в результате полевых и лабораторных исследований, свидетельствуют о том, что H. d. самостоятельно создал одну из ярких верхнепалеолитических культур в Евразии, которая развивалась на протяжении нескольких десятков тысяч лет конвергентно культурам европейских неандертальцев и кроманьонцев без каких-либо заметных влияний, связанных с миграцией сюда популяций из соседних регионов [Там же].
На основе сравнительного анализа геномов H. n., H. d. и Homo sapiens sapiens ( H. s. s. ) были получены оценки времени их дивергенции – приблизительно 0,8 млн л.н. [Reich et al . , 2010]. Однако остается открытым вопрос о наиболее вероятных системах генов, подвергавшихся движущему отбору у исчезнувших архаичных людей неандартальского и денисовского типов. В связи с этим нами было проведено компью-
Рис. 1. Обобщенная схема канонического пути созревания микроРНК.
терное сравнение генома H. s. s. с геномами H. n. и H. d. по особенностям структурно-функциональной организации кодируемых ими микроРНК. Такая постановка задачи обусловлена следующим [Hu et al . , 2011; Somel et al . , 2011]: 1) в настоящее время становится все более очевидной связь наиболее быстрых эволюционных преобразований при дивергенции гоминидов прежде всего с изменением генов транскрипционных факторов и микроРНК; 2) недавно было показано, что мутации генов микроРНК при формировании человека современного типа могут быть связаны с изменениями в развитии и функционировании центральной нервной системы. Согласно результатам проведенного нами анализа, после дивергенции H. n. и H. d. от общего предка в их геномах были накоплены отличия по ряду микроРНК, в т.ч. регулирующих экспрессию генов, которые функционируют в тканях нервной системы, матки, семенников, иммунной системы и др.
Современные данные о процессе созревания микроРНК
Молекула предшественника микроРНК (пре-микроРНК), кодируемая соответствующим геном, имеет длину ~80 нуклеотидов и формирует шпилькоподобную вторичную структуру, образованную дуплексом, замыкаемым петлей*. Как правило, вначале пре-микро-
*Вторичная структура РНК образуется при комплементарном взаимодействии различных участков РНК (соеди-
РНК опознается белковым комплексом DGCR8/Dro-sha, далее фермент Drosha отрезает удаленную часть стебля РНК-шпильки, затем РНК-шпилька с укороченным стеблем с помощью белка Exportin-5 переносится в цитоплазму, где она связывается с ферментом Dicer, отсекающим петлю [Treiber T., Treiber N., Meister, 2012] (рис. 1). В результате образуется дуплекс микроРНК длиной ~20 нуклеотидов, одна из цепей которого обычно представляет собой зрелую микроРНК [Ibid.; Yang, Lai, 2011]. Существует также множество альтернативных путей созревания микроРНК. Например, оно может происходить непосредственно из последовательностей интронов* белоккодирующих генов [Yang, Lai, 2011]. Последовательность зрелой микроРНК и иногда ее комплементарная последовательность (микроРНК*) влияют на экспрессию белокко-дирующих генов за счет комплементарного связывания с матричной РНК (мРНК) в составе РНК-белкового комплекса RISC (RNA-Induced Silencing Complex), подавляя трансляцию и/или инициируя деградацию мРНК [Treiber T., Treiber N., Meister, 2012; Yang, Lai, 2011]. Эффективность разрезания пре-микроРНК белком Dicer в значительной степени зависит от общей длины стебля шпильки и наличия в стебле пре-микроРНК неспаренных участков [Starega-Roslan et al., 2011]. На процессинг пре-микроРНК белком Drosha особое влияние оказывают неспаренные участки в основании стебля шпильки и одноцепочечные окончания РНК-шпильки, а также длина стебля шпильки [Han et al., 2006]. Существенную роль в этом процессе также играет сама последовательность шпильки премикроРНК, т.к. она важна для взаимодействия премикроРНК с белками-модификаторами процессинга [Saj, Lai, 2011].
Отбор быстро эволюционировавших генов микроРНК Homo neanderthalensis и Homo denisova
На основе выравнивания геномов шести приматов из базы данных ENSEMBL (rel. 61) были отобраны экспериментально подтвержденные гены предшественников микроРНК человека (по данным miRBase, rel. 18), идентичные у человека и шимпанзе, для реконструкции консенсусов пре-микроРНК в геномах H. d. и H. n. Эти геномы были представлены в виде коротких нуклеотидных последовательностей, которые картированы на геном человека (см. и . Консенсусная последовательность пре-микроРНК древних людей составлялась из коротких фрагментов с использованием нуклеотидов с наивысшим качеством прочтения [Green et al., 2010]. Не учитывались пре-микроРНК: а) не полностью секвенированные; б) у которых качество прочтения хотя бы одного нуклеотида в позиции древнего генома, несущей замену по отношению к человеку, по шкале Phred* [Ewing, Green, 1998] было ниже 30 (согласно рекомендациям [Green et al., 2010; Reich et al., 2010]); в) содержащие делецию/вставку с качеством секвенирования соседних с ней нуклеотидов < 30. В результате были сформированы две референсные выборки пре-микроРНК: из 114 генов H. n. и из 342 генов H. d. Трехкратное различие в количестве обнаруженных генов-ортологов** у H. d. и H. n. может отражать улучшения в технологии секвенирования генома H. d. по сравнению с H. n. [Reich et al., 2010].
Известно, что в ходе деградации ископаемой ДНК наиболее частыми были спонтанные замены нуклеотидов C→T и G→A [Green et al., 2010; Reich et al., 2010]. С учетом этого обстоятельства, а также во избежание возможных ошибок секвенирования [Champlot et al., 2010] мы исключили из обеих выборок такие премикроРНК, которые содержат только замены C→T и G→A по отношению к H. s. s. и имеют менее двух однонуклеотидных замен любой другой природы. Таким образом были отобраны пре-микроРНК древних людей с заменами, с большой вероятностью имевшими эволюционное происхождение. Наконец, при помощи программы Blast мы исключили пре-микроРНК, встречающиеся в геномах H. s. s., H. d ., H. n. более чем в одной копии . Это было сделано для того, чтобы выбрать пре-микроРНК древних людей, с большой вероятностью имевшие уникальные функции. В результате мы обнаружили гены пре-микроРНК H. s. s. , для которых характерны большие отличия от ортологичных генов пре-микроРНК H. n . и H. d. (табл. 1).
Анализ влияния эволюционных изменений микроРНК на их созревание и функциональную специфичность
С использованием экспериментальной информации из базы данных miRBase (rel. 18) была проведена реконструкция вторичных структур десяти пре-микроРНК H. s. s. , указанных в табл. 1. Мы спроецировали все нуклеотидные замены, выявленные при сравнении ортологов пре-микроРНК в парах H. s. s. / H. n. и H. s. s. / H. d. (табл. 1), на вторичные структуры соответствующих пре-микроРНК H. s. s. На рис. 2 приведены два примера такой проекции. Анализ показал, что подавляющее большинство замен, отличающих пре-микроРНК H. d . и H. n. от пре-микроРНК H. s. s. (18 из 24), локализованы в позициях, значимых для процессинга или функционирования пре-микроРНК современного человека (см. табл. 1). Вероятность наблюдать по случайным причинам такое расположение замен в предположении их равновероятного распределения по последовательности пре-микроРНК мала*.
*Применялся рандомизационный тест. Вдоль последовательности пре-микроРНК симулировалось 105 случайных распределений замен и подсчитывалась их доля, соответствующая наблюдаемому распределению, которая отражала уровень статистической значимости ( p ). Если замена наблюдалась в зрелой микроРНК (и/или микроРНК * ), то мы увеличивали количество симулируемых замен на 1 и считали, что позиции обеих симулированных замен, соответствующих наблюдаемой, должны находиться в участке зрелой микроРНК. Так учитывалась важная роль этой
Таблица 1. Характеристика экспериментально выявленных генов пре-микроРНК Homo sapiens sapiens , имеющих наибольшие эволюционно значимые отличия от ортологичных генов H. neanderthalensis и H. denisova
|
ENSEMBL-идентификатор гена пре-микроРНК H. s. s. |
Эволюционно значимые отличия * |
Наименование микроРНК H. s. s. |
Значения E-value поиска Blast пре-микроРНК в геноме |
|
|
H. n. или H. d. ** |
H. s. s. (ENSEMBL, rel. 61) |
|||
|
ENSG00000221598 |
A10G; A19G; G13T |
Homo neanderthalensis hsa-miR-1249 |
3×10-26 |
4×10-21 |
|
ENSG00000211520 |
T3G; T11G ; A21G |
hsa-miR-216b |
5×10-35 |
3×10-24 |
|
ENSG00000208036 |
C73G ; C76A |
hsa-miR-106b |
5×10-35 |
7×10-30 |
|
ENSG00000207758 |
A79G; A82G |
hsa-miR-532 |
6×10-40 |
2×10-36 |
|
ENSG00000207728 |
C44G; A47G; A52G |
hsa-miR-449b |
3×10-43 |
4×10-38 |
|
ENSG00000207579 |
C11G; G13C; C14A |
hsa-miR-662 |
4×10-42 |
2×10-35 |
|
ENSG00000207719 |
T9C; A25G |
hsa-miR-623 |
9×10-44 |
3×10-40 |
|
ENSG00000221269 |
C35A; A38C |
Homo denisova hsa-miR-1302-8 |
5×10-60 |
8×10-57 |
|
ENSG00000216105 |
T68C ; T83C |
hsa-miR-943 |
5×10-38 |
9×10-35 |
|
ENSG00000207551 |
C37G ; A72G |
hsa-miR-608 |
2×10-43 |
3×10-40 |
*Формат описания замен: [нуклеотид Homo sapiens ][позиция][замененный нуклеотид]; позиции даны по гену пре-микроРНК H. s. s. Жирным шрифтом выделены замены, локализованные в позициях зрелой микроРНК или в позициях вторичной структуры пре-микроРНК H. s. s ., значимых для ее процессинга.
**Последовательности фрагментов геномов H. n. и H. d. получены из данных [Green et al., 2010; Reich et al., 2010] с помощью программы samtools [Li et al., 2009], запуск которой производился с параметром pileup (данные H. n. содержат 33 044 622 фрагмента общей длиной 3 114 859 696 нуклеотидов, H. d. – 21 810 956 фрагментов общей длиной 4 620 799 428 нуклеотидов).
hsa-miR-1249
А А /а\ А Р\ Р\
ggaggaggg gg да дддс guuccи
11111111 II II 111111111
cuucuuccc-cc си сссд-- сааддд дисса | | \/"|У с ас hsa-miR-1302-8
а
и
и
а
сссаиииа аси дааиииса аи аасассд—иааииии
А
адсаи адиди ис
А Л Р°х
са
ас
^ддиадаи^да^ииааади^и^ yuguggt^ ^ииаааа
: д с с д £д | ^аа^
ucgua ucaua ag
gu
V у У
zua
▼ д
и
Рис. 2. Проекция нуклеотидных замен на вторичные структуры ортологичных пре-микроРНК Homo sapiens sapiens (по данным miRBase, rel. 18) на примерах пре-микроРНК H. neanderthalensis (hsa-miR-1249) и H. denisova (hsa-miR-1302-8) .
Жирным шрифтом выделены сайты процессинга пре-микроРНК; курсивом – зрелые микроРНК; подчеркиванием – позиции, содержащие замены по отношению к последовательности пре-микроРНК H. s. s. , тип замены указан стрелкой.
Так, для hsa-miR-1249 она не превышает 0,0014, для hsa-miR-1302-8 – 0,0013. Эти результаты свидетельствуют о том, что нуклеотидные замены в генах премикроРНК H. d. и H. n. в ходе их дивергенции от общей с H. s. s. предковой формы фиксировались в функционально значимых районах пре-микроРНК. Следовательно, они могли оказывать существенное влияние как на процессы созревания микроРНК, так и на их функциональную специфичность, связанную с регуляцией экспрессии мРНК-мишеней.
Дополнительно для десяти отобранных пре-микроРНК H. s. s. был проведен поиск известных SNP-вариантов* с использованием базы данных dbSNP (rel. 136) [Sherry et al., 2001]. Ни для одной из них таковых не найдено, что может служить косвенным аргументом в пользу функциональной значимости этих премикроРНК у H. s. s и, следовательно, обнаруженных замен у ортологичных пре-микроРНК H. d. и H. n.
Идентификация генов-мишеней быстро эволюционировавших микроРНК Homo neanderthalensis и Homo denisova
Чтобы установить функциональную роль выявленных нами быстро эволюционировавших микроРНК древних людей, мы определили термины функциональной аннотации их генов-мишеней (биологические и молекулярные процессы, особенности экспрессии мРНК и др.). С помощью данных starBase** [Yang et al., 2011] в геноме H. s. s. были выявлены гены-мишени последовательности в формировании дуплекса мРНК/мик-роРНК. Если замены наблюдались в остальных участках пре-микроРНК (3’- и 5’-одноцепочечные и двуцепочечные хвосты, нефункциональная микроРНК*, петля шпильки), то число симулируемых замен соответствовало наблюдаемому. В этом случае в анализе учитывалось только положение симулированных замен. Разбиение пре-микроРНК на участки осуществлялось с учетом известных данных о механизме ее процессинга [Han et al., 2006; Yang, Lai, 2011; Starega-Roslan et al., 2011; Saj, Lai, 2011; Treiber T., Trei-ber N., Meister, 2012].
микроРНК-ортологов H. d. и H. n. Мы идентифицировали гены-мишени для трех и семи микроРНК-ортологов H. s. s. , включающих отобранные быстро эволюционировавшие микроРНК соответственно H. d. и H. n ., и двух референсных выборок микроРНК H. d. и H. n ., содержащих 342 и 114 пре-микроРНК соответственно. Информация о взаимодействии мРНК/микроРНК подтверждалась на основе данных starBase двумя или более CLIP-seq-экспериментами и минимум одной программой предсказания. Для референсных выборок было установлено, что 342 ортолога микроРНК H. d. имеют в геноме H. s. s. 4 702 гена-мишени, а 114 ортологов микроРНК H. n. – 3 893. Для генов-мишеней быстро эволюционировавших микроРНК-ортологов H. d. и H. n . мы дополнительно проанализировали множественные выравнивания сайтов связывания мРНК/микроРНК для четырех приматов: человека, шимпанзе, гориллы, орангутана (ENSEMBL, rel. 65). Из них мы отбирали только эволюционно консервативные, для которых не более чем одна последовательность из трех (шимпанзе, горилла, орангутан) имеет отличия от человека. Это было сделано для того, чтобы обеспечить эволюционную консервативность мишеней микроРНК гоминидов вплоть до этапа дивергенции H. d. и H. n . от H. s. s. В результате такого отбора установлено, что в геноме H. s. s. три микроРНК, ортологичных быстро эволюционировавшим микроРНК H. d. , имеют 136 генов-мишеней, а семь, ортологичных быстро эволюционировавшим микроРНК H. n., – 715 (табл. 2).
Для функциональной аннотации генов-мишеней быстро эволюционировавших микроРНК древних людей мы выбрали два независимых источника – банк данных GNF и базу данных GeneOntology, которые представлены в интернет-сервисе DAVID (верс. 6.7) [Huang, Sherman, Lempicki, 2009] и содержат наиболее полную и значимую интегрированную информацию о функциях генов человека*. В банке данных GNF, созданном Геномным институтом Фонда Новартис (Genomics Institute of the Novartis Research Foundation), описаны ткани и органы, в которых экспрессируются мРНК генов человека. База данных GeneOntology содержит информацию о функциях генов и их белковых продуктов. Эти информационные источники позволяют сформировать альтернативное и взаимодополняющее представление о функции рассматриваемых генов-мишеней.
*DAVID (верс. 6.7) содержит 13 113 генов человека, для которых имеется информация о тканеспецифичности экспрессии (по данным Геномного института Фонда исследований Новартис, GNF), и 14 209 генов человека, для которых охарактеризованы биологические процессы (согласно GeneOntology, категория «биологический процесс»), а также множество иных данных.
Таблица 2. Примеры кодирующих белки генов-мишеней, регулируемых микроРНК Homo sapiens sapiens, быстро эволюционировавшие ортологи которых найдены у H. neanderthalensis и H. denisova
|
RefSeq-идентификатор мРНК H. s. s., регулируемой микроРНК |
Название гена |
Функции белка, кодируемого соответствующей мРНК |
|
Homo denisova |
||
|
NM_153047 |
FYN |
Требуется для развития и функционирования мозга, играет важную роль в регуляции роста аксонов |
|
NM_020465 |
NDRG4 |
Экспрессируется в мозге, необходим для функционирования астроцитов, клеток нейроглии |
|
NM_002158 |
FOXN2 |
Регулирует транскрипцию вируса Т-клеточного лейкоза человека, участвует в иммунном ответе на ретровирусную инфекцию |
|
NM_001077397 |
IRF2BP2 |
Модулирует интерферонрегулируемую транскрипцию генов, участвует в иммунном ответе на вирусную инфекцию |
|
NM_001124 |
ADM |
Обладает гипотензивным действием, обнаруживается в крови гипертоников в повышенных количествах |
|
NM_080881 |
DBN1 |
Играет важную роль в процессе роста нейронов, уменьшение его количества в мозге приводит к нарушениям памяти при болезни Альцгеймера |
|
NM_017420 |
SIX4 |
Транскрипционный фактор, участвующий в дифференциации и созревании нервных клеток Homo neanderthalensis |
|
NM_024749 |
VASH2 |
Ингибитор ангиогенеза, тормозит образование сети эндотелиальных клеток |
|
NM_020440 |
PTGFRN |
Ингибирует связывание простагландина F2-α с его рецептором (регулирует процессы, связанные с имплантацией оплодотворенной яйцеклетки в матку) |
|
NM_181828 |
NF2 |
Располагаясь преимущественно в клеточных контактах, тормозит рост клеток и ингибирует рост опухолей |
|
NM_006472 |
TXNIP |
Ингибирует активность тиреоредоксина (белка-антиоксиданта) |
|
NM_012465 |
TLL2 |
Протеаза, специфически необходимая при эмбриогенезе, влияет на формирование спинно-брюшной оси и скелета |
|
NM_003373 |
VCL |
Белок цитоскелета, участвующий в креплении F-актина к мембране, его дефекты приводят к застойной сердечной недостаточности и аритмии |
|
NM_001145103 |
SMAD3 |
Ингибитор заживления ран, опосредующий модуляцию роста и миграции кератиноци-тов и хемотаксис моноцитов; регулирует формирование хряща и кости, ингибирует раннее заживление переломов костей |
Чтобы выявить функциональные характеристики генов-мишеней микроРНК, наиболее часто встречающиеся в их аннотациях, по сравнению с таковыми всех генов человека, мы применили рандомизацион-ный тест*. Для конкретной выборки генов-мишеней микроРНК рассматривалась характеристика func и подсчитывалось число nreal(func) генов, аннотации которых содержали ее. Затем из полного набора аннотированных генов человека методом случайной выборки без возвращения** формировался набор генов, рав- ный по объему анализируемой выборке. Для него подсчитывалось число nrand(func) генов, имевших функциональную характеристику func. Процедура повторялась 5×106 раз. Подсчитывалось число случайных выборок M, в которых nrand(func) ≥ nreal(func). Далее вычислялась вероятность наблюдать по случайным причинам функциональную характеристику func (p = M/5×106) в выборке генов человека, равной по объему анализируемой.
Данный тест повторялся отдельно для каждого термина аннотации funс и каждой из четырех выборок генов-мишеней микроРНК H. d. и H. n. Отметим, ван генератор случайных чисел Вихрь Мерсенна [Matsumoto, Nishimura, 1998]. Он обладает огромным периодом 219937 – 1, что более чем достаточно для рандомизации всех генов человека.
что частая встречаемость определенной характеристики func в выборках генов-мишеней, соответствующих быстро эволюционировавшим микроРНК H. d. и H. п., могла быть связана как с движущим отбором в эволюции этих древних людей, так и с неполнотой секвенированных пре-микроРНК H. d., H. п. и фрагментарностью обнаруженных генов-мишеней. По- этому мы отбирали характеристики func, которые достоверно часто (р < 0,05) встречаются в данных выборках, но не перепредставлены (р > 0,3) в генах-мишенях, соответствующих референсным выборкам микроРНКH. d. и H. п. (табл. 3,4). Отобранные таким способом характеристики func могут быть связаны с наиболее вероятными системами генов, подвергавши-
Таблица 3. Примеры тканей и органов, где наиболее часто экспрессируются мРНК генов-мишеней, регулируемых микроРНК Homo sapiens sapiens , быстро эволюционировавшие ортологи которых найдены у H. neanderthalensis и H. denisova (анализ на основе банка данных GNF)
|
Ткань/орган |
Вероятность наблюдаемого числа генов-мишеней |
|
|
Быстро эволюционировавшие микроРНК |
Референсная выборка микроРНК |
|
|
Homo denisova |
||
|
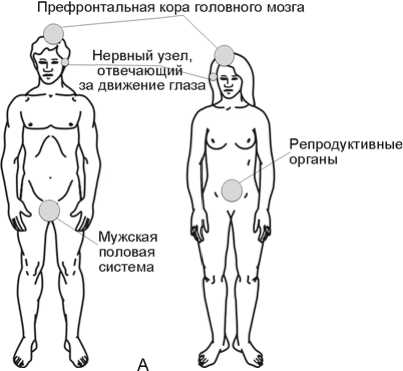
Префронтальная кора головного мозга |
0,0363 |
0,999 |
|
Ganglion сiliare (нервный узел, отвечающий за движения глаза) |
0,0193 |
0,995 |
|
Яичко |
0,0122 |
0,999 |
|
Homo neanderthalensis |
||
|
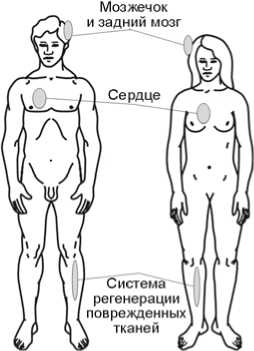
Medulla oblongata (нижняя часть ствола головного мозга) |
0,034 |
0,790 |
|
Атриовентрикулярный узел (нервный узел, отвечающий за сокраще- |
||
|
ния сердца) |
0,038 |
0,701 |
Таблица 4. Примеры функций генов, наиболее часто встречающихся в выборке генов-мишеней микроРНК Homo sapiens sapiens, быстро эволюционировавшие ортологи которых найдены у H. neanderthalensis и H. denisova (анализ на основе базы данных GeneOntology)
мися движущему отбору у архаичных людей неандар-тальского и денисовского типов.
Обсуждение результатов
Рассмотрим примеры тканей и органов, в которых наиболее часто наблюдается экспрессия генов-мишеней, регулируемых микроРНК H. s. s. , быстро эволюционировавшие ортологи которых найдены у H. n. и H. d. (см. табл. 3, рис. 3).
Homo denisova. Интересно, что гены-мишени быстро эволюционировавших ортологов микроРНК H. d. преимущественно экспрессируются в префронтальной коре головного мозга, нервных узлах, отвечающих за движение глаз, а также в мужских гениталиях – тканях и органах, функции которых связаны с восприятием окружающей информации и репродукцией и в целом могут быть охарактеризованы как определяющие взаимодействие древних людей в популяции, что согласуется с высоким уровнем развития культуры H. d. [Деревянко, 2011].
Homo neanderthalensis. По-видимому, одним из важных факторов, определявших различия между H. n . и H. s. s ., являлась система условных и безусловных рефлексов, детерминируемая нижней частью ствола головного мозга. Эволюционные изменения H. n . по сравнению с H. s. s . также, возможно, были связаны с контролем работы сердца.
Рассмотрим примеры функций (терминов GeneOntology), которые наиболее часто встречаются в аннотации генов-мишеней, регулируемых микроРНК H. s. s. , быстро эволюционировавшие ортологи которых найдены у H. n. и H. d. (см. табл. 4, рис. 3).
Homo denisova. Наиболее сильное воздействие в результате быстрых эволюционных изменений пре-микроРНК H. d. могли испытывать гены-мишени, отвечающие за беременность, морфогенез глаз, а также, что очень важно, за сигнальные процессы, обеспечивающие взаимодействие организмов в популяции. Это согласуется с археологическими данными о высоком уровне развития культуры H. d. [Там же].
Homo neanderthalensis. Наиболее сильному влиянию движущего отбора в связи с накоплением замен в пре-микроРНК H. n. могли быть подвержены процессы, протекающие в мозжечке и стволе головного мозга, что хорошо согласуется с известными археологическими данными о специфике строения этих отделов у неандертальцев [Дробышевский, 2007]. Эволюционные изменения, по-видимому, затронули и систему регенерации поврежденных тканей, а именно регуляцию регенерации аксонов, регуляцию вазоконстрикции и клеточной адгезии. Это согласуется с данными о жизнедеятельности H. n ., протекав-
Б
Рис. 3. Ткани, органы и функциональные системы, функция и/или развитие которых регулируются быстро эволюционировавшими в линиях H. denisova (А) и H. neanderthalensis (Б) микроРНК. Показана проекция на ткани и органы H. sapiens sapiens.
шей в суровых условиях как природной, так и, возможно, социальной среды [Медникова, 2007]*.
Выводы
Таким образом, в настоящей работе показано, что изменение генов микроРНК могло вносить существенный вклад в эволюцию молекулярно-генетических систем развития и функционирования ряда отделов головного мозга H. n. и H. d., а также других тканей и органов. Согласно результатам проведенного анализа, движущий отбор, связанный с быстрой эволюцией микроРНК H. n. и H. d., затрагивал у этих двух линий древних людей не одни и те же ткани, органы и функциональные системы. Данное обстоятельство может свидетельствовать в пользу физиологических и анатомических различий H. n. и H. d. Однако полученные нами данные не позволяют сделать вывод о том, что эти различия могли способствовать формированию разных подвидов человека разумного (H. d., H. n. и H. s. s.). Необходимо комплексное исследование с привлечением полной информации о геномах древних людей, палеогеногеографии H. d., H. n. и H. s. s., археологических данных об их культуре.


