Ведение беременности при диссеминированной гастроинтестинальной стромальной опухоли. Случай из практики
Автор: Абдуллаев Амир Гусейнович, Курбанов Асадулла Асадуллаевич
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Случай из клинической практики
Статья в выпуске: 6 т.19, 2020 года.
Бесплатный доступ
Актуальность. Гастроинтестинальные стромальные опухоли встречаются редко, составляя 10-20 случаев на 1 млн населения в год. Все желудочно-кишечные новообразования - это потенциально злокачественные опухоли, имеющие в основном спорадический характер. Желудочно-кишечные стромальные опухоли во время беременности - крайне редкое явление, с которым сложно справиться с этической, хирургической и онкологической точек зрения. Описание клинического случая. В статье описан клинический случай ведения беременности на фоне асцита и канцероматоза брюшины, который был выявлен на 16-17-й нед. Пациентка находилась под наблюдением врачей акушеров-гинекологов, онкологов и неонатологов, проводился еженедельный УЗИ мониторинг. На 26-й неделе беременности, учитывая признаки прогрессирования болезни, было произведено родоразрешение (корпоральное кесарево сечение) с целью скорейшего назначения противоопухолевого лечения и постнатальной адаптации новорожденного. Заключение. Представлен первый, зарегистрированный в литературе случай успешного комбинированного лечения - корпоральное кесарево сечение и резекция опухоли у 31-летней беременной пациентки с гастроинтестинальной стромальной опухолью тонкой кишки, осложненной канцероматозом брюшины и асцитом. Нет никаких рекомендаций по оптимальному сроку резекции опухоли во время беременности, и поэтому ключевые решения должны приниматься в условиях мультидисциплинарной команды с учетом пожеланий пациентки. Представленный нами клинический случай демонстрирует возможность изменения в исключительных случаях подходов в ведении и лечении пациентов с интраперитонеальной диссеминацией, а также подчёркивает важность долгосрочного междисциплинарного подхода при участии онкологов, акушеров и гинекологов, неонатологов и других специалистов, что ведет к благополучному родоразрешению и проведению всего необходимого спектра лечения.
Гастроинтестинальная стромальная опухоль и беременность, таргетная терапия
Короткий адрес: https://sciup.org/140254392
IDR: 140254392 | УДК: 616.33/.34-006-08:618.2 | DOI: 10.21294/1814-4861-2020-19-6-148-154
Текст научной статьи Ведение беременности при диссеминированной гастроинтестинальной стромальной опухоли. Случай из практики
Гастроинтестинальная стромальная опухоль (ГИСО) – злокачественная мезенхимальная опухоль, исходящая из клеток Кахала (синонимы: телоциты, интерстициальные пейсмекерные клетки желудочно-кишечного тракта, интерстициальные пейсмекерные клетки) [1]. Среди опухолей желудочно-кишечного тракта стромальные мезенхимальные (неэпителиальные) новообразования составляют, по данным литературы, около 1 %. Случаи стромальных мезенхимальных опухолей впервые описаны в 1984 г., методы гистохимической верификации разработаны в конце ХХ века. Наиболее частой локализацией таких новообразований являются желудок (более 50 %) и тонкая кишка (25–30 %), преобладает экстра-органный вариант роста, что обусловливает длительное скрытое течение процесса. Как минимум в половине случаев стромальные мезенхимальные опухоли проявляются острыми осложнениями, среди которых доминируют желудочно-кишечные кровотечения. Методы визуализации далеко не всегда помогают своевременно выявить опухоль, и она диагностируется в качестве находки во время операции. Окончательный диагноз устанавливают при комплексном морфологическом исследовании операционного (или секционного) препарата.
Клинические рекомендации не требуют при стромальных мезенхимальных опухолях выполнения объёмных операций, как при раке. При высоком индексе пролиферации применяют таргетную терапию.
Все гастроинтестинальные новообразования – это потенциально злокачественные опухоли, имеющие в основном спорадический характер. Средний показатель заболеваемости в мире составляет 1,0–1,5 случая на 100 тыс. человек в год. Ежегодная заболеваемость на 1 млн населения составляет в Гонконге 16,8–19,6 случая, в Исландии – 11 случаев. В США ежегодно выявляются 5000–6000 новых случаев ГИСО. Заболеваемость в России неизвестна [2]. Наибольшая заболеваемость отмечается среди пациентов в возрасте 50–65 лет. Различий в уровнях заболеваемости между мужчинами и женщинами не отмечено [3].
До 1983 г. неэпителиальные опухоли желудочнокишечного тракта, развивающиеся из стромы, гладкомышечных структур и нервных элементов, иммунофенотипически отличающихся от обычных опухолей с гладкомышечной или нейрогенной дифференцировкой, традиционно диагностировались как лейомиосаркомы, лейомиомы, лейомиобласто-мы, неврилеммомы (шванномы) [4–6]. В 1983 г. M.T. Mazur и H.B. Clark внесли существенный вклад в уточнение классификации и понимание патогенеза ГИСО, открыв молекулярный механизм развития этих опухолей, основанный на мутации генов, кодирующих рецептор тирозиновой киназы и свойственных для интерстициальных мезенхимальных клеток Кахала. Это позволило доказать особую природу ГИСО, внести их отдельной нозологической единицей в международную классификацию опухолей и открыть путь для разработки таргетной терапии этих опухолей [7–9].
В 1998 г. иммуногистохимическими исследованиями был уточнён гистогенез ГИСО: в 85 % опухолей была обнаружена мутация в гене KIT и в 3–18 % – в гене PDGFRА . В 10–15 % случаев не выявляются мутации в генах KIT и PDGFRА – дикий тип, WT (Wild type). При исследовании более широких профилей генов выявлено, что стромальные опухоли с WT являются разнородной группой с активирующими мутациями ВRAF , RAS , SDH , NF1 и др. Наследственный тип ГИСО встречается крайне редко [10–14]. В итоге M.T. Mazur и H.B. Clark, описавшие и выделившие эти опухоли как уникальную разновидность стромальных опухолей, дали им такое название, которое признано во всём мире [15].
Опухоль исходит из мышечного слоя стенки органа инкапсулированным узлом, иногда несколькими узлами. Характерен экстраорганный рост, в связи с чем опухоль локализуется в брюшной полости, брыжейке или забрюшинном пространстве. Также были описаны случаи инвазии в слизистую оболочку с изъязвлением [16–17]. Среди гистологических форм преобладает веретеноклеточный вариант, который встречается в 71 % случаев, эпителиоидноклеточный – в 8 %, смешанный – в 21 %. Критериями злокачественности ГИСО являются: размер опухоли более 5 см; высокая клеточность; атипия ядер; наличие более 5 фигур митоза на 50 репрезентативных полей зрения при ×400; индекс пролиферации по экспрессии Ki67 более 10 %; инвазия в сосуды; наличие очагов некроза. По системе FNCLCC выделяют три степени злокачественности ГИСО (Grade I, II, III). Подобно саркомам, ГИСО в основном метастазирует гематогенным путём, причём до 90 % метастазов образуется в печени. Возможны имплантационные метастазы по брюшине и сальнику, лимфоузлы поражаются редко. Вероятность осложнений и злокачественного течения возрастает по мере увеличения размеров опухоли [4–8, 17–19].
Хирургическому лечению подлежат опухоли диаметром 2 см и более, при меньших размерах рекомендуется наблюдать пациентов в динамике. При хирургическом лечении допускается использование органосберегающих операций. Лимфаденэктомия не показана. Применяется таргетная терапия ингибиторами тирозинкиназ: иматинибом, сунитинибом, нилотинибом и др. До появления иматиниба 5-летняя выживаемость после резекции опухоли составляла менее 50 %, при этом ГИСО были невосприимчивы ко всем традиционным системным методам лечения [4–8]. В 2000 г. иматиниб был впервые использован для лечения пациентов с прогрессирующей ГИСО, что в дальнейшем позволило значимо улучшить 5-летнюю выживаемость [20].
Проанализировав данные мировой литературы, мы не обнаружили случаев описания наблюдений клинически проявляющейся гастроинтестинальной стромальной опухоли в сочетании с беременностью. Именно такое клиническое наблюдение представлено нами.
Клинический случай
Пациентка И., 31 год. На базе ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России проведён ретроспективный анализ истории болезни пациентки с беременностью в сочетании с гастроинтестинальной опухолью.
Из анамнеза известно, что в декабре 2017 г. пациентка была экстренно госпитализирована в стационар по месту жительства с острыми болями в эпигастральной области. При обследовании обнаружен выпот в брюшной полости неясного генеза, произведен лапароцентез, патологии не выявлено.
В июле 2018 г. отмечено ухудшение состояния, острые боли в эпигастральной области. По данным УЗИ обнаружена свободная жидкость в брюшной полости неясного генеза, была установлена беременность, 8 нед. В сентябре 2018 г. во втором триместре при плановом УЗИ плода было выявлено образование тонкой кишки и метастазы по брюшине, направлена в ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова». Консилиумом врачей было принято решение о сохранении беременности при условии тщательного динамического УЗИ-контроля за состоянием плода с определением последующей лечебной тактики после родоразрешения.
МРТ брюшной полости (1.11.18): в печени 2 очага (вероятно, метастазы), множественные образования преимущественно в проекции большого сальника и брыжейки.
Учитывая признаки прогрессирования опухоли, принято решение о родоразрешении на раннем сроке с целью скорейшего назначения противоопухолевого лечения и постнатальной адаптации новорожденного. 6.11.18 в ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова» на 26-й нед хирургической бригадой в составе врачей акушеров-гинекологов и онкологов было произведено родоразрешение (корпоральное кесарево сечение). Была извлечена живая девочка массой 900 г при росте 39 см с оценкой по шкале Апгар 6/8 баллов. При интраоперационной ревизии также был выявлен распространенный канцеро- матоз, в стенке тощей кишки было обнаружено опухолевое образование диаметром до 7 см, метастазы по париетальной брюшине.
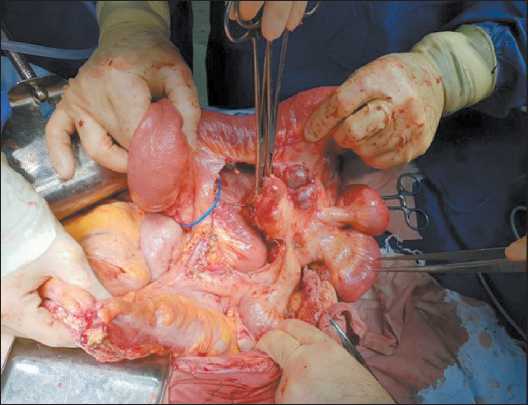
Рис. 1. Удаление опухоли с резекцией брыжейки тонкой кишки
Fig. 1. Removal of a tumor with resection of the small bowel mesentery
УЗИ брюшной полости (11.11.18): в левой доле печени определяются два образования пониженной эхогенности 2,5 см и 2,3 см. Расширение петель кишечника до 4 см за счет жидкостного содержимого. Свободной жидкости в брюшной полости не обнаружено.
На 6-е сут после операции, 12.11.18, появились жалобы на кровь в стуле, боль внизу живота. При общем анализе крови – анемия тяжелой степени, заподозрено желудочно-кишечное кровотечение. Пациентка экстренно переведена в торакоабдоминальное отделение НМИЦ онкологии им. Н.Н. Блохина для дообследования и комбинированного лечения.
При поступлении состояние тяжелое. Периферические лимфатические узлы пальпаторно не увеличены. Живот нормальной формы, симметричен. На передней брюшной стенке – «свежий» послеоперационный рубец от срединной лапаратомии, без признаков воспаления. Тургор кожных покровов снижен. При перкуссии живота отмечается тимпанит различной степени выраженности. При поверхностной пальпации – боль внизу живота. Стул нерегулярный, испражнения оформленной консистенции, темно-серого цвета, без патологических примесей. Пациентка находилась под динамическим контролем, проводилась консервативная терапия.
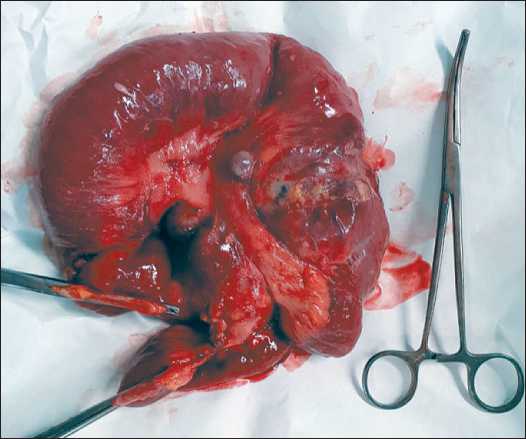
Рис. 2. Операционный макропрепарат Fig. 2. Surgical specimen
При контрольном общем анализе крови (16.11.18) отмечено снижение гемоглобина до 7,8 г/дл, наблюдалось нарастание ЧСС до 120 уд/мин, вздутие живота. Учитывая клинические признаки высокой тонкокишечной непроходимости и желудочно-кишечного кровотечения, принято решение об экстренной операции. При интраоперационной ревизии – выраженный спаечный процесс с фиксацией нескольких петель тонкой кишки между собой за счет спаек и опухолевой инфильтрации. Адгеозиолизис. В брюшной полости около 300 мл асцитической жидкости, которая была эвакуирована. В корне брыжейки тонкой кишки определялся опухолевый конгломерат кистозно-солидной структуры, диаметром до 10 см, новообразование инфильтрировало стенки кишки с сужением её просвета. В большом сальнике – 2 опухолевых конгломерата такой же структуры, диаметром до 1,5 см. В проекции III сегмента печени пальпировалось субкапсулярное образование до 2 см в диаметре. Выполнена циторедуктивная операция в объеме резекции тонкой кишки с опухолью, удаления малого сальника, резекции III сегмента печени, удаления двух опухолевых конгломератов с брыжейки поперечной ободочной кишки (рис. 1–3).
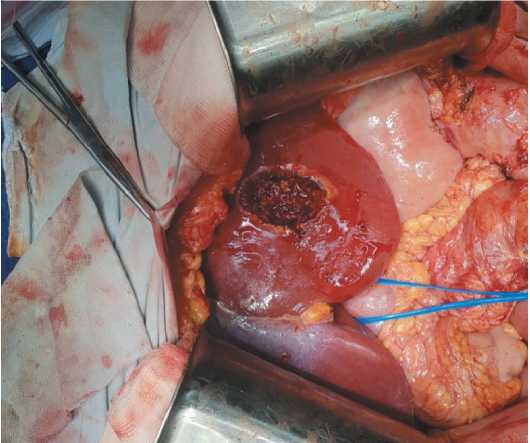
Рис. 3. Зона резекции III сегмента печени Fig. 3. Resection area of segment III of the liver
На 4-е сут после операции с признаками перфорации кишечника пациентка была повторно взята
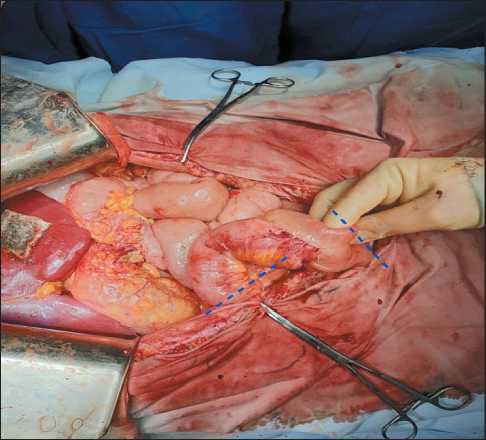
Рис. 4. Зона резекции тонко-тонкокишечного анастомоза с участком перфорации в приводящей петле
Fig. 4. Resection area of the small bowel anastomosis with perforated blind loop в экстренную операционную. При интраоперационной ревизии обнаружена перфорация тонкой кишки в месте ранее ушитого десерозированного участка. Выполнена резекция тонкой кишки с формированием двухрядного межтонкокишечного анастомоза по типу «бок в бок», санация и дренирование брюшной полости (рис. 4).
В послеоперационном периоде наблюдалось нагноение послеоперационной раны, проводилась антибактериальная терапия. Пациентка выписана из стационара на 28-е сут после операции в удовлетворительном состоянии, послеоперационная рана – без признаков воспаления, заживление вторичным натяжением.
При иммуногистохимическом исследовании операционного материал, с 2 блоков с использованием антител к CD117, Dog1, S100 протеину, SOX10, HMB45, Melan A, MITF, CD99, панцитоке-ратину АЕ1/АЕ3, EMA, синаптофизину, хромогранину А, D1-40, TTF3, CD31, CD34, WT1, десмину, aSMA, миогенину, рецепторам эстрогенов и рецепторам прогестерона. Выявлена диффузная экспрессия в крупных опухолевых клетках эпителиоидного типа, формирующих солидно-альвеолярные очаги, – EMA и SOX10, в части клеток опухоли выявляется экспрессия Dog1(+) и панцитокератин АЕ1/АЕ3, что при отсутствии экспрессии опухолевыми клетками остальных иммуногистохимических маркеров, включая рецепторы эстрогенов и прогестерона, с учетом гистологического строения, свидетельствует в пользу злокачественной гастроинтестинальной стромальной опухоли, эпителиоидно-клеточного варианта.
Список литературы Ведение беременности при диссеминированной гастроинтестинальной стромальной опухоли. Случай из практики
- MiettinenM., Lasota J. Gastrointestinal stromal tumors--definition, clinical, histological, immunohistochemical, and molecular genetic features and differential diagnosis. Virchows Arch. 2001 Jan; 438(1): 1-12. doi: 10.1007/s004280000338.
- Никулин М.П., Стилиди И.С. Гастроинтестинальные стромальные опухоли (ГИСО). Эпидемиология, диагностика, современные подходы к лечению. Современная онкология. Экстравыпуск. 2007. 350. [Nikulin M.P., Stilidi I.S. Gastrointestinal stromal tumors (GIST). Epidemiology, diagnostics, modern approaches to treatment. Modern oncology. Extra release. 2007. 3-50. (in Russian)].
- Королева И.А., Королева А.М. Новые возможности терапии распространенных и метастатических гастроинтестинальных стромальных опухолей. Медицинский алфавит. 2016; 25(288): 7-15. [KorolevaI.A., KorolevaA.M. New possibilities of advansed and metastatic gastrointestinal stromal tumors therapy. Medical alphabet. 2016; 25(288): 7—15. (in Russian)].
- Егоров В.И., Кармазановский Г.Г., Щеголев В.А., Дубова Е.А., Яшина Н.И., Осипова Н.Ю., Степанова Ю.А., Солодинина Е.Н. Значение предоперационной визуализации для выбора хирургической тактики при гастроинтестинальных стромальных опухолях двенадцатиперстной кишки. Медицинская визуализация. 2017; 2: 34-43. [Egorov V.I., Karmazanovsky G.G., ShchegolevA.I., DubovaE.A., Yashi-na N.I., Osipova N.Yu., Stepanova Yu.A., Solodinina E.N. A Significance of a Preoperative Diagnostic Imaging for Selection of a Tactic of Surgical Treatment of Stromal Gastrointestinal Tumors. Medical Visualization. 2017; 2: 34-43. (in Russian)].
- Егоров В.И., Кубышкин В.А., Вишневский В.А., Щеголев А.И., Кармазановский Г.Г., ЯшинаН.И., СтепановаЮ.А., СолодининаЕ.Н., Дубова Е.А. Гастроинтестинальные стромальные опухоли двенадцатиперстной кишки. Хирургия. Журнал им. Н.И. Пирогова. 2017; 10: 66-72. [Egorov V.I., Kubyshkin VA., Vishnevskij V.A., Shchegolev A.I., Karmazanovskiï G.G., Iashina N.I., Stepanova Iu. A., Solodinina E.N., Dubova E.A. Gastrointestinal stromal tumors of duodenum. Pirogov Russian Journal of Surgery. 2017; 10: 66-72. (in Russian)].
- Кригер А.Г., Старков Ю.Г., Кармазановский Г.Г., Берелави-чус С.В., Горин Д.С., Солодкий А.В., Ветшева Н.Н., Курушкина Н.А. Диагностика и тактика хирургического лечения гастроинтестинальной стромальной опухоли. Хирургия. Журнал им. Н.И. Пирогова. 2014; 1: 15-20. [Krieger A.G., Starkov Yu.G., Karmazanovskiy G.G., Berelavi-chus S.V., GorinD.S., SolodkiyA.V., VetshevaN.N., KurushkinaN.A. Diagnostics and tactics of gastrointestinal stromal tumor surgical treatment. Pirogov Russian Journal of Surgery. 2014; 1: 15-20. (in Russian)].
- ПальцевМ.А., КактурскийЛ.В., Зайратьянц О.В. Патологическая анатомия: национальное руководство. М., 2011. 1264 с. [Fingers M.A., KakturskyL.V., ZayratyantsO.V. Pathological Anatomy: A National Guide. Moscow, 2011.1264 p. (in Russian)].
- Стромальные опухоли желудочно-кишечного тракта (GIST). Клиническая монография. Тверь, 2006. 40 с. [Stromal tumors of the gastrointestinal tract (GIST). Clinical monograph. Tver, 2006. 40 p. (in Russian)].
- Hamilton S.R., AaltonenL.A. World Health Organization classification of tumors. Tumors of the digestive system. Lyon: 2002. 314 p.
- Hirota S., Isozaki K., Moriyama Y., Hashimoto K., Nishida T., Ishiguro S., Tunio G.M. Gain-of-function mutations of c-kit in human gastrointestinal stromal tumors. Science. 1998; 279: 577-580.
- MiettinenM., Lasota J. Gastrointestinal stromal tumors (GISTs): definition, occurrence, pathology, differential diagnosis and molecular genetics. Pol J Pathol. 2003; 54: 3-24.
- Архири П.П., Цымжитова Н.Ц., Стилиди И.С., Поддуб-ная И.В., Никулин М.П., Цыганова И.В., Мазуренко Н.Н. Клиническое и прогностическое значение мутационного статуса у больных гастроинтестинальными стромальными опухолями. Саркомы костей, мягких тканей и опухоли кожи. 2003; 1: 42-46. [Arkhiri P.P., Tsymgi-tova N.T., Stilidi I.S., Poddubnaya I.V., Nikulin M.P., Tsyganova I.V., Anurova O.A., MazurenkoN.N. Clinical and prognostic value of mutational status in patients with gastrointestinal stromal tumors. Sarcomas of Bones, Soft Tissues and Skin Tumors. 2003; 1: 42-46. (in Russian)].
- Corless C.L., Barnett C.M., HeinrichM.C. Gastrointestinal stromal tumours: origin and molecular oncology. Nat Rev Cancer. 2011 Nov 17; 11(12): 865-78. doi: 10.1038/nrc3143.
- Lasota J., Miettinen M. KIT and PDGFRA mutations in gastrointestinal stromal tumors (GISTs). Semin Diagn Pathol. 2006 May; 23(2): 91-102. doi: 10.1053/j.semdp.2006.08.006.
- Mazur M.T., Clark H.B. Gastric stromal tumors. Reappraisal of histogenesis. Am J Surg Pathol. 1983 Sep; 7(6): 507-19. doi: 10.1097/00000478-198309000-00001.
- Богомолов Н.И., Кузнецова И.А., Чарторижская Н.Н., Прохоров Н.Б., Пахольчук П.П., Орлов А.А., Мартиросян Г.Ч., Синицын А.С., Скажутина Л.Н., Мусорина В.П., Курносов В.Д. GIST - гастроинтестинальные стромальные опухоли: опыт диагностики и лечения. Забайкальский медицинский вестник. 2010; 2: 32-5. [BogomolovN.I., KuznetsovaI.A., ChartorizhskayaN.N., ProkhorovN.B., PakholchukP.P., Orlov A.A., Martirosyan G. Ch., SinitsynA.S., Skazhutina L.N., Musorina V.P., Kurnosov V.D. GIST - gastrointestinal stromal tumors: experience of diagnosis and treatment. Transbaikalian Medical Bulletin. 2010; 2: 32-5. (in Russian)].
- ДубоваЕ.А., Щеголев А.И., Мишнев О.Д., Кармазановский Г.Г. Гастроинтестинальные стромальные опухоли (лекция). Медицинская визуализация. 2007; 1: 25-31. [Dubova E.A., Shchegolev A.I., Mish-nev O.D., Karmazanovsky G.G. Nonepithelial gastrointestinal tumors (lecture). Medical Visualization. 2007; 1: 25-31. (in Russian)].
- Маландин А.Г., Меркулов И.А., Иванов Ю.В., Пастухов А.И. Гастроинтестинальные стромальные опухоли (GIST): особенности диагностики и лечения. Хирургия. Журнал им. Н.И. Пирогова. 2012; 3: 32-41. [Malandin A.G., Merkulov I.A., Ivanov Yu. V., Pastukhov A.I. Gastrointestinal stromal tumours: features of diagnostics and treatment. Pirogov Russian Journal of Surgery. 2012; 3: 32-41. (in Russian)].
- Овчинников В.А., Абелевич А.И., Володин А.Н., Артифексо-ва А.А., Кузнецов С.С. Гастроинтестинальные стромальные опухоли: клинические маски, диагностика, лечение. Хирургия. Журнал им. Н.И. Пирогова. 2009; 7: 63-65. [Ovchinnikov V.A., Abelevich A.I., Volodin A.N., Artifeksova A.A., Kuznetsov S.S. Gastrointestinal stromal tumors: clinical masks, diagnostics, treatment. Pirogov Russian Journal of Surgery. 2009; 7: 63-65. (in Russian)].
- Joensuu H., Roberts P.J., Sarlomo-Rikala M., Andersson L.C., TervahartialaP., TuvesonD., Silberman S., CapdevilleR., Dimitrijevic S., DrukerB., Demetri G.D. Effect of the tyrosine kinase inhibitor STI571 in a patient with a metastatic gastrointestinal stromal tumor. N Engl J Med. 2001 Apr 5; 344(14): 1052-6. doi: 10.1056/NEJM200104053441404.


