Верификация среднесуточной ПДК стирола в атмосферном воздухе населенных мест по результатам эпидемиологических исследований детского населения
Автор: Землянова М.А., Камалтдинов М.Р.
Журнал: Анализ риска здоровью @journal-fcrisk
Рубрика: Практика оценки риска в гигиенических и эпидемиологических исследованиях
Статья в выпуске: 1 (9), 2015 года.
Бесплатный доступ
Представлены материалы по верификации среднесуточной ПДК стирола в атмосферном воздухе населенных мест, выполненной по результатам собственных углубленных эпидемиологических исследований детского населения в соответствии с принципами международной практики оценки риска. Установлено, что у детей 4-7 лет в условиях экспозиции стирола на уровне выше 1,2 ПДК сс развиваются негативные эффекты воздействия в виде нарушений гормональной регуляции, пигментного обмена, антиоксидантной активности, цитолиза, иммунной реактивности, цитогенетического дисбаланса, обусловливающие повышенную заболеваемость болезнями ЦНС, эндокринной системы, органов дыхания, пищеварения, кожи. На основе доказанных причинно-следственных связей биомаркеров негативных эффектов с концентрацией стирола в крови (как маркера экспозиции стирола) показано, что реперной концентрацией стирола в крови является 0,002 мг/дм 3. Обоснованная величина соответствует и подтверждает принятую в России среднесуточную концентрацию стирола в атмосферном воздухе населенных мест на уровне 0,002 мг/м 3, обеспечивающую безопасность для здоровья населения (1 ПДК сс).
Стирол, среднесуточная пдк, атмосферный воздух, эпидемиологическое исследование, детское население, маркер экспозиции, биомаркеры эффекта, органы-мишени
Короткий адрес: https://sciup.org/14237894
IDR: 14237894 | УДК: 614.878.086
Текст научной статьи Верификация среднесуточной ПДК стирола в атмосферном воздухе населенных мест по результатам эпидемиологических исследований детского населения
Стирол (винилбензол, фенилэтилен, эти-ленбензол) относится к конденсированным ароматическим соединениям, имеющим в своей молекуле одно бензольное кольцо (C 8 H 8 ). Представляет собой бесцветную жидкость, обладающую специфическим запахом. Применяется преимущественно для производства разнообразных полимеризационных пластмасс (полистирол, пенопласт), синтетических сополимерных каучуков и пластиков, входящих в состав строительных и упаковочных материалов. Основные производящие страны: США, Япония, ФРГ, Россия. По данным Федеральной службы государственной статистики РФ объем производства стирола в России за 2014 г. составил 4371,2 тыс. тонн.
Основной путь поступления стирола в организм человека – ингаляционный. Для большинства населения поступление стирола осуществляется с воздухом закрытых помещений жилых и общественных зданий. Средние концентрации в воздухе жилых помещений составляют от 0,0003 до 0,05 мг/м3 благодаря его поступлению из строительных материалов, бытовых средств и табачного дыма [17]. Общая суточная экспозиция населения стиролом составляет 0,0003–0,0008 мг/кг/день (из расчета на 70 кг массы тела) [17].
По данным отечественных и зарубежных авторов, при хроническом воздействии стирол характеризуется политропным действием на организм человека. Наряду с общетоксическим обладает раздражающим, мутагенным, эмбрио-токсическим и канцерогенным эффектом, высокой степенью кумулятивности [13, 14, 16, 17]. Хроническая экспозиция стирола обусловливает воздействие на ЦНС (отмечается снижение скорости нервной проводимости, ослабление нейроповеденческих реакций), эндокринную систему (нарушение гормоногенеза), печень (нару-
Стирол по данным Агентства по охране окружающей среды США входит в список опасных загрязнителей атмосферного воздуха [15]. При этом гигиенические нормативы содержания стирола в атмосферном воздухе в России и за рубежом имеют 130–500-кратное различие. В США максимальная концентрация стирола, обеспечивающая приемлемый уровень риска, для хронического ингаляционного воздействия ( RfC ) [15] составляет 1 мг/м3 по критерию воздействия на ЦНС [14]. ВОЗ в качестве минимальной действующей концентрации стирола рекомендует 0,26 мг/м3 [5]. В России среднесуточная предельно допустимая концентрация (ПДК сс ) стирола в атмосферном воздухе населенных мест составляет 0,002 мг/м3 [7] по критерию рефлекторного, общерезорбтивного и специфических эффектов (канцерогенный, мутагенный, эмбриотоксичный, гонадотропный, аллергенный) действия.
В последние годы роль гигиенических нормативов не всегда оценивается однозначно. Высказывается мнение о несовершенстве этих величин как критериев качества объектов среды обитания [1]. В рамках развития методологии гармонизации гигиенических нормативов с требованиями международных организаций и повышения эффективности мероприятий по снижению неприемлемого риска для здоровья населения, обусловленного факторами среды обитания, актуальным является расширение методических подходов к гигиеническому нормированию для повышения надежности и достоверности исходных материалов, лежащих в основе ПДК одних и тех же веществ в России и за рубежом [3].
Целью настоящего исследования являлась верификация среднесуточной ПДК стиро- ла в атмосферном воздухе населенных мест по результатам эпидемиологических исследований детского населения.
Материалы и методы. Гигиеническая оценка качества атмосферного воздуха на территориях с размещением источников выброса стирола в атмосферный воздух выполнена на примере г. Перми по материалам мониторинговых наблюдений Управления Роспотребнадзора по Пермскому краю и натурных исследований ФБУН «Федеральный научный центр медикопрофилактических технологий управления рисками здоровью населения» за период 2002–2013 гг., реализованных в соответствии с РД 52.04.186–89 [8]. Информация обобщена в соответствии с ГН 2.1.6.1338–03 [7]. Экспозицию оценивали на основании расчета средней суточной дозы хронической экспозиции при ингаляционном пути поступления согласно руководству Р 2.1.10.1920–04 [9].
Собственными углубленными эпидемиологическими исследованиями, выполненными в соответствии с принципами международной практики оценки риска, за период 2002–2013 гг. охвачено 2248 человек. Группа наблюдения включала детей из г. Перми в возрасте 4–7 лет обоего пола (всего 1892 человека, средний возраст – 5,5±0,6 г., девочек – 51 %, мальчиков – 49 %). Дети проживали и посещали не менее 1 года детские организованные учреждения, расположенные в селитебной застройке исследуемой территории, находящейся в условиях экспозиции стирола (от 0,3 до 3,0 км от источника). Группа контроля включала детей из г. Кунгура Пермского края в возрасте 4–7 лет (всего 356 человек, средний возраст – 5,8±0,3 г., девочек – 50,5 %, мальчиков – 49,5 %), проживающих в условиях отсутствия экспозиции стирола. Исследуемые группы были сопоставимы:
– по характеру и частоте встречаемости патологии в перинатальном, младенческом периоде и периоде раннего детства: в группе наблюдения – 10 %, в группе контроля – 12 %;
– по социально-бытовым условиям жизни – благоустроенное жилье и средний уровень материальной обеспеченности относительно среднедушевого прожиточного минимума: группе наблюдения – 85 %, в группе контроля – 82 %;
– по частоте и характеру отягощенного наследственного анамнеза у родственников 1-й и 2-й линии: в группе наблюдения – 15 %, в группе контроля – 14 %;
– по частоте и характеру вредных привычек и профессиональных вредностей у родителей – в группе наблюдения 17,5 %, в группе контроля – 15,0 %.
На момент обследования дети не имели острых инфекционных заболеваний не менее чем в течение 4 недель до начала исследования, индекс инфекционности – 0,2–0,5, не принимали лекарственных препаратов, оказывающих выраженное влияние на гемодинамику, функцию печени и др. (барбитураты, омепразол, циметидин и т.д.), не менее чем за 30 дней до начала исследования.
От каждого законного представителя ребенка, включенного в выборку, получено письменное информированное согласие на добровольное участие в обследовании, выполненном специалистами ФБУН «Федеральный научный центр медико-профилактических технологий управления риском здоровью населения» на базе мобильного консультативно-диагностического отделения и клиники, в соответствии с обязательным соблюдением этических норм, изложенных в Хельсинкской декларации Всемирной медицинской ассоциации 1964 г. (с изменениями и дополнениями на 2008 г.).
Химико-аналитические исследования включали определение содержания в крови стирола методом ВЭЖХ в соответствии с МУК 4.1.2116–06. Клинический осмотр выполнен в соответствии со специально разработанными картами клинического обследования. Гематологические (гемоглобин, эритроциты, цветной показатель, ретикулоциты, лейкоциты, моноциты, лимфоциты), биохимические (активность АСАТ, АЛАТ, γ-глутамилтранспептидазы (γ-ГТП), глутатионпероксидазы (ГПО); содержание гидроперекисей липидов, малонового диальдегида (МДА), общего и прямого билирубина, общего белка, альбумина в сыворотке крови), показатели гор-моногенеза (содержание ТТГ, АКТГ в сыворотке крови) исследованы унифицированными методами [4]. Индикация цитогенетических нарушений выполнена методом полиорганного микроядерного теста на эксфолиативных буккальных эпителиоцитах [6].
Для оценки достоверности различий полученных результатов использовали t-критерий Стьюдента (сравнение показателей исследуемых выборок по абсолютным значениям признака) и Z-тест Фишера (сравнение показателей исследуемых выборок по долям признака). Различия полученных результатов являлись статистически значимыми при р≤0,05 [2]. На основании клинических и лабораторных данных оценивали состояние здоровья детей в соответствии с МКБ-10.
Обоснование маркера экспозиции стирола выполнено на основании установленной достоверной связи концентрации стирола в крови с экспозицией. Математическая модель, описывающая анализируемую зависимость в условиях низких концентраций, представляет собой линейное уравнение вида: x = b 1 D + b 0 , где D – среднесуточная концентрация стирола в атмосферном воздухе, мг/м3, х – средняя концентрация стирола в крови, мг/дм3; b 0 , b 1 – параметры модели, характеризующие начальный уровень концентрации стирола в крови и скорость абсорбции [2]. Обоснование биомаркеров неканцерогенных эффектов выполняли по расчету показателя отношения шансов ( OR ), характеризующего связь концентрации стирола в крови с показателями ответных реакций у детей. Наличие связи оценивали по критерию OR >1 [10]. Установление реперного (порогового) уровня (Benchmark concentration, BMC) стирола в крови, при котором предполагается 10%-ное превышение риска среди индивидуумов, находящихся ниже 2-го или выше 98-го персентиля, в случае нормального распределения ответов со стороны здоровья [18] выполнено моделированием зависимости изменения показателя отношения шансов от изменения концентрации стирола в крови (маркера экспозиции) для каждого маркера эффекта. Оценку параметров зависимости проводили методом построения регрессионной модели в виде экспоненциальной функции [12]: OR = e a 0 - a 1 x , где OR - показатель отношения шансов; x 0 – концентрация стирола в крови, мг/дм3; a 0 , a 1 – параметры модели, определяемые методом регрессионного анализа. Адекватность полученной модели оценивали по критерию Фишера ( F >3,63) и коэффициенту детерминации ( R 2) [12]. Анализ информации по результатам исследований и оценку параметров моделей выполняли с использованием пакета прикладных программ Statistica 6.0 и специальных программных продуктов, сопряженных с приложениями MS-Office.
Реперный уровень стирола в крови ( x 0 ) для каждого маркера эффекта расчитывали, исходя из условия OR =1 (признак отсутствия связи маркера эффекта с концентрацией стирола в крови), по формуле: x 0 = a 0- , где x 0 - концен- a 1
трация стирола в крови, мг/дм3; a0, a1 – пара- метры модели, определяемые методом регрессионного анализа. Из полученного ряда 95 % верхних доверительных границ концентраций стирола в крови для каждого маркера эффекта определяли наименьшую, которую рекомендовали в качестве реперного уровня для условий хронического воздействия. На основании зависимости концентрации стирола в крови от его содержания в атмосферном воздухе вычисляли уровень стирола в атмосферном воздухе, соответствующий реперной концентрации стирола в крови.
Результаты и их обсуждение. Среднесуточная концентрация стирола в жилой застройке территории наблюдения (г. Пермь) за исследуемый период зарегистрирована уровне 0,0015–0,0043 мг/м3, что соответствует 0,8–2,2 ПДК сс или 0,0015–0,004 RfC cr . В атмосферном воздухе контрольной территории содержание стирола не превышало нижний предел измерения (0,02 мг/м3), выполненного методом газовой хроматографии. Хроническая экспозиция на территории наблюдения характеризовалась суммарной средней суточной дозой стирола от 0,0002 до 0,0005 мг/ (кг·день). Экспонируемой субпопуляцией является 360 тыс. населения, в том числе 42 тыс. детей в возрасте от 0 до 14 лет.
У детей группы наблюдения идентифицирован стирол в крови как маркер экспозиции в диапазоне концентраций от 0,0001 до 0,009 мг/дм3. Частота регистрации проб с наличием стирола в крови составила 55 % от общего количества исследованных проб. В контрольной группе детей стирол в крови не идентифицирован ни в одном случае, превышающем нижний предел измерения, выполненного методом ВЭЖХ. В группе наблюдения установлена достоверная зависимость ( R 2=0,33, F =460,74, р =0,000) концентрации стирола в крови детей от среднесуточной концентрации вещества в атмосферном воздухе, описываемая уравнением вида: y = –0,003 + 2,45 x (рис. 1).
Результаты углубленного исследования ответных реакций организма детей группы наблюдения на экспозицию стирола позволили выделить биомаркеры, характеризующие развитие негативных эффектов, спектр и выраженность которых имеют достоверную зависимость от концентрации стирола в крови. В контрольной группе детей достоверные причинно-следственные связи ( р <0,05) биомаркеров негативных эффектов с содержанием стирола в крови не установлены.
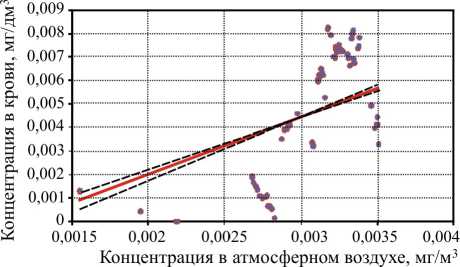
Рис. 1. Зависимость концентрации стирола в крови детей от среднесуточной концентрации стирола в атмосферном воздухе
У детей с концентрацией стирола в крови на уровне 0,002 мг/дм3 и ниже, соответствующей на основании установленной зависимости концентрации стирола в атмосферном воздухе 1 ПДК сс , не выявлены показатели ответных реакций организма, имеющие достоверные отклонения, с аналогичными показателями у детей контрольной группы и достоверные связи с концентраций стирола в крови.
У детей с концентрацией стирола в крови на уровне 0,003–0,004 мг/дм3, что соответствует концентрации стирола в атмосферном воздухе 1,2–1,4 ПДК сс , биомаркерами эффекта являлись повышение уровня АКТГ и ТТГ в сыворотке крови в 1,3 и 1,2 раза соответственно относительно показателя в контрольной группе ( F =18,19÷170; 8; R 2=0,16÷0,56; р =0,000), что свидетельствует о нарушении синтеза гормонов передней доли гипофиза и, как следствие, нейроэндокринной регуляции (табл. 1).
Кроме этого, в данной подгруппе детей зарегистрировано повышение уровня общего билирубина в сыворотке крови в 1,4 раза относительно показателя контрольной группы ( F =2953,8; R 2=0,62; р =0,000), характеризующее нарушение пигментного обмена. Данный процесс отмечается на фоне активации цитолиза, установленного по повышению активности АСАТ и γ-ГТП в сыворотке крови в 1,3–1,5 раза по сравнению с показателями контрольной группы ( F =200,7÷253,3; R 2=0,52÷0,69; р =0,000). Выявлено повышение уровня моноцитов и лимфоцитов в цельной крови ( F =11,28÷152,7; R 2=0,48÷0,60; р =0,000), отражающее вовлечение иммуноком-петеных клеток в ответную реакцию организма на воздействие стирола. Установлено снижение антиоксидантной активности, обеспечиваемой системой глутатиона печени, в ответ на усиление перекисного окисления липидов клеточной
Таблица 1
Сравнительный анализ гематологических и биохимический показателей у детей в возрасте 4–7 лет с концентрацией стирола в крови на уровне 0,003–0,004 мг/дм3, обусловленной экспозицией стирола (на примере г. Перми)
|
Показатель |
Среднее значение ( M ± m ) |
Достоверность различий ( p ) |
|
|
группа наблюдения |
группа контрольная |
||
|
ТТГ, мкМЕ/см 3 |
2,22±0,02 |
1,85±0,21 |
0,005 |
|
АКТГ, пг/см 3 |
28,48±1,55 |
21,91±1,55 |
0,000 |
|
АСАТ, Е/дм 3 |
30,78±0,55 |
23,68±1,29 |
0,000 |
|
y-ГТ, Е/дм 3 |
26,26±2,34 |
17,51±0,73 |
0,000 |
|
Билирубин общий, мкмоль/дм 3 |
10,05±0,38 |
7,20±1,09 |
0,000 |
|
Лимфоциты, % |
43,03±2,51 |
39,94±0,48 |
0,030 |
|
Моноциты, % |
6,58±0,38 |
4,44±0,11 |
0,000 |
|
Антиоксидантная активность, % |
30,21±0,33 |
36,50±0,49 |
0,000 |
|
Гидроперекись липидов, мкмоль/дм 3 |
461,1±20,4 |
194,2±24,2 |
0,000 |
|
Глутатионпероксидаза, нг/см 3 |
30,14±1,71 |
35,59±4,14 |
0,016 |
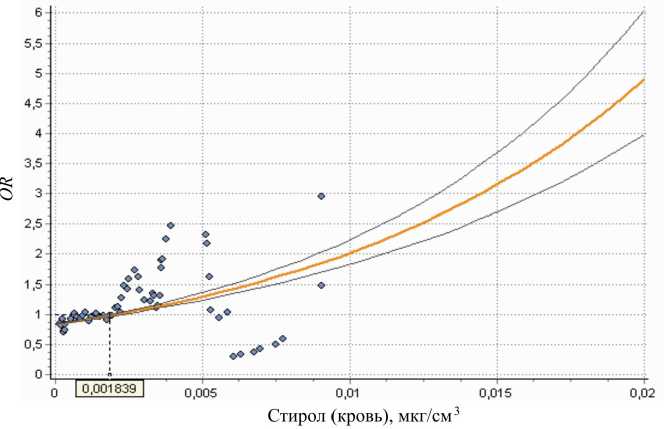
Рис. 2. Зависимость показателя отношения шансов ( OR ) повышения уровня ТТГ в сыворотке крови от концентрации стирола в крови
мембраны, о чем свидетельствует достоверное повышение содержания гидроперекиси липидов, снижение активности глутатионпероксидазы и общей антиоксидантной активности сыворотки крови ( р =0,000÷0,016). У детей описываемой выборки в 1,5 раза чаще регистрируются болезни эндокринной системы, расстройства питания и нарушения обмена веществ (код по МКБ-10 – Е00-Е07, Е65-Е68), имеющие доказанную связь с концентрацией стирола в крови ( F =61,3÷1108,0; R 2=0,69÷0,52; р =0,000). Пример графического изображения достоверной зависимости показателя отношения шансов повышения уровня ТТГ в сыворотке крови от концентрации стирола в крови ( F =868,0; р =0,000), описываемой уравнением вида OR = e - 0,180 - 88, 5 1 , представлен на рис. 2.
В представленном примере реперным уровнем концентрации стирола в крови является концентрация 0,002 мг/дм3, 95%-ная верхняя доверительная граница реперного уровня стирола в крови составляет 0,0018 мг/дм3.
У детей описываемой выборки (по данным объективного осмотра) зарегистрирована большая частота встречаемости функциональных нарушений центральной нервной системы (в 2,2–3,0 раза относительно контрольной группы) в виде синдрома гиперреактивности и неврозоподобного синдрома (код по МКБ-10 – G93.8), головной боли напряженного типа (G44.8), других уточненных поражений головного мозга; в 1,5–2,0 раза чаще – болезней органов пищеварения в виде дискинезии желче- выводящих путей (К83.8), синдрома мальабсорбции (К90.0); в 1,3–1,7 раза – болезней органов дыхания в виде гипертрофии аденоидов и миндалин (J35.0–J35.3), хронического ринита (J31.0), болезней бронхов (J40, J42). Установлена достоверная связь вероятности развития болезней нервной системы, органов пищеварения и органов дыхания с концентрацией стирола в крови (F=61,3÷1108,0; R2=0,52÷0,69; р=0,000). Пример графического изображения достоверной зависимости показателя отношения шансов повышения частоты заболеваний органов дыхания от концентрации стирола в крови (F=405,91; р=0,000), описываемой уравнением вида OR = e-°,198-124,61, представлен на рис. 3.
В данном примере реперным уровнем стирола в крови является концентрация 0,002 мг/дм3, 95%-ной верхней доверительной границей реперного уровня – концентрация 0,0016 мг/дм3.
У детей с концентрацией стирола в крови выше 0,005 мг/дм3, что соответствует концентрации стирола в атмосферном воздухе выше 0,0032 мг/м3 (или выше 1,6 ПДКсс), дополни- тельно регистрировали повышенную частоту (в 1,8 раза относительно показателя контрольной группы) болезней кожи и подкожной клетчатки в виде атопического дерматита (L20). Результаты цитогенетических исследований свидетельствуют о повышенной генетической нестабильности, зафиксированной в эксфолиативных клетках буккального эпителия детей с концентрацией стирола в крови выше 0,003 мг/дм3 (выше 1,2 ПДКсс). Установлено нарушение нормального цикла митотического деления, ведущего к формированию микроядер, и активация процесса клеточного деления, характеризующиеся усилением апоптотической активности и ядерной деструкции. Частота клеток с микроядрами и ядерными протрузиями типа «язык» и «разбитое яйцо» до 1,5 раза выше показателей контрольной группы (р=0,006÷0,022) и до 3,0 раза выше среднероссийских показателей [18]. Частота клеток с апоптозными телами и вакуолизацией клеточного ядра до 1,6 раза выше показателей контрольной группы (р=0,003÷0,012) (табл. 2).
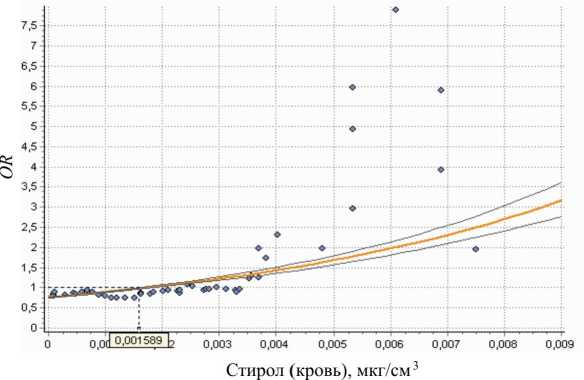
Рис. 3. Зависимость показателя отношения шансов ( OR ) повышения частоты заболеваемости болезнями органов дыхания от концентрации стирола в крови
Таблица 2
Частота изменений эксфолиативных буккальных эпителиоцитов у детей в возрасте 4–7 лет с концентрацией стирола в крови выше 0,003 мг/дм3, ‰ ( р ≤0,05)
|
Показатель |
Группа наблюдения ( M ± m ) |
Контрольная группа ( M ± m ) |
Достоверность различий ( р ) |
|
Цитогенетические показатели |
|||
|
Микроядра |
0,86±0,16 |
0,64±0,09 |
0,022 |
|
Ядерные протрузии типа «язык» |
0,45±0,09 |
0,31±0,06 |
0,010 |
|
Ядерные протрузии типа «разбитое яйцо» |
0,14±0,02 |
0,09±0,03 |
0,006 |
|
Показатели деструкции |
|||
|
Ядра с вакуолизацией |
12,09±1,50 |
9,86±0,19 |
0,003 |
|
Клетки с апоптозными телами |
0,95±0,24 |
0,59±0,15 |
0,012 |
Установленные биомаркеры цитогенетических нарушений имеют достоверную связь с концентрацией стирола в крови ( F =55,4÷1558,0; R 2=0,54÷0,62; р =0,000).
В результате определены реперные концентрации стирола в крови для каждого маркера эффекта (представленного в виде изменения лабораторного показателя или повышения частоты заболеваний) при хронической экспозиции атмосферного воздуха в диапазоне 0,002–0,005 мг/дм3. Из имеющегося ряда реперных концентраций стирола в крови наименьшей является 0,002 мг/дм3, соответствующая среднесуточной концентрации стирола в атмосферном воздухе на уровне 0,002 мг/м3, что подтверждает действующую в России величину среднесуточной ПДК стирола в атмосферном воздухе населенных мест.
Выводы . Обобщение результатов эпидемиологических исследований детского населения, выполненных в соответствии с принципами международной практики оценки риска, в целях верификации среднесуточной ПДК стирола в атмосферном воздухе населенных мест показало:
– при содержании стирола в атмосферном воздухе населенных мест на уровне 0,002 мг/м3 и выше у детей селитебных территорий, находящихся в зонах экспозиции, идентифицирован в крови стирол на уровне 0,002 мг/дм3 и выше;
– при концентрации стирола в крови на уровне 0,002 мг/дм3 и ниже не обнаружены достоверные различия показателей ответных реакций организма с аналогичными у детей контрольной группы и достоверные связи с концентраций стирола в крови;
– при концентрации стирола в крови на уровне 0,003–0,004 мг/дм3 и выше, что соответствует концентрации стирола в атмосферном воздухе, равной 1,2–1,4 ПДК сс и выше, установлено нарушение состояние здоровья детского населения, обусловленное экспозицией стирола (атмосферный воздух), в виде повышения заболеваемости болезнями ЦНС, эндокринной системы, дыхания, органов пищеварения, кожи и развития негативных эффектов в виде цитолиза, нарушений пигментного обмена, гормональной регуляции, антиоксидантной активности, вовлечения иммунокомпетентных клеток, цитогенетического дисбаланса;
– реперной концентрацией стирола в крови является концентрация 0,002 мг/дм3, соответствующая среднесуточной концентрации стирола в атмосферном воздухе – 0,002 мг/м3 (или 1 ПДК сс );
– концентрация стирола в атмосферном воздухе 0,002 мг/м3, принятая в России, обеспечивает безопасность для здоровья населения.
Список литературы Верификация среднесуточной ПДК стирола в атмосферном воздухе населенных мест по результатам эпидемиологических исследований детского населения
- Гигиенические нормативы химических веществ в окружающей среде/Ю.А. Рахманин, В.В. Семенова, А.В. Москвина, ред., Л.А. Аликбаева, Ю.Д. Губернский, Доценко В.А. . -СПб.: НПО «Профессионал», 2007. -766 с.
- Гланц С. Бузикашвили Н.Е. Медико-биологическая статистика. -М.: Практика; 1998. -459 с.
- Зайцева Н.В., Май И.В., Клейн С.В. К вопросу установления и доказательства вреда здоровью населения при выявлении неприемлемого риска, обусловленного факторами среды обитания//Анализ риска здоровью. -2013. -№ 2. -С. 14-27.
- Меньшиков В.В. Лабораторные методы исследования в клинике: справочник. -М.: Медицина; 1987. -366 с.
- Мониторинг качества атмосферного воздуха для оценки воздействия на здоровье человека/Региональные публикации ВОЗ, Европейская серия. -№ 85. -Копенгаген: ВОЗ, Европейское региональное бюро; 2001 . -URL: http://www.euro.who.int/_data/assets/pdf_file/0011/119675/Е67902R.pdf (дата обращения: 10.03.2014).
- Оценка цитологического и цитогенетического статуса слизистых оболочек полости носа и рта у человека: методические рекомендации. -М., 2005. -37 с.
- Предельно допустимые концентрации (ПДК) загрязняющих веществ в атмосферном воздухе населенных мест: ГН 2.1.6.1338-03. -М., 2003.
- Руководство по контролю загрязнения атмосферы: РД 52.04.186-89. -М., 1991. -695 с.
- Руководство по оценке риска здоровью населения при воздействии химических веществ: Р 2.1.10.1920-04. -М.: Федеральный центр Госсанэпиднадзора Минздрава России, 2004. -143 с.
- Флетчер Р., Флетчер С., Вагнер Э. Клиническая эпидемиология. Основы доказательной медицины. -М.: Медиа Сфера, 1998. -352 с.
- Цитогенетические маркеры и гигиенические критерии оценки хромосомных нарушений у населения и работников в условиях воздействия химических факторов с мутагенной активностью (на примере металлов, ароматических углеводородов, формальдегида)/Н.В. Зайцева, М.А. Землянова, В.Б. Алексеев, С.Г. Щербина. -Пермь: Книжный формат, 2013. -222 с.
- Четыркин Е.М. Статистические методы прогнозирования. -М.: Статистика, 1977. -356 с.
- Chronic Toxicology Summary: Styrene . State of California, Office of Environmental Health Hazard Assessment (OEHHA). Provides a summary of chronic reference exposure levels adopted by OEHHA. 2012. . -URL: https://www.osha.gov/SLTC/styrene (дата обращения: 10.03.2014).
- Styrene (CASRN 100-42-5): Environmental Protection Agency (EPA), Integrated Risk Information System (IRIS). Discusses the health effects of styrene. 2000. . -URL: http://www.epa.gov/ttn/atw/hlthef/styrene.html (дата обращения: 10.03.2014).
- Styrene. Environmental Protection Agency (EPA). Lists styrene as a Hazardous Air Pollutant (HAP) under the National Emissions Standard Hazardous Air Pollutants section of its Clean Air Act: Second Report to Congress on the Status of the Hazardous Air Pollutant Program under the Clean Air Act. 1997. . -URL: http://www.epa.gov/ttn/atw/112s/fnl_rpt.pdf (дата обращения: 10.03.2014).
- Styrene: Reasonably anticipated to be a human carcinogen. First listed in the Twelfth Report on Carcinogens. 2011. . -URL: http://www.ntp.niehs.nih.gov/ntp/roc/twelth/profiles/styrene.pdf (дата обращения: 10.03.2014).
- Toxicological Profile for Styrene: U.S. Department of Health and Human Services. Agency for Toxic Substances and Disease Registry. -Atlanta, 2010. -236 р.
- U.S. EPA. The Use of the Benchmark Dose Approach in Health Risk Assisment//EPA/630/R-94/007. -Washington, DC, 1992. -146 p.


