Вероятностная модель антибиотикотипирования непатогенных актинобактерий
Автор: Осипенко М.А., Куюкина М.С., Ившина И.Б., Потеряева Е.В., Рогожникова Е.Н.
Журнал: Российский журнал биомеханики @journal-biomech
Статья в выпуске: 2 (24) т.8, 2004 года.
Бесплатный доступ
Разработана математическая модель антибиотикотипирования непатогенных актинобактерий с использованием дискодиффузионного метода. В качестве количественной меры антибиотикочувствительности использовалось значение диаметра зоны ингибирования бактериального роста вокруг соответствующего индикаторного диска, которое рассматривалось как случайная величина. На основе экспериментальных данных антибиотикочувствительности 250 коллекционных штаммов актинобактерий, принадлежащих к родам Dietzia, Gordonia и Rhodococcus, построены плотности распределения соответствующих случайных величин для большинства известных видов диетций, гордон и родококков. Предложен алгоритм идентификации актинобактерий на основании их чувствительности к минимальному набору антибиотиков. В рамках разработанной модели определена вероятность правильной идентификации бактериального штамма. Найдены оптимальные наборы из одного, двух и трех антибиотиков, максимизирующие упомянутую вероятность. Предложенный алгоритм реализован в виде программы с удобным интерфейсом.
Актинобактерии, идентификация бактерий, антибиотикочувствительность, случайная величина, вероятность правильной идентификации штамма
Короткий адрес: https://sciup.org/146215799
IDR: 146215799 | УДК: 531/534:57+612.7
Текст научной статьи Вероятностная модель антибиотикотипирования непатогенных актинобактерий
В последнее десятилетие углеводородокисляющие актинобактерии, в частности представители родов Dietzia , Gordonia , Rhodococcus , все чаще становятся объектом фундаментальных исследований в области биохимии, физиологии и генетики микроорганизмов, а также прикладных разработок в области промышленной микробиологии, биотехнологии и биомеханики. Это обусловлено, прежде всего, широкими метаболическими возможностями данных организмов, осуществляющих окисление природных и антропогенных углеводородов, и способностью их выживать в разнообразных, в том числе экстремальных, условиях существования [1]. О повышении интереса исследователей к данной группе микроорганизмов свидетельствует выделение все большего числа штаммов актинобактерий из природных субстратов и соответствующее пополнение генофондов мировых микробных коллекций.
В лаборатории алканотрофных микроорганизмов Института экологии и генетики микроорганизмов Уральского отделения (ИЭГМ УрО) РАН ведутся многолетние исследования биологии и систематики углеводородокисляющих актинобактерий [2, 3]. На базе лаборатории создана Уральская профилированная коллекция алканотрофных микроорганизмов, зарегистрированная во Всемирной федерации коллекций культур ( World Federation for Culture Collection WFCC 768; www.iegm/iegmcol ). В генофонде коллекции 2000 чистых идентифицированных культур, принадлежащих к бактериальным родам Rhodococcus, Corynebacterium, Dietzia, Gordonia, Mycobacterium, Nocardia и выделенных из контрастных экологогеографических регионов нашей страны и зарубежья [4]. В коллекционной работе при проведении таксономических исследований широко используются как традиционные методы бактериальной систематики, основанные на изучении морфологических и физиологических свойств культур, так и современные высокоспециализированные хемотаксономические, иммунохимические и генетические методы.
Следует отметить, что систематика актинобактерий чрезвычайно сложна и до сих пор находится в состоянии становления. Имеют место случаи переноса отдельных видов в другие таксоны, описания новых штаммов и видов и даже появления новых родов. Примером последнего может служить выделение в 1995 году представителей R. maris в самостоятельный род Dietzia [5]. Все вопросы, связанные с прикладными аспектами изучения алканотрофных микроорганизмов, требуют, прежде всего, четкого определения таксономической принадлежности промышленно-ценных культур. В связи с этим, остро стоит проблема родовой и видовой классификации актинобактерий и объективной идентификации природных изолятов. Использование для этих целей, особенно в крупномасштабных таксономических исследованиях, генетических и иммунохимических методов не всегда оправдано из-за сложности постановки тестов и высоких временных и финансовых затрат. Поэтому поиск новых надежных и экспрессных таксономических критериев сохраняет актуальность.
В последние годы новый импульс развития в бактериальной систематике получают методы нумерической таксономии . Это связано с разработкой минимизированных биохимических тестирующих систем и наборов; применением флуорогенных меток для оценки специфической ферментной активности; созданием усовершенствованных компьютерных программ, позволяющих дифференцировать наиболее полезные идентификационные признаки и формировать таксономические базы данных; применением высокоскоростных операционных систем [6].
Известен опыт применения для идентификации коринеподобных и нокардиоподобных актинобактерий идентификационной системы API Coryne [7], включающей R. equi в базу данных. Однако установлено [8], что данная система является недостаточно надежной, поскольку с ее помощью представители R. rhodochrous определяются как R. equi .
При проведении нумерических исследований, наряду с задачей технического усовершенствования процесса тестирования признаков, более важной проблемой остается отбор среди многочисленных фенотипических признаков наиболее стабильных и надежных в таксономическом плане. В этой связи представляет интерес определение чувствительности бактерий к антибиотическим веществам различной природы и механизма действия. Антибиотикочувствительность бактериальных культур широко используется в коллекции ИЭГМ в качестве таксономического маркера при родовой и видовой диагностике актинобактерий, а также подтверждения систематической принадлежности коллекционных и свежевыделенных из природных сред штаммов [9].
Таблица 1
Характеристика чувствительности представителей Rhodococcus erythropolis к ампициллину
|
Номер штамма, ИЭГМ |
7 |
13 |
18 |
22 |
23 |
24 |
26 |
188 |
190 |
199 |
200 |
|
D , мм |
29 |
19 |
30 |
29 |
40 |
37 |
38 |
33 |
27 |
30 |
42 |
|
Номер штамма, ИЭГМ |
201 |
202 |
203 |
204 |
208 |
209 |
215 |
216 |
252 |
265 |
267 |
|
D , мм |
30 |
28 |
34 |
29 |
19 |
16 |
27 |
33 |
18 |
25 |
37 |
|
Номер штамма, ИЭГМ |
272 |
682 |
683 |
684 |
685 |
686 |
687 |
688 |
689 |
690 |
691 |
|
D , мм |
35 |
15 |
16 |
18 |
35 |
25 |
21 |
29 |
18 |
30 |
25 |
Математическая модель антибиотикотипирования
Определение чувствительности штаммов актинобактерий к антибиотикам проводилось методом стандартных индикаторных дисков [10]. Исходная бактериальная взвесь плотностью в 10 Ед оптического стандарта ГИСК готовилась на физиологическом растворе и разбавлялась в 10 раз. Посевная суспензия содержала 109 клеток/мл, выращенных на мясопептонном агаре и отобранных в конце экспоненциальной фазы роста. Бактериальная взвесь в количестве 0,1 мл вносилась в чашки Петри с 5 мл агаризованной питательной среды. Использовались бумажные диски, пропитанные стандартными растворами испытуемых антибиотических веществ. Диски накладывали стерильно на поверхность зараженной питательной среды (по 2-4 диска на одну чашку). Засеянные чашки инкубировались при 28 ° С. Результаты учитывались на третьи сутки путем измерения (в миллиметрах) диаметра D зоны ингибирования бактериального роста вокруг соответствующего диска.
Диаметр D зоны ингибирования роста является количественной мерой уровня чувствительности бактериального штамма к антибиотику. При этом штаммы, принадлежащие к одному виду актинобактерий, проявляют различную чувствительность к индивидуальным антибиотикам. В качестве примера в табл. 1 приведены значения D для представителей вида R. erythropolis в отношении ампициллина.
Подобные таблицы значений D построены для M = 8 видов актинобактерий: R. erythropolis , R. longus , R. fascians , R. opacus , R. rhodochrous , R. ruber , G. rubropertincta , D. maris в отношении A = 19 антибиотиков: ампициллина, бензилпенициллина, гентамицина, доксициклина, канамицина, карбенициллина, линкомицина, налидиксовой кислоты, неомицина, оксациллина, олеандомицина, полимиксина, ристомицина, стрептомицина, тетрациклина, фузидина, хлорамфеникола, цефалексина, эритромицина.
Как видно из табл. 1, наблюдается нерегулярный внутривидовой разброс значений D , что дает основание моделировать D как случайную величину. На основе таблиц экспериментальных значений D были построены эмпирические плотности распределений соответствующих случайных величин [11]. Для построения плотности первоначально все содержащиеся в таблице значения D упорядочивались с учетом
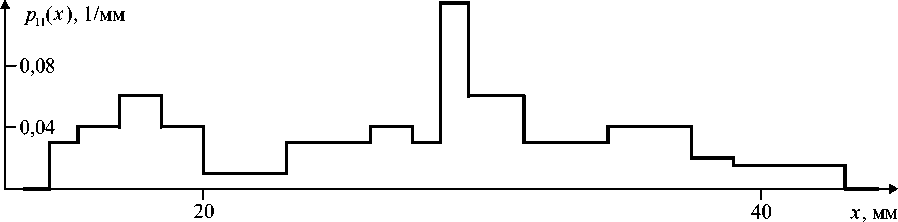
Рис. 1. График эмпирической плотности распределения значений диаметра зоны ингибирования роста представителей Rhodococcus erythropolis по отношению к ампициллину
повторений, то есть находились числа D 1 < D2 <... < Dn (N - количество различных значений D в таблице) и числа к 1, k2,..., kN такие, что значение Dn встречается в таблице kn раз (1 < n < N). Выражение для плотности затем выбиралось в виде ступенчатой функции где
N
Р ( x ) = £ n = 1
k n 2
K D n + i - D n — 1
( D n — 1 + D n
I , 2
D n
+ D n + 1
N
K = £ k n , n = 1
f ( x , x 1 , x 2 ) = <
если x1 < x < x2, если x < x1 или x > x2,
и условно введены
D 0 =< 2 D 1 - D 2
- D1
если N = 1, если N > 1 и 3D1 > D2, если N > 1 и 3D1 < D2;
dn + 1 = 2 dn - dn - 1 .
Описанным образом были построены плотности p m a ( x ) (1 < m < M , 1 < a < A )
значений диаметра зоны ингибирования роста для M видов актинобактерий по отношению к A антибиотикам. На рис. 1 в качестве примера приведен график функции p 1 1 ( x ), которая соответствует табл. 1.
Если выбраны B < A различных антибиотиков с номерами а, в ,..., ю, то значения диаметра зоны ингибирования роста для представителей вида актинобактерий с номером m по отношению к этим антибиотикам считаются независимыми случайными величинами; тогда [11] плотность их совместного распределения pm ар...ю(x а,x в
,...,
x ю ) p m а ( x а ) p m в ( x в )". p m ю ( x ю ).
Пусть теперь имеется штамм актинобактерии неопределенного видового положения и требуется идентифицировать этот штамм. Пусть неизвестный вид является с равными вероятностями (1/ M ) одним из вышеперечисленных M видов. Выбираются B < A антибиотиков с некоторыми номерами а , в ,—, ю и экспериментально находятся диаметры D а , D в ,^, D ю зон ингибирования роста для данного штамма по отношению к выбранным антибиотикам. Далее находится номер m * вида актинобактерий такой, что величина pm ар,„ю ( D а , D в ,..., D ю ) (1 < m < M )
достигает максимума при m = m ∗ (если имеется несколько номеров, отвечающих максимальному значению, то выбирается любой из них). Окончательно делается вывод: исследуемый штамм относятся к виду с номером m ∗ . Нетрудно доказать, что вероятность правильной идентификации штамма
1 +∞ +∞ +∞
P = ... max pmαβ...ω (xα , xβ xω)dxαdxβ ... d xω
B 0 0 0 1 ≤ m ≤ M
Следует заметить, что при заданных α , β ,…, ω , величину P можно подсчитать заранее (до экспериментального нахождения D α , D β ,…, D ω ). Поэтому при выбранном количестве B антибиотиков можно заранее найти оптимальный набор антибиотиков, отвечающий максимальному значению P .
Программная реализация алгоритма антибиотикотипирования
Описанный выше алгоритм идентификации бактериального штамма был реализован в виде программы, работающей в операционной системе Windows . Основное окно программы показано на рис. 2.
Выбрав количество B антибиотиков (один, два или три) и сами антибиотики, следует задать экспериментально найденные значения диаметра зоны ингибирования роста для исследуемого штамма по отношению к выбранным антибиотикам. После нажатия кнопки “Выполнить идентификацию” выводится сообщение о видовой принадлежности исследуемого штамма и значение P вероятности правильной идентификации. Если max pm α β...ω (Dα , Dβ ,..., Dω ) = 0,
1≤m≤M то выводится сообщение “Штамм не относится ни к одному из известных видов ”, хотя, строго говоря, это утверждение противоречит принятому выше предположению, что идентифицируемые штаммы относятся к одному из известных видов актинобактерий, и формально следовало бы выводить название любого из известных видов. Однако в такой ситуации адекватность модели становится проблематичной и это должно быть сообщено исследователю.
При нажатии кнопок из группы “Оптимальные” производится поиск одного, двух или трех антибиотиков, максимизирующих вероятность правильной идентификации штамма. В табл. 2 приведены десять антибиотиков, расположенных в порядке убывания этой вероятности. В табл. 3 и 4 приведены десять пар и троек антибиотиков, аналогично упорядоченных. Следует заметить, что первая пара антибиотиков в табл. 3 не совпадает с первым и вторым антибиотиками из табл. 2; первая тройка антибиотиков в табл. 4 не совпадает с первым, вторым и третьим антибиотиками из табл. 2 и не содержит первую пару антибиотиков из табл. 3. Тем самым, в табл. 2, 3, 4 представлены нетривиальные результаты.
В нижней части основного окна программы помещены список известных видов актинобактерий и кнопка вызова справки.
Таблица 2
Вероятность P правильной идентификации бактериального штамма при использовании одного антибиотика
|
Антибиотик |
P |
|
Фузидин |
0,582 |
|
Эритромицин |
0,549 |
|
Карбенициллин |
0,538 |
|
Бензилпенициллин |
0,532 |
|
Ампициллин |
0,524 |
|
Олеандомицин |
0,523 |
|
Цефалексин |
0,510 |
|
Хлорамфеникол |
0,496 |
|
Оксациллин |
0,489 |
|
Канамицин |
0,488 |
Таблица 3
Вероятность P правильной идентификации бактериального штамма при использовании двух антибиотиков
|
Антибиотик 1 |
Антибиотик 2 |
P |
|
Бензилпенициллин |
Фузидин |
0,840 |
|
Канамицин |
Фузидин |
0,826 |
|
Ампициллин |
Фузидин |
0,819 |
|
Карбенициллин |
Фузидин |
0,811 |
|
Фузидин |
Хлорамфеникол |
0,805 |
|
Бензилпенициллин |
Налидиксовая кислота |
0,801 |
|
Бензилпенициллин |
Канамицин |
0,798 |
|
Канамицин |
Эритромицин |
0,792 |
|
Олеандомицин |
Фузидин |
0,789 |
|
Фузидин |
Эритромицин |
0,788 |

Рис. 2. Основное окно программы идентификации бактериального штамма
Таблица 4
Вероятность P правильной идентификации бактериального штамма при использовании трех антибиотиков
|
Антибиотик 1 |
Антибиотик 2 |
Антибиотик 3 |
P |
|
Бензилпенициллин |
Налидиксовая кислота |
Эритромицин |
0,943 |
|
Бензилпенициллин |
Канамицин |
Эритромицин |
0,927 |
|
Бензилпенициллин |
Канамицин |
Налидиксовая кислота |
0,927 |
|
Канамицин |
Фузидин |
Эритромицин |
0,926 |
|
Бензилпенициллин |
Фузидин |
Эритромицин |
0,925 |
|
Бензилпенициллин |
Канамицин |
Фузидин |
0,924 |
|
Канамицин |
Налидиксовая кислота |
Эритромицин |
0,923 |
|
Ампициллин |
Налидиксовая кислота |
Эритромицин |
0,919 |
|
Бензилпенициллин |
Налидиксовая кислота |
Хлорамфеникол |
0,919 |
|
Канамицин |
Оксациллин |
Эритромицин |
0,919 |
Заключение
Построена математическая модель антибиотикотипирования непатогенных актинобактерий, позволяющая идентифицировать бактериальные штаммы на основании их чувствительности к антибиотическим веществам и подбирать антибиотики, максимизирующие вероятность правильной идентификации. Разработанная на основании предложенного алгоритма программа широко используется в коллекционной работе Уральской профилированной коллекции алканотрофных микроорганизмов ИЭГМ УрО РАН для экспрессной идентификации выделенных из природы штаммов актинобактерий. Дальнейшее развитие и модификация разработанной модели могут состоять в (1) учете других таксономически значимых фенотипических признаков актинобактерий; (2) более точном построении плотностей распределения значений диаметра зоны ингибирования бактериального роста, вызванного действием антибиотика; (3) дополнительном исследовании заложенного в модели предположения о равновероятной принадлежности исследуемого штамма к одному из известных видов актинобактерий; (4) учете неполной экспериментальной информации об антибиотикочувствительности актинобактерий (имеется ряд антибиотиков, по отношению к которым определена чувствительность представителей не всех видов актинобактерий, и ряд штаммов, чувствительность которых определена в отношении не всех антибиотиков).
Благодарности
Исследования частично поддержаны грантом Программы Президиума РАН «Научные основы сохранения биоразнообразия России» (Направление 7. Проект 7.4).


