Везикулы типичных и геновариантов штаммов холерных вибрионов О1 Эль Тор, их выделение и характеристика
Автор: Якушева О.А., Алексеева Л.П., Евдокимова В.В., Мелоян М.Г., Зюзина В.П., Симакова Д.И.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Микробиология
Статья в выпуске: 1, 2024 года.
Бесплатный доступ
Установлено, что типичный штамм и геноварианты Vibrio cholerae О1 при культивировании в среде AKI на разных стадиях роста выделяют в окружающую среду везикулы наружных мембран. Методом осаждения сульфатом аммония получены препараты везикул и проведена их визуализация с помощью электронной микроскопии. С применением моноклональных антител и поликлонального антитоксического конъюгата установлено наличие липополисахарида и белков наружной мембраны OmpU и OmpT, а также холерного токсина в этих структурах. На модели культуры клеток двух линий CHO-К1 и HuTu 80 показано, что в присутствии везикул наблюдаются морфологические изменения клеток-мишеней, характерные для холерного токсина. Полученные результаты дают основание предположить, что содержимое везикул наружных мембран зависит от стадии роста вибрионов, и продуцируемые ими биологически активные вещества способны вызывать повреждение клеток, тем самым провоцируя воспалительную реакцию клеток в организме хозяина.
Vibrio cholerae, везикулы наружных мембран, лпс, белки ompu и ompt, холерный токсин
Короткий адрес: https://sciup.org/147243410
IDR: 147243410 | УДК: 579.834.1:612.017.4:579.61:577.112 | DOI: 10.17072/1994-9952-2024-1-61-73
Текст научной статьи Везикулы типичных и геновариантов штаммов холерных вибрионов О1 Эль Тор, их выделение и характеристика
For citacion: Yakusheva О. А., Alekseeva L. P., Evdokimova V. V., Meloyan M. G., Zyuzina V. P., Simakova D. I. [Vesicles of toxigenic strains of Vibrio cholera O1 El Tor, their isolation and characterization]. Bulletin of Perm University. Biology. Iss. 1 (2024): pp. 61-73. (In Russ.).
На сегодняшний день известно, что холерные вибрионы, как и другие грамотрицательные бактерии, выделяют в окружающую среду внеклеточные мембранные везикулы, которые представляют собой сферические наноструктуры диаметром 20–250 нм, образуемые в результате контролируемого выпячивания наружной мембраны с захватом части периплазматического содержимого и последующего отщепления. Они действуют как носители для транспортирования селективного груза, который может быть связан с мембранным бислоем, либо присутствовать в их просвете. Эти частицы переносят разнообразные молекулы: ДНК, РНК, белки, липиды, липополисахариды (ЛПС), холерные токсины (ХТ) и другие факторы патогенности в отдалённые клетки-хозяева [Аронова и др., 2021]. Процесс формирования везикул, как и их загрузка у Vibrio cholerae О1, не является случайным и регулируется малой РНК, получившей название VrrA (Vibrio regulatory RNA of OmpA) [Song et al., 2008], и транспортной системой VacJ/Yrb ABC (АТФ-связывающая кассета) [Zingl et al., 2020]. В качестве маркера везикул принято считать белок наружной мембраны OmpU, который является их основным компонентом [Elluri et al., 2014; Sjöström et al., 2015]. Образование везикул наружной мембраны V. cholerae О1 не ограничивается конкретными условиями, этот процесс происходит и во время роста бактерий в жидких и на агаровых средах, в составе биоплёнки, а также во время инфекции внутри организма хозяина. Обычно секретируемые естественным путём везикулы получают из жидких культуральных сред после культивирования до логарифмической или стационарной фаз роста. При этом очень важно определить оптимальное время для выделения везикул в зависимости от кривой роста и метаболического состояния культуры. Культивирование до поздней стационарной фазы приводит к увеличению выхода везикул, но может также способствовать лизису бактериальных клеток в результате гибели и загрязнению препаратов разрушенными мембранами и цитоплазматическими белками. В целом фаза роста влияет на процесс везикуляции как количественно, так и качественно, что было показано для Pseudomonas aeruginosa и Francisella novicida [Klimentová, Stulík, 2015].
В истории холеры зарегистрировано семь пандемий, вызванных штаммами холерных вибрионов О1 се-рогруппы, к которой относится два биовара — классический и El Tor. В настоящее время продолжается седьмая пандемия холеры, вызванная типичными штаммами V. cholerae О1 El Tor. Несмотря на то, что классические и El Tor вибрионы относятся к одной О1 серогруппе, они имеют фенотипические и генетические различия, а также отличаются по способности выживать во внешней среде. Больше ХТ продуцируют V. cholerae О1 сlasssical , вызывая тяжёлые формы болезни, но при попадании в открытые водоёмы быстро погибают. В то же время холера, вызванная штаммами V. cholerae О1 El Tor, характеризуется лёгким течением болезни, т.к. они меньше синтезируют ХТ, но способны длительное время сохранятся во внешней среде. В 90-х годах прошлого столетия в результате мутаций появились и получили широкое распространение генетически изменённые штаммы (или геноварианты) V. cholerae El Tor. Они отличаются от типичных El Tor вибрионов повышенной вирулентностью, что выражается в более тяжёлых проявлениях болезни и высоких показателях смертности. Данные штаммы содержат в опероне ctxАB , кодирующем биосинтез ХТ, ген ctxB классических вибрионов ( ctxB1 ) в отличие от типичных El Tor вибрионов, имеющих аллель ctxB El Tor ( ctxB3 ). Были также обнаружены другие геноварианты возбудителя, несущие новую аллель гена ctxAB7 , который, в отличие от аллеля ctxAB1 , несет дополнительную замену С/А в позиции 58. Геновариан-ты синтезируют повышенное количество ХТ I (классического) типа, приближаясь по данному показателю к высокотоксигенным штаммам классического биовара [Заднова и др., 2019].
Несмотря на то, что первые сообщения о везикулах холерных вибрионов появились около полувека назад, основной период их изучения приходится на два последних десятилетия. За это время выделены и охарактеризованы везикулы, продуцируемые классическими холерными вибрионами, вместе с тем чёткого представления о везикулах геновариантов V. cholerae О1 El Tor нет. В настоящее время геновариан-ты V. cholerae О1 El Tor получили широкое распространение и практически вытеснили классические и типичные V. cholerae О1 El Tor [Zingl et al., 2021].
Отметим, что развитие инфекционного процесса, вызываемого геновариантами V. cholerae О1 El Tor, недостаточно изучено, а механизмы выделения токсинов в везикулах наружных мембран и их взаимодействия с клетками организма-хозяина не описаны. Новые сведения об условиях, способствующих максимальной продукции везикул, их детальная характеристика вносят определённый вклад в решение вопросов, касающихся выяснения механизмов межклеточных взаимодействий и патогенеза при холере.
Цель работы – выделение, сравнительное изучение везикул типичных и геновариантов штаммов холерных вибрионов биовара Эль Тор, оценка их иммунохимической и биологической активности.
Материалы и методы исследований
В работе использовали токсигенные штаммы V. cholerae О1 El Tor Ogawa : прототипный ( ctx B3 , tcpAET , rtxA 1) – № 1310, и геноварианты: «предгаитянский» ( ctx B1 , tcpAET , rtxA 1) – № 18367, «гаитянский» ( ctxB7, tcpACIRS, rtxA4 ) – № 19188/2, «постгаитянский» ( ctxB7, tcpACIRS, rtxA4а ) – № 19667, полученные из лаборатории «Коллекция патогенных микроорганизмов» ФКУЗ Ростовский-на-Дону противочумный институт Роспотребнадзора. Штаммы V. cholerae О1 El Tor с различным генотипом были подобраны согласно их паспортным данным. Все исследуемые штаммы были типичными по морфологическим, культуральным, биохимическим и серологическим свойствам. Штаммы культивировали на агаре Мартена, pH 7.7. Построение кривых роста проводили следующим образом: 18-часовые агаровые культуры суспендировали в среде AKI до оптической плотности (ОП) 0.2. Далее их разбавляли до концентрации (ОП) 0.01 средой AKI и культивировали при 37°С, измерения показателей ОП проводили каждые два часа при длине волны 600 нм. С целью получения изолированных везикул наружных мембран суточные культуры штаммов V. cholerae O1 El Tor засевали в пробирку с жидкой средой AKI (1.5% бактопептона, 0.4% дрожжевого экстракта, 0.5% NaCl, 0.3% NaHCO 3 ), pH 7.6, и культивировали в течение 4 ч. при 37°С по стандартному методу [Iwanaga, Kuy-yakanond, 1987]. Далее культуру переносили в колбу, содержащую среду AKI, и последующее культивирование проводили при температуре 37°С с аэрацией. Все этапы работы с живыми культурами различных штаммов V. cholerae O1 El Tor проводили с учётом требований СанПиН 3.3686-21 «Санитарноэпидемиологические требования по профилактике инфекционных болезней».
Выделение мембранных везикул проводили методом осаждения сульфатом аммония по методике [Кудрякова и др., 2017] с некоторыми модификациями. Клетки из 1 л культуры удаляли центрифугированием при 10 000 g в течение 20 мин. при 4°С. Супернатант фильтровали через фильтры типа GVWP с диаметром 0.45 мкм и 0.22 мкм для удаления дебриса, добавляли гентамицин до конечной концентрации 800 мкг/мл. Далее делали высев на стерильность для подтверждения специфической стерильности и добавляли ингибитор протеаз, не содержащий ЭДТА, для предотвращения деградации белка. Из бесклеточного супернатанта везикулы осаждали (NH 4 ) 2 SO 4 (65% насыщения) в течение 2 ч. при 4°С с перемешиванием. Затем центрифугировали при 20 000 g в течение 35 мин. при 4°С. Полученный осадок везикул ресуспендировали в растворе 0.1M фосфатно-солевого буфера, pH 7.2. Препарат диализовали против 10 объёмов того же буфера с последующим центрифугированием при 100 000 g в течение 1 ч. при 4°С. Осадок везикул промывали 0.1M фосфатно-солевым буфером, pH 7.2, и осаждали при той же скорости в течение 1 ч., затем ресуспендировали в 1 мл 0,1M фосфатно-солевого буфера, pH 7.2. Разливали на аликвоты и хранили при –20°С.
Общую концентрацию белка измеряли методом Лоури [Lowry et al., 1951]. Концентрацию белка рассчитывали по калибровочной кривой, построенной для БСА.
Для трансмиссионной электронной микроскопии (ТЭМ) образцы наносили на поверхность формаро-вой плёнки-подложки с углеродным покрытием, контрастировали 0.2%-ным раствором уранилацетата в воде 1 мин. при комнатной температуре, промывали дистиллированной водой, просушивали и исследовали под электронным микроскопом х 100 000.
Электрофоретический анализ препаратов везикул проводили в ПААГ с градиентом плотности 6% и 12.5% в денатурирующих условиях с додецилсульфатом натрия и β-меркаптоэтанолом. В качестве маркеров использовали смесь белковых стандартов «Blue Plus II Protein Marker» (14–120 кДа). Для обнаружения белков использовали окраску Кумасси синий R-250 [Laemmli, 1970].
После полусухого переноса из геля на нитроцеллюлозную мембрану осуществляли постановку имму-ноблотинга, как описано в [Towbin, 1984]. Для предварительной окраски белков на мембране использовали краситель Ponceau S. Холерный токсин определяли после инкубации мембраны с поликлональным кроличьим антитоксическим пероксидазным конъюгатом [Якушева и др., 2020]. ЛПС выявляли с помощью моноклональных антител гибридомы (ГХ-F8/О1), депонированной ранее в «Специализированной коллекции перевиваемых соматических клеток позвоночных» Института цитологии (г. Санкт-Петербург) под номером РККК (П) 386Д. Для выявления мембранных белков использовали моноклональные антитела гибридом (ГХ-А5D8/OmpU и ГХ-H2F5/OmpT), депонированных в «ГКПМ-Оболенск» (№179, №180) [Евдокимова и др., 2016]. В качестве вторых антител использовали антимышиный пероксидазный конъюгат (Invitrogen). После инкубации мембрану проявляли 3.3-диаминобензидином (Aldrich).
Концентрацию ЛПС определяли в иммуноферментном анализе с использованием моноклональных антител, направленным к эпитопам ЛПС V. cholerae О1. Концентрацию ЛПС рассчитывали по калибровочной кривой, построенной для ЛПС штамма V. cholerae О1 El Tor № 5879.
Постановку иммуноферментного анализа (ИФА) осуществляли следующим образом. В лунки планшета вносили препарат везикул и выдерживали в течение 2 ч. при 37°С, после окончания инкубации аккуратно удаляли жидкость из лунок. Процедуру блокирования свободной поверхности полистироловых планшетов от иммунореагентов проводили в течение 30 мин. (37°С) с применением в качестве блокирующего агента бычьего сывороточного альбумина в концентрации 1%. Инкубацию везикул с монокло- нальными антителами к ЛПС проводили в течение часа и далее – с антимышиным пероксидазным конъюгатом в течение 45 мин. Для разведения конъюгата использовали 0.01М фосфатно-солевого буфера (ФСБ) с добавлением 0.05% Твин-20 (рН 7.4). После каждого этапа следовала процедура отмывания планшета от несвязавшихся компонентов реакции раствором 0,01М ФСБ с добавлением 0.05% Твин-20 (рН 7.4). Реакцию проявляли свежеприготовленным субстратным раствором ТМБ (3.3'.5.5'-тетраметилбензидин) в течение 25 мин., после её остановки 2М серной кислотой измеряли значения оптической плотности. Результаты ИФА регистрировали при длине волны 450 нм (референс-волна 630нм). Все исследования проводили не менее чем в трёх повторностях [Егоров и др., 1991].
Биологическую активность оценивали на перевиваемых клеточных линиях CHO-К1 (овариальные клетки китайского хомячка) и HuTu 80 (человек, аденокарцинома двенадцатиперстной кишки) (РКККП, Институт цитологии РАН, г. Санкт-Петербург). Культивирование культур клеток CHO-К1 и HuTu 80 осуществляли согласно паспортным данным. Вне периода постановки опытов коллекционные культуры хранились в криоконсервированном состоянии в биохранилище с жидким азотом при –196°С. Все этапы с перевиваемыми линиями клеток были выполнены в соответствии с рекомендациями [Фрешни, 2018]. Для тестирования биологической активности везикул наружных мембран клетки CHO-К1 и HuTu 80 высевали в лунки 96-луночного планшета в дозе 5 т. кл. на лунку. Через сутки после распластывания клеток их трижды промывали раствором Хенкса (pH 7.4) и в лунки 96-луночного планшета вносили по 0.1 мл бессывороточной среды, содержащей исследуемые препараты в концентрации 100 нг/мл по общему белку, после чего инкубировали в течение ночи при 37°С в 5% СО 2 . Отрицательным контролем служила бессывороточная среда, добавленная к клеткам CHO-К1 и HuTu 80. В качестве положительного контроля использовали очищенный холерный токсин [Алексеева и др., 2019] в бессывороточной среде в аналогичных концентрациях. Для контроля специфичности использовали антитоксическую сыворотку в разведении 1:1000 [Якушева, 2019]. Учёт проводили с помощью инвертированного микроскопа, изучали морфологию клеток, сравнивая с контрольными (интактными). Для фотографирования клеточный слой осторожно промывали раствором Хенкса, pH 7.4, подсушивали, фиксировали в течение 20 мин. 96°-м этанолом и окрашивали по Романовскому-Гимзе.
При анализе результатов были использованы статистические методы (p<0.05) [Ашмарин, Воробьёв, 1962].
Результаты и их обсуждение
Согласно данным литературы, логарифмическая и стационарная фазы роста холерных вибрионов являются оптимальными для получения значительного количества везикул [Brameyer et al., 2018; Rasti et al., 2018;]. На первом этапе работы синхронизировали рост типичного, «предгаитянского», «гаитянского» и «постгаитянского» штаммов. Для каждого штамма строили кривую роста путём измерения ОП суспензионной культуры в заданных временных интервалах. Исследуемые штаммы культивировали в среде AKI, специально рекомендуемой для получения холерного токсина, продуцируемого природными штаммами V. cholerae El Tor, и обеспечивающей эффективную активацию сложного регуляторного каскада ToxR, необходимого для выраженной экспрессии структурных генов ctxAB [Zingl et al., 2021] . В результате проведённых исследований было установлено, что геноварианты росли с одинаковой скоростью, логарифмическая фаза роста наступала через 6 ч. культивирования и длилась до 14 ч. с переходом в стационарную фазу. У типичного штамма V. cholerae О1 El Tor был отмечен замедленный рост – логарифмическая фаза наступала через 8 ч. культивирования, после перехода в стационарную фазу (16 ч.) наблюдалось накопление максимального количества бактериальной массы, что сопровождалось снижением количества жизнеспособных клеток. Из супернатантов суспензионных культур, выращенных в течение 6 ч. для геновариантов и 8 ч. для типичного (логарифмическая фаза роста), и 14–16 ч. (стационарная) соответственно, методом осаждения сульфатом аммония были получены везикулы наружных мембран.
Их образование подтверждено электронно-микроскопическими исследованиями. С помощью ТЭМ установлено, что все штаммы в логарифмической и в стационарной фазах роста формировали везикулы наружных мембран. При визуальной оценке препаратов везикул не были обнаружены бактериальные клетки, жгутики и пили. Везикулы наружных мембран представляли собой сферические структуры с диаметрами от 50 до 200 нм, заполненные веществом с низкой электронной плотностью. На рис. 1 представлена электронная микроскопия выделенных препаратов везикул.
Отметим, что в препаратах, полученных через 8 ч. культивирования, преобладали везикулы с размером 56–86 нм, а также обнаруживались единичные крупные везикулы. По мере роста холерных вибрионов через 16 ч. культивирования размер везикул увеличился, и преобладали везикулы крупных размеров 114–180 нм. Разница в размерах везикул может быть связана с их участием в транспорте секреторных белков во внеклеточное пространство.
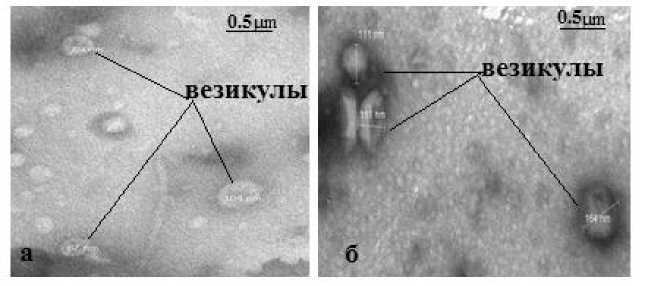
а – логарифмическая фаза роста, б – стационарная фаза роста
Рис. 1. Электронная микроскопия препаратов везикул, окрашенных уранилацетатом, на примере «постгаитянского» штамма V. cholerae О1 El Tor № 19 667, увеличение х 100 000
[Electron microscopy of vesicle preparations stained with uranyl acetate, using the example of the “post-Haitian” strain of V. cholerae O1 El Tor № 19667, magnification х 100 000:]
Для оценки количества везикул, образуемых штаммами V.cholerae О1 El Tor, было произведено определение концентрации общего белка и ЛПС. Согласно полученным результатам, концентрация белка в анализируемых препаратах везикул, выделенных культурами в логарифмическую фазу роста, была в пределах 4.53–16.61 мкг/мл, ЛПС 7.4–8.6 мкг/мл, а в стационарную фазу роста эти показатели равнялись 6.1–19.8 мкг/мл, ЛПС 12.8–16.1 мкг/мл (таблица). Очевидно, что концентрация белка и ЛПС в препаратах везикул, полученных из клеток стационарной фазы роста, выше по сравнению с препаратами везикул, выделенными в логарифмическую фазу роста. Сравнение уровней продукции везикул наружных мембран типичным штаммом и геновариантами штаммов V. cholerae El Tor, судя по общему количеству белка и ЛПС, позволило установить, что последние отличались повышенной везикуляцией. Как правило, внеклеточные везикулы грамотрицательных бактерий имеют природу наружной мембраны, при этом белки наружной мембраны, как и ЛПС, являются основными их компонентами [Chatterjee, Chaudhuri, 2013].
Общий белок и ЛПС в препаратах везикул, выделенных из штаммов V. cholerae О1 El Tor
[Evaluation of total protein and LPS in vesicle preparations isolated from V. cholerae O1 El Tor strains]
|
Препараты везикул, полученные из штаммов |
Количество белка и ЛПС (мкг/мл) |
|||
|
Логарифмическая фаза роста |
Стационарная фаза роста |
|||
|
белок |
ЛПС |
белок |
ЛПС |
|
|
V. cholerae О1 El Tor 19667 «постгаитянский» |
16.61±0.003 |
8.6±0.004 |
19.8±0.002 |
16.1±0.001 |
|
V. cholerae О1 El Tor 19188/2 «гаитянский» |
14.83±0.001 |
7.8±0.001 |
16.9±0.003 |
15.2±0.004 |
|
V. cholerae О1 El Tor 18367 «предгаитянский» |
8.51±0.002 |
7.6±0.001 |
12.1±0.004 |
14.4±0.004 |
|
V. cholerae О1 El Tor 1310 «прототипный» |
4.53±0.001 |
7.4±0.002 |
6.1±0.001 |
12.8±0.002 |
Примечание. Приведены средние значения ± стандартное отклонение.
Повышенное содержание белка и ЛПС в препаратах везикул в стационарную фазу роста может быть связано с большим размером везикул, что согласуется с данными электронной микроскопии, а также с большей концентрацией этих компонентов на единицу площади везикул.
Далее сравнение белкового состава полученных везикул наружных мембран проводили с помощью электрофореза в присутствии додецилсульфата натрия (рис. 2). Для выявления белковых полос гель окрашивали Кумасси синий R-250 и идентифицировали по молекулярным массам.
Сравнительный анализ белкового состава везикул «типичного», «предгаитянского», «гаитянского» и «постгаитянского» штаммов показал, что они практически не отличаются по основным мажорным белкам, что свидетельствует о сходстве их белкового состава. Обращает на себя внимание препарат везикул штамма V. cholerae О1 El Tor № 19667, у которого более выражены мажорные белки. Из данных литературы известно, что везикулы грамотрицательных бактерий сформированы из наружной мембраны с захватом части периплазматического пространства, поэтому белки наружной мембраны и белки периплазмы являются их обязательными компонентами. В то же время в образующихся у V. cholerae везикулах может выявляться до 90 различных белков [Altindis, Fu, Mekalanos, 2014]. В составе везикул исследованных штаммов обнаружены белки, которые, судя по их молекулярным массам, соответствуют описанным в научной литературе мембранным белкам (OmpX (27 кДа), OmpA (35 кДа), OmpU (38 кДа), OmpT (40 кДа) и OmpS (45 кДа)), а также субъединицы холерного токсина. Вместе с тем белок с молекулярной массой 40 кДа выражен только в препарате везикул штамма V. cholerae О1 El Tor № 19667. Аналогичные результаты были получены после электрофоретического разделения препаратов везикул стационарной фазы. Белковые профили везикул были перенесены на нитроцеллюлозную мембрану, после чего она была обработана моноспецифическими иммуноглобулинами, направленными к мембранным белкам OmpT и OmpU. На рисунке 3 представлены препараты везикул, в которых наглядно выявлены мембранные белки OmpU и OmpT. Как видно, в препаратах везикул V. cholerae О1 El Tor № 18367, № 19188/2 и № 1310 был только белок OmpU. Везикулы V. cholerae О1 El Tor № 19667 содержали белки OmpT и OmpU. Наличие последнего во всех препаратах везикул изученных штаммов можно объяснить функциональными свойствами белка OmpU. В отличие от OmpT, OmpU представляет собой анион-селективный порин, который ограничивает прохождение отрицательно заряженных соединений, в том числе и желчи.
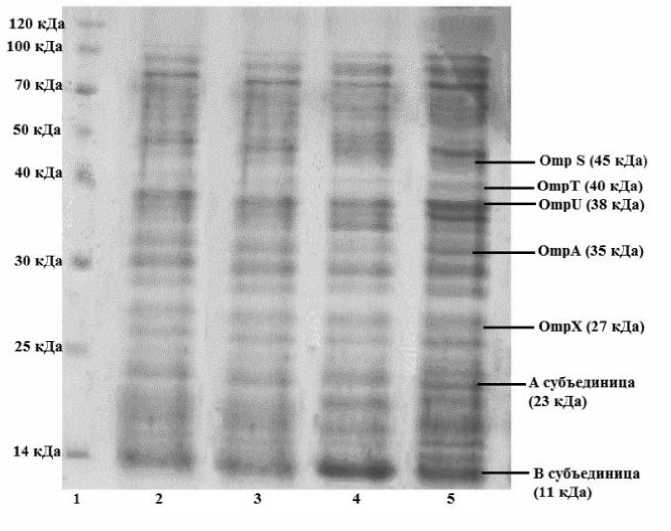
Рис. 2. Белковый состав препаратов везикул, выделенных в логарифмическую фазу роста (окраска Кумасси синий R-250)
1 – маркеры молекулярных весов; 2 – препарат везикул штамма V. cholerae О1 El Tor № 1310; 3 – препарат везикул штамма V. cholerae О1 El Tor № 18367; 4 – препарат везикул штамма V. cholerae О1 El Tor № 19188/2; 5 – препарат везикул штамма V. cholerae О1 El Tor № 19667
[Protein composition of vesicle preparations isolated in the logarithmic growth phase, stained with Coomassie blue R-250]
Для лучшей адаптации в неблагоприятных условиях, особенно при колонизации кишечника хозяина, а также в среде AKI, холерные вибрионы с помощью регулятора вирулентности ToxR активируют экспрессию генов ompU и подавляют ompT, что в свою очередь отражается на синтезе поринов. В то же время процесс формирования везикул у холерных вибрионов не пассивный, а функционирует как контролируемый механизм секреции компонентов клетки или оболочки, и регулируется малой РНК VrrA, которая экспрессируется в среде AKI. Действие этой регуляторной мРНК направлено на подавление производства белка OmpT [Song, Sabharwal, Wai, 2010], что является причиной отсутствия последнего в везикулах у большинства штаммов. Однако недавние исследования показали, что белок OmpT в условиях активации ToxR дополнительно к репрессии может активно удаляться с поверхности клеток холерных вибрионов с помощью везикул [Zingl et al., 2020]. Это объясняет присутствие белка наружной мембраны OmpT на поверхности везикул у штамма V. cholerae О1 El Tor № 19667 при культивировании в среде AKI. Согласно данным литературы [Zingl et al., 2020; Jugder, Watnick, 2020], можно предположить, что «постгаитянский» штамм на начальных этапах инфекции будет иметь преимущество в адаптации по сравнению с другими испытуемыми штаммами за счёт быстрого изменения поверхности своей наружной мембраны в результате удаления белка OmpT в везикулах для повышения устойчивости к желчи. Нако- нец, только в одной публикации сообщается, что порины наружной мембраны, OmpU и OmpT играют важную роль в интернализации везикул эпителиальными клетками кишечника [Zingl et al., 2021].
ЛПС является эндотоксином и служит важным антигеном и лигандом на поверхности мембраны, играя решающую роль в адгезии и активации иммунного ответа, а также может оказывать влияние на скорость проникновения везикул в клетку-мишень. В настоящее время в литературе нет сведений о роли ЛПС в проникновении везикул природных геновариантов V. cholerae О1 El Tor в клетку-мишень. С помощью моноспецифических иммуноглобулинов, направленных к эпитопам О-антигена ЛПС V. cholerae О1, была охарактеризована его структура в исследуемых образцах. Результаты иммуноблота представлены на рис. 3, из которого можно видеть, что в районе 30 кДа выявлена одна широкая диффузная полоса, которая, согласно данным литературы, соответствует О-антигену S-ЛПС.
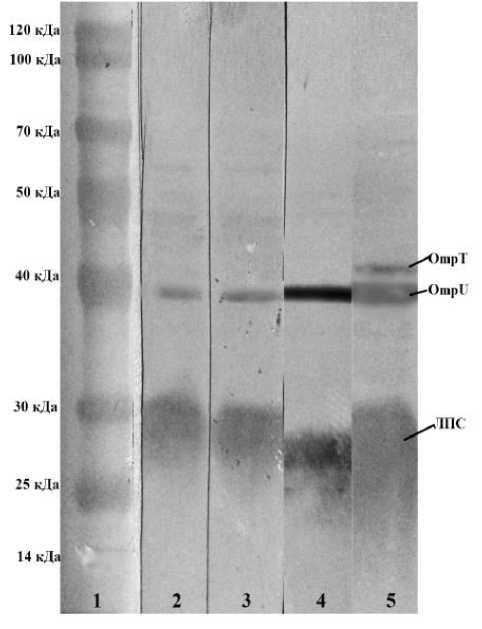
Рис. 3. Иммуноблоттинг препаратов везикул, выделенных в логарифмическую фазу роста, обработанных иммуноглобулинами гибридом ГХ-F8/О1, ГХ-А5D8/OmpU и ГХ-H2F5/OmpT
1 – маркеры молекулярных весов; 2 – препарат везикул штамма V. cholerae О1 El Tor № 1310; 3 – препарат везикул штамма V. cholerae О1 El Tor № 18367; 4 – препарат везикул штамма V. cholerae О1 El Tor № 19188/2;
5 – препарат везикул штамма V. cholerae О1 El Tor № 19667
[Immunoblotting of vesicle preparations isolated in the logarithmic growth phase, treated with immunoglobulins hybrid GH-F8/O1, GH-A5D8/OmpU and GH-H2F5/OmpT]
Везикулы Escherichia coli, содержащие О-антиген, быстрее интернализуются в клетки-мишени по сравнению с везикулами, лишенными его [O´Donoghue, 2017]. Показана также важная роль S-ЛПС в процессе поглощения везикул, продуцируемых Haemophilus influenzae, Campylobacter jejuni, P. aeruginosa , в клетки-мишени через богатые холестерином липидные рафты. Иными словами, везикулы с S-ЛПС используют более быстрый механизм поглощения, зависимый от липидного рафта, а везикулы, лишенные О-антигена, интернализуются в клетки в течение более длительного периода времени, в основном клатрин-зависимым эндоцитозом [Caruana, Walper, 2020].
Наличие О-антигена S-ЛПС в составе везикул типичного и природных геновариантов V. cholerae О1 El Tor дает основание предположить, что при проникновении везикул в клетки-мишени задействован путь, зависимый от рафтов. Подтверждение этому нам предстоит найти в будущем при изучении эндоци-тарных путей поглощения везикул.
Известно, что холерный токсин находится в периплазме, откуда он секретируется через двухступенчатую Sec-зависимую систему секреции 2-го типа (T2SS) в свободной форме [Зюзина и др., 2023]. Кроме того, он может быть захвачен везикулами, что было описано у классического штамма V. cholerae О1 Inaba 569 B. При этом в статических условиях культивирования холерный токсин высвобождается в виде целой молекулы CtxAB5, в то же время в условиях низкой осмолярности среды у этого же штамма только субъединица CtxA упаковывается в везикулы [Rasti et al., 2018; Rasti, Brown, 2019].
Для определения наличия субъединиц холерного токсина и их связи с везикулами был проведен иммуноблоттинг с использованием поликлонального антитоксического конъюгата. Как видно на рис. 4, в препаратах везикул наружных мембран, полученных в логарифмическую фазу роста, конъюгат выявлял зону примерно 24–26 кДа, которая соответствует субъединице А, и вторую полосу в районе 11–12 кДа, что соответствует субъединице В холерного токсина. Это свидетельствует о том, что холерный токсин в виде целой молекулы присутствует у типичного штамма и природных геновариантов не только в виде растворимой секретируемой формы, но также связан с везикулами. При этом в везикулах, выделенных через 16 ч., холерный токсин был обнаружен в меньших количествах, о чём свидетельствовали менее выраженные полосы иммуноблота. Более низкое содержание холерного токсина в везикулах в стационарной фазе роста может быть связано с высокой плотностью микробных клеток в этот период. На этой стадии регулятор транскрипции HapR холерных вибрионов репрессирует экспрессию генов холерного токсина и токсин-корегулируемых пилей и активирует синтез двух протеаз – Hap/A, PrtV [Boardman, Meehan, Satchell, 2007].

а б
Рис. 4. Иммуноблот препаратов везикул с антитоксическим пероксидазным конъюгатом:
а – логарифмическая фаза, б – стационарная фаза; 1 – маркеры молекулярных весов; 2 – препарат везикул штамма V. cholerae О1 El Tor № 1310; 3 – препарат везикул штамма V. cholerae О1 El Tor № 18367; 4 – препарат везикул штамма V. cholerae О1 El Tor № 19188/2; 5 – препарат везикул штамма V. cholerae О1 El Tor № 19667
[Immunoblot of vesicle preparations with an antitoxic peroxidase conjugate]
Для оценки биологической активности полученных препаратов везикул использовали две линии культуры клеток ( CHO-К1 и HuTu 80 ) одновременно, поскольку первая традиционно используется для тестирования холерного токсина, а другая представляет собой эпителиальные клетки кишечника человека (рис. 5). Спустя сутки после внесения препаратов везикул, полученных в логарифмическую и стационарную фазы роста, в световом микроскопе наблюдалось изменение морфологии клеток обеих линий. Анализ наблюдаемых морфологических изменений культуры клеток при тестировании препаратов везикул, полученных в логарифмическую фазу роста, показал удлинение клеток CHO-К1 и появление игольчатых отростков в культуре клеток HuTu 80, характерное для действия холерного токсина. Судя по полученным результатам, следует отметить, что в препаратах везикул холерный токсин биологически активен. Если допустить, что везикулы в процессе контакта с клеточными культурами разрушаются, и изменения их морфологии являются следствием выхода и действия ХТ. Очевидно, что в этом случае предварительная обработка везикул антитоксической сывороткой привела бы к нейтрализации действия ХТ и отсутствию типичного удлинения клеток-мишеней. В наших опытах после инкубации везикул с антитоксической сывороткой регистрировали морфологические изменения клеток, характерные для ХТ. В отношении препаратов везикул, выделенных в стационарную фазу роста, можно сказать, что при контакте с культурами клеток обеих линий они обладали большей протеолитической активностью, вызывая округление клеток CHO-К1 и HuTu 80.
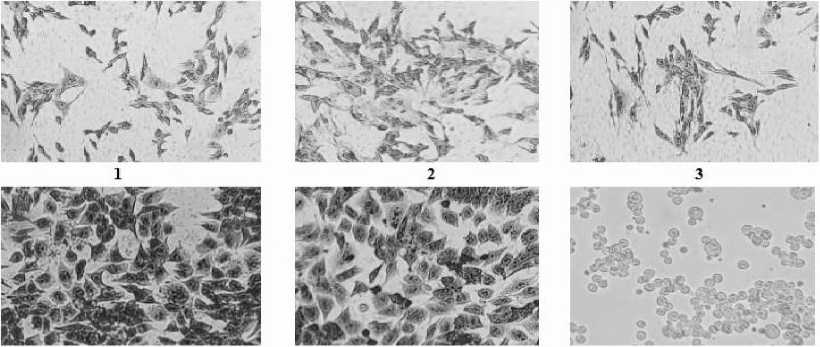
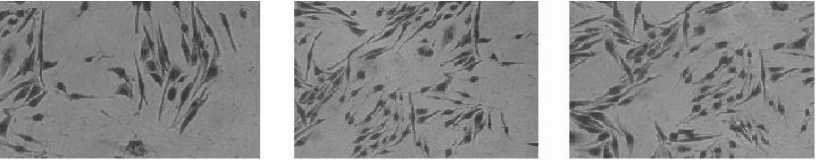

10 11 12
Рис. 5. Морфологическое изменение культуры клеток CHO-К1 и HuTu 80 , вызванное воздействием препаратов везикул под инвертированным микроскопом (окрашивание по Романовскому-Гимзе, увеличение 10 x 15):
-
1 – действие везикул логарифмической фазы на культуру клеток HuTu 80 ; 2 – действие холерного токсина на культуру клеток HuTu 80 ; 3 – действие везикул логарифмической фазы, предварительно обработанных антитоксической сывороткой на культуру клеток HuTu 80 ; 4 – действие холерного токсина, предварительно обработанного антитоксической сывороткой на культуру клеток HuTu 80; 5 – культура клеток HuTu 80; 6 – действие везикул стационарной фазы на культуру клеток HuTu 80 ; 7 – действие везикул логарифмической фазы на культуру клеток CHO-К1 ; 8 – действие холерного токсина на культуру клеток CHO-К1 ; 9 – действие везикул логарифмической фазы, предварительно обработанных антитоксической сывороткой на культуру клеток CHO-К1 ; 10 – действие холерного токсина, предварительно обработанного антитоксической сывороткой на культуру клеток культура клеток CHO-К1; 11 – культура клеток CHO-К1 ; 12 – действие везикул стационарной фазы культуру клеток CHO-К1
[Morphological changes in CHO-K1 and HuTu 80 cell cultures caused by exposure to vesicle preparations under an inverted microscope, Romonovsky-Giemsa staining]
Заключение
Таким образом, нами впервые получены данные об образовании везикул геновариантов V. cholerae О1 El Tor. В результате проведённых исследований показано, что стадия роста V. cholerae О1 El Tor влияет на размер и состав выделяемых ими везикул наружных мембран, что указывает на селективную упаковку молекул во время роста бактерий. При этом природные геноварианты V. cholerae О1 El Tor в среде AKI продуцируют везикулы наружных мембран в большем количестве по сравнению с типичными штаммами, что, возможно, является одним из механизмов их повышенной выживаемости при действии различных стрессовых факторов и, как следствие, их широкого распространения.
В настоящей работе установлено, что везикулы, полученные из типичного и геновариантов V. cholerae О1 El Tor, практически не отличаются по основным мажорным белкам, за исключением штамма V. cholerae О1 El Tor № 19667, что свидетельствует о сходстве их белкового состава. Некоторые отличия связаны с присутствием белка наружной мембраны OmpT на поверхности везикул «постгаитян- ского» штамма. Этот факт косвенно указывает на преимущество в адаптации и устойчивости к желчи на начальных этапах инфекции по сравнению с другими испытуемыми штаммами за счёт быстрого изменения поверхности своей наружной мембраны в результате удаления белка OmpT в везикулах.
В данной работе также установлено, что у типичного и геновариантов штаммов V. cholerae О1 El Tor в среде AKI везикулы наружной мембраны принимают участие в транспорте холерного токсина, который переносится в виде целой молекулы CtxAB5. Мембранные везикулы типичного штамма и геновариантов V. cholerae О1 El Tor, выделенные из культур в логарифмической и стационарной фазах роста, способны по-разному повреждать клетки-мишени. На основании этих результатов очевидна роль мембранных везикул как средств доставки факторов вирулентности в биологически активной форме и влияния переносимых ими веществ на клетки человека, включая цитотоксичность и протеолитическую активность.
Результаты нашей работы показали, что везикулы типичного и геновариантов V. cholerae О1 El Tor содержат О-антиген S-ЛПС. Наличие О-антигена S-ЛПС в составе везикул типичного и природных гено-вариантов V. cholerae О1 El Tor дает основание предположить, что при проникновении везикул в клетки-мишени задействован путь, зависимый от рафтов. Пока остается открытым вопрос, каким образом везикулы геновариантов холерных вибрионов проникают в клетки-мишени, и исследования в этом направлении будут продолжены.
Список литературы Везикулы типичных и геновариантов штаммов холерных вибрионов О1 Эль Тор, их выделение и характеристика
- Алексеева Л.П. и др. Современные методические приёмы очистки холерного токсина // Вестник биотехнологии и физико-химической биологии имени Ю.А. Овчинникова. 2019. Т. 15, № 1. С. 5-9.
- Аронова Н.В. и др. Роль везикул наружных мембран возбудителей особо опасных инфекций в патогенезе и иммуногенезе инфекционного процесса // Проблемы особо опасных инфекций. 2021. № 4. С. 6-15. doi: 10.21055/0370-1069-2021-4-6-15.
- Ашмарин И.П. Воробьев А.А. Статистические методы в микробиологических исследованиях. Л.: Медгиз, 1962. 180 с.
- Евдокимова В.В. и др. Иммуноферментные методы анализа в диагностике холеры // Клиническая лабораторная диагностика. 2016. № 5. С. 303-307.
- Егоров А.М. и др. Теория и практика иммуноферментного анализа. М.: Высш. шк., 1991. 288 с.
- Заднова С.П. и др. Сравнительный анализ адаптационных свойств типичных и генетически измененных штаммов Vibrio cholerae биовара El Tor // Журнал микробиологии. 2019. № 2. С. 25-30.
- Зюзина В.П. и др. Роль везикул в транспорте холерного токсина // Проблемы особо опасных инфекций. 2023. № 2. С. 29-34. doi: 10.21.055/0370-1069-2023-2-29-34/.
- Кудрякова И.В. и др. Изучение факторов биогенеза везикул Lysobacter sp. XL1 // Биохимия. 2017. Т 82, № 4. С. 677-686.
- Фрешни Р.Я. Культура животных клеток: практическое руководство. М.: Бином. Лаборатория знаний, 2018. 691с.
- Якушева О.А. и др. Получение антитоксических сывороток и возможность их применения в диагностике холеры // Вестник Пермского университета. Сер. Биология. 2019. Вып. 4. С. 426-433.
- Якушева О.А. и др. Характеристика и оценка диагностической значимости поли- и моноклональ-ных пероксидазных конъюгатов к холерному токсину // Вестник биотехнологии и физико-химической биологии имени Ю.А. Овчинникова. 2020. Т. 16, № 2. С. 37-43.
- Altindis E., Fu Y., Mekalanos J.J. Proteomic analysis of Vibrio cholerae outer membrane vesicles // Proc. Natl. Acad. Sci. USA. 2014. Vol. 111, № 15. P. 1548-1556. doi: 10.1073/pnas.1403683111.
- Boardman B.K., Meehan B.M., Fullner K.J. Satchell Growth phase regulation of Vibrio cholerae RTX toxin export // J. Bacteriol. 2007. Vol. 189, № 5. P. 1827-1835. doi: 10.1128/JB.01766-06.
- Brameyer S. et al. Outer Membrane Vesicles Facilitate Trafficking of the Hydrophobic Signaling Molecule CAI-1 between Vibrio harveyi Cells // J. Bacteriol. 2018. Vol. 200, № 15. doi: 10.1128/JB.00740-17.
- Caruana J.C., Walper S.A. Bacterial Membrane Vesicles as Mediators of Microbe - Microbe and Microbe - Host Community Interactions // Front Microbiol. 2020. Vol. 11, № 432. doi: 10.3389/fmicb.2020.00432.
- Chatterjee D., Chaudhuri K. Vibrio cholerae O395 outer membrane vesicles modulate intestinal epithelial cells in a NOD1 protein-dependent manner and induce dendritic cell-mediated Th2/Th17 cell responses // J. Biol. Chem. 2013. Vol. 288, № 6. P. 4299-42309. doi: 10.1074/jbc.M112.408302.
- Elluri S. et al. Outer Membrane Vesicles Mediate Transport of Biologically Active Vibrio cholerae Cy-tolysin (VCC) from V. cholerae Strains // PLoS One. 2014. Vol. 9, № 9. e106731. doi: 10.1371/journal.pone.0106731.
- Iwanaga M., Kuyyakanond T. Large production of cholera toxin by Vibrio cholerae O1 in yeast extract peptone water. // Journal of Clinical Microbiology. 1987. Vol. 25, № 1. P. 2314-2316.
- Jugder B.E., Watnick P.I. Vibrio cholerae Sheds Its Coat to Make Itself Comfortable in the Gut // Cell Host & Microbe. 2020. Vol. 27, № 2. P. 225-237. doi.org/10.1016/j.chom.2020.01.017.
- Klimentova J., Stulik J. Methods of isolation and purification of outer membrane vesicles from gramnegative bacteria // Microbiological Research. 2015. Vol. 170. P. 1-9. doi: 10.1016/j.micres.2014.09.006.
- Laemmli U.K. Cleavage of structural proteins during assembly of the head of bacteriophage T4 // Nature. 1970. Vol. 227, № 5259. P. 680-685.
- Lowry O.H. et al. Protein measurement with the folin phenol reagent // J. Biol. Chem. 1951. Vol. 193, № 1. P. 265-275.
- O'Donoghue E.J. et al. Lipopolysaccharide structure impacts the entry kinetics of bacterial outer membrane vesicles into host cells // PLoS Pathog. 2017. Vol. 13, № 11. e1006760. doi: 10.1371/journal.ppat. 1006760.
- Rasti E.S. et al. Association of Vibrio cholerae 569B outer membrane vesicles with host cells occurs in a GM 1 -independent manner // Cell Microbiol. 2018. Vol. 20, № 6. e12828. doi: 10.1111/cmi.12828.
- Rasti E.S., Brown A.C. Cholera Toxin Encapsulated within Several Vibrio cholerae O1 Serotype Inaba Outer Membrane Vesicles Lacks a Functional B-Subunit // Toxins (Basel). 2019. Vol. 11, № 4. P. 207. doi: 10.3390/toxins11040207.
- Sjöström A.E., et al. Membrane vesicle-mediated release of bacterial RNA // Sci. Rep. 2015. Vol. 5. doi: 10.1038/srep15329.
- Song T., Sabharwal D., Wai S.N. VrrA mediates Hfq-dependent regulation of OmpT synthesis in Vibrio cholerae // J. Mol. Biol. 2010. Vol. 400, № 4. P. 682-688. doi: 10.1016/j.jmb.2010.05.061.
- Song T. et al. A new Vibrio cholerae sRNA modulates colonization and affects release of outer membrane vesicles // Mol. Microbiol. 2008. Vol. 70, № 1. P. 100-111. doi: 10.1111/j.1365-2958.2008.06392.x.
- Towbin H. Immunoblotting and dot immunobinding - Current status and outlook // J. Immunol. Methods. 1984. Vol. 72. P. 313-340.
- Zingl F.G. et al. Outer Membrane Vesiculation Facilitates Surface Exchange and In Vivo Adaptation of Vibrio cholerae // Cell Host Microbe. 2020. Vol. 27, № 2. P. 225-237. doi: 10.1016/j.chom.2019.12.002.
- Zingl F.G. et al. Outer Membrane Vesicles of Vibrio cholerae Protect and Deliver Active Cholera Toxin to Host Cells via Porin-Dependent Uptake // mBio. 2021. Vol. 12, № 3. e0053421. doi: 10.1128/mBio.00534-21.


