Видовая принадлежность и серогрупповая вариабельность стрептококков, выделяемых от свиней в Краснодарском крае
Автор: Толстова Е.А., Агольцов В.А., Черных О.Ю., Семиволос А.М., Падило Л.П., Попова О.М.
Статья в выпуске: 3 т.255, 2023 года.
Бесплатный доступ
Использование комплексной лабораторной диагностики, включающей в себя бактериологический, серологический, биохимический и биологический методы исследований при стрептококкозе свиней позволили определить виды, серогрупповую принадлежность и патогенность стрептококков, циркулирующих у свиней в Краснодарском крае. При исследовании патматериала от свиней (свиноматок; носовые смывы, трупы поросят) были выделены S. pneumonia, S. zooepidemicus, S. faecalis и впервые S. uberis. При определении серогрупповой принадлежности стрептококков в реакции преципитации установили, что в основном среди свиней Краснодарского края циркулируют патогенные варианты серологических групп: B, G, I, R.
Стрептококкоз свиней, виды стрептококков, лабораторная диагностика
Короткий адрес: https://sciup.org/142238923
IDR: 142238923 | УДК: 619.615.33.616.24-002.636.4 | DOI: 10.31588/2413_4201_1883_2_255_329
Текст научной статьи Видовая принадлежность и серогрупповая вариабельность стрептококков, выделяемых от свиней в Краснодарском крае
Стрептококкоз свиней представляет собой, как самостоятельное заболевание, так и возникающий на фоне целого ряда инфекционных патологий, который может вызывать тяжелые поражения, в виде менингита, артрита, бронхопневмоний и других патоморфологических изменений [3, 4, 5].
Первой стадией патогенного процесса, является прикрепление и колонизация на слизистой оболочке или на эпителиальных поверхностях хозяина. Второй этап – инвазия в более глубокие ткани и внеклеточная транслокация бактерий в кровяное русло, либо свободно находящихся в циркуляции, либо прикрепленных к поверхности моноцитов. Если S. pneumonia, S. uberis, S. faecalis, S. Zooepidemicus, присутствующие в крови, не вызывают септицемию со смертельным исходом, то стрептококкоз может перейти в третью стадию, включающую проникновение в органы хозяина, в основном путем преодоления гематоэнцефалического барьера, чтобы получить доступ к центральной нервной системе (ЦНС) и вызывать менингит. Четвертая стадия – воспаление, которое имеет связующую роль в патогенезе как системных инфекций, так и инфекций ЦНС. Патоген может индуцировать перепроизводство провоспалительных цитокинов, вызывающих септический шок, или привлечение и активацию различных популяций лейкоцитов, вызывая острое воспаление ЦНС [4, 5, 6].
На всех стадиях патогенного процесса S. pneumonia, S. uberis, S. faecalis , S. zooepidemicus взаимодействует со многими типами иммунокомпетентных клеток хозяина, такими как полиморфноядерные лейкоциты, мононуклеарные макрофаги, лимфоциты, дендритные клетки и микроглия, используя ряд универсальных факторов вирулентности для уклонения от врожденной и адаптивной иммунной защиты хозяина, и для преодоления экологического стресса [7, 8, 9].
Частота встречаемости, тяжесть клинических проявлений стрептококкоза свиней, а также распространенность видов стрептококков, устойчивых к антимикробным агентам, несмотря на проводимую интенсивную антибактериальную терапию, определяют необходимость постоянного мониторинга возбудителей и расширения исследований по повешению эффективности лечения и специфической профилактики стрептококкоза свиней в Краснодарском крае. [7,8,10].
Целью проведения исследований явилась необходимость дифференциации видовой принадлежности и серогрупповой вариабельности стрептококков, выделяемых от свиней и их патогенность.
Материал и методы исследований.
Исследования проводились на базе
Кропоткинской краевой ветеринарной лаборатории. Были применены микроскопические, культуральные и биологические методы исследований. Материалом для лабораторных исследований служили: влагалищные смывы от заболевших свиноматок, смывы из носовых ходов и трупы поросят в возрасте от 1 до 4 месяцев, павших от стрептококкоза. Для определения видов стрептококков использовали СТРЕПТОтест 16, предназначенный для биохимической идентификации стрептококков. Данный набор позволяет проводить до 60-ти определений по 16-ти биохимическим тестам с возможностью визуальной и автоматизированной оценки результатов биохимических реакций по идентификационной таблице. Для установления серогрупповой принадлежности стрептококков использовали стрептококковые групповые преципитирующие сыворотки ФГБУ ВГНКИ. Определение патогенности стрептококков проводили на трех белых беспородных мышах 15-16 г. Для заражения использовали 18-часовые культуры стрептококков. Культуру в объеме 0,5 мл вводили внутрибрюшинно.
Результат исследований.
Возбудители болезни относятся к роду Streptococcus, который включает более 20 серологических групп стрептококков, различающихся антигенными свойствами.
Кроме стрептококков от животных часто выделяли другие грамположительные кокки. Для первичной дифференциации использовали характерные признаки в соответствии с рекомендациями (Таблица 1).
Результаты, полученные при проведении лабораторных диагностических исследований патматериала, поступавшего в Кропоткинскую краевую ветеринарную лабораторию за последние четыре года (с 2019 по 2022гг.), свидетельствуют о высокой частоте обнаружения стрептококков (Таблица 2).
Таблица 1 – Отличительные особенности родов семейства Streptococcaceae
|
Наименование рода |
Характерные признаки |
|
Streptococcus |
Клетки делятся в одной плоскости. Глюкозу ферментируют до образования молочной кислоты без выделения углекислого газа |
|
Leuconostoc |
Клетки делятся в одной плоскости. Глюкозу ферментируют с образованием углекислого газа |
|
Pediococcus |
Клетки делятся в двух плоскостях, образуя тетрады. Глюкозу ферментируют до образования молочной кислоты без выделения углекислого газа. |
|
Aerococcus |
Клетки делятся в двух плоскостях, образуя тетрады. Глюкозу ферментируют до образования молочной кислоты без выделения углекислого газа. |
|
Gemella |
Клетки делятся в одной плоскости. По Граму окрашиваются негативно. |
Таблица 2 – Статистические данные по стрептококкозу свиней в Краснодарском крае за 2019-2022гг
|
Год |
Количество проб патматериала |
Проведено исследований |
Получено положительных результатов |
||
|
Микроскопических |
Бактериологических |
Биологических |
|||
|
2019 |
33 |
33 |
13 |
4 |
14 |
|
2020 |
36 |
36 |
36 |
9 |
12 |
|
2021 |
40 |
40 |
40 |
8 |
15 |
|
2022 |
15 |
15 |
15 |
5 |
3 |
Высевы из патологического материала делали пастеровской пипеткой в мясо-пептонный бульон с 1 % глюкозы и 10 % инактивированной нормальной сывороткой лошади и на мясо-пептонный агар с 1 % глюкозы и 5-10 % дефебринированной крови барана. Посевы инкубировали в термостате при 37 °С в течение 19 часов. На глюкозо- кровяном агаре стрептококки росли в виде мелких, прозрачных и слегка мутноватых колоний, которые были окружены зоной гемолиза.
S. pneumonia - круглые, плоские, полупрозрачные колонии, диаметром 0,50,8 мкм. Иногда встречались мукойдные колонии – они были более крупные, слизистой консистенции. На сывороточноглюкозном бульоне росли с равномерным помутнением среды с образованием осадка (Рисунок 1).
-
S. uberis - на кровяном агаре формировал колонии: крупные, блестящие, вязкие, с неровными краями, прозрачные,
матовые, мелкие, диаметром 0,1-0,2 мм. На сывороточно-глюкозном бульоне росли с равномерным помутнением.
-
S. zooepidemicus – образовывал мелкие колонии, блестящие, вязкие, в виде капли воды, серые, диаметром 0,1-0,3 мм.
-
S. faecalis – колонии округлой формы, с ровными краями, диаметр 1,52 мм, с красноватым оттенком (Рисунок 2). При выделении стрептококков серологической группы Д определяли разновидность энтерококков. Для этого использовали среду с теллуритом калия или энтерококковую дифференциальнодиагностическую среду.
Культура S. faecalis устойчива к теллуриту калия (0,07 %) и хорошо растет на плотной среде в его присутствии, образуя колонии черного цвета. На дифференциально-диагностической среде через 15 ч роста колонии S. faecalis приобретают вишнево-красный цвет.
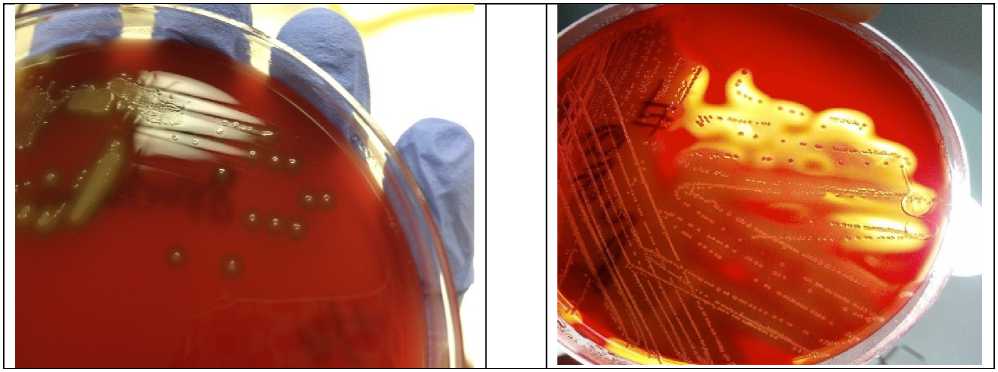
Рисунок 1 – S. pneumonia
Рисунок 2 – S. faecalis
Таблица 3 – Виды стрептококков, выделенные от свиней в Краснодарском крае за 2019- 2022гг
|
Год |
Район |
Исследовано проб |
Исследуемый материал |
Вид и частота выделения стрептококков |
|
2019 |
Усть-Лабинский |
3 |
Смывы из влагалища свиноматок |
S. uberis 3 |
|
г. Краснодар |
8 |
Смывы из влагалища свиноматок, трупы поросят, носовые смывы |
S. pneumonia 4, S. uberis 2, S. faecalis 2 |
|
|
Новопокровский |
3 |
Смывы из влагалища свиноматок, носовые смывы |
S. uberis 2, S. pneumonia 1 |
|
|
2020 |
Выселковский |
6 |
Носовые смывы |
S. pneumonia 6 |
|
г. Краснодар |
6 |
Смывы из влагалища свиноматок |
S. uberis 6 |
|
|
2021 |
г. Краснодар |
15 |
Носовые смывы, трупы поросят |
S. pneumonia 13 S. zooepidemicus2 |
|
2022 |
г. Краснодар |
3 |
Носовые смывы, трупы поросят |
S. uberis 1, S. pneumonia 2 |
Таблица 4 – Идентификационная таблица СТРЕПТОтест 16
|
Показатель |
Ряд1 |
STREPTOtest 16 |
s 9 s s И s |
|||||||||||||||||
|
Ряд 2 |
||||||||||||||||||||
|
Серогруп па |
s щ к |
pi >н Рн |
Н Рн > |
H |
G |
F |
E |
D |
C |
B |
A |
H |
G |
F |
E |
D |
C |
B |
A |
|
|
(Z) ж |
p. < H— |
Pi о |
< |
о < |
Щ Pi |
i |
Pi c |
Щ Pi H |
< H- |
< Pi |
i |
p: 2 |
m C^ |
|||||||
|
A |
+ |
+ |
– |
– |
+ |
+ |
(–) |
– |
– |
+ |
– |
– |
– |
+ |
+ |
– |
– |
– |
– |
S.pyogenes |
|
B |
(+) |
– |
+ |
+ |
+ |
+ |
d |
– |
– |
+ |
– |
– |
– |
(+) |
d |
– |
– |
– |
(+) |
S.agalactiae |
|
C |
– |
– |
– |
– |
+ |
+ |
+ |
– |
– |
+ |
– |
– |
d |
+ |
+ |
– |
– |
– |
+ |
S.dysgalactiae |
|
C |
+ |
– |
– |
– |
+ |
+ |
+ |
– |
– |
+ |
– |
– |
– |
– |
– |
– |
– |
– |
– |
S.equi subsp. equi |
|
C |
+ |
– |
– |
– |
+ |
+ |
+ |
– |
(–) |
+ |
– |
– |
+ |
– |
+ |
– |
– |
– |
(+) |
S.equi subsp. zooepidemicus |
|
C |
+ |
– |
– |
– |
+ |
+ |
(+) |
– |
(–) |
+ |
– |
– |
– |
+ |
d |
– |
– |
– |
+ |
S.equisimilis |
|
G |
+ |
– |
– |
– |
+ |
+ |
(–) |
d |
d |
+ |
– |
– |
– |
(–) |
(+) |
– |
– |
– |
+ |
S.group G |
|
L |
+ |
– |
– |
d |
+ |
+ |
+ |
– |
– |
+ |
– |
– |
– |
+ |
(+) |
– |
– |
– |
+ |
S.group L |
|
E, P, U, V |
+ |
– |
+ |
+ |
+ |
+ |
+ |
d |
+ |
+ |
– |
+ |
(+) |
+ |
d |
– |
– |
– |
(+) |
S.porcinus |
|
R, S, RS, T |
– |
d |
– |
– |
– |
+ |
+ |
(+) |
(+) |
+ |
– |
– |
– |
+ |
+ |
d |
d |
– |
– |
S.suis |
|
F, C, (G, A) |
d |
– |
+ |
– |
+ |
+ |
– |
d |
+ |
+ |
– |
(–) |
– |
+ |
(+) |
d |
– |
(–) |
– |
S.anginosus |
|
F (C, G) |
d |
– |
+ |
– |
+ |
+ |
– |
– |
– |
+ |
– |
– |
– |
(+) |
(–) |
– |
– |
d |
– |
S.constellatus |
|
F, C (G) |
d |
– |
+ |
– |
+ |
+ |
– |
– |
+ |
+ |
– |
– |
– |
+ |
+ |
– |
– |
– |
– |
S.intermedius |
|
– |
– |
+ |
– |
– |
+ |
– |
(+) |
+ |
– |
– |
+ |
+ |
+ |
+ |
(+) |
(+) |
+ |
– |
S.mutan s“group” |
|
|
– |
– |
+ |
– |
d |
+ |
– |
– |
+ |
– |
d |
– |
– |
d |
d |
(+) |
d |
– |
– |
S.salivarius |
|
|
– |
– |
+ |
– |
– |
+ |
– |
– |
d |
– |
+ |
– |
– |
– |
(+) |
– |
– |
– |
– |
S.vestibularis |
|
|
D |
– |
– |
+ |
– |
– |
+ |
– |
d |
+ |
– |
– |
+ |
– |
+ |
+ |
+ |
(+) |
d |
– |
S.bovis I |
|
D |
– |
– |
+ |
– |
– |
+ |
– |
+ |
+ |
– |
– |
– |
– |
(–) |
+ |
+ |
d |
(+) |
– |
S.bovis II/1 |
|
D |
– |
– |
+ |
– |
– |
+ |
d |
(+) |
+ |
– |
– |
– |
– |
+ |
+ |
d |
(–) |
d |
– |
S.bovis II/2 |
|
D |
– |
– |
+ |
– |
– |
+ |
– |
– |
+ |
– |
– |
(–) |
– |
(–) |
d |
(–) |
(–) |
d |
– |
S.equinus |
|
E |
– |
(–) |
+ |
+ |
d |
+ |
+ |
(–) |
+ |
+ |
– |
+ |
+ |
+ |
+ |
(–) |
+ |
– |
+ |
S. uberis |
|
E |
– |
(–) |
+ |
d |
d |
+ |
(–) |
(–) |
+ |
+ |
– |
+ |
+ |
+ |
+ |
(–) |
(–) |
– |
(+) |
S.parauberis |
|
– |
(–) |
– |
+ |
d |
+ |
d |
– |
– |
(–) |
– |
d |
– |
(+) |
(+) |
– |
– |
– |
(–) |
S.acidominimus |
|
|
– |
(–) |
– |
– |
– |
+ |
– |
(+) |
(–) |
d |
– |
– |
– |
+ |
+ |
(+) |
d |
– |
– |
S.pneumoniae |
|
|
– |
– |
– |
– |
d |
+ |
– |
d |
– |
+ |
– |
– |
(–) |
– |
+ |
d |
– |
d |
– |
S.mitis 2 |
|
|
– |
– |
– |
– |
d |
+ |
– |
d |
– |
– |
– |
– |
– |
(–) |
+ |
d |
– |
d |
– |
S.oralis / mitis 1 |
|
|
– |
– |
– |
– |
– |
+ |
– |
d |
+ |
+ |
– |
– |
(–) |
(+) |
+ |
d |
(+) |
d |
– |
S.sanguis esl+ |
|
|
– |
– |
– |
– |
– |
+ |
– |
+ |
– |
+ |
– |
– |
– |
(+) |
+ |
– |
(+) |
– |
– |
S.sanguis esl– |
|
|
– |
– |
– |
– |
+ |
+ |
– |
d |
+ |
+ |
– |
– |
– |
+ |
(+) |
d |
(+) |
d |
– |
S.gordonii |
|
|
– |
d |
(–) |
(+) |
– |
– |
(–) |
d |
(+) |
– |
– |
d |
(–) |
+ |
(+) |
d |
(–) |
– |
d |
Aerococcus viridans |
|
Пояснения:
|
+ = положительная реакция |
d = вариабельная реакция |
– =отрицательная реакция |
|
-+) = большей частью положительная реакция |
( – ) = большей частью отрицательная реакция |
|
|
HEM = β-гемолиз |
PYR = пирролидонилариламидаза (ПИРАтест) |
VPT = ацетон (VPtest) |
Примечание: для зеленящих стрептококков в случае неоднозначной идентификации можно проводить идентификацию до:
S. salivarius group = S. salivarius, S. vestibularis; S. milleri group = S. anginosus, S.
constellatus, S. intermedius; S. sanguis group = S. sanguis, S. gordonii; S. mitis group = S. mitis, S. oralis; (RUOFF, K. L. 1995. Streptococcus, p. 299–307. In: P.R. Murray et al. (ed.), Manual of Clinical Microbiology, 6th ed. ASM, Washington
Streptococcus uberis является экологическим патогеном, ассоциированным с субклиническим и клиническим маститом, как у лактирующих, так и у нелактирующих коров, который может сохраняться в вымени и вызывать хроническую инфекцию в молочной железе [1, 7, 10].
Эталонный штамм S. uberis 0140J является условно-патогенным микроорганизмом, который может адаптироваться к различным экологическим нишам благодаря своей питательной гибкости. Этот вездесущий микроорганизм был выделен из кожи, губ и миндалин коров, в полости рта, рубце, прямой кишке и дыхательных путях, на коже сосков и каналах, а также в инфицированном вымени и фекалиях [2, 3, 10]. S. uberis также может быть выделен из окружающей коровы среды в виде отработанного молока, воды для очистки, подстилки для пастбищ и амбаров. Все это является основным источником инфекции. Коровы выделяют S. uberis со своими фекалиями через слизистые оболочки пищеварительного тракта, что может объяснить широкое распространение и поддержание этого патогена в молоке. Участки рядом с доильным залом богаты органическими веществами (фекалиями, молоком), которые могут попадать на вымя. Когда сосковые каналы открыты, фекальное загрязнение вымени может способствовать проникновению микроорганизмов [3, 10, 12].
Более того, патоген распространяется в слизистых оболочках полости рта и губ при облизывании шерсти и эпидермиса других коров. S. uberis может сохраняться в результате фекальноорального цикла передачи. До сих пор роль микробиоты молочной железы крупного рогатого скота во взаимодействии хозяин– патоген была плохо изучена, и в основном во время инфекционного процесса. У здоровых лактирующих коров исследовали микробный состав и разнообразие из фекалий, молока и лейкоцитов крови [3, 10, 11]. Для определения видовой принадлежности проведены биохимические исследования выделенных культур стрептококков. Продуцирование сероводорода, аммиака и индола определяли с использованием индикаторных бумажек при инкубации стрептококков в МПБ с добавлением 0,2 % глюкозы.
Для определения сахаролитических свойств стрептококков, исследуемые культуры засеяли на специальные питательные среды Гисса. Использовали питательные среды с 12 углеводами и спиртами: раффиноза, ксилоза, сахароза, галактоза, мальтоза, декстроза, глюкоза, маннит, дульцит, лактоза, арабиноза, инулин. Результаты видовой принадлежности стрептококков представлены в таблице 3.
Для идентификации видового состава стрептококков применяли таблицу СТРЕПТОтест 16 (Таблица 4).
Таблица 5 – Результаты постановки реакции преципитации со стрептококками
|
Серологическая группа стрептококков |
Патматериал |
Частоты выделений, % |
|
B |
Смывы из влагалища свиноматок |
17 |
|
C |
- |
- |
|
E |
- |
- |
|
G |
Смывы из влагалища свиноматок; Носовые смывы, трупы поросят |
58 |
|
D |
- |
- |
|
I |
Носовые смывы, трупы поросят |
15 |
|
R |
Носовые смывы, трупы поросят |
10 |
|
S |
- |
- |
Серогрупповую принадлежность стрептококков определяли в реакции преципитации в капиллярах, с преципитирующей сывороткой, по методике ФГБУ ВГНКИ (Таблица 5).
Определение патогенности стрептококков проводили на трех белых беспородных мышах массой 15-16 г. для каждой установленной серогруппы стрептококков. Для заражения использовали 18-часовые культуры стрептококков. Культуру в объеме 0,5 мл вводили внутрибрюшинно. Культуру признают патогенной при гибели не менее двух мышей.
При заражении патогенной культурой стрептококков мыши погибали в течение 1-2 суток (Таблица 6).
Таблица 6 – Результаты постановки биопробы различными серологическими группами стрептококков на белых мышах
|
Серологическая группа |
Гибель мышей, сутки |
Микроскопия мазка печени мышей по Граму |
|
|
1 сутки |
2 сутки |
||
|
B |
- |
+ |
+ |
|
G |
+ |
- |
+ |
|
I |
+ |
- |
+ |
|
R |
- |
+ |
+ |
Из органов павших мышей готовили мазки, окрашивали по Граму, микроскопировали под иммерсионной системой при увеличении х 100.
Заключение. Использование комплексной лабораторной диагностики, включающей в себя бактериологический, серологический, биохимический и биологический методы исследований при стрептококкозе свиней позволили определить виды, серогрупповую принадлежность и патогенность стрептококков, циркулирующих у свиней в Краснодарском крае. Кроме того, впервые в значительном количестве проб патматериала удалось выявить от свиней S. uberis, ранее не являющийся эпизоотически значимым видом стрептококков , который ранее считался причиной маститов у крупного рогатого скота.
Резюме
Использование комплексной лабораторной диагностики, включающей в себя бактериологический, серологический, биохимический и биологический методы исследований при стрептококкозе свиней позволили определить виды, серогрупповую принадлежность и патогенность стрептококков, циркулирующих у свиней в Краснодарском крае. При исследовании патматериала от свиней (свиноматок; носовые смывы, трупы поросят) были выделены S. pneumonia, S. zooepidemicus, S. faecalis и впервые S. uberis . При определении серогрупповой принадлежности стрептококков в реакции преципитации установили, что в основном среди свиней Краснодарского края циркулируют патогенные варианты серологических групп: B, G, I, R.
Список литературы Видовая принадлежность и серогрупповая вариабельность стрептококков, выделяемых от свиней в Краснодарском крае
- Панин, А. Н. Методика и условия постановки реакции коагглютинации для определения серогрупповой принадлежности стрептококков / А.Н. Панин, В. К. Астафьева // Всесоюзная научная конференция: Совершенствование методов государственного контроля ветеринарных препаратов – 1991. – С.168-170.
- Рыжакина, Е. А. Лабораторная диагностика стрептококковых инфекций животных: Методические указания / Е. А. Рыжакина // Вологда – Молочное: Вологодская ГМХА – 2016. – 19 с.
- Терехов, П. Ю. Стрептококкозы свиней / П. Ю. Терехов, А. В. Капустин // Труды Всероссийского НИИ экспериментальной ветеринарии им. Я.Р. Коваленко – 2019. – С. 27-34.
- Толстова, Е. А. Особенности диагностики и терапии стрептококкоза свиней, осложненного РРСС на племенной ферме / Е. А. Толстова, В. А. Агольцов, Л. П. Падило // Научная жизнь – 2022. – Том 17. – Выпуск 1 – С. 157-166.
- Толстова, Е. А. Особенности диагностики и терапии стрептококкоза свиней на племенной ферме / Е. А. Толстова, В. А. Агольцов, О. М. Попова // Проблемы и пути развития ветеринарной и зоотехнической наук Международная научно-практическая конференция обучающихся, аспирантов и молодых ученых, посвященная памяти Колесова А.М. // Саратовский источник – 2022. – С.123-130.
- Толстова, Е. А. Диагностика, терапия и специфическая профилактика стрептококкоза свиней, осложненного пастереллезом и микоплазмом / Е. А. Толстова, М. М. Лигидова, Л. П. Падило, А. М. Семиволос, В. А. Агольцов // Аграрный научный журнал – 2022. – №1 – С.71-75.
- Шевченко, А. А. Рекомендации по лабораторной диагностике стафилококкозов и стрептококкозов животных / А. А. Шевченко, О. Ю. Черных, В. Н. Шевкопляс, Л. В. Шевченко // Краснодар: КубГАУ – 2008. – 31с.
- Эпизоотология с микробиологией: учебник для вузов / А. С. Алиев, Ю. Ю. Данко, И. Д. Ещенко [и др.] – Санкт-Петербург: Лань, 2022. – 432с. – ISBN 978-5-507-44161-7.
- Amaro, R. Development and characterization of a new swine model of invasive pneumococcal pneumonia / R. Amaro, G. Li Bassi, A. Motos, L. Fernandez-Barat // Lab Anim (NY). – 2021 – Nov;50(11) – P. 327-335.
- Fessia, A. S. Potential factors involved in the early pathogenesis of Streptococcus uberis mastitis: a review / A. S. Fessia, L. M. Odierno // Folia Microbiol (Praha). – 2021 – Aug; 66(4) – P. 509-523.
- Costa, M. O. Streptococcus equi subsp. zooepidemicus infection of pigs leads to shedding in faeces and a carrier state / M. O. Costa, J. C. S. Harding, Y. Huang, R. Nosach // Transbound Emerg Dis. – 2022 – Sep;69(5) – P.1503-1509
- Chen, X. Genetic characterization of Streptococcus equi subspecies zooepidemicus associated with high swine mortality in the United States / X. Chen, N. Resende-De-Macedo, P. Sitthicharoenchai, O. Sahin [et al.] // Transbound Emerg Dis. – 2020 – Nov. 67(6) – P. 2797-2808.


