Видовой спектр микробиоты молока у здоровых коров и животных с маститом имеет различия
Автор: Масленникова И.Л., Михайловская В.С., Афанасьевская Е.В., Жданова И.Н., Кузнецова М.В.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Ветеринарная микробиология
Статья в выпуске: 6 т.59, 2024 года.
Бесплатный доступ
Мастит остается наиболее распространенным заболеванием коров как в России, так и в других странах с интенсивным молочным производством, несмотря на различные программы по профилактике и борьбе с инфекциями в животноводстве. Многочисленные исследования показали, что острая форма мастита встречается у 10-25 % животных, частота субклинической формы достигает 50 %. Этиология мастита чрезвычайно разнообразна: патогенные и условно-патогенные возбудители могут быть представлены индигенной микробиотой, но, как правило, бактерии попадают в сосковый канал молочной железы при ее экзогенном инфицировании. Методологии и результаты исследования микробного спектра молока здоровых и больных животных варьируются в результатах разных исследовательских групп. В представленной работе бактериологическим методом оценена обсемененность молока здоровых коров и коров с маститом, определены доминантные возбудители мастита и их некоторые биологические свойства, а в рамках отдельной задачи проведен анализ микробного разнообразия методом газовой хроматографии-масс-спектрометрии (ГХ-МС). Здоровых коров и животных с маститом (с клинической формой заболевания) отбирали в крупном агропромышленном комплексе (Пермский край), специализирующемся на разведении молочного крупного рогатого скота и производстве сырого молока. Все животные голштинской породы (n = 45, привязное содержание), возраст 2-5 лет, физиологический статус: период сухостоя, I, II и III фазы лактации. Бактериальная обсемененность исследованных проб, полученных от коров с маститом и здоровых животных, составила 100 %. Наиболее распространенными, как в монокультуре, так и в составе ассоциаций в обеих группах были бактерии рода Staphylococcus и Escherichia coli. Эшерихии достоверно (р 0.05). В то же время анализ микробного разнообразия с помощью многомерного неметрического шкалирования показал, что в пробах от здоровых животных видовой состав микроорганизмов существенно варьировался, в то время как микробиота молока у коров с проявлениями мастита имела сходство. Кроме того, степень микробного разнообразия молока среди здоровых животных снижалась в более поздние фазы лактации. Определенные бактериологическим методом доминантные возбудители мастита - Е. coli и представители рода Staphylococcus также детектировали методом ГХ-МС, но их доли в общем спектре микроорганизмов были незначительными: у животных с маститом в период сухостоя представленность эшерихий и стафилококков не превышала соответственно 0,16 и 2,50 %, у лактирующих коров с маститом - 0,35 и 2,05 %. Учитывая многочисленные функции микроорганизмов в биотопе, а также возможное участие представителей индигенной микробиоты в патогенезе маститов, полагаем, что на предприятиях молочного животноводства может применяться метод ГС-МС, позволяющий учитывать полный микробный профиль секрета вымени как признак, характеризующий здоровье животных. Таким образом, при проведении комплексных эпизоотических исследованиях в животноводческих хозяйствах и текущем микробиологическом мониторинге целесообразно использовать бактериологический метод, тогда как метод ГХ-МС может быть применен для оценки качества продукции и углубленных исследований прогностического характера.
Мастит, масс-спектрометрия, крупный рогатый скот, микробный спектр молока, бактериологический метод, газовая хроматография
Короткий адрес: https://sciup.org/142244131
IDR: 142244131 | УДК: 619:636.2.034:579.62 | DOI: 10.15389/agrobiology.2024.6.1204rus
Текст научной статьи Видовой спектр микробиоты молока у здоровых коров и животных с маститом имеет различия
Мастит остается наиболее распространенным заболеванием коров молочных пород как в России, так и в других странах с интенсивной молочным производством, несмотря на различные программы по профилактике и борьбе с инфекциями в животноводстве (1, 2). Заболевания наносят значительный экономический ущерб сельскохозяйственным предприя-
∗ Исследование выполнено при финансовой поддержке Правительства Пермского края в рамках научного проекта ¹ С-26/541.
тиям вследствие снижения продуктивности и общего благополучия животных (3-5). Учитывая, что употребление молока, содержащего микроорганизмы или их токсины, может приводить к пищевым отравлениям, проблема имеет не только ветеринарный, но и медицинский аспект. Сегодня предъявляются высокие требования как в отношении надлежащего благополучия сельскохозяйственных животных, так и в отношении качества и безопасности пищевых продуктов, что необходимо учитывать при проведении микробиологического контроля на предприятиях молочного животноводства (6, 7).
Известно, что в молоке здоровых коров присутствуют многочисленные микробные сообщества (8, 9). Аборигенная микробиота при должном содержании животного, как правило, не вызывает инфекционного процесса в молочной железе и не влияет на качество молочных продуктов. При неудовлетворительном санитарно-гигиеническом состоянии вымени в технологическом процессе доения или отсутствии профессиональной работы специалистов по профилактике маститов возникает воспаление молочной железы, связанное с эндогенной инфекцией, либо, что встречается чаще, имеет место экзогенное инфицирование (10). Мастит крупного рогатого скота —комплексное заболевание, которое развивается вследствие сильной воспалительной реакции в сосковом канале, обусловленной патогенными или условно-патогенными бактериями (1). Формы заболевания могут быть различными, поскольку мастит вызывают представители более чем 140 видов микроорганизмов (11). С учетом тяжести болезни возбудителей маститов традиционно делят на основных и второстепенных (8, 10). Результаты метаанализа, проведенного P. Krishnamoorthy с соавт. (12), показали, что в молоке коров с маститом часто присутствовали следующие микроорганизмы: Staphylococcus aureus , коагулазонегативные виды Staphylococcus spp . , Escherichia coli , Streptococcus agalactiae и Streptococcus uberis . Согласно данным некоторых авторов, в зависимости от пути инфицирования маститы разделяют на контагиозные и экологические (1). Этиопатогены контагиозных» маститов, например Staphylococcus aureus, передаются животным во время доения через руки работников или доильные аппараты. Возбудители экологических маститов, среди которых основными являются условно-патогенные E. coli , попадают в сосковый канал из окружающей среды, вызывая гнойно-септические процессы. При любом типе инфицирования животного успешное лечение мастита зависит от раннего выявления и корректной идентификации возбудителя (6, 13).
Встречаемость и видовой состав возбудителей маститов крупного рогатого скота существенно различаются в разных странах и даже в пределах одного региона, что связано, в первую очередь, с особенностями технологии и условиями содержания животных, а также с частотой проведения санитарно-гигиенических мероприятий на сельскохозяйственных предприятиях (14-17). Кроме того, за последние десятилетия на молочных фермах произошли значительные структурные изменения — увеличился размер стада, применяются автоматизированные доильные системы (18-21), что также может сказываться на распространенности, доминирующих клинических формах и этиологии маститов.
В представленной работе бактериологическим методом оценена об-семененность молока здоровых коров и животных с маститом, определены доминантные возбудители мастита и их биологические свойства. Впервые проведен анализ микробного состава молока методом газовой хроматографии—масс-спектрометрии. Выявлено, что микробиота молока у коров с признаками мастита имела существенное сходство, что, по-видимому, свя- зано с доминированием этиопатогенов, которые конкурентно ингибируют присутствие минорных бактерий-ассоциантов. Последнее, в свою очередь, приводит к снижению микробного разнообразия по сравнению со здоровыми животными.
Цель исследования — оценка обсемененности молока здоровых и маститных коров, определение доминантных возбудителей мастита и их биологической характеристики. В рамках отдельной задачи выполнен анализ микробного состава молока методом газовой хроматографии—масс-спектрометрии.
Методика . Отбор животных. Здоровых коров и животных с маститом (с клинической формой заболевания) отобрали на крупном сельскохозяйственном предприятии (Пермский край), специализирующемся на разведении молочного крупного рогатого скота и производстве сырого молока. Все животные были голштинской породы, возраст 2-5 лет, тип содержания привязный. Физиологический статус коров следующий: период сухостоя, лактация I фаза (10-100 сут после родов), лактация II фаза (101200 сут после родов), лактация III фаза (201-305 сут после родов).
Отбор проб молока. Образцы молока от больных маститом (п = 25) и здоровых ( n = 20) коров были собраны в апреле-июле 2022 года. Пробы молока отбирали во время утренней дойки. Перед отбором проб оборудование и вымя дезинфицировали.
Бактериологический метод. Пробы исследовали согласно «Методическим указаниям по бактериологическому исследованию молока и секрета вымени сельскохозяйственных животных» (Минск, 2008). Сразу после доставки материала в лабораторию проводили посев на мясопептонный агар с 5 % цитратной кровью и дифференциально-диагностические среды (желточно-солевой агар, агар Мак-Конки, цетримидный агар, агар Сабуро). Посевы инкубировали в термостате при температуре 37 °С в аэробных условиях в течение 24 ч. Бактерии идентифицировали с помощью диагностических тест-систем ENTEROtest 16, STAPHYtest 16 и NEFERMtest 24 («Erba Lachema s.r.o.», Чехия) согласно рекомендациям производителя. Определяли индекс встречаемости таксонов С (%), который рассчитывали по формуле: С = р х 100/ Р , где р — число проб, в которых обнаружены микроорганизмы исследуемого вида, Р — общее число проанализированных проб. В зависимости от значений С микроорганизмы подразделяли на доминантные, или постоянные ( С > 50 %), редкие, или добавочные (25 % < С < 50 %) и эпизодически встречающиеся, или случайные ( С < 25 %).
Выделение ДНК и типирование культур. Образцы тотальной ДНК для ПЦР-анализа готовили следующим образом. Одну микробиологическую петлю биомассы бактерий переносили в микропробирки объемом 500 мкл, суспендировали в 100 мкл стерильной дистиллированной воды, прогревали при 97 °С в течение 10 мин в твердотельном термостате Термит (ООО «ДНК-Технология», Россия) и центрифугировали (MiniSpin, «Eppendorf», Германия) 10 мин при 13 тыс. об/мин. Для стафилококков процедуру проводили 3-кратно, каждый раз замораживая пробу при -18 °С. Бесклеточные супернатанты использовали для дальнейших исследований немедленно или после замораживания при -18 °С.
Культуры, выделенные из молока больных маститом и здоровых коров, были проверены на генетическое разнообразие с помощью rep-ПЦР (Enterobacterial Repetitive Intergenic Consensus ) с праймерами ERIC1/2 (ООО «Синтол», Россия) в соответствии с описанием (22).
Детекция генов патогенности. Штаммы E. coli проанализи- ровали методом ПЦР по конечной точке на присутствие 15 ассоциированных с вирулентностью генов, кодирующих адгезины (afa/draBC, fimH, papC), токсины (hlyA, hlyF, eltA, estI, estII, stx1, stx2, subAB, cnf1) и факторы устойчивости к системам защиты макроорганизма (iss, ompT, kpsMTII). Использовали рекомендуемые праймеры и условия ПЦР-амплификации (23, 24). Амплификацию проводили в 25 мкл реакционной смеси (реагенты производства ООО «Синтол», Россия) на термоциклере DNA Engine Dyad Thermal Cycler («Bio-Rad», США). Визуализацию полос и документирование данных осуществляли с помощью системы гель-документации Gel-DocXR («Bio-Rad», США).
Определение чувствительности к антибиотикам и гемолитической активности. Штаммы E. coli были проверены диско-диффузионным методом с использованием агара Мюллера-Хинтон (ФБУН ГНЦ ПМБ, г. Оболенск, Россия) и дисков (НИЦФ, г. Санкт-Петербург) на чувствительность к 16 антибиотикам: бета-лактамам (ампициллин, цефа-золин, цефоперазон, цефоперазон с сульбактамом, цефтриаксон, цефепим, меропенем, имипенем, азтреонаму), аминогликазидам (амикацин, гентамицин), фторхинолонам (ципрофлоксацин, левофлоксацин, норфлоксацин), тетрациклину и хлорамфениколу. Культуры стафилококков тестировали на чувствительность к 14 антибиотикам: бета-лактамам (бензилпенициллин, ампициллин, оксациллин), эритромицину, клиндамицину, ванкомицину, рифампицину, аминогликазидам (гентамицин, тобрамицин), фтор-хинолонам (ципрофлоксацин, моксифлоксацин, тетрациклин, хлорамфеникол), фузидиевой кислоте. Результаты интерпретировали в соответствии с клиническими рекомендациям «Определение чувствительности микроорганизмов к антимикробным препаратам» (МАКМАХ, Версия-2018-03).
Гемолитическую активность культур оценивали при посеве штрихом на 5 % кровяной агар («Биомед», филиал ФГУП «Микроген», Россия). О наличие гемолитической активности судили по просветлению среды вокруг штриха.
Газовая хроматография—масс-спектрометрия. Определение количественного и качественного состава микробиоты в секрете вымени коров выполняли с помощью ГХ–МС микробных маркеров на газовом хроматографе с масс-спектрометрическим детектором («Agilent Technologies», США). Липидные компоненты молока коров (аликвота 1 мл) экстрагировали методом кислого метанолиза в 0,4 мл 1 М NaCl в метаноле в течение 1 ч при 80 °С. Полученный экстракт высушивали при 80 °С. Сухой остаток обрабатывали 20 мкл N,O-бис(триметилсилил)-трифторацет-амида в течение 15 мин, далее 1-2 мкл полученной реакционной смеси разбавляли гексаном и вводили в инжектор хромато-масс-спектрометра. Для количественных измерений в качестве внутреннего стандарта добавляли гексановый раствор дейтерометилового эфира тридекановой кислоты. Для анализа использовали кварцевую капиллярную колонку HP-5ms. Хроматографирование проводили в режиме программирования температуры от 130 до 320 °С со скоростью 5 °С/мин. Температура инжектора 280 °С, интерфейса — 250 °С. Полученные хроматограммы анализировали с помощью штатной программы обработки данных и формировали отчет о реконструированном по маркерам составе микробного сообщества (25).
Статистическая обработка результатов включала расчет среднего арифметического (M) и среднеквадратичного отклонения (±SD) с помощью программы Microsoft Excel. Достоверность различий оценивали по t-критерию Стьюдента, тесту Манна-Уитни (W-test). Различия считали статистически значимыми при p < 0,05. Разнообразие видов в пробах молока оценивали методом многомерного неметрического шкалирования. Статистическую обработку данных и построение графиков проводили с использованием стандартных пакетов программ Microsoft Office XP Excel и STATISTICA 10.
Ðåçóëüòàòû . Микробная обсемененность молока при оценке бактериологическим методом и определение доминантных возбудителей мастита. Бактериальная обсемененность исследованных 45 проб от коров с маститом и здоровых животных составила 100 %. Всего было выделено 86 культур: 36 — из молока здоровых и 50 — из молока больных маститом коров. В результате исследования детектировали микроорганизмы, преимущественно принадлежащие к родам Escherichia , Staphylococcus , Enterococcus , Citrobacter , Proteus . В пробах молока как здоровых, так и маститных коров наиболее распространенными были представители Escherichia coli и Staphylococcus spp. Бактерии таксономических групп Cit-robacter , Proteus , Serratia , Burkholderia , Streptococcus принадлежали к эпизодически встречающимся (случайным). В секрете вымени здоровых коров наиболее распространенными оказались микроорганизмы рода Staphylococcus , обнаруженные в 70 % образцов, при этом все выделенные стафилококки относились к группе коагулазонегативных (табл.). В пробах, полученных от больных маститом коров, доминировали культуры E. coli (80 %) и Staphylococcus spp. (68 %). Бактерии Enterococcus выявлены в 16 % проб, в двух пробах обнаружены микроорганизмы Streptococcus spp. и Burkholderia cepacia complex, в единичных случаях — Serratia marcescens и Proteus mirabi-lis . Большинство выделенных стафилококков относились к коагулазонегативным, и только в одной пробе был обнаружен S. aureus . Важно отметить, что эшерихии чаще встречались в молоке больных коров ( F -test: р = 0,01), энтерококки — в пробах от здоровых животных ( F -test: р = 0.02), тогда как стафилококки были доминантными в обеих группах.
Микробные профили проб молока у здоровых и больных маститом голштинских коров (бактериологичский метод оценки; Пермский край, апрель-июль 2022 года)
|
Микроорганизм |
Индекс встречаемости, % |
Статистика |
||
|
здоровыe ( n = 20)1 больные ( n = 25) |
F -test |
^ отношение шансов (OR) |
||
|
Escherichia coli |
40 |
80 |
0,01 |
6,00 |
|
Citrobacter spp. |
10 |
4 |
0,58 |
0,38 |
|
Proteus spp. |
5 |
4 |
1,00 |
0,79 |
|
Serratia spp. |
0 |
4 |
– |
|
|
Burkholderia spp. |
0 |
8 |
– |
|
|
Staphylococcu s spp. |
70 |
68 |
1,00 |
0,91 |
|
Enterococcus spp. |
50 |
16 |
0,02 |
0,19 |
|
Streptococcus spp. |
0 |
8 |
– |
|
|
Примечание. |
Прочерки в таблице означают, что расчет невозможен. |
|||
Ассоциации из трех микроорганизмов чаще обнаруживались у больных животных (28 % против 5 %), тогда как ассоциации из двух культур, напротив, среди здоровых коров (44 % против 60 %). Следует отметить, что в пробах молока здоровых животных стафилококки встречались в 3,1 раза чаще в виде монокультур, а в образцах от больных животных — в 1,9 раза чаще совместно с эшерихиями.
Б иологические свойства штаммов E. coli и Staphylococcus spp. из проб молока здоровых и больных маститом коров. По результатам ERIC-ПЦР выявили 11 изолятов E. coli с индивидуальными генетическими профилями (семь штаммов от коров с маститом, и четыре штамма — от здоровых коров). Культуры проанализировали на присутствие основных детерминант патогенности. Наиболее распространенными были гены фимбриального адгезина fimH и гемолизина hlyA, кото- рые встречались у 36,4 % штаммов E. coli. Гены токсинов, ассоциированные с диареегенными патотипами, не детектированы, однако в одном случае в пробе от больного животного обнаружен ген stx2. Чаще культуры проявляли устойчивы к ампициллину (36,4 %), два штамма имели промежуточную устойчивость. Все штаммы оказались чувствительными к карбапенемам, фторхинолонам, тетрациклину, хлорамфениколу и цефопе-разону с сульбактамом. У здорового животного мы обнаружили штамм с фенотипом резистентности к шести антибиотикам. Один штамм E. coli был гемолитическим.
По результатам ERIC-ПЦР было определено семь культур Staphylococcus epidermidis с индивидуальными генетическими профилями и один штамм Staphylococcus aureus . Культуры стафилококков были чувствительны ко всем протестированным антибиотикам, за исключением фузидиевой кислоты, к которой четыре штамма имели устойчивость. Среди культур лишь в одном случае мы обнаружили гемолитический штамм S. aureus . Биопленки образовывали 54,5 % стафилококков.
Оценка микробной обсемененности молока методом ГХ—МС. Анализ микробного разнообразия. Состав микробиоты молока определяли в группах здоровых коров в период сухостоя (I группа) и животных в период сухостоя с признаками мастита (II группа), лактирую-щих здоровых животных (III группа) и лактирующих животных с маститом (IV группа) без учета фаз лактации. Кроме того, дополнительно исследовали микробиоту молока здоровых коров в зависимости от фаз лактации.
-
* Firm/cutes Butyrivibrio
-
■ Finnicutes Eubacterium lentum 7742 (группа В) •Finnicutes Ruminicoccus
•Finnicutes Streptococcus mutans (анаэробные) Finnicutes Eubacterium spp.
Finn rentes Enterococcus
Finn rentes Clostridium perfringens
Finn rentes StapMococcus Finn rentes Eubacterium spp. Finnicutes Clostridium difficile Finn rentes Eubacterium monilifonne Finnicutes Lactobacillus о Finnicutes Staphylococcus intermedins Finnicutes Clostridium rarnosum Finnicutes Clostridiumpropionicum Finnicutes Bacillus megateriion Finnicutes Peptostreptococcus anaerobius Finnicutes Clos tridi ion hystolyticum Finnicutes Streptococcus (оранные) Bacteroidetes Porphyromonas a Bacteroidetes Flavobacteriion
Bacteroidetes Bacteroides lypennegas Proteobacteria Achromobacter
Proteobacteria Helicobacter pylori, hl8 Proteobacteria Enterobac teriaceae Proteobacteria Campylobacter mucosalis Proteobacteria Alcaligenes
•Proteobacteria Stenotrophomonas maltophilia •Proteobacteria Pseudomonas aeruginosa
-
■ Proteobacteria Acinetobacter
Actinobacteria AAcobacterium/Candida Actinobacteria Propionibacteriion jensenii Actinobacteria Actinomyces viscosus Actinobacteria Actinomycetes 10Mel4 Actinobacteria Propionibacteriion acnes Actinobacteria Nocardia asteroides
Actinobacteria Propionibacteriion freudenreichii Actinobacteria Bifidobacterium
Actinobacteria Corinefonn CDC-groupXX Actinobacteria Rhodococcus
Actinobacteria Pseudonocardia Actinobacteria Актиномицеты Actinobacteria Propionibacteriion Actinobacteria Nocardia spp.
Actinobacteria Eubacterium lentum (группа A) Fuso bacterium
Fungi Микр грибы
Viruses Herpes
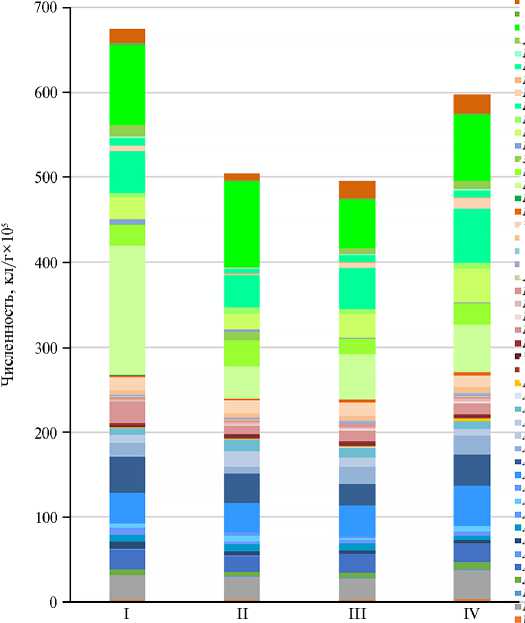
Рис. 1. Состав микробиоты молока у здоровых голштинский коров (I, III; n = 20) и животных с признаками острой формы мастита (II, IV; n = 25): I, II — животные в период сухостоя; III, IV — лактирующие животные (без учета фаз лактации) (метод газовой хроматографии— масс-спектрометрии; Пермский край, апрель-июль 2022 года).
По результатам ГХ—МС анализа в молоке коров в период сухостоя (I и II группы) доминировали представители филума Firmicutes , которые составили у здоровых коров 64,1 %, у коров с маститом 57,3 % (рис. 1). Вторую по численности группу микроорганизмов составлял филум Actinobacteria : 25,8 % у здоровых коров, 32,2 % — у больных животных. На представителей филумов Proteobacteria , Bacteroidetes и Fungi у здоровых и маститных коров приходилось соответственно 5,3 и 4,3 %; 0,4 и 0,7 %; 4,4 и 5,5 %. Оказалось неожиданным, что количественное распределение представителей Firmicu-tes , Actinobacteria , Proteobacteria , Bacteroidetes и Fungi не различалось между группами здоровых и маститных коров (р соответственно 0,49; 1,00; 0,06; 0,33; 0,14,). В контрольной группе коров в период сухостоя среди фирми-кутов доминировали бактерии рода Clostridium (45,5 %; у животных с маститом 31,4 %), при этом представителей Clostridium propionicum было достоверно меньше (p ≤ 0,05) у больных животных. Следует отметить, что Clostridium difficile и Clostridium perfringens встречались в молоке как здоровых, так и больных животных, но с тенденцией к увеличению в последней группе. Кроме того, у коров с маститом также отмечалось большее представительство Ruminicoccus (21,8 % у здоровых против 34,6 % у маститных животных), при этом встречаемость Eubacterium (18,7 % против 20,9 %) не различались. Среди актинобактерий чаще других мы детектировали представителей родов Nocardia (37,4 % против 31,9%) и Propionibacterium (36,5 % против 35,8 %).
В группе лактирующих здоровых животных и коров с признаками мастита доли крупных филумов были следующими: Firmicutes — соответственно 57,3 и 59,2 %; Actinobacteria — 31,3 и 29,4 %; Proteobacteria — 5,5 и 4,9 %; Bacteroidetes — 0,8 и 0,7 %; Fungi — 5,1 и 5,9%. Как и у коров в период сухостоя, у коров в период лактации разницы по представленности Firmicutes , Actinobacteria , Proteobacteria , Bacteroidetes и Fungi мы не выявили (р соответственно 0,35; 0,62; 0,44; 0,16; 0,51).
Отметим, что определенные бактериологическим методом доминантные возбудители мастита — Å. coli и представители рода Staphylococcus детектировались и методом ГХ—МС, но их доли в общем спектре микроорганизмов были незначительными. Так, у животных с маститом в период сухостоя представленность эшерихий и стафилококков не превышала соответственно 0,16 и 2,50 %, у лактирующих коров с маститом — 0,35 и 2,05 %.
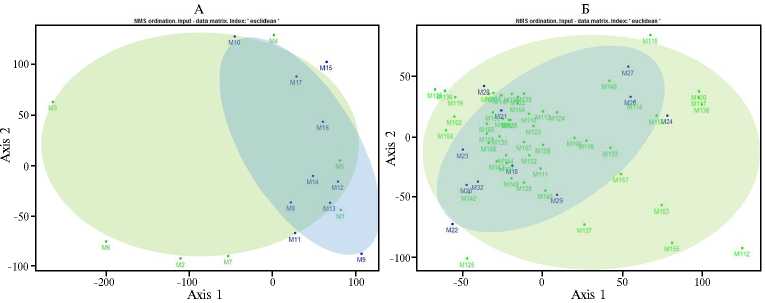
Рис. 2. Анализ сходства по составу микробиоты молока у животных в период сухостоя ( n = 17) (А) и лактирующих ( n = 56) (Б) голштинских коров. Зеленые точки — здоровые животные; синие — животные с признаками острого мастита; М — пробы молока (Пермский край, апрель-июль 2022 года).
Учитывая широкий видовой спектр микроорганизмов, присутствующих в молоке обеих исследуемых групп животных, представляло интерес провести оценку микробиоценоза секрета вымени коров в целом в рамках единых микроэкологических подходов. Анализ микробного разнообразия молока методом многомерного неметрического шкалирования показал, что в пробах от здоровых животных в период сухостоя (рис. 2, А) и лактации (рис. 2, Б) видовой состав микроорганизмов значительно варьировал по сравнению с микробиотой молока коров с проявлениями мастита.
В связи с большим разнообразием микробиоты молока у здоровых коров, следующим этапом стало изучение микробных сообществ в разные фазы лактации, поскольку в предыдущих данных этот показатель не учитывался.
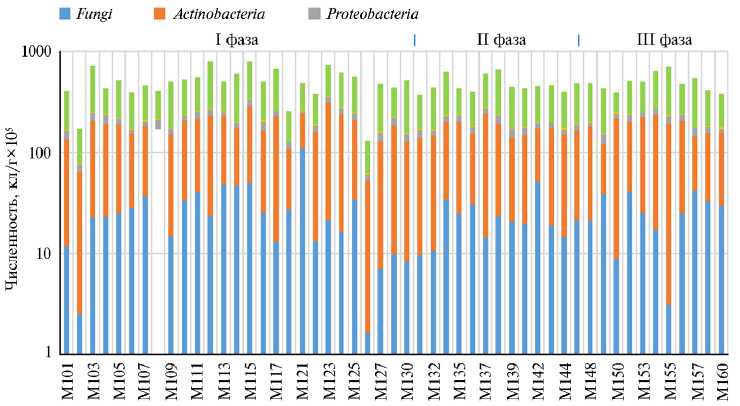
Рис. 3. Основные филумы микроорганизмов, детектированные в молоке здоровых голштинских коров в зависимости от фазы лактации: I фаза — 10-100 сут после родов ( n = 27); II фаза — 101-200 сут после родов ( n = 13); III фаза — 201-300 сут после родов ( n = 11); М101-М160 — индивидуальные пробы молока (Пермский край, апрель-июль 2022 года).
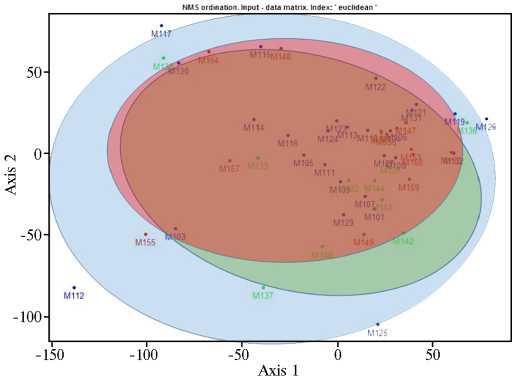
Рис. 4. Анализ сходства по составу микробиоты молока у здоровых коров в зависимости от фазы лактации . Синие точки — молоко от коров в I фазу лактации (1-100 сут после родов, n = 27); зеленые — от коров во II фазу лактации (101200 сут после родов, n = 13); красные — от коров в III фазу лактации (201-300 сут после родов; n = 11); М101-М160 — индивидуальные пробы молока (Пермский край, апрель-июль 2022 года).
Как видно из рисунка 3, состав микробиоты молока у некото- рых коров варьируется в пределах одной фазы лактации. Однако усредненные количественные показатели по Firmicutes, Actinobacteria, Proteobacteria, Bacteroidetes è Fungi не выявили разницы между фазами лактации (соответственно p 0,66; 0,84; 0,95; 0,64; 0,9,). Представители филумов Fir- micutes и Actinobacteria доминировали среди микробиоты. Среди фирмику-тов у здоровых коров в I, II, III фазы лактации доли бактерий рода Clostridium (40,4; 37,6; 44,3 %), Eubacterium (15,7: 12,1; 10,6 %) и Streptococcus (4,3; 8,2; 3,6 %) оказались наиболее многочисленными. Следует отметить присутствие патогенных клостридий, включая Clostridium difficile (2,8; 2,0; 2,7 %) и Clostridium perfringens (0,3; 0,3; 0,3 %), в молоке здоровых животных. Представленность Staphylococcus среди фирмикутов по фазам составила соответственно 3,65; 1,73 и 0,93 %, рода Enterococcus — 2,35; 2,70 и 4,02 %. Бактерии рода Pseudomonas составили 0,5; 0,4 и 0,3 % микробиоты молока у здоровых коров соответственно в I, II и III фазы лактации. Эти данные существенно отличаются от результатов бактериологического исследования, в котором не учитывались анаэробные и некультивируемые группы микроорганизмов. Выявлено, что уровень разнообразия микробиоты молока у здоровых животных снижался в более поздние фазы лактации (рис. 4).
Важно отметить, что хроническая форма мастита коров — одна из основных причин неудовлетворительных показателей молока и молочной продукции, а молоко от животных с острой формой мастита запрещено к использованию по ветеринарно-санитарным правилам для организаций, осуществляющих деятельность по производству молока, а также согласно ГОСТ Р 52054-2003 (рег. 10.08.2017) (7). Многочисленные исследования показали, что острая форма мастита встречается у 10-25 % животных, доля животных с субклинической формой достигает 50 % (2, 18, 26, 27). Этиология мастита чрезвычайно разнообразна: патогенные и условно-патогенные возбудители могут быть представлены индигенной микробиотой, но, как правило, бактерии попадают в сосковый канал молочной железы при ее экзогенном инфицировании. В сообщениях разных исследовательских групп методологии и результаты исследования микробного спектра молока здоровых и больных животных варьируются. В представляемой работе бактериологическим методом мы оценили обсемененность молока здоровых коров и коров с маститом на крупном предприятии по производству молока в Пермском крае, определили доминантных возбудителей мастита и описали их некоторые биологические свойства. Отдельная задача состояла в изучении микробного разнообразия молока с помощью ГХ—МС и возможности использования этого метода для комплексной оценки здоровья животных, а также диагностики и прогнозирования мастита коров.
Показатель бактериальной обсемененности молока, полученного от больных маститом и здоровых коров, в нашем исследовании составил 100 %. Следует подчеркнуть, что концентрация микроорганизмов в молоке больных животных в большинстве случаев составляла 5,0Е±03 клеток/мл и выше, тогда как в пробах от здоровых животных этот показатель был ниже (данные не представлены). Результаты проведенного шведскими учеными общенационального исследования этиологии мастита у молочных коров показали, что только 10,6 % и 4,5 % образцов были соответственно без роста микроорганизмов или контаминации (28). Российскими исследователями установлено, что в молоке здоровых коров титр мезофильных аэробных и факультативно анаэробных микроорганизмов достигал 104 КОЕ/мл. При этом в 72,1 % случаев показатель был ниже 103 КОЕ/мл, а около 25 % исследованных проб молока были свободны от микроорганизмов (29). У коров с маститом средний показатель обсемененности молока составил около 106 КОЕ/мл, а более чем в 85 % случаев концентрация бактерий превышала 105 КОЕ/мл (29).
Современные стратегии профилактики и лечения маститов сель- скохозяйственных животных ограничили распространение грамположи-тельных бактерий (стафило- и стрептококков) во всем мире, тем не менее S. aureus все еще считается основным возбудителем контагиозных маститов (преимущественно субклинических форм) в некоторых странах, например в Швеции (28). Исследование распространенности интрамаммарной инфекции у коров, проведенное в 2003 году в 49 молочных стадах в Нидерландах, показало, что коагулазоотрицательные стафилококки были наиболее часто выделяемой группой бактерий (10,8 % четвертей вымени) и встречались во всех стадах (30). Представители колиформных бактерий, такие как Å. coli, относятся к наиболее распространенным этиопатогенам, вызывающим экологический мастит (1, 30). Кроме них при указанной форме мастита могут встречаться некоторые виды родов Staphylococcus, Pseudomonas, Proteus и Serratia (1). В результате нашего исследования детектированы микроорганизмы, преимущественно принадлежащие к родам Escherichia, Staphylococcus, Enterococcus, Citrobacter, Proteus (см. табл.). Важно отметить, что эшерихии чаще встречались в молоке больных коров (F-test: р = 0,01), энтерококки — в пробах от здоровых животных (F-test: р = 0,02), тогда как стафилококки были доминантными в обеих группах. Исследование, проведенное в хозяйствах Воронежской области, также показало, что классические возбудители мастита (Streptococcus agalactiae и Staphylococcus aureus) присутствовали в молоке здоровых коров в большом проценте случаев (29).
Различие между данными других авторов и результатами наших исследований заключается в выявленной нами более высокой доле экологических патогенов, и в первую очередь E. coli . В большинстве работ наиболее часто выделяемыми бактериями оказываются различные виды стрептококков ( Streptococcus uberis , S. agalactiae) и стафилококков, за которыми уже следуют представители семейства Enterobacteriacae (31, 32). Данные о ведущей роли энтеробактерий в распространенности субклинического мастита крупного рогатого скота получены в региональном исследовании, проведенном в штате Герреро (Мексика) (33). Авторы установили, что в 97,5 % всех положительных проб присутствовали грамотрицательные энтеробактерии, при этом 37,5 % возбудителей были представлены Proteus vulgaris , 25 % — Salmonella spp., 12,5 % — Enterobacter aerogenes и только в 10 % проб детектировали E. coli (33), то есть спектр энтеробактерий отличался от выявленного нами. Кроме вышеперечисленных энтеробактерий штаммы Klebsiella spp. могут вызывать как единичные клинические случаи мастита, так и вспышки заболевания в молочных стадах (34). Из-за уменьшения продукции молока и снижения выживаемости животных при маститах, вызванных клебсиеллами , экономические потери намного больше, чем в случаях, когда возбудителями патологии служат эшерихии (13). В целом следует согласиться с выводами некоторых авторов, что распространенность и этиология мастита существенно различаются на сельскохозяйственных предприятиях в различных регионах вследствие многих факторов, в том числе особенностей окружающей среды и систем управления.
Источником энтеробактерий — возбудителей экологических маститов становятся не только сами животные, но и внутрихозяйственные объекты (контаминированные микроорганизмами поверхности, подстилка, почва). Интересно, что, как сообщалось, риск выделения E. coli выше при беспривязном содержании животных, чем при привязном (27, 28), тем не менее в нашем исследовании в группе коров с привязным содержанием представители E. coli доминировали. Это согласуется с данными, подтверждающими, что в условиях ограниченной подвижности животного риск развития интрамаммарной коли-инфекции повышается (35). Большую роль в предотвращении экзогенной контаминации вымени играет тип и физико-химические свойства материала подстилки, а также своевременный и правильный уход за подстилкой, что обеспечивает чистоту стойл и животных (35).
Y. Nagasawa и соавт. (36) выявили, что бактериальная нагрузка колиформными бактериями в молоке коррелирует с клинической оценкой тяжести мастита у крупного рогатого скота. При этом описаны случаи развития тяжелого клинического мастита у коров с относительно низкой концентрацией E. coli в молоке, что может объясняться патогенностью бактерий и состоянием иммунной системы животного (37). Показано, что патогенность E. coli , вызывающих мастит у коров (mammary pathogenic E. coli , MPEC), связана с локусом fec в системе поглощения цитрата железа (локус fecIRABCDE встречался у MPEC и отсутствовал в геномах фекальных изолятов) (38). Эти результаты демонстрируют, что тяжесть колиформного мастита может зависеть от биологических свойств представителей вида. Интересно, что керли (сurli) — пили, образованные амилоидным белком и участвующие в адгезии к поверхностям, агрегации клеток и образовании биопленок, впервые обнаружены в конце 1980-х годов именно на штаммах E. coli , вызывающих мастит крупного рогатого скота (37). Однако следует отметить, что в настоящее время четких маркеров, которые отличали бы вызывающие маститы E. coli от других штаммов условнопатогенных эшерихий, не выявлено. Это затрудняет обнаружение потенциальных возбудителей мастита (в отличие от возбудителей кишечных эшерихиозов), в связи с чем его ранняя диагностика остается проблемой в молочном животноводстве и ветеринарной практике (2). Изучение встречаемости вирулентных генов, кодирующих некоторые адгезины, токсины и факторы устойчивости к системам защиты макроорганизма, показало, что они не были широко представлены в выделенных штаммах эшерихий. Наиболее распространенным оказались гены фимбриального адгезина fimH и гемолизина hlyA . Гены токсинов, ассоциированные с диареегенными патотипами, мы не детектировали, однако в одном случае обнаружен ген stx2 . По-видимому, как отмечают некоторые исследователи , тяжесть мастита, вызванного Å. coli , с одной стороны, обусловлена вирулентностью возбудителя, а с другой — состоянием резистентности животного, что, в свою очередь, определяет клиническую картину и исход заболевания. Так, при моделировании экспериментального мастита при заражении различными штаммами MPEC показано, что у всех коров, инфицированных любым из штаммов, развивался клинический мастит, но иммунный ответ животных различался, что может быть связано с патогенными свойствами культур. При этом штамм E. coli К71, изолированный из окружающей среды, не вызывал воспаления молочных желез у крупного рогатого скота (39).
Использование молекулярных методов позволило получить подробные сведения о микробном разнообразии сырого молока и молочных продуктов, изучить динамику видового состава микроорганизмов в молоке коров на протяжении года (8, 40), оценить состав микробиома молока у здоровых лактирующих животных и коров с маститом, а также установить связь между бактериальной нагрузкой и степенью тяжести мастита у крупного рогатого скота (1). Однако сравнение микробного спектра молока у здоровых и больных животных в разные фазы физиологического цикла, а также анализ состава микробиоты здоровых коров в зависимости от фазы лактации, ранее не проводились.
В настоящей работе мы продемонстрировали, что при исследовании микробиоты молока методом ГХ—МС между здоровыми коровами и животными с маститом выявляются некоторые различия, что указывает на существенную роль воспалительного процесса в формировании видового состава микробиоты. Так, структура бактериальных сообществ коровьего молока на уровне крупных филумов (актинобактерии, фирмикуты, бактероиды и протеобактерии) оставалась стабильной и в уравновешенных соотношениях. Однако анализ методом многомерного неметрического шкалирования показал, что в пробах молока от здоровых животных микробное разнообразие более выражено, в то время как микробиота молока у коров с проявлениями мастита обладала большим сходством (см. рис. 2). Кроме того, выявлены некоторые изменения на уровне рода и вида микроорганизмов между здоровыми и больными животными. Так, бактерий рода Clostridium, в частности C. propionicum , в группе коров в период сухостоя с маститом было достоверно (р <0.05) меньше, чем у здоровых животными. Напротив, патогенные виды клостридий C. difficile и C. perfrin-gens встречались в молоке больных животных чаще, чем у здоровых. Кроме того, у коров с маститом также отмечена большая представленность Ruminicoccus и Nocardia . По данным литературы, нокардии Nocardia pseudo-brasiliensis (48,06 %) и N. mikamii (15,19 %) часто обнаруживали в молоке коров при рецидивирующем клиническим мастите (41).
Интересное метагеномное исследование на основе анализа последовательностей гена 16S рРНК было посвящено микробиому молока здоровых коров (8). Авторы идентифицировали представителей 785 родов и подтвердили присутствие в молоке животных различных групп микроорганизмов с учетом их роли согласно современной классификации (41): бактерии, способствующие ферментации молочных продуктов (fermentation, F); бактерии, вызывающие порчу продуктов (spoilage, S); бактерии, укрепляющие здоровье (health, H) и бактерий, вызывающие болезни (disease, D). Представленный нами анализ состава микробных сообществ вымени в зависимости от фаз лактации здоровых коров показал, что у некоторых особей состав микробиоты молока варьируется в пределах одной фазы лактации, но усредненные показатели по филумам не указывают на различия между фазами лактации. Представители филумов Firmicutes и Actinobacteria доминировали среди микробиоты. Следует также отметить, что температура и влажность могут быть определяющими факторами при изменении бактериального состава образцов молока в течение года. Показано, что более высокое содержание представителей Actinobacteria коррелирует с низкой температурой, а более высокая численность Firmicutes — с высокой температурой окружающей среды (8). Поскольку все исследованные пробы молока мы отбирали летом, доминирование в них фирмикутов может быть связано, в том числе, с этим фактором.
Представители родов Salmonella , Campylobacter и Listeria способны вызывать серьезные заболевания крупного рогатого скота, поэтому анализ на их наличие в сыром молоке обязателен при контроле качества продукции (ГОСТ 32901-2014 «Молоко и молочная продукция. Методы микробиологического анализа». М., 2014). Кроме того, некоторые виды родов Aeromonas , Chryseobacterium и Stenotrophomonas относятся к условно-патогенным микроорганизмам, вызывающим у коров широкий спектр инфекций (42, 43). В нашем исследовании такие бактерии в составе молока детектированы в единичных случаях.
Еще одной важной группой бактерий, связанных с порчей и, следовательно, с безопасностью пищевых продуктов, являются представители родов Pseudomonas и Bacillus, которые можно обнаружить почти во всех природных средах. У здоровых коров эти микроорганизмы также были обнаружены, но их доля в общем микробном спектре, по нашим данным, не превышала 0,1 %. Известно, что присутствие представителей рода Enterococcus свидетельствует о контаминации молока при его получении и обработке вследствие несоблюдения санитарно-гигиенических правил. Следует отметить, что в нашем исследовании доля энтерококков в молоке здоровых коров имела тенденцию к увеличению в зависимости от длительности лактации.
Анализ молочной микробиоты — перспективная область научных исследований, поскольку долгое время считалось, что молоко стерильно. С разработкой молекулярного методов, не требующих культивирования бактерий, выяснилось, что сырое коровье молоко имеет собственную многочисленную микробиоту (8, 12). Полученные нами данные по составу микробиоты молока здоровых животных имеют важный экологический аспект. По-видимому, здоровье коров при лактации определяется не только наличием микроорганизмов, способствующих здоровью и ферментации молочных продуктов (Н и F), при отсутствии бактерий, вызывают порчу продуктов и болезни (S и D), а совокупной микробиотой. Учитывая, что в пробах от здоровых животных видовой состав микроорганизмов, по нашим данным, был разнообразнее, чем микробиота молока у коров с проявлениями мастита, можно предположить, что у последних в биотопе преобладают этиопатогены, которые вытесняют минорных бактерий-ассоциантов, что, в свою очередь, приводит к снижению микробного разнообразия по сравнению с таковым у здоровых животных. Это согласуется с данными литературы (43, 44), где показано, что молоко из маститной четверти вымени имело более высокую бактериальную нагрузку и меньшее микробное разнообразие по сравнению с молоком из здоровой четверти. При разрешении болезни показатель разнообразия увеличивался, а относительная численность возбудителя, напротив, снижалась (43). Полагаем, что такая закономерность характерна для сочетания «здоровые животные—животные с признаками мастита». Кроме того, следует отметить, что у здоровых животных уровень микробного разнообразия молока снижался в более поздние фазы лактации (см. рис. 4). Если степень сходства микробиоты считать одним из показателей здоровья животных, то продолжительную лактацию следует признать неблагоприятным фактором развития мастита коров.
В целом следует заключить, что состояние здоровья животных, их продуктивность и воспроизводство в большинстве случаев зависят от используемых животноводческими хозяйствами методов и управленческих решений. Обязательный элемент профилактики инфекционных заболеваний и контроля продукции на предприятиях — микробиологический мониторинг (44, 45), важной частью которого служит бактериологический анализ, учитывающий профили и биологические особенности циркулирующих микроорганизмов.
Таким образом, мы выявили обсемененность и определили таксономическая принадлежность микроорганизмов, встречающихся в пробах молока от здоровых и больных маститом коров. В обеих группах животных бактерии рода Staphylococcus и Escherichia coli были наиболее распространенными как в монокультуре, так и в составе ассоциаций. Эшерихии достоверно (р < 0.05) чаще встречались в молоке больных животных и характеризовались чувствительностью к антибиотикам и единичным присутствием детерминант патогенности hlyA, stx2, kpsMTII и iss. Полученные бактериологическим методом данные свидетельствуют о распространенности экологических маститов крупного рогатого скота. Этим продиктована необходимость уделять особое внимание санитарно-профилактическим мерам на предприятиях молочного животноводства, учитывая основные пути инфицирования. Доли представителей основных филумов (Firmicutes, Actinobacteria, Proteobacteria, Bacteroidetes и Fungi, определенные с помощью газовой хроматографии—масс-спектрометрии (ГХ—МС), не различались в молоке здоровых животных и коров с маститом. В то же время анализ микробного разнообразия с помощью многомерного неметрического шкалирования показал, что в пробах от здоровых животных видовой состав микроорганизмов существенно варьировался, тогда как микробиота молока у коров с проявлениями мастита обладала сходством. Кроме того, степень микробного разнообразия молока среди здоровых животных снижалась в более поздние фазы лактации. Принимая во внимание множественные функции микроорганизмов в биотопе, а также возможное участие представителей индигенной микробиоты в патогенезе маститов, полагаем, что на предприятиях молочного животноводства может применяться газово-хроматографический метод, учитывающий полный микробный профиль секрета вымени как прогностический признак здоровья животных. Оба метода могут быть полезны в комплексных эпизоотических исследованиях в животноводческих хозяйствах. Доступность бактериологического метода позволяет использовать его на предприятиях в текущем микробиологическом мониторинге, тогда как метод ГХ—МС может быть применен для оценки качества продукции и углубленных исследований прогностического характера.


