Вискозиметрическое определение эндоглюканазной активности ферментных кормовых добавок
Автор: Комаров А.А., Телишевская Л.Я., Сарханова А.А., Васильева Л.В., Титова Е.Г., Панин А.Н.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Кормопроизводство, кормовые добавки
Статья в выпуске: 2 т.51, 2016 года.
Бесплатный доступ
Многие зарубежные и российские компании производят большое число ферментных препаратов для кормопроизводства, в том числе имеющих эндо-β-глюканазную активность. Единых методов анализа активности этих препаратов нет, что создает трудности в оценке их качества. Целью предпринятого нами исследования была разработка унифицированной методики измерения. В результате впервые оптимизирована методика вискозиметрического определения действия фермента, основанная на оценке измерения относительной текучести субстрата с использованием капиллярного вискозиметра Оствальда. Приняты следующие условия проведения анализа: диаметр капилляра 0,73 мм; температура гидролиза 30 °С; растворитель - ацетатный буфер (рН 4,7), время анализа - 5, 10, 15 мин в соответствии с кинетикой ферментативной реакции; субстрат - β-глюкан в концентрации 0,4 %. Показано, что применение в качестве субстрата карбоксиметилцеллюлозы дает не сопоставимые с данными по β-глюкану результаты, которые характеризуют не β-глюканазную, а целлюлазную активность фермента, что не соответствует целям кормопроизводства. Единица измерения при использовании метода - количество фермента, которое в стандартных условиях гидролиза приводит к увеличению относительной текучести субстрата, равному 1 мин-1. Оценку показателей точности методики проводили по ГОСТ Р ИСО 5725-2002, для чего из коммерческого образца β-глюканазы («Sigma-Aldrich», США) с известной глюканазной активностью (стандарт) готовили 5 аттестованных образцов с разной активностью. За активность стандарта принимали величину, заявленную фирмой-производителем, с эквивалентом по глюкозе (соответствующую количеству фермента, которое действует на b-глюкан с высвобождением 1 мкмоль восстанавливающих сахаров в пересчете на глюкозу), приведенную к 1 г препарата (ед. ГлА). Анализ аттестованных образцов проводили в условиях внутрилабораторной прецизионности с тремя изменяющимися факторами: оператор, матрица, набор реактивов. В качестве матриц использовали минеральные наполнители - карбонат кальция и цеолит. Для оценки показателей точности методики результаты измерения вязкости аттестованных образцов пересчитывали по калибровочным кривым в единицах ГлА. Расширенная неопределенность результатов методики вискозиметрического определения эндо-β-глюканазной активности находится в пределах от 10 до 22 % при коэффициенте охвата k = 2.
Эндоглюканазная активность, некрахмалистые полисахариды, гемицеллюлозы, вязкость, вискозиметрия, β-глюкан, карбоксиметилцеллюлоза, матрица, внутрилабораторная прецизионность, расширенная неопределенность
Короткий адрес: https://sciup.org/142213932
IDR: 142213932 | УДК: 636.087.7:577.15:57.088 | DOI: 10.15389/agrobiology.2016.2.223rus
Текст научной статьи Вискозиметрическое определение эндоглюканазной активности ферментных кормовых добавок
В настоящее время для животноводства разработано множество ферментных добавок, применяемых для снижения антипитательности кормов. Ферменты, позволяющие расщеплять компоненты растительного происхождения (цитолитические ферменты — ксиланазы, глюканазы, целлюлазы) добавляют в корма моногастричных животных, в том числе птицы, у которых некрахмалистые остовые полисахариды (целлюлозы, гемицеллюлозы, лигнин, пектин) плохо усваиваются. Повышенное содержание растворимых некрахмалистых полисахаров — гемицеллюлоз (глюканов и ксиланов) вызывает высокую вязкость кормовой массы, особенно при использовании свежесобранного урожая или в засушливые годы. Широкое внедрение препаратов целлюлаз и гемицеллюлаз, наблюдаемое в последнее время, связано с тем, что кукурузу в рационах заменяют зерновыми (ячменем, рожью, пшеницей, овсом, тритикале, а также шротами и жмыхами), и с увеличением содержания некрахмалистых полисахаридов в кормах. Активность таких добавок зарубежные фирмы-производители определяли с использованием собственных методик (Rovabio, BASF, Biovet AD, Kemin). У потребителей это вызывает за- труднения, так как не удается сравнить действие разных ферментных кормовых добавок между собой и с заявленным производителями аналогичной по назначению продукции (1-3).
В 2012 году в России были разработаны межгосударственные стандарты, регламентирующие определение β -ксиланазной и целлюлазной активности ферментных кормовых добавок (ГОСТ 31488, ГОСТ 31662), а с 1 июня 2013 года введен в действие национальный стандарт (ГОСТ Р 54905-2012), описывающий унифицированную методику определения активности экзоглюканазы. Однако в последнее время все больше иностранных фирм и лабораторий переходят на использование методов измерения эндо- β -глюканазной активности, что связано с потребностями кормопроизводства.
Именно эндоглюканазы позволяют уменьшать вязкость химуса при его прохождении через желудочно-кишечный тракт моногастричных животных, в частности свиней и сельскохозяйственной птицы (4, 5), а также молодняка крупного и мелкого рогатого скота. Способность ферментов, вносимых в корма извне, разрывать углеводные полимеры на более мелкие фрагменты позволяет решать задачи по повышению усвояемости некрахмалистых полисахаридов типа целлюлоз и гемицеллюлоз, которые практически не расщепляются гликолитическими ферментами животных. Добавки ферментов позволяют шире использовать зерновые рационы как источники энергии для сельскохозяйственной птицы и свиней (6, 7). Существует более 60 энзимных препаратов с разным типом активности, которые считаются авторизованными (8-11). Тем не менее, для них не установлены единые способы оценки и сравнения действия, что создает проблему для осуществления контроля за их производством и применением (12).
Описанные методы можно разделить на две группы — вискозимет-рические и колориметрические (13). Вискозиметрические методы обеспечивают прямое измерение активности, поскольку основаны на определении скорости уменьшения вязкости субстрата-полисахарида. Колориметрические методы косвенные, и в этом случае принцип заключается в гидролизе ферментом окрашенных субстратов (полисахаридов) с отщеплением хромофора и определении развивающейся при этом окраски. Результаты колориметрических определений приходится оценивать в собственных единицах (единицы оптической плотности — ед. ОП) или пересчитывать в единицы, принятые для измерения экзоглюканазной активности (ГлА) в эквиваленте по глюкозе с ферментом-стандартом. Однако, поскольку единого стандартного метода определения активности эндоглю-каназы не существует, декларируемая активность стандартного фермента зависит от фирмы-производителя (в том числе от метода определения активности и специфичности фермента). Поэтому из двух подходов, по нашему мнению, вискозиметрия более перспективна для стандартизации приемов исследования эндоглюканазной активности и получения сопоставимых результатов и используется в ряде лабораторий (14-16). При выполнении вискозиметрического исследования за единицу активности принимают такое количество фермента, которое в стандартных условиях гидролиза β -глюкана приводит к увеличению относительной текучести субстрата, равному 1 мин - 1.
Таким образом, в Российской Федерации ранее не существовало стандартизованных методик определения активности эндо-β-глюканазы в ферментных препаратах для животных, что создавало трудности при регистрационной экспертизе этой группы кормовых добавок и разработке регламентов их применения. Нами впервые оптимизирована методика вис- козиметрического определения действия фермента, основанная на оценке измерения относительной текучести субстрата с использованием капиллярного вискозиметра.
Нашей целью была разработка метода, позволяющего стандартизировать определение эндо- β -глюканазной активности в ферментных препаратах, применяемых в качестве добавок к кормам для снижения их антипитательности.
Описание методики . Вязкость образцов исследовали с использованием методики вискозиметрического определения (17) в нашей модификации. Определяли относительную вязкость (текучесть) субстрата на капиллярном вискозиметре Оствальда с диаметром капилляра 0,73 мм по скорости истечения жидкости (вискозиметр истечения) в сравнении с растворителем (ацетатный буфер, рН 4,7) при 30 ° С. Растворитель заливали в вискозиметр, выдерживали при 30 ° С в течение 5 мин, после чего пропускали его последовательно 3-5 раз, чтобы определить среднее время истечения ( tp ). Затем вискозиметр освобождали от растворителя, вносили в него пипеткой 8 см3 субстрата и 1 см3 буферного раствора (определенный объем для каждого вискозиметра; в нашем случае — 9 см3), выдерживали 5 мин при температуре 30 ° С и пропускали смесь 3-5 раз (начальное время истечения т 0). Вискозиметр снова освобождали, тщательно промывали, высушивали и вносили 8 см3 субстрата. Выдерживали при температуре 30 ° С в течение 5-7 мин, после чего добавляли 1 см3 раствора фермента (образца), который также предварительно прогревали при 30 ° С. Содержимое вискозиметра перемешивали, продувая воздух. С помощью секундомера фиксировали время истечения инкубационной смеси субстрата с ферментом (t i ) в периоды инкубации ( т i ) 5, 10 и 15 мин, что согласуется с данными по кинетике этой ферментативной реакции (M.L. Rabinovich, А.А. Klesov, I.V. Beresin, 1977).
Рассчитывали относительную вязкость инкубируемой смеси для каждого периода инкубации ( т i , в том числе т 0) по формуле:
П , =
ti
—
t p
t p
где п , — относительная вязкость в период инкубации т i ; t i — время истечения инкубационной смеси в каждый период инкубации, с; tp — время истечения растворителя, с. На основании полученных значений рассчитывали относительную текучесть как величину, обратную относительной вязкости (1/ η i = b i ).
Для каждого отрезка времени определяли изменение относительной текучести в минуту:
A = (Ь, - Ь^/т,-, мин—1 = Ab/т, мин—1, [2]
где b0 — начальная относительная текучесть (при т 0).
Эндо- β -глюканазную активность (ед/г) рассчитывали по формуле: А
ЭндоГлА = — , [3]
где А — изменение относительной текучести в 1 мин; С — количество ферментного препарата в реакционной смеси, г.
Величину А определяли как среднюю арифметическую величин A i , полученных для каждого периода инкубации ( т , ) по формуле [2].
Из образца стандарта готовили серию разведений (стандартные растворы) и с ними определяли изменение вязкости (текучести) того же субстрата в реакции гидролиза. Время истечения измеряли однократно после 10 мин инкубации.
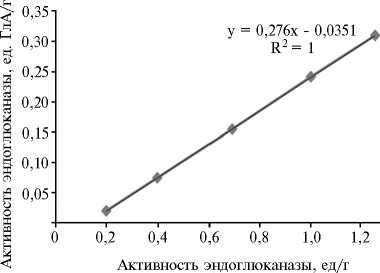
дуцент Trichoderma longibrachiatum ) с
Пример градуировочного графика для пересчета данных вискозиметрии в единицы ГлА при оценке эндо- β -глюканазной активности образца по изменению текучести субстрата.
Для выражения эндо- β -глюканазной активности в единицах ГлА в каждой серии определений строили градуиро-1,4 вочный график (рис.).
В качестве стандарта использовали β -глюканазу (проактивностью 3100 ед/г (ед. ГлА)
(«Sigma-Aldrich», США). В дальнейшем пересчитывали данные виско-зиметрического определения (ед/г) в единицы ГлА.
Точность методики оценивали, анализируя аттестованные образцы с разным содержанием β-глюканазы в условиях внутрилабораторной прецизионности со следующими изменяющимися факторами: оператор (¹ 1 и ¹ 2), набор реактивов (¹ 1 и ¹ 2), матрица. Матрицей служили минеральные носители — карбонат кальция (хч, Россия) и цеолит (НПФ «Новь», г. Новосибирск). Активность каждого аттестованного образца рассчитывали по концентрации стандарта (фермента) в аттестованной смеси (в смеси с минеральным носителем). Таким образом, с каждым носителем готовили по 5 образцов с активностью 93, 310, 620, 1033 и 1550 ед. ГлА/г, а с учетом трех факторов по каждой активности было выполнено 8 экспери- ментов (всего 40 измерений) (табл. 1).
1. Схема эксперимента по оценке точности методики, предложенной для стандартизации вискозиметрического определения эндо- β -глюканазной активности образца
|
Номер эксперимента |
Изменяемый фактор |
||
|
матрица |
набор реактивов |
оператор |
|
|
1 |
Карбонат кальция |
1 |
1 |
|
2 |
Карбонат кальция |
2 |
2 |
|
3 |
Цеолит |
2 |
2 |
|
4 |
Карбонат кальция |
2 |
1 |
|
5 |
Цеолит |
1 |
2 |
|
6 |
Карбонат кальция |
1 |
2 |
|
7 |
Цеолит |
1 |
1 |
|
8 |
Цеолит |
2 |
1 |
|
Примечание. 1 и |
2 — варианты изменяемого фактора. |
||
В качестве субстратов испытывали растворы β -глюкана и карбок-симетилцеллюлозы ( КМЦ) (концентрации 0,1-0,5 %) в ацетатном буфере (0,1 M, рН 4,7).
При статистической обработке данных для каждого аттестованного образца с учетом результатов единичных анализов по 8 вариантам определяли средние значения и дисперсию среднего значения S2. На основании полученных величин рассчитывали относительную расширенную неопределенность (%), предел повторяемости (%) и показатели правильности относительной стандартной неопределенности (%).
Определяя оптимальные концентрации субстратов, обращали внимание на время истечения исходного раствора в сравнении с растворителем. При скорости истечения растворителя (буферный раствор) 26-30 с скорость истечения исходных растворов субстратов в испытуемых концентрациях составляла от 40 с (для 0,1 % КМЦ) до 114 с (для 0,5 % β -глю-кана). Оптимальным временем истечения можно признать 60-80 с. При 226
более высоких скоростях (например, как для 0,1 % КМЦ) снижение вязкости смеси в результате действия фермента может привести к уменьшению времени ее истечения до такового у растворителя. При увеличении периода истечения (более 80 с) уменьшается контролируемое время контакта субстрата и фермента.
Исходя из этого, в качестве оптимальных концентраций субстратов мы выбрали для β -глюкана — 0,4 %, для КМЦ — 0,2 % и в дальнейшем использовали их в работе.
Испытание разных субстратов в оптимальных концентрациях показало несоответствие между конечными результатами по вязкости, что связано со спецификой фермента. Эндо- β -глюканаза расщепляет 1,3- и 1,4- β -гликозидные связи в цепи остатков глюкозы и гидролизует по этим связям как глюкан (гемицеллюлозу), так и целлюлозу. По этой причине некоторые авторы используют указанные субстраты как взаимозаменяемые (17, 18), а названия ферментов β -глюканаза и целлюлаза — как синонимы. Оба вещества представляют собой полимеры глюкозы, в которых мономеры соединены связями β -1,3 и β -1,4. Они относятся к некрахмалистым полисахаридам и антипитательным веществам, поскольку не расщепляются ферментами в желудочно-кишечном тракте животных и препятствуют усвоению других питательных компонентов корма.
Однако эти соединения различаются как по составу, так и по физико-химическим свойствам. Глюканы — это гемицеллюлозы с молекулярной массой до 50000 Да и разветвленной структурой. Они растворимы в слабых кислотах и щелочах, содержатся в семенах ячменя, ржи и пшеницы. Целлюлозы представляют собой нерастворимые линейные полимеры глюкозы с молекулярной массой от 50000 до 1800000 Да. Они не растворяются в кислотах и щелочах, входят в состав клеточных стенок злаков. Именно гемицеллюлозы (глюканы и ксиланы) обусловливают вязкость химуса и вызывают основные проблемы с перевариванием и усвоением питательных веществ корма.
Для сравнения влияния субстрата на конечные результаты проводили вискозиметрический анализ эндоглюканазной активности образца Хостазим («Biovet», Болгария). Как показали проведенные исследования, вязкость образца при использовании в качестве субстрата β -глюкана составила 12125±1819 ед/г, а КМЦ — 56500±8475 ед/г.
β -Глюкан позволяет выявлять β -глюканазную активность, в то время как КМЦ дает данные о целлюлазной (точнее, КМ-целлюлазной) активности, которые для одного и того же образца могут значительно различаться. В нашем случае последняя была в 4,5 раза выше, что, видимо, определяется специфичностью фермента, в котором целлюлазная активность преобладает, и зависит от свойств гриба-продуцента.
2. Рассчитанные показатели точности методики, предложенной для стандартизации вискозиметрического определения эндо- β -глюканазной активности образца
|
Активность стандартных образцов, ед. ГлА/г |
|
|
93 310 620 1033 1550 |
|
Относительная расширенная неопределенность при коэффициенте охвата
|
k = 2, % |
22,1 |
11,3 |
9,6 |
12,2 |
11,3 |
|
Предел повторяемости, % |
12,8 |
7,3 |
13,3 |
2,6 |
8,0 |
|
Показатель правильности относи- |
|||||
|
тельной неопределенности, % |
4,6 |
3,2 |
3,2 |
3,4 |
3,4 |
В связи с этим в дальнейших испытаниях мы использовали в качестве субстрата только β-глюкан и проводили исследования, варьируя три фактора — оператор, матрица (карбонат кальция и цеолит) и набор реактивов. На основании полученных данных оценили показатели точности методики в соответствии с ГОСТ Р ИСО 5725-2002 (24) и РМГ 61-2010 (25) (табл. 2).
Полученные результаты позволяют принять область определения активности эндоглюканазы при использовании вискозиметрического метода, равную 93-1550 ед. ГлА/г (в пересчете на глюканазный эквивалент). Лучшие результаты могут быть получены в диапазоне значений 310-1550 ед. ГлА/г, что соответствует 1240-6200 ед/г в единицах, принятых при виско-зиметрическом методе (расширенная неопределенность 10-12 %).
Таким образом, оптимизированы условия оценки эндо- β -глюка-назной активности кормовых добавок по снижению относительной вязкости (повышения относительной текучести) смеси фермента с субстратом. Для определения используется капиллярный вискозиметр с диаметром капилляра 0,73 мм при температуре гидролиза 30 мин, растворитель — ацетатный буфер с рН 4,7, соответствующим оптимуму действия фермента, при времени анализа 5, 10, 15 мин. В качестве субстрата из двух возможных вариантов ( β -глюкан и карбоксиметилцеллюлоза) выбран раствор β -глюкана в концентрации 0,4 % как наиболее соответствующий специфичности действия фермента. Показана возможность пересчета получаемых данных в единицы β -глюканазной активности с эквивалентом по глюкозе (ед. ГлА) с помощью градуировочных графиков, построенных с использованием стандарта — фермента с известной активностью. Оценены показатели точности разработанной методики. Расширенная неопределенность результатов измерений находится в пределах от 10 до 22 % (10-12 %) при коэффициенте охвата k = 2.
Список литературы Вискозиметрическое определение эндоглюканазной активности ферментных кормовых добавок
- Гришутин С.Г., Дзедзюля Е.И., Кондратьева Е.Г., Зоров И.Н., Синицына О.А., Синицын А.П. Сравнительное тестирование коммерческих ферментных препаратов для кормопроизводства. Режим доступа: http://biovet-ferment. ru/index.php?id=50. Дата просмотра 25.03.16.
- Комаров А.А., Телишевская Л.Я., Шевченко А.А., Васильева Л.В., Панин А.Н. Кормовые ферменты и проблемы, связанные с их использованием. Веткорм, 2013, 3: 8-10.
- Choct M. Enzymes for the feed industry: past, present and future. Worlds Poult. Sci. J., 2006, 62: 5-15 ( ) DOI: 10.1079/WPS200480
- Zhang Z., Marquardt R.R., Guenter W. Evaluating the efficacy of enzyme preparations and predicting the performance of Leghorn сhicks fed rye-based diets with a dietary viscosite assay. Poultry Sci., 2000, 79: 1158-1167 ( ) DOI: 10.1093/ps/79.8.1158
- Geraert P.-A., Palais F., Grenier S., Jakob S. Dietary carbohydrates: a review of their physicochemical properties and digestibility in poultry and swine. Proc. Eastern Nutrition Conference (May 10-11, 2005). Canada, Ontario, 2005: 1-18.
- Olukosi O.A., Cowieson A.J., Adeola O. Energy utilization and growth of broilers receiving diets supplemented with enzymes containing carbohydrase or phytase activity individually or in combination. Br. J. Nutr., 2008, 99(3): 682-690.
- Carvalho J.C.C., Rios R.L., Lima E.M.C., Bertechini A.G., Piracés F., Sorbara J.O.B. Differences in corn energy with the use of a-amylase and b-glucanase for broilers in various production stages. Proc. Poultry Science Association Annual Meeting. Canada, Ontario, 2008: 67.
- РовабиоТМЭксель АП (http://agrovetspb.ru).
- Натугрейн TS. Натугрейн TS.mht (http://kormovet.com).
- Лекарственный препарат Hostasim (фирма «Biovet AD», «Huvefarma AD», Болгария). Режим доступа: http://www.webvidal.ru/Veterinary/2011/LP_100988.htm. Дата просмотра 25.03.2016
- Kemzyme. Kemin products. Режим доступа: https://www.kemin.com/en/middle-east/pro-ducts/kemzyme/kemzyme-range/. Дата просмотра 25.03.16.
- Ziebal R. Pitfalls and challenges for the official control of enzymes in feed. In: Antimicrobial growth promoters. Wageningen Academic Publishers, the Netherlands, 2006: 249-254.
- Телишевская Л., Сарханова А., Васильева Л., Хватова Д., Титова Е. Разработка колориметрического метода определения эндоглюканазной активности. Комбикорма, 2015, 9: 103-104.
- Engelen A.J., van der Heeft F.C., Randsdorp P.H.G. Viscometric determination of beta-glucanase and endoxylanase activity in feed. Journal of AOAC International, 1996, 79: 5.
- McCleary B.V. Analysis of feed enzymes. In: Enzymes in farm nutrition/M. Bedford, G. Partrige (eds.). CAB International, 2001: 85-107.
- Полыгалина Г.В., Чередниченко В.С., Римарева Л.В. Определение активности β-глюканаз. В сб.: Определение активности ферментов. М., 2003: 180-181.
- Vlasenko E.Yu., Ryan A.I., Shoemaker Ch.F., Shoemaker Sh.P. The use of capillary viscometry, reducing end-group analysis, and size exclusion chromatography combined with multi-angle laser light scattering to characterize endo-1,4-β-D-glucanases on carboxymethylcellulose: a comparative evaluation of the three methods. Enzyme and Microbial Technology, 1998, 23: 350-359.
- Анкудимова Н.В. Биохимические и физико-химические свойства ключевой тополитической эндоглюканазы целлюлазного комплекса Chaetomium cellulolyticum. Канд. дис. М., 2000.
- ГОСТ Р ИСО 5725-2002. Точность (правильность и прецизионность) методов и результатов измерений. М., 2002.
- РМГ 61-2010. Рекомендации по межгосударственной стандартизации. Государственная система обеспечения единства измерений. Показатели точности, правильности, прецизионности методик количественного химического анализа. Методы оценки (введены в действие Приказом Росстандарта от 13.12.2011 ¹ 1064ст). М., 2013.


