Вязкоупругий гистерезис папиллярной мышцы
Автор: Смолюк Л.Т., Проценко Ю.Л.
Журнал: Российский журнал биомеханики @journal-biomech
Статья в выпуске: 2 (52) т.15, 2011 года.
Бесплатный доступ
Проведен анализ экспериментальных данных по вязкоупругому гистерезису изолированных папиллярных мышц крысы до и после удаления кардиомиоцитов. Показано, что значения площадей петель гистерезиса мышц контрольной группы при всех исследованных режимах нагрузок больше площадей петель гистерезиса группы мышц после удаления миоцитов. Показано, что при удалении кардиомиоцитов уменьшается и жесткость, и вязкость папиллярных мышц, а также уменьшается примерно в два раза площадь петли гистерезиса в цикле «растяжение-укорочение» мышц при исследованных режимах нагрузки. Это говорит о том, что примерно 50% потерь энергии на тепло в цикле «растяжение-сжатие» папиллярных мышц приходится на соединительнотканный каркас мышцы. Предложена структурно-функциональная модель, которая адекватно воспроизводит экспериментальные данные по вязкоупругому гистерезису папиллярных мышц при различных режимах нагрузки и в случае контрольного препарата, и в случае препарата после удаления кардиомиоцитов.
Вязкоупругие свойства, папиллярная мышца, моделирование
Короткий адрес: https://sciup.org/146216022
IDR: 146216022 | УДК: 531/534:
Текст научной статьи Вязкоупругий гистерезис папиллярной мышцы
Известно, что в механизмах, обеспечивающих насосную функцию сердца, помимо контрактильного аппарата, важную роль играют вязкоупругие свойства миокарда в норме и особенно при патологии. Для понимания закономерностей работы сердца важно установить вклад вязкоупругих свойств в регуляцию сократительной функции миокарда, так как напряжение стенки камер в диастолу также определяет ударный выброс [4, 5]. Кроме того, пассивное напряжение является одним из факторов, определяющих скорость сокращения кардиомиоцитов [11]. Пассивное напряжение обусловлено различными морфологическими структурами миокарда, однако основными источниками в миокарде являются кардиомиоциты и соединительнотканный каркас [6]. Помимо этого, соединительнотканный каркас обеспечивает связь кардиомиоцитов в миокарде, защиту от чужеродных белков, бактерий и вирусов, питание миоцитов, таким образом обусловливая нормальную физиологическую функцию сердца [12]. Поэтому актуальной задачей становится определение вкладов соединительнотканного каркаса и кардиомиоцитов в вязкоупругие свойства миокарда.
Наряду с характеристиками релаксации напряжения важной динамической характеристикой вязкоупругого поведения папиллярных мышц является вязкоупругий гистерезис. Экспериментальные данные по вязкоупругому гистерезису позволяют оценить вязкость препаратов и энергию, рассеиваемую в тепло при различных режимах нагрузок.
Смолюк Леонид Тимофеевич, к.ф.-м.н., м.н.с. лаборатории биологической подвижности, Екатеринбург
Проценко Юрий Леонидович, д.б.н., гл.н.с. лаборатории биологической подвижности, Екатеринбург
В данной работе поставлена задача: получить вязкоупругий гистерезис папиллярных мышц и установить, какой вклад вносят соединительнотканный каркас мышцы и кардиомиоциты в гистерезис при пилообразном изменении длины препарата.
Методика эксперимента
Эксперименты проведены на папиллярных мышцах правого желудочка сердец крыс «Вистар» весом 150–250 г и возрастом 4–6 мес. С животными обращались в соответствии с принципами, принятыми Комитетом по гуманному обращению с животными Института иммунологии и физиологии УрО РАН. Перед экспериментом животным вводили гепарин (0,3 мл/кг), препятствующий образованию тромбов в коронарных сосудах. После умерщвления животного и вскрытия грудной клетки извлеченное сердце промывали в физиологическом растворе, содержащем 30 мМ/л 2,3-бутандион моноксима ( BDM ) для предотвращения изменения сократительных свойств препарата миокарда во время процедуры выделения [7]. Физиологический раствор содержал (в милимолях): NaCl – 118,5, KCl – 4,2, MgSO 4 – 7, H 2 O – 1,2, NaHCO 3 – 14,5, KH 2 PO 4 – 1,2, CaCl 2 – 2,5, глюкозу – 11,1. Стабильный уровень pH (7,35) поддерживали фосфатно-карбонатным буфером с барбатированием карбогеном (95% O 2 + 5% CO 2 ) при температуре 25 °С. Затем вскрывали правый желудочек и вырезали папиллярные мышцы. Для исследования выбирали препараты длиной 2000– 3000 мкм, диаметром 300–500 мкм. Изолированную мышцу фиксировали к штокам измерительной аппаратуры в ванночке с проточным раствором и подвергали стимуляции импульсами постоянного тока с межстимульным интервалом 3 с в течение 60 минут до установления стабильных механических характеристик сокращения мышц и вымывания BDM .
Перед тем как приступить к исследованию вязкоупругих характеристик сердечной мышцы, измеряли длину провисания мышцы L 0 в изоляции. Препарат укорачивали до тех пор, пока пассивная составляющая силы не переставала изменяться, а активная составляющая достигала минимального значения, тогда эта длина принималась за длину провисания. После измерений мышцу растягивали со скоростью 0,5 мкм/с. Растяжение продолжали до тех пор, пока рост активной составляющей силы либо практически останавливался, либо падал, и соответствующую длину считали максимальной ( L max ). Затем стимуляцию препарата прекращали и проводили запись вязкоупругого гистерезиса при пилообразном изменении длины мышцы на длинах 1,08 L 0 и 1,18 L 0 с периодами 1 и 10 с и амплитудой 4% от L 0 . В промежутках между записями проводили контроль физиологического состояния препаратов – начинали стимуляцию и проверяли уровень сократимости и соотношение активного к пассивному напряжений, чтобы исключить препараты, в которых регистрировался рост пассивного напряжения и падение активного, т.е. возникала гипоксическая контрактура.
После получения вязкоупругих характеристик контрольного препарата его подвергали децеллюляризации в 1%-ном растворе додецил-сульфата натрия ( SDS ) в соответствии с методикой [10]. Раствор готовили на дистиллированной воде. Мышца подвергалась воздействию проточного 1%-ного раствора SDS в течение 60 минут. Эту процедуру проводили без снятия препарата с креплений в той же ванночке. После удаления кардиомиоцитов реологические испытания были проведены по тому же протоколу.
Контроль эффективности разрушения кардиомиоцитов осуществляли методом гель-электрофореза, 8%-ного SDS – PAGE -анализа согласно методике [8]. Кроме того, для подтверждения качества воздействия SDS были получены гистологические срезы контрольных препаратов и препаратов после децеллюляризации в соответствии с методикой [3].
О 10 20 30 40 50 60 70
Время t, с
Рис. 1. Пример записи пассивного напряжения контрольной папиллярной мышцы (внизу, левая шкала) при пилообразном изменении длины мышцы (вверху, правая шкала) с амплитудой 4% L 0 при исходной длине препарата 1,18 L 0 и периодом 10 с
Показано, что обработка 1%-ным раствором SDS приводит к удалению практически всех внутриклеточных мышечных белков [1]. Следовательно, можно утверждать, что препараты, подвергнутые децеллюляризации, содержат только соединительнотканные белки. Гистологическое исследование препаратов папиллярной мышцы до и после обработки 1%-ным раствором SDS убедительно подтверждает данные SDS – PAGE -анализа о качестве удаления миоцитов из мышцы. С другой стороны, показано, что структура соединительнотканного каркаса папиллярной мышцы после воздействия 1%-ным раствором SDS сохраняется [1].
Проведена статистическая обработка результатов реологических испытаний папиллярных мышц контрольной группы ( n = 15, p < 0,05) и SDS -группы ( n = 10, p < 0,05) с 95%-ным доверительным интервалом. Проверка достоверности различий проводилась по U -тесту Манна–Уитни.
Экспериментальные результаты
Исходными данными для анализа являлись записи пассивного напряжения папиллярной мышцы при пилообразном изменении длины мышцы с амплитудой 4% L 0 на разных длинах препарата (рис. 1).
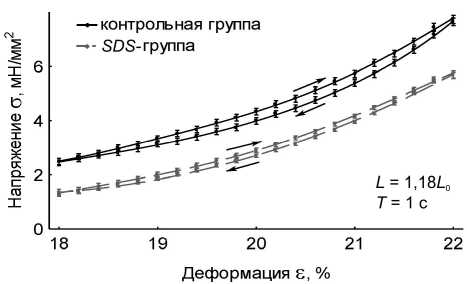
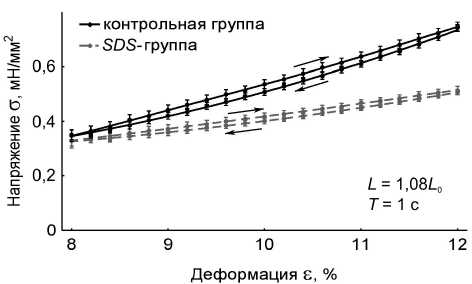
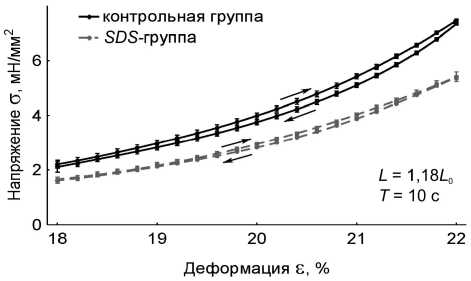
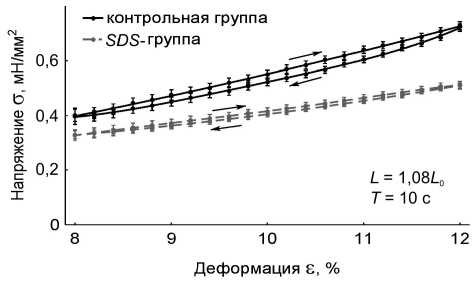
Временные зависимости пассивного напряжения и длины препарата были приведены к координатам «напряжение – деформация». В работе получены данные по вязкоупругому гистерезису папиллярных мышц в пассивном состоянии: на длине 1,08 L 0 , на длине 1,18 L 0 с периодами пилообразного изменения длины мышцы 1 с и 10 с для контрольной группы мышц ( n = 15, p < 0,05) и SDS -группы ( n = 10, p < 0,05). Длины 1,08 L 0 и 1,18 L 0 выбраны для того, чтобы получить вязкоупругий гистерезис препаратов при существенно отличающихся степенях растяжения – вблизи длины провисания и вблизи максимальной длины. Результаты представлены на рис. 2.
Анализ данных по вязкоупругому гистерезису папиллярных мышц позволил авторам установить, что децеллюляризация препарата приводит к значительному изменению реологических характеристик мышц. Показано, что при удалении кардиомиоцитов уменьшается и жесткость, и вязкость папиллярных мышц (рис. 3), а также уменьшается примерно в два раза площадь петли гистерезиса в цикле «растяжение–сжатие» мышц при всех рассмотренных длинах и режимах нагрузки (табл. 1). Отметим, что при длине 1,08 L 0 площадь петли гистерезиса SDS -препаратов
а
б
в
г
Рис. 2. Вязкоупругий гистерезис препаратов папиллярных мышц контрольной группы (черные сплошные линии) ( n = 15, p < 0,05) и SDS -группы (серые прерывистые линии) ( n = 10, p < 0,05). В правом нижнем углу графиков указаны длины мышц L , на которых записывался гистерезис, и период пилообразного изменения длины мышц Т . Стрелками отмечено направление хода петли гистерезиса: а – L = 1,18 L 0 , T = 1 c; б – L = 1,08 L 0 , T = 1 c; в – L = 1,18 L 0 , T = 10 c; г – L = 1,08 L 0 , T = 10 c
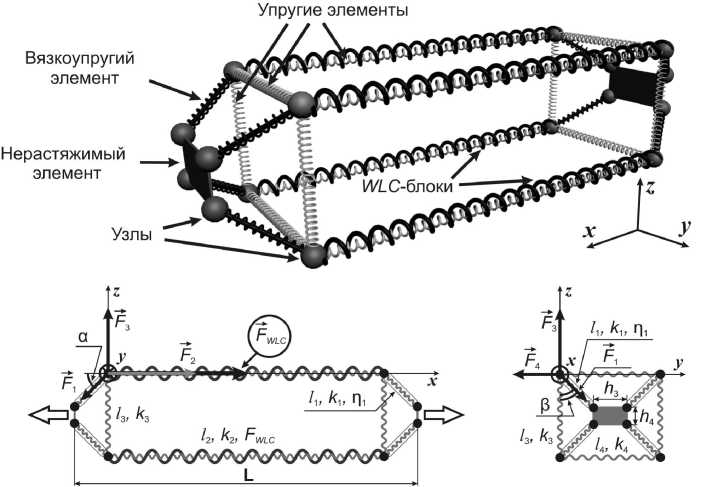
Рис. 3. Модель фасцикулы миокарда. Большими пустыми стрелками показано направление деформации всей модели
составляет приблизительно 40% от площади петли гистерезиса контрольных препаратов, а при длине 1,18 L 0 площадь петли гистерезиса SDS -препаратов составляет приблизительно 50% от площади петли гистерезиса контрольных препаратов. Этот факт говорит о том, что при больших деформациях соединительнотканный каркас начинает вносить более существенный вклад в вязкоупругие характеристики миокарда.
Таблица 1
Значения площадей петель вязкоупругого гистерезиса (мН/мм2) контрольной группы мышц ( n = 15, p < 0,05) и SDS -группы ( n = 10, p < 0,05)
|
Группа |
Удлинение, время, с |
|||
|
L =1,18 L 0 , T = 1 |
L = 1,18 L 0 , T = 10 |
L = 1,08 L 0 , T = 1 |
L = 1,08 L 0 , T = 10 |
|
|
Контрольная группа |
5,152 ± 0,420 |
4,120 ± 0,405 |
0,544 ± 0,154 |
0,493 ± 0,168 |
|
SDS -группа |
2,422 ± 0,352 |
2,000 ± 0,322 |
0,220 ± 0,085 |
0,190 ± 0,094 |
Таким образом, использованная авторами методика позволяет количественно оценить вклад кардиомиоцитов и соединительнотканного каркаса в характеристики вязкоупругого гистерезиса папиллярных мышц.
Описание модели
Разработанная авторами ранее 3D структурно-функциональная модель фасцикулы миокарда состоит из продольных и поперечных упругих элементов и наклонных вязкоупругих элементов, соединенных шарнирно, без трения, масса элементов не учитывается [2]. Геометрия модели схожа с геометрией реальных изолированных папиллярных мышц, т.е. в качестве исходных геометрических размеров использовались длина провисания и диаметр папиллярной мышцы в каждом конкретном эксперименте. В модели представлены основные морфологические структуры, обеспечивающие пассивное напряжение миокардиальной ткани: соединительнотканный каркас и тайтин [6]. Соединительнотканный каркас представлен упругими и вязкоупругими элементами, тайтин представлен в виде WLC-блоков (см. рис. 3). Поведение модели в ответ на деформацию описывается системой соотношений:
2 • 1i • ( F 2 + F WLC ) - ( L - 1 2 ) ' F i = 0, F 1 = k1 ■ ( 1 l iO ) + П 1 1 1,
2 • l i • F 3 - ( 1 з - h 3 ) • F i = 0, F 2 = k 2 • ( 1 2 - 1 20 ) ,
2 • l i • F 4 -( 1 4 - h 4 ) • F i = 0, F 3 = k 3 • ( 1 30 - 1 3 ) ,
(13 - h3 ) +(14 - h4 ) +(L - 12 ) = 4 • 1i2 , F4 = k4 •( 140 - 14 ) , где FWLC – сила, приложенная к блоку WLC модели тайтина, FWLC = µ·fWLC, где µ – коэффициент пропорциональности, характеризующий число молекул тайтина на единицу площади поперечного сечения препарата; fWLC – сила, развиваемая одиночной молекулой тайтина при растяжении [9]; l10, l20, l30, l40 – начальные длины элементов модели; l1, l2, l3, l4 – текущие длины элементов модели; k1, k2, k3, k4 – коэффициенты упругости; η1 – коэффициент вязкости; F1, F2, F3, F4 – силы, приложенные к соответствующим элементам; h3, h4 – размеры нерастяжимого элемента; L – длина всей модели.
Сила, развиваемая одиночной молекулой тайтина, выражается как fWL^C
kT A
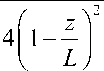
1 z
--+ _
4 L
где k – постоянная Больцмана, Т – абсолютная температура, А – характеристическая константа, z – расстояние между концами молекулы, L – длина полностью распутанной молекулы.
а
б
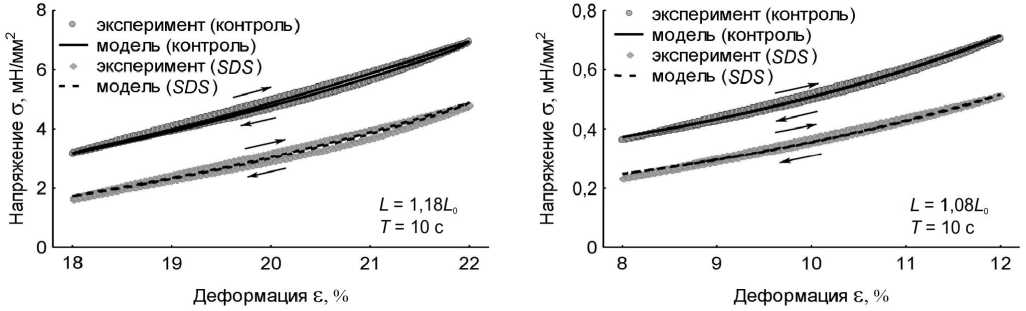
в г
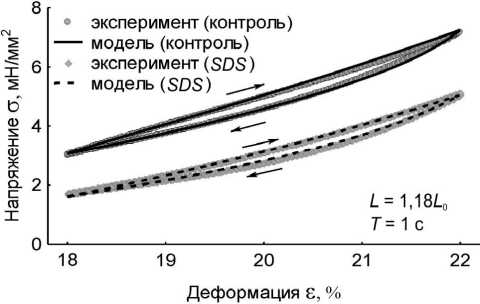
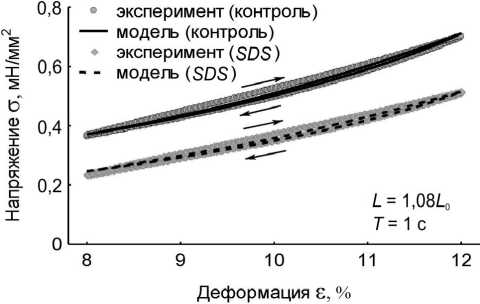
Рис. 4. Вязкоупругий гистерезис. Петли гистерезиса контрольного препарата – кружки, петли гистерезиса модели с WLC -блоком – сплошные линии, петли гистерезиса препарата после удаления кардиомиоцитов – ромбики, петли гистерезиса модели без WLC -блока – пунктирные линии. В правом нижнем углу графиков указаны длина препарата и модели L , на которой записывался гистерезис, и период пилообразного изменения длины препарата и модели Т . Стрелками указано направление хода петли гистерезиса: а – L = 1,18 L 0 , T = 1 c;
б – L = 1,08 L 0 , T = 1 c; в – L = 1,18 L 0 , T = 10 c; г – L = 1,08 L 0 , T = 10 c
Таблица 2
Значения площадей петель вязкоупругого гистерезиса папиллярной мышцы крысы и 3 D -модели морфофункциональной единицы миокарда, мН/мм2
|
Удлинение, время, с |
Контрольный препарат |
SDS -препарат |
||
|
мышца |
модель |
мышца |
модель |
|
|
L = 1,18 L 0 , T = 1 |
4,786 |
6,015 |
2,755 |
2,325 |
|
L = 1,18 L 0 , T = 10 |
3,754 |
1,540 |
2,280 |
0,460 |
|
L = 1,08 L 0 , T = 1 |
0,423 |
0,134 |
0,281 |
0,132 |
|
L = 1,08 L 0 , T = 10 |
0,355 |
0,031 |
0,191 |
0,022 |
Численные эксперименты на модели повторяли экспериментальный протокол для реальной мышцы.
Результаты моделирования
В численных экспериментах сопоставлены результаты по вязкоупругому гистерезису модели и папиллярной мышцы в двух состояниях при различных режимах нагрузки (рис. 4, табл. 2). Площади петель вязкоупругого гистерезиса модели и реального препарата количественно различаются. Однако качественно динамика изменения площадей для каждого из случаев испытаний сохраняется. Площадь петли гистерезиса контрольного препарата больше площади гистерезиса SDS-препарата для всех рассмотренных длин и периодов пилообразного изменения длины. При больших длинах и меньших периодах пилообразного изменения длины площадь модельного гистерезиса больше. Отметим, что величина пассивного напряжения модели в вершинах петли гистерезиса на всех длинах и при всех периодах пилообразного изменения длины совпадает с этой величиной у папиллярной мышцы. Модель качественно отражает изменения площади петли гистерезиса изолированного препарата миокарда при разных режимах нагрузки, а также количественно воспроизводит жесткость препарата в этих испытаниях. Кроме того, модель хорошо воспроизводит вязкоупругие характеристики препаратов и контрольной группы, и SDS-группы.
Таким образом, предложенная модель адекватно описывает вязкоупругий гистерезис изолированных папиллярных мышц и в случае контрольного препарата, и в случае препарата после удаления миоцитов.
Заключение
В данной работе получены и проанализированы экспериментальные данные по вязкоупругому гистерезису контрольных папиллярных мышц крысы и мышц после удаления кардиомиоцитов. Вид петли гистерезиса определяется уникальными вязкоупругими свойствами миокарда и носит нелинейный характер. Показано, что значения площадей петель гистерезиса препаратов контрольной группы при всех исследованных режимах нагрузок больше площадей петель гистерезиса SDS -группы. Кроме того, обращает на себя внимание различие на порядок площади петли гистерезиса контрольной группы и SDS - группы на длинах 1,18 L 0 и 1,08 L 0 . Для всех рассмотренных длин препаратов и периодов задания деформаций угол наклона петли гистерезиса препаратов контрольной группы больше угла наклона петли гистерезиса препаратов SDS - группы. Установлено, что децеллюляризация препарата приводит к значительному изменению вязкоупругих характеристик мышц. Показано, что при удалении кардиомиоцитов уменьшается и жесткость, и вязкость папиллярных мышц. На длинах вблизи длины провисания площадь петли гистерезиса SDS -препаратов составляет приблизительно 40% от площади петли гистерезиса контрольных препаратов. А на длинах вблизи максимальной длины площадь петли гистерезиса SDS -препаратов составляет примерно 50% от площади петли гистерезиса контрольных препаратов. Такое изменение вклада соединительнотканного каркаса говорит о том, что при больших деформациях соединительная ткань проявляет конструкционную жесткость, чтобы предотвратить перерастяжение миокарда.
Разработана структурно-функциональная модель, описывающая вязкоупругое поведение изолированных папиллярных мышц. Показана возможность воспроизведения нелинейного вязкоупругого поведения изолированного препарата миокарда с помощью пространственной комбинации линейных упругих и вязких элементов близкой по структуре к морфофункциональной единице миокарда – фасцикуле. В данной модели отражен вклад основных морфологических структур миокарда – соединительнотканного каркаса и тайтина – в развитие пассивного напряжения в миокарде. Предложенная модель адекватно воспроизводит экспериментальные данные по вязкоупругому гистерезису папиллярных мышц при различных режимах нагрузки и в случае контрольного препарата, и в случае препарата после удаления кардиомиоцитов.
Благодарности
Работа выполнена при поддержке гранта РФФИ 10-04-00601-а и гранта Уральского отделения РАН 10-4-НП-343.
Список литературы Вязкоупругий гистерезис папиллярной мышцы
- Смолюк Л.Т. Экспериментальное и теоретическое исследование вязкоупругих свойств папиллярной мышцы: aвтореф. дис.... канд. физ.-мат. наук, 2011. -Пущино, 20 c.
- Смолюк Л.Т., Проценко Ю.Л. Механические свойства пассивного миокарда: эксперимент и математическая модель//Биофизика. -2010. -Т. 55(5). -С. 905-909.
- Улумбеков Э.Г., Челышев Ю.А. Гистология. -М.: ГЭОТАР-МЕД, 2001. -672 с.
- Allen D.G., Kentish J.C. The cellular basis of the length-tension relation in cardiac muscle//J. Mol. Cell. Cardiol. -1985. -Vol. 17(9). -P. 821-840.
- Brady A.J. Mechanical properties of isolated cardiac myocytes//Physiol. Rev. -1991. -Vol. 71(2). -P. 413-428.
- Granzier H.L., Irving T.C. Passive tension in cardiac muscle: contribution of collagen, titin, microtubules, and intermediate filaments//Biophysical Journal. -1995. -Vol. 68(3). -P. 1027-1044.
- Kiriazis H., Gibbs C.L. Papillary muscles split in the presence of 2,3-butanedione monoxime have normal energetic and mechanical properties//Am. J. Physiol. -1995. -Vol. 269(5). -P. 1685-1694.
- Laemmli U.K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4//Nature. -1970. -Vol. 227. -P. 680-685.
- Linke W.A., Fernandez J.M. Cardiac titin: molecular basis of elasticity and cellular contribution to elastic and viscous stiffness components in myocardium//J. Muscle Res. Cell. Motil. -2002. -Vol. 23. -P. 483-497.
- Ott H.C., Matthiesen T.S., Goh S.-K., Black L.D., Kren S.M., Netoff T.I., Taylor D.A. Perfusion-decellularized matrix: using nature's platform to engineer a bioartificial heart//Nature Medicine. -2008. -Vol. 14. -P. 213-221.
- Sweitzer N.K., Moss R.L. Determinants of loaded shortening velocity in single cardiac myocytes permeabilized with alpha-hemolysin//Circulation Research. -1993. -Vol. 73. -P. 1150-1162.
- Weber K.T. Cardiac interstitium in health and disease: the fibrillar collagen network//Journal of the American College of Cardiology. -1989. -Vol. 13. -P. 1637-1652.


