ВЭЖХ анализ новых биологически активных соединений: азометинов, тиенопиримидинов и диметоксихиназолинонов
Автор: Чиряпкин Алексей Сергеевич, Ларский Михаил Владимирович, Кодониди Иван Панайотович, Петрова Алла Леонидовна
Журнал: Бюллетень науки и практики @bulletennauki
Рубрика: Медицинские науки
Статья в выпуске: 12 т.8, 2022 года.
Бесплатный доступ
В данной работе осуществлен ВЭЖХ анализ новых биологически активных соединений: азометинов, тиенопиримидинов и диметоксихиназолинонов. Для данных структур установлены такие виды фармакологического действия, как антитирозиназная, противовирусная и церебропротекторная, что делает их перспективными соединениями для фармацевтического изучения. С целью установления чистоты анализируемых веществ и разработки методик их хроматографического исследования проведен сепарационный анализ методом высокоэффективной жидкостной хроматографии обращено-фазовым вариантом. В ходе эксперимента осуществлен подбор оптимальной подвижной фазы. Наилучшие варианты для анализа достигнуты в ходе использования смеси, состоящей из ацетонитрила и 0,5% муравьиной кислоты. Значительную достоверность результатов первичного фармакологического скрининга обеспечивает высокая чистота исследуемых веществ, а это в свою очередь позволяет разработать лабораторный регламента получения соединения-лидеров, в качестве активной фармацевтической субстанции.
Азометины, тиенопиримидины, хиназолиноны, вэжх
Короткий адрес: https://sciup.org/14126160
IDR: 14126160 | УДК: 547.855:547.856:615:281 | DOI: 10.33619/2414-2948/85/34
Текст научной статьи ВЭЖХ анализ новых биологически активных соединений: азометинов, тиенопиримидинов и диметоксихиназолинонов
Бюллетень науки и практики / Bulletin of Science and Practice
УДК 547.855:547.856:615:281
Поиск новых биологически активных соединений является актуальным направлением фармации и медицины. В частности это относится к целенаправленному синтезу производных пиримидина и их ациклических предшественников с заданными фармакологическими свойствами [1]. Данные группы органических соединений обладают разнообразными видами фармакологической активности, что позволяет рассматривать их в качестве перспективных объектов для поиска и создания высокоэффективных и безопасных лекарственных средств [2, 3].
Известно, что азометиновые производные 2-амино-4,5,6,7-тетрагидро-1-бензотиофен-3-карбоксамида могут обладать антибактериальными свойствами в отношении Slaphylococcus. aureus, Bacillussubtillis, Pseudomonasaeruginosa и Escherichia coli [4]. Они проявляют противораковую активность [5] и оказались эффективными, например, для лечения рака предстательной железы на поздних стадиях заболевания [6]. Для анализируемых в работе азометиновых производных 2-амино-4,5,6,7-тетрагидро-1-бензотиофен-3-карбоксамида установлена церебропротекторная активность за счет снижения агрегации амилоидных частиц и антихолинэстеразного действия, что делает их перспективными кандидатами для разработки новых лекарственных препаратов против болезни Альцгеймера [7]. Помимо этого они проявляют противовирусную активность в отношении новой коронавирусной инфекции (SARS-CoV-2) [8]. За счет ингибирования тирозиназы азометины могут применяться для лечения нарушений пигментации кожных покровов человека [9].
Что касается тиенопиримидинов, то, например, некоторые представители тиено[2,3-d]пиримидин-4(1 Н )-онов подавляли рост опухолевых клеток толстой кишки человека [10]. Результаты фармакологического скрининга выявили у 2-замещенных 5,6,7,8-тетрагидробензо[4,5]тиено[2,3-d]пиримидин-4(3 H )-она способность ингибировать продукцию медиаторов воспаления [11]. Как и их азометиновые предшественники производные тиено[2,3-d]пиримидин-4(3 H )-она показали высокую ингибирующую активность тироизназы [12] и протеаз вируса SARS-CoV-2 [8]. Они также обладают антихолинэстеразным и антиамилоидным действиями, что важно для разработки лекарственных средств обладающих выраженными церебропротекторными свойствами [13].
Имеются литературные данные, указывающие, что производные 6,7-диметоксихиназолинон-4(3 H )-она можно использовать для терапии сердечно-сосудистых заболеваний [14], проявлять гиполипидемическое действие [15], облегчать течение атеросклероза и обладают широким спектром противовоспалительных свойств [16]. Для производного 6,7-диметоксихиназолинон-4(3 H )-она обнаружена ингибирующая активность гистаминового H 1 -рецептора человека, что позволяет его использовать для лечения астмы и аллергии [17]. В ходе исследования in vivo установлено, что представители исследуемых рядов обладают высоким нейропротекторным действием [18].
Таким образом, азометиновые производные 2-амино-4,5,6,7-тетрагидро-1-бензотиофен-3-карбоксамида и их циклические продукты тиенопиримидины, а также производные 6,7- диметоксихиназолинон-4(3H)-она следует рассматривать в качестве перспективных соединений для дальнейших медико-биологических и химико-фармацевтических исследований.
Одним из этапов разработки норм качества новых активных фармацевтических субстанций является проведение хроматографического анализа с целью разработки методик установления подлинности и чистоты анализируемых соединений, что является целью осуществленных исследований.
Материал и методы исследования
Объектами анализа выступают ранее синтезированные азометиновые производные 2-амино-4,5,6,7-тетрагидро-1-бензотиофен-3-карбоксамида [7, 19] и соответствующие продукты их циклизации – 2-замещенные 5,6,7,8-тетрагидробензо[4,5]тиено[2,3-d]пиримидин-4(3 H )-она [12, 13] и производные 6,7-диметоксихиназолин-4(3 Н )-она, содержащие остатки аминокислот и дипептидов [18]. Структурные формулы изучаемых соединений приведены на Рисунок 1 и 2.
Условия определения посторонних примесей в анализируемых образцах посредством ВЭЖХ анализа для азометиновых производных 2-амино-4,5,6,7-тетрагидро-1-бензотиофен-3-карбоксамида
Хроматограф «Стайер», снабженный УФ-детектором UVV-104M (НПО «Аквилон», Россия). Хроматографическая колонка Luna C18 150 х 4,6 мм (Phenomenex, США) с размером частиц 5 мкм. Подвижная фаза: смесь ацетонитрила и воды для ВЭЖХ в объемном соотношении компонентов 70:30, продолжительность анализа 30 минут, температура колонки 25 °С, объем пробы 20 мкл, длина волны детектирования 210 нм. Для соединения 1k в качестве подвижной фазы использовали смесь ацетонитрила и 0,5% муравьиной кислоты в объемном соотношении компонентов 80:20. В указанных условиях проводили хроматографический анализ синтезированных и исходных веществ, а также подвижной фазы.
Приготовление испытуемых растворов. 0,01 г соединения (точная навеска) растворяли в подвижной фазе, используя мерную колбу вместимостью 50 мл. Переносили 5 мл полученного раствора в мерную колбу вместимостью 25 мл, после чего объем раствора доводили до метки тем же растворителем.
Условия определения посторонних примесей в анализируемых образцах посредством ВЭЖХ анализа для 2-замещенных 5,6,7,8-тетрагидробензо[4,5]тиено[2,3-d]пиримидин-4(3H)-она
Хроматограф Dionex Ultimate 3000 (Thermo Scientific, США), снабженный УФ-детектором UWD-3000. Хроматографическая колонка Luna C18(2) 150 х 4,6 мм (Phenomenex, США) с размером частиц 5 мкм. Подвижная фаза: смесь ацетонитрила и 0,5 % муравьиной кислоты в объемном соотношении компонентов 65:35, продолжительность анализа 30 минут, температура колонки 30 °С, объем пробы 20 мкл, длина волны детектирования 210 нм. В случае 2j и 2k в качестве подвижной фазы использовали смесь ацетонитрила и 0,5% муравьиной кислоты в объемном соотношении компонентов 80:20. В указанных условиях проводили хроматографирование синтезированных и исходных веществ, а также подвижной фазы.
Приготовление испытуемых растворов. 0,01 г соединения (точная навеска) растворяли в ацетонитриле, используя мерную колбу вместимостью 100 мл. Переносили 5 мл полученного раствора в мерную колбу вместимостью 10 мл, после чего объем раствора доводили до метки.
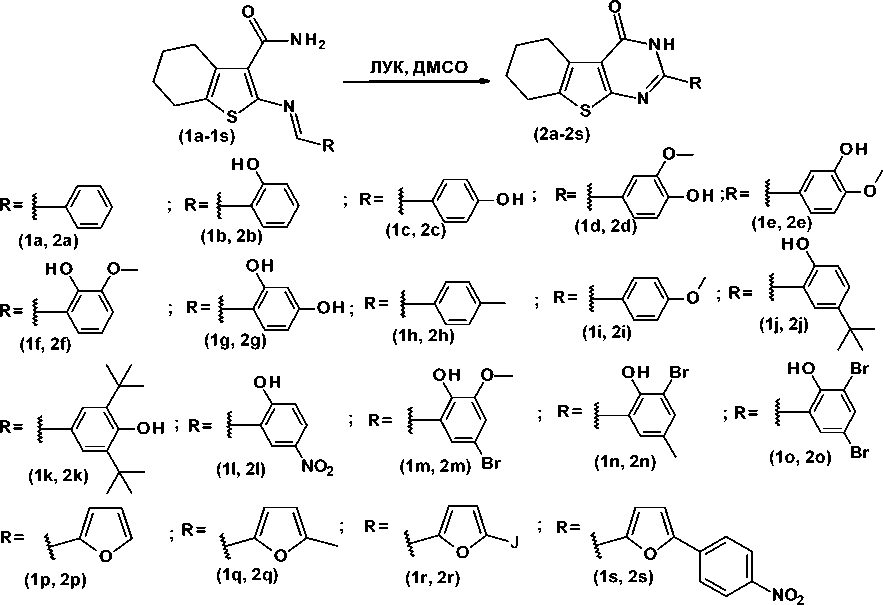
Рисунок 1. Синтез 2-замещенных 5,6,7,8-тетрагидробензо[4,5]тиено[2,3-d]пиримидин-4(3 Н )-она (2a-2s) и их азометиновых предшественников (1a-1s)
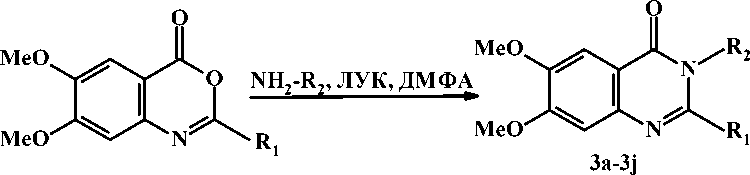
3a; R = -C H, R = -CH -COOH
3b; R = -C H , R = -CH -C(O)-NH-CH -COOH
3e; R = -C H , R = -CH -COOH
3f; R = -C H , R = -CH -C(O)-NH-CH -COOH
3c; R1 = -C2H5, R2 =
3d; R1 = -C2H5, R2 =
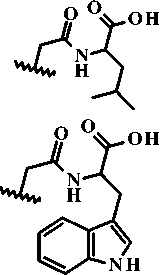
3g; R1 = -C3H7, R2 =
3h; R = -C H, R =
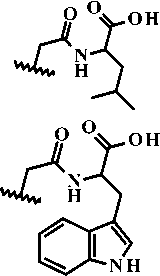
3i; R = -CH(CH) , R = -CH -C(O)-NH-CH -COOH
3k; R = -CH ; R = -CH COOH
3l; R = Ph; R = -CHCOOH
3m; R = Ph; R = -CHCOOH
3j; R1 = -CH(CH3)2, R2 =
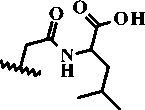
Рисунок 2. Синтез производных 6,7-диметоксикиназолин-4(3 Н )-она (3а-3m)
Условия определения посторонних примесей в анализируемых образцах посредством ВЭЖХ анализа для производных 6,7-диметоксихиназолин-4(3H)-она
Хроматограф Dionex Ultimate 3000 (Thermo Scientific, США), снабженный УФ-детектором VD-3000. Хроматографическая колонка Luna C18(2) 150 х 4,6 мм (Phenomenex, США) с размером частиц 5 мкм. Подвижная фаза для 3a, 3b, 3e, 3f, 3i и 3k: смесь ацетонитрила и 0,5% муравьиной кислоты в объемном соотношении компонентов 20:80. Подвижная фаза для 3c, 3d, 3g, 3h, 3j, 3l и 3m: смесь ацетонитрила и 0,5% муравьиной кислоты в объемном соотношении компонентов 35:65. Продолжительность анализа 30 минут, температура колонки 30 °С, объем пробы 20 мкл, длина волны детектирования 210 нм. В указанных условиях проводили хроматографирование синтезированных и исходных веществ, а также подвижной фазы.
Приготовление испытуемых растворов. 0,01 г соединения (точная навеска) растворяли в ацетонитриле, используя мерную колбу вместимостью 100 мл. Переносили 1 мл полученного раствора в мерную колбу вместимостью 10 мл, после чего объем раствора доводили до метки подвижной фазой.
Результаты и обсуждение
ВЭЖХ-анализ с детектированием при неспецифичной длине волны 210 нм показал удовлетворительное разделение синтезированных соединений и посторонних примесей. В выбранных условиях определения соблюдались приемлемые характеристики хроматографических пиков всех целевых соединений – эффективность – от 5000 до 7900 теоретических тарелок, фактор асимметрии для соединений не превышает 1,5.
Предварительное изучение УФ-светопоглощения растворов синтезированных соединений и исходных веществ в подвижной фазе при 210 нм позволило заключить, что фактор отклика детектора в отношении потенциальных примесных соединений не выходит за границы диапазона 0,8-1,2. Это, в свою очередь, позволило использовать метод внутренней нормализации для оценки содержания целевых веществ и посторонних примесей в синтезированных субстанциях [20]. При расчете не учитывали площади пиков, полученных при хроматографировании подвижной фазы. Результаты оценки чистоты синтезированных субстанций представлены в Таблице 1.
Таблица 1
РЕЗУЛЬТАТЫ ОЦЕНКИ ЧИСТОТЫ АНАЛИЗИРУЕМЫХ СОЕДИНЕНИЙ МЕТОДОМ ВЭЖХ
|
Соединение |
Содержание целевого компонента, % |
Относительное время удерживания пика соединения, мин |
|
1a |
99,6 |
6,79 |
|
1b |
98,0 |
2,06 |
|
1c |
97,5 |
3,00 |
|
1d |
99,1 |
3,52 |
|
1e |
97,1 |
3,62 |
|
1f |
96,2 |
3,01 |
|
1g |
96,2 |
1,82 |
|
1h |
99,5 |
9,09 |
|
1i |
98,8 |
6,93 |
|
1j |
98,7 |
6,06 |
|
1k |
99,5 |
10,57 |
|
1p |
97,6 |
4,66 |
|
1q |
98,8 |
6,02 |
|
1r |
97,3 |
4,48 |
Бюллетень науки и практики / Bulletin of Science and Practice Т. 8. №12. 2022
|
2a |
97,6 |
5,36 |
|
2b |
95,7 |
6,31 |
|
2c |
95,5 |
2,32 |
|
2d |
99,6 |
2,58 |
|
2e |
97,3 |
2,39 |
|
2f |
98,9 |
5,09 |
|
2g |
99,5 |
2,86 |
|
2h |
96,6 |
7,59 |
|
2i |
99,4 |
5,58 |
|
2j |
99,7 |
7,42 |
|
2k |
99,1 |
9,18 |
|
2p |
98,7 |
2,92 |
|
2q |
98,2 |
4,01 |
|
2r |
95,4 |
6,00 |
|
3a |
98,9 |
6,03 |
|
3b |
99,4 |
3,59 |
|
3c |
95,4 |
3,96 |
|
3d |
96,0 |
4,89 |
|
3e |
98,7 |
11,79 |
|
3f |
99,0 |
6,18 |
|
3g |
98,9 |
6,06 |
|
3h |
97,9 |
9,17 |
|
3i |
97,8 |
9,83 |
|
3j |
96,3 |
8,77 |
|
3k |
95,6 |
5,87 |
|
3l |
98,9 |
3,93 |
|
3m |
99,1 |
3,92 |
Примечание – растворимость соединений 1l-1o, 1s и 2l-2o, 2s в метаноле, ацетонитриле, воде и разбавленных кислотах была неудовлетворительна для проведения ВЭЖХ-анализа в обращенно-фазовом варианте
Как следует из представленных результатов, анализируемые соединения обладают высокой чистотой, что важно для проведения первичного фармакологического скрининга и создания лабораторного регламента получение активной фармацевтической субстанции. На Рисунке в качестве примера приведены хроматограммы соединений 1i.
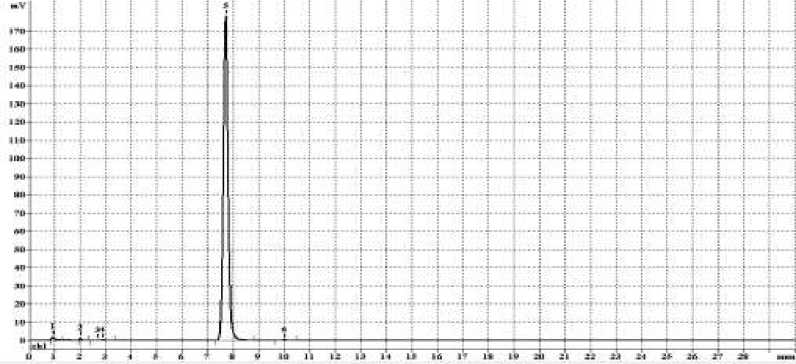
Рисунок. ВЭЖХ хроматограмма 1i.
Заключение
Разработаны условия ВЭЖХ-анализа азометиновых производных 2-амино-4,5,6,7-тетрагидро-1-бензотиофен-3-карбоксамида, 2-замещенных 5,6,7,8- тетрагидробензо[4,5]тиено[2,3-d]пиримидин-4(3H)-она и производных 6,7- диметоксихиназолин-4(3Н)-она, которые можно использовать в дальнейших сепарационных исследованиях методом ВЭЖХ близких по строению органических соединений.
Результаты анализа свидетельствуют о высокой чистоте синтезированных веществ, что важно для достоверного проведения первичного фармакологического скрининга и дальнейшей разработки лабораторного регламента получения активной фармацевтической субстанции на базе соединений-лидеров.
Финансирование: Исследование выполнено при финансовой поддержке РФФИ в рамках научного проекта № 20-315-90060.
Financing . The reported study was funded by RFBR, project number 20-315-90060.
Список литературы ВЭЖХ анализ новых биологически активных соединений: азометинов, тиенопиримидинов и диметоксихиназолинонов
- Кодониди И.П., Ларский М.В., Кодониди М.И., Чиряпкин А.С. Целенаправленный синтез производных хиназолин-4(3H)-она и их ациклических предшественников с заданными фармакологическими свойствами. М.: Русайнс. 2022. 170 с.
- Elkanzi N. A. A. Synthesis and Biological Activities of Some Pyrimidine Derivatives: A Review // Orient J Chem. 2020. V. 36. №6. P. 15-1001. http://dx.doi.org/10.13005/ojc/360602
- Patil S. B. Biological and medicinal significance of pyrimidines: A review // Int. J. Pharm. Sci. Res. 2018. V. 9. №1. P. 44-52.
- El-Sharief, A. S., Micky, J. A. A., Shmeiss, N. A. M. M., & El-Gharieb, G. Synthesis and reactions of some tetrahydrobenzothieno [2, 3-d] pyrimidine derivatives with biological interest // Phosphorus, Sulfur, and Silicon and the Related Elements. 2003. V. 178. №3. P. 439-451. https://doi.org/10.1080/10426500307912
- Wang Y. D. et al. Inhibition of tumor cell proliferation by thieno [2, 3-d] pyrimidin-4 (1H)- one-based analogs //Bioorganic & medicinal chemistry letters. – 2005. – Т. 15. – №. 16. – С. 3763-3766. https://doi.org/10.1016/j.bmcl.2005.05.127
- Amawi H., Hussein N., Boddu S. H., Karthikeyan C., Williams F. E., Ashby Jr C. R., Tiwari A. K. Novel Thienopyrimidine Derivative, RP-010, Induces β-Catenin fragmentation and is efficacious against prostate Cancer Cells // Cancers. 2019. V. 11. №5. P. 711. https://doi.org/10.3390/cancers11050711
- Chiriapkin A. S., Kodonidi I. P., Pozdnyakov D. I., Zolotych D. S. Synthesis and QSAR of new azomethine derivatives as agents for the treatment of Alzheimer's disease // Synthesis. 2021. V. 3. P. 563-584.
- Чиряпкин А. С., Кодониди И. П., Поздняков Д.И. Противокоронавирусная активность азометинов, тиенопиримидинов и производных 6,7-диметоксихиназолин-4(3H)-она // Аллея науки. 2022. Т. 10. № 73.
- Чиряпкин А. С., Кодониди И. П., Поздняков Д. И. Изучения антитирозиназной активности азометиновых производных 2-амино-4,5,6,7-тетрагидро-1-бензотиофен-3-карбоксамида // Вестник Воронежского государственного университета. Серия: Химия. Биология. Фармация. 2022. № 1. С. 110-116.
- Wang Y. D., Johnson S., Powell D., McGinnis J. P., Miranda M., Rabindran S. K. Inhibition of tumor cell proliferation by thieno [2, 3-d] pyrimidin-4 (1H)-one-based analogs // Bioorganic & medicinal chemistry letters. 2005. V. 15. №16. P. 3763-3766. https://doi.org/10.1016/j.bmcl.2005.05.127
- Zhang Y., Luo L., Han C., Lv H., Chen D., Shen G., Ye F. Design, synthesis, and biological activity of tetrahydrobenzo [4, 5] thieno [2, 3-d] pyrimidine derivatives as anti-inflammatory agents // Molecules. 2017. V. 22. №11. P. 1960. https://doi.org/10.3390/molecules22111960
- Chiriapkin A., Kodonidi I., Pozdnyakov D. Targeted Synthesis and Study of Antityrosinase Activity of 2-Substituted Tetrahydrobenzo [4, 5] Thieno [2, 3-d] Pyrimidine-4 (3H)-One // Iranian Journal of Pharmaceutical Research. 2022. https://dx.doi.org/10.5812/ijpr-126557
- Chiriapkin A. S., Kodonidi I. P., Pozdnyakov D. I., Glushko A. A. Synthesis, in vitro and docking studies of 2-substituted 5, 6, 7, 8-tetrahydrobenzo [4, 5] thieno [2, 3-d] pyrimidine-4 (3H)- one derivatives as agents for the treatment of Alzheimer's disease // Chimica Techno Acta. 2022. V. 9. №2. P. 20229204. https://doi.org/10.15826/chimtech.2022.9.2.04
- Yadav M. R., Naik P. P., Gandhi H. P., Chauhan B. S., Giridhar R. Design and synthesis of 6, 7-dimethoxyquinazoline analogs as multi-targeted ligands for α1-and AII-receptors antagonism // Bioorganic & medicinal chemistry letters. 2013. V. 23. №13. P. 3959-3966. https://doi.org/10.1016/j.bmcl.2013.04.054
- Refaie F. M., Esmat A. Y., Gawad S. M. A., Ibrahim A. M., Mohamed M. A. The antihyperlipidemic activities of 4 (3H) quinazolinone and two halogenated derivatives in rats // Lipids in health and disease. 2005. V. 4. №1. P. 1-11. https://doi.org/10.1186/1476-511X-4-22
- Fessler M. B. The challenges and promise of targeting the Liver X Receptors for treatment of inflammatory disease // Pharmacology & therapeutics. 2018. V. 181. P. 1-12. https://doi.org/10.1016/j.pharmthera.2017.07.010
- Gao Y., Rubin P., Xiaoyi N., Zepp C. Therapeutic compounds for the treatment of asthma and allergy, and methods of use thereof: 09813096. 2002.
- Chiriapkin A. S., Kodonidi I. P., Pozdnyakov D. I. Synthesis and Evaluation of Cerebroprotective Activity of Novel 6, 7-dimethoxyquinazolin-4 (3H)-one Derivatives Containing Residues of Amino Acids and Dipeptides // Chimica Techno Acta. 2022. V. 9. № 2. http://dx.doi.org/10.15826/chimtech.2022.9.2.12
- Чиряпкин А. С., Кодониди И. П., Ларский М. В. Целенаправленный синтез и анализ биологически активных азометиновых производных 2-амино-4, 5, 6, 7-тетрагидро-1- бензотиофен-3-карбоксамида // Разработка и регистрация лекарственных средств. 2021. Т. 10. №2. С. 25-31. https://doi.org/10.33380/2305-2066-2021-10-2-25-31
- Государственная фармакопея Российской Федерации. Т. I. М.: Министерство здравоохранения Российской Федерации; 2018. С. 845-872.


