Вклад нарушений углеводного обмена в прогноз хронической сердечной недостаточности у пациентов, перенесших поражение легких при COVID-19
Автор: Редькина И.Н., Суплотова Л.А., Бессонова М.И., Авдеева К.С., Ярославская Е.И., Петелина Т.И.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 2 т.40, 2025 года.
Бесплатный доступ
Введение. Пандемия COVID-19 привела к значительному росту сердечно-сосудистых патологий, включая развитие и прогрессирование хронической сердечной недостаточности (ХСН) в постковидном периоде. Подобные изменения могут быть ассоциированы с продолжающимся воспалением, нарушениями иммунной регуляции и гипергликемией. Изучение влияния нарушений углеводного обмена на развитие ХСН у пациентов, перенесших COVID-19, остается важной задачей для современного здравоохранения. Цель: оценить вклад нарушений углеводного обмена в прогноз ХСН у пациентов, перенесших поражение легких при COVID-19. Материал и методы. Проведен ретроспективный анализ базы данных пациентов Тюменского кардиологического научного центра – филиала Томского НИМЦ (n = 350), которые перенесли поражение легких при COVID-19 в 2020–2021 гг. и наблюдались на базе Тюменского кардиологического научного центра в период с 10 апреля 2020 по 11 июля 2022 гг. В исследовании приняли участие 116 пациентов, которые были разделены на 2 группы в зависимости от наличия ХСН: на группу пациентов с ХСН (n = 63) и группу пациентов без ХСН (n = 53). Верификация ХСН проведена в соответствии с клиническими рекомендациями «Хроническая сердечная недостаточность» (2020), утвержденными Министерством здравоохранения Российской Федерации. Комплексное обследование (осмотр кардиолога, лабораторное и инструментальное обследование) участников было выполнено через 3 и 12 мес. после перенесенного поражения легких при COVID-19. Результаты. У пациентов с ХСН выявлены статистически значимо более высокие уровни гликированного гемоглобина (HbA1c) (p = 0,01), холестерин липопротеинов низкой плотности (ХС-ЛПНП) (p < 0,01), интерлейкин-8 (ИЛ-8) (p < 0,01) в сравнении с пациентами без ХСН. Согласно результатам ROC-анализа, повышение HbA1c может прогнозировать развитие ХСН в постковидном периоде. Площадь под ROC-кривой составляла 0,823 ± 0,061 с 95% ДИ: 0,704–0,942 (р = 0,001). Пороговое значение HbA1c – 5,95%. Построена статистически значимая модель логистической регрессии, оценивающая вероятность развития ХСН в течение года после поражения легких при COVID-19 (p < 0,001) с предикторами: HbA1c, ХС-ЛПНП, ИЛ-8, наличие ишемической болезни сердца (ИБС). ROC-анализ модели: AUC – 0,91. Чувствительность – 90,1%, специфичность – 79,3%. Заключение. HbA1c, ХС-ЛПНП и ИЛ-8 имеют высокую прогностическую значимость в развитии ХСН у пациентов после поражения легких при COVID-19.
Гликированный гемоглобин, холестерин липопротеинов низкой плотности, интерлейкин-8, COVID-19, хроническая сердечная недостаточность
Короткий адрес: https://sciup.org/149148585
IDR: 149148585 | УДК: 616.98:578.834.1]-036.21+616.24-001]:577.124.8:616.12-008 | DOI: 10.29001/2073-8552-2025-40-2-83-91
Текст научной статьи Вклад нарушений углеводного обмена в прогноз хронической сердечной недостаточности у пациентов, перенесших поражение легких при COVID-19
Мир продолжает сталкиваться с отдаленными последствиями пандемии, вызванной SARS-CoV-2. Несмотря на детальную проработку патогенетических механизмов кардиоваскулярных нарушений, ассоциированных с острой фазой COVID-19 [1], вопросы долгосрочного влияния инфекции на сердечно-сосудистую систему остаются недостаточно изученными [1, 2]. В частности, существует ограниченное количество исследований, посвященных поиску предикторов хронической сердечной недостаточности (ХСН) в отдаленном периоде после перенесенной инфекции [1].
Анализ данных, предоставленных Министерством здравоохранения США, выявил увеличение риска развития ХСН на 72% в течение 12 мес. после инфицирования SARS-CoV-2 [1–3]. Примечательно, что уже спустя 30 дней с момента заражения у пациентов, включая лиц без госпитализации в острой фазе, регистрируется повышенная вероятность кардиоваскулярных событий, таких как декомпенсация ХСН [3, 4]. Одним из ключевых факторов, потенцирующих прогрессирование ХСН, выступает персистирующий воспалительный ответ, патогенез которого включает дисрегуляцию иммунного ответа, продолжающееся цитопатическое действие вирусных компонентов, аутореактивность гуморального иммунитета [4–6]. Особый интерес представляет роль гипергликемии как триггера хронического воспаления и независимого предиктора кардиальной дисфункции в постковидном периоде [7]. Учитывая вышесказанное, изучение показателей углеводного обмена в разрезе ХСН у пациентов, перенесших поражение легких при COVID-19, является актуальной задачей современного здравоохранения.
Цель исследования: оценить вклад нарушений углеводного обмена в прогноз ХСН у пациентов, перенесших поражение легких при COVID-19.
Материал и методы
Исследование представляет собой ретроспективный анализ базы данных Тюменского кардиологического научного центра филиала Томского НИМЦ, охватывающий период с апреля 2020 по июль 2022 гг. В исследовании приняли участие 116 пациентов (из общей выборки n = 350), соответствующих критериям включения: возраст 40–68 лет, подтвержденный диагноз COVID-19-ассоции-рованной пневмонии, наличие информированного согласия на участие. Критерии исключения: возраст < 40 лет и > 68 лет, неудовлетворительное качество визуализации при эхокардиографии (ЭхоКГ), беременность, онкологические заболевания, отказ от участия.
Участники были разделены на 2 группы: группу пациентов с ХСН (n = 63) и группу пациентов без ХСН (n = 53 Верификация ХСН проведена в соответствии с клиническими рекомендациями «Хроническая сердечная недостаточность» (2020), утвержденными Министерством здравоохранения Российской Федерации1. При- 10.29001/2073-8552-2025-40-2-83-91
менялись классификации по стадиям Н.Д. Стражеско, В.Х. Василенко и функциональному классу (ФК) Нью-Йоркской ассоциации Сердца (NYHA)2. Комплексное обследование включало осмотр кардиолога, лабораторные и инструментальные исследования, выполненные через 3 и 12 мес. после перенесенного поражения легких при COVID-19.
Определение показателей общего анализа крови (ОАК) (скорость оседания эритроцитов (СОЭ), мм/ч; лейкоциты, 109/л – число лейкоцитов; тромбоциты, 109/л – число тромбоцитов) осуществлялось импедансным методом с технологиями проточной цитометрии на аппарате 5Diff, анализатор «Mindrey BC 5800» (Китай). Биохимические показатели (креатинин, мкмоль/л, лактатдегидрогеназа (ЛДГ), Ед/л, аспартатаминотрансфераза (АСТ), Ед/л, аланинаминотрансфераза (АЛТ), Ед/л, общий холестерин (ОХС), ммоль/л, холестерин липопротеинов высокой плотности (ХС-ЛПВП), ммоль/л, холестерин липопротеинов низкой плотности (ХС-ЛПНП), ммоль/л, ферритин, мг/мл, глюкоза натощак, ммоль/л, триглицериды (ТГ), ммоль/л) определяли на автоматическом анализаторе «CobasIntegra 400 plus» (Швейцария) спектрофотометрическим методом при помощи аналитических наборов «Roche DiagnosticsGmb» (Германия). Исследование гликированного гемоглобина (HbA1c, %) выполнено на анализаторе D-10 компании Био-Рад. Метод определения HbA1c сертифицирован в соответствии с National Glycohemoglobin Standardization Program (NGSP) и стандартизован в соответствии с референсными значениями, принятыми в Diabetes Control and Complications Trial (DCCT). Параметры коагулограммы (фибриноген, г/л, международное нормализованное отношение (МНО, Ед), Д-димер, мг/мл, протромбиновый индекс (ПТИ, %), активированное частичное тромбопластиновое время (АЧТВ, c) определены на селективном автоматическом анализаторе «Destiny Plus» (Ирландия) методом клоттингового тестирования (на механическом и оптическом режимах).
Определение таких иммунологических показателей, как фактор некроза опухоли α (ФНО-α), пг/мл, интерлейкин-1 (ИЛ-1β), пг/мл, интерлейкин-6 (ИЛ-6), пг/ мл, интерлейкин-8 (ИЛ-8), пг/мл, высокочувствительный С-реактивный белок (вч-СРБ), мг/л, терминальный мозговой натрийуретический пептид (NT-proBNP), пг/мл, произведено с помощью набора Вектор-Бест (Россия) на микропланшетном фотометре «Stat Fax 4200» (США). Гомоцистеин, мкмоль/л, определен с помощью твердофазного конкурентного хемилюминесцентного иммунофер-ментного анализа с использованием набора IMMULITE Homocysteine.
Эхокардиографическое исследование проводилось на ультразвуковой системе Vivid S70 с матричным датчиком M5Sc-D (1,5–4,6 МГц) с сохранением данных в формате DICOM.
Статистический анализ выполнялся с использованием программ MS Excel и IBM SPSS STATISTICS 25. Нор- мальность распределения количественных показателей проверялась по критерию Шапиро – Уилка. Количественные показатели представлены средним значением (М) и стандартным отклонением (SD), M ± SD; при отсутствии нормального распределения – медианой (Ме) и межквартильным промежутком [Q1; Q3], Me [Q1; Q3]. Категориальные показатели описывались абсолютными (n) и относительными (в %) частотами встречаемости, n (%). Для сравнения качественных переменных в двух независимых группах применялись точный критерий Фишера и критерий χ2 Пирсона, для количественных переменных – критерий Манна – Уитни и t-критерий Стьюдента, в том числе в модификации Уэлча (с учетом критерия Ливиня). Для выявления статистически значимых предикторов возникновения ХСН после перенесенного COVID-19 с поражением легких построена модель многофакторной логистической регрессии и проведен ее ROC-анализ.
Исследование проведено в соответствии с принципами надлежащей клинической практики (GCP) и Хельсинкской декларации. Протокол исследования № 159 от 23.07.2020 г. одобрен локальным этическим комитетом и зарегистрирован в международном реестре ClinicalTrials. gov (NCT04501822).
Результаты
Средний возраст пациентов, включенных в исследование, составил 52,4 ± 5,6 года. Распределение по полу: в пользу женщин – 69,5%. Медиана индекса массы тела (ИМТ) определена на уровне 30 кг/м2, курение зарегистрировано у 40% участников. Ишемическая болезнь сердца (ИБС) выявлена у 12,9%, артериальная гипертония (АГ) – у 77,5%, нарушения сердечного ритма – у 14,6% пациентов. Подробная характеристика пациентов представлена в таблице 1.
Пациенты в группах с ХСН и без ХСН были сопоставимы по полу, возрасту (табл. 2). Медиана ИМТ была выше в группе с ХСН ( р < 0,01). Пациенты с ХСН закономерно чаще страдали ИБС ( р < 0,01) и АГ ( р < 0,01). Но течение АГ в группах имело контролируемый характер, и значения систолического артериального давления (САД) ( р = 0,59), диастолического артериального давления (ДАД) ( р = 0,28), частоты сердечных сокращений (ЧСС) ( р = 0,25) в группах статистически значимо не различались. В группах не выявлено различий в частоте нарушений сердечного ритма ( р = 0,54). Тяжесть поражения легких в острую фазу COVID-19 была сопоставима с таковой в группе без ХСН ( р = 0,54). Частота курения в группах не различалась ( р = 0,37).
При сравнительном анализе показателей ЭхоКГ в группах не выявлено статистически значимых различий в значениях фракции выброса левого желудочка (ЛЖ): 68 [66; 71] и 69 [66; 71] % соответственно (р = 0,47); массы миокарда ЛЖ: 149[123,5; 186] и 142,8 [111; 160,5] г соответственно (р = 0,07). Пациенты с ХСН имели бόльшие показатели толщины задней стенки ЛЖ: 10,0 [9,0; 11,0] и 9,0 [8,5; 10,0] мм соответственно (р < 0,01), размер правого желудочка: 26 [25; 27,5] и 25 [24; 27] мм соответственно (р = 0,03) и конечный систолический объем левого предсердия (ЛП): 19 [15; 24] и 16 [13,0; 20,0] мл соответственно (р < 0,01). Обнаружена тенденция к повышенным значениям передне-заднего размера ЛП у пациентов с ХСН: 36 [34; 39] и 35 [33; 37] мм соответственно (р = 0,08), толщины межжелудочковой перегородки: 11,0 [10,0; 12,0] и 10,0 [9,0; 10,75] мм соответственно (р = 0,05). Индексиро- ванные эхокардиографические параметры статистически значимых различий между группами не продемонстрировали.
При анализе параметров ОАК и биохимических показателей в группах с ХСН и без ХСН были выявлены статистически значимые различия в уровнях лейкоцитов ( р = 0,01), тромбоцитов ( р = 0,01), ОХС ( р = 0,04), ХС-ЛП-НП ( р < 0,01), холестерин липопротеинов очень низкой плотности (ХС-ОНП) (р < 0,01), ТГ ( р < 0,01), ХС-ЛПВП ( р = 0,03). Пациенты с ХСН имели большую медиану HbA1c ( р = 0,01), чем участники без ХСН. Также стоит отметить тенденцию к более высоким медианным значениям ЛДГ ( р = 0,08) у пациентов с ХСН. Результаты сравнительного анализа биохимических показателей представлены в таблице 3.
В коагулограмме пациентов с ХСН выявлена тенденция к более высоким медианным значениям фибриногена: 2,6 [2,3; 2,9] и 2,9 [2,4; 3,4] г/л соответственно ( р = 0,059). Значения Д-димера: 0,26 [0,12; 0,48] и 0,3 [0,15; 0,8] мг/мл соответственно ( р = 0,355), ПТИ: 103 [85,9; 109,5] и 101 [95; 109] % соответственно ( р = 0,67), МНО: 0,9 [0,9; 1,2] и 0,91 [0,9; 1,1] Ед соответственно ( р = 0,68) и АЧТВ: 26,9 [25,6; 29,4] и 26,8 [25; 29,3] с соответственно ( р = 0,71) не показали статистически значимых различий.
Анализ иммунологических показателей выявил изменения медианы уровня высокочувствительного СРБ (р < 0,01), ИЛ-6 ( р = 0,03), ИЛ-8 ( р < 0,01) в группе пациентов с ХСН. Отмечается тенденция к более высоким медианным значениям ИЛ-1β в группе с ХСН ( р = 0,06). Результаты сравнительного анализа иммунологических показателей представлены в таблице 4.
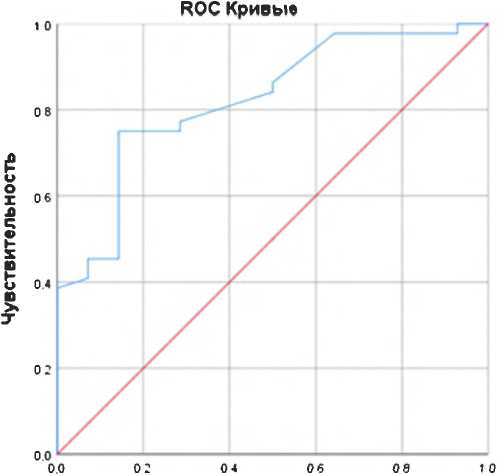
Для оценки вклада потенциальных предикторов в предсказание развития ХСН в течение года после перенесенного COVID-19 построена статистически значимая модель логистической регрессии ( р = 0,001), выполнен ее ROC-анализ. Результаты ROC-анализа продемонстрировали, что повышение HbA1c статистически значимо прогнозирует развитие ХСН в постковидном периоде. Площадь под ROC-кривой составила 0,823 с 95% ДИ: (0,704; 0,942). Построенная однофакторная модель логистической регрессии являлась статистически значимой (р = 0,001). Пороговое значение HbA1c в точке cut-off равнялось 5,95%, что предполагает повышение вероятности развития ХСН при превышающем значении показателя. Чувствительность и специфичность модели составили 77,3 и 71,4% соответственно (рис. 1).
С учетом полученных результатов сравнительного анализа была выделена группа факторов риска, независимо ассоциированных с прогнозом ХСН в постковидном периоде, построена статистически значимая модель логистической регрессии, включающая в себя следующие показатели: HbA1c, ХС-ЛПНП, ИЛ-8, наличие ИБС. Вероятность развития ХСН в течение года после поражения легких при COVID-19 можно рассчитать по формуле:
р = (1 )/(1+e–z), где z = –25,656+2,68×А+1,553×В+0,206×С+1,842×I; А – уровень HbA1c в %; В – уровень ХС-ЛПНП, ммоль/л; C – уровень ИЛ-8, пг/мл; I – наличие ИБС у пациента (0 – нет; 1 – есть), е = 2,718.
Исходя из значения коэффициента детерминации Найджелкерка, модель учитывает 71,1% факторов, опре-
Таблица 1 . Клинико-анамнестическая характеристика пациентов, включенных в исследование
Table 1 . Clinical and anamnestic characteristics of patients included in the study
|
Показатели |
n = 116 |
|
|
Возраст, лет, М ± SD |
52,4 ± 5,6 |
|
|
Пол: мужчины, n (%) |
54 (46,5) |
|
|
ИМТ, кг/м2, Me [Q1; Q3] |
30,0 [26,7; 33,7] |
|
|
Курение, n (%) |
47 (40) |
|
|
САД, мм рт. ст., Me [Q1; Q3] |
130 [120; 139,5] |
|
|
ДАД, мм рт. ст., Me [Q1; Q3] |
86 [80; 94] |
|
|
ЧСС, уд/мин, Me [Q1; Q3] |
76 [67; 81] |
|
|
ИБС, n (%) |
15 (12,9) |
|
|
Функциональный класс стенокардии напряжения |
I |
5 (33,3) |
|
II |
7 (46,4) |
|
|
III |
3 (20) |
|
|
АГ, n (%) |
90 (77,5) |
|
|
Степень АГ |
1 |
26 (28,8) |
|
2 |
44 (48,8) |
|
|
3 |
27 (30) |
|
|
Нарушение ритма, n (%) |
17 (14,6) |
|
|
ХСН |
63 (54,3) |
|
|
ФК |
I |
45 (71,5) |
|
II |
13 (20,6) |
|
|
III |
5 (7,9) |
|
|
Степень поражения легких при COVID-19 по КТ ОГК во время госпитализации, n (%) |
КТ-1 (< 25%) |
17 (14,7) |
|
КТ-2 (25–50%) |
36 (31) |
|
|
КТ-3 (50–75%) |
49 (42,2) |
|
|
КТ-4 (> 75%) |
14 (12,1) |
|
Примечание: здесь и далее в таблице 2: ИМТ индекс массы тела, САД – систолическое артериальное давление, ДАД – диастолическое артериальное давление, ЧСС – частота сердечных сокращений, ИБС – ишемическая болезнь сердца, АГ артериальная гипертония, ФК – функциональный класс, КТ ОГК – компьютерная томография органов грудной клетки.
Таблица 2 . Сравнительная характеристика клинико-анамнестических показателей у пациентов с хронической сердечной недостаточностью и без нее через 12 месяцев после перенесенного поражения легких при COVID-19
Table 2 . Comparative characteristics of clinical and anamnestic parameters in patients with and without CHF 12 months after suffering lung damage from COVID-19
|
Показатели |
ХСН нет, n = 53 |
ХСН есть, n = 63 |
p |
|
|
Возраст, лет, Me [Q1; Q3] |
52 [47; 56] |
54 [48; 56] |
0,53 |
|
|
Пол: мужчины, n (%) |
25 (47,2) |
36 (57,1) |
0,35 |
|
|
ИМТ, кг/м2, Me [Q1; Q3] |
28,3 [26; 30,7] |
31,6 [27,7; 35,7] |
< 0,01 |
|
|
Курение, n (%) |
19 (35,8) |
27 (42,8) |
0,37 |
|
|
САД, мм рт. ст., М ± SD |
127,1 ± 14,4 |
131,5 ± 14,5 |
0,59 |
|
|
ДАД, мм рт. ст., М ± SD |
84,4 ± 10 |
86,3 ± 11,8 |
0,28 |
|
|
ЧСС, уд/мин, М ± SD |
73,6 ± 9,2 |
76,9 ± 11,04 |
0,25 |
|
|
ИБС, n (%) |
2 (3,7) |
13 (20,6) |
< 0,01 |
|
|
АГ, n (%) |
32 (60) |
58 (92) |
< 0,01 |
|
|
Степень АГ |
1 |
12 (37,5) |
8 (13,8) |
0,07 |
|
2 |
16 (50) |
28 (48,3) |
||
|
3 |
4 (12,5) |
22 (37,9) |
||
|
Нарушение ритма, n (%) |
8 (15,1) |
9 (14,2) |
0,54 |
|
|
Степень поражения легких при COVID-19 по КТ ОГК во время госпитализации, n (%) |
КТ-1 (< 25%) |
9 (17) |
6 (9,5) |
0,07 |
|
КТ-2 (25–50%) |
20 (37,7) |
16 (25,4) |
||
|
КТ-3 (50–75%) |
19 (35,8) |
30 (47,6) |
||
|
КТ-4 (> 75%) |
5 (9,5) |
11 (17,5) |
||
Таблица 3 . Сравнительный анализа биохимических показателей у пациентов с хронической сердечной недостаточностью и без нее через 12 месяцев после перенесенного поражения легких при COVID-19
Table 3 . Comparative analysis of biochemical parameters in patients with and without CHF 12 months after suffering lung damage from COVID-19
|
Показатели |
ХСН нет, n = 53 |
ХСН есть, n = 63 |
p |
|
Me [Q1; Q3] |
Me [Q1; Q3] |
||
|
Лейкоциты, 10 × 9/л |
5,3 [4,3; 5,9] |
5,95 [4,8; 7,6] |
0,01 |
|
СОЭ, мм/ч |
12 [9; 20] |
13 [8,0; 20] |
0,75 |
|
Тромбоциты, 10 × 9/л |
181 [145; 206] |
238 [220,5; 317,5] |
0,01 |
|
Креатинин, мкмоль/л |
72,6 [62,6; 80,1] |
68,1 [60,3; 78,4] |
0,24 |
|
АСТ, Ед/л |
20,6 [15,8; 24,3] |
20,1 [16,7; 27,5] |
0,44 |
|
АЛТ, Ед/л |
22,5 [16; 27,7] |
22,1 [15,5; 34,3] |
0,65 |
|
ОХС, ммоль/л |
5,6 [5,1; 6,3] |
5,9 [5,2; 6,8] |
0,04 |
|
ХС-ЛПВП, ммоль/л |
1,3 [1,1; 1,8] |
1,2 [1,0; 1,4] |
0,03 |
|
ХС-ЛПНП, ммоль/л |
3,4 [2,8; 3,9] |
3,8 [3,0; 4,5] |
< 0,01 |
|
ХС-ОНП, ммоль/л |
0,54 [0,39; 0,75] |
0,75 [0,5; 1,1] |
< 0,01 |
|
ТГ, ммоль/л |
1,18 [0,87; 1,64] |
1,64 [1,24; 2,4] |
< 0,01 |
|
Глюкоза натощак |
5,4 [5,74; 5,94] |
5,8 [4,9; 6,9] |
0,32 |
|
HbA1c, % |
5,8 [5,4; 6,1] |
6,2 [5,8; 7,6] |
0,01 |
|
КФК, Ед/л |
98,9 [76,8; 151,5] |
89,3 [70,7; 110,6] |
0,13 |
|
КФК-МВ, Ед/л |
12,1 [9,4; 14,9] |
12,6 [9,8; 15,1] |
0,87 |
|
ЛДГ, Ед/л |
179,5 [161; 192] |
189,5 [165,7; 205,6] |
0,08 |
Таблица 4 . Сравнительный анализа иммунологических показателей у пациентов с хронической сердечной недостаточностью и без нее через 12 месяцев после перенесенного поражения легких при COVID-19
Table 4 . Comparative analysis of immunological parameters in patients with and without CHF 12 months after suffering lung damage from COVID-19
|
Показатели |
ХСН нет, n = 53 |
ХСН есть, n = 63 |
p |
|
Me [Q1; Q3] |
Me [Q1; Q3] |
||
|
ВЧ СРБ, мг/л |
3,26 [1,72; 4,58] |
6,1 [3,8; 10,9] |
< 0,01 |
|
Гомоцистеин, мкмоль/л |
11,4 [9,5; 14,2] |
11,2 [8,5; 15,3] |
0,79 |
|
ИЛ-1β, пг/мл |
1,88 [1,48; 2,45] |
2,36 [1,69; 3,14] |
0,06 |
|
ИЛ-6, пг/мл |
2,5 [2; 3,7] |
3,1 [2,5; 4,1] |
0,03 |
|
ИЛ-8, пг/мл |
12,1 [8,9; 15,1] |
15,3 [12,1; 18,4] |
< 0,01 |
|
NT-proBNP, пг/мл |
61 [25,0; 136,4] |
71,7 [27,0; 143,8] |
0,43 |
|
ФНО, пг/мл |
5,6 [4,0; 7,2] |
5,86 [4,8; 7,2] |
0,39 |
1 - Специфичность
Ди)гон)ль«ьи сегменты. сгенерированные сетями
Рисунок 1. ROC-кривая диагностической значимости гликированного гемоглобина в прогнозе хронической сердечной недостаточности Figure 1. ROC curve of glycated hemoglobin in the prognosis of CHF
Таблица 5 . Характеристика коэффициентов уравнения логистической регрессии
Table 5 . Indicators of the logistic regression
|
Показатели |
Коэффициент В |
Стандартная ошибка |
Статистика Вальда |
р |
Ехр. (В) |
|
HbA1c, % |
2,680 |
1,163 |
5,310 |
0,021 |
14,59 |
|
ХС-ЛПНП, ммоль/л |
1,553 |
0,776 |
4,005 |
0,045 |
4,726 |
|
ИЛ-8, пг/мл |
0,206 |
0,125 |
2,709 |
0,10 |
1,228 |
|
ИБС (0 – нет; 1 – есть) |
1,842 |
0,794 |
5,388 |
0,02 |
6,311 |
|
Константа |
–25,65 |
10,544 |
5,92 |
0,015 |
0,000 |
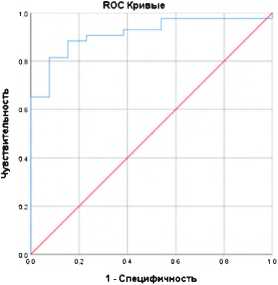
Рисунок 2. ROC-кривая диагностической значимости полученной регрессионной модели прогноза хронической сердечной недостаточности
Figure 2. ROC curve of the regression model for the prognosis of CHF
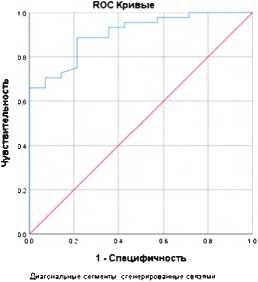
Рисунок 3. ROC-кривая диагностической значимости регрессионной модели прогноза хронической сердечной недостаточности без учета влияния ишемической болезни сердца
Figure 3. ROC curve of the regression model for the prognosis of CHF without coronary heart disease
Таблица 6 . Характеристика коэффициентов уравнения логистической регрессии без учета влияния ишемической болезни сердца
Table 6 . Characteristics of logistic regression indicators without coronary heart disease
С помощью ROC-анализа оценено диагностическое качество полученной регрессионной модели: площадь под ROC-кривой AUC = 0,91, 95% ДИ AUC: (0,8; 1,0) ( p < 0,0001). Пороговая вероятность cut-off – 0,46. Чувствительность модели составила 90,1%, специфичность – 79,3% (рис. 2).
Для подтверждения диагностической значимости полученных предикторов была дополнительно построена еще одна статистически значимая модель логистической регрессии без учета влияния ИБС ( p = 0,001). Диагностическая точность модели составила 81%. Характеристика полученных коэффициентов представлена в таблице 6.
Согласно результатам ROC-анализа полученной регрессионной модели прогноза развития ХСН без учета влияния ИБС, площадь кривой AUC составила 0,901, 95% ДИ AUC: (0,83; 0,92) ( p < 0,0001). Чувствительность модели – 88%, специфичность – 78,6% (рис. 3).
Для использования полученного уравнения логистической регрессии в практическом здравоохранении была разработана и зарегистрирована программа для ЭВМ
(патент № 2024681351), которая облегчает применение прогностической модели в рутинной практике врачей различных специальностей.
Обсуждение
Влияние нарушений углеводного обмена на развитие ХСН у пациентов, перенесших поражение легких в результате COVID-19, остается недостаточно изученным, о чем свидетельствует ограниченное количество научных работ, посвященных данной проблеме [8]. При этом в прогностических моделях, разрабатываемых для оценки риска ХСН в постковидном периоде, биохимические параметры зачастую не учитываются в полной мере [9]. В рамках проведенного исследования подтвердилась диагностическая значимость иммуно-биохимических показателей в аспекте прогнозирования ХСН у пациентов после COVID-19. Особое внимание в исследовании уделено вкладу ИБС в формирование ХСН. Представленные показатели продемонстрировали высокую диагностическую эффективность в моделях прогноза с учетом влияния ИБС и без учета ее влияния. Одним из ведущих предикторов ХСН в постковидном периоде стал HbA1c, что во многом обосновано. Хроническая гипергликемия после острого COVID-19 способствует поддержанию длительного системного воспалительного ответа [10] и оказывает существенное влияние на формирование сердечно-сосудистой патологии [11]. Каскад патофизиологических процессов, включая гликозилирование белков и активацию полиолового пути окисления глюкозы [11], приводит к снижению функциональной активности кардиомиоцитов. Окислительный стресс и избыточное образование свободных радикалов вызывают разрушение клеточных структур, усиливают воспалительный ответ и потенцируют дисфункцию эндотелия [12]. В исследовании Д.К. Менезе и соавт. [13] была подтверждена значимость уровня HbA1c в постковидном периоде. У пациентов с выраженными длительными проявлениями COVID-19 наблюдался повышенный уровень HbA1c, который коррелировал с госпитализацией в острой фазе заболевания и появлением сопутствующей симптоматики. Высокий уровень HbA1c также был ассоциирован с нарушениями кардиометаболического гомеостаза после острой фазы COVID-19 [11–13].
Диагностическую эффективность в прогнозе ХСН после COVID-19 также продемонстрировал ХС-ЛПНП. Повышение уровня ХС-ЛПНП и ТГ может способствовать развитию атеросклеротических изменений и усугублять состояние пациентов с уже существующими сердечно-сосудистыми патологиями [14]. В крупном исследовании, включавшем 51 919 пациентов из базы данных Министерства по делам ветеранов США, были выявлены повышенные уровни ЛПНП, ТГ и ОХС, а также снижение уровня ЛПВП у лиц, перенесших поражение легких при COVID-19 по сравнению с контрольной группой [14]. Степень выраженности дислипидемии коррелировала с тяжестью острой фазы заболевания и необходимостью госпитализации в отделение интенсивной терапии. T. Liu и соавт. [15] выявили сильную взаимосвязь между уровнем ХС-ЛПНП и развитием долгосрочных сердечно-сосудистых осложнений после COVID-19. Предполагается, что эти осложнения могут быть также ассоциированы с воспалительными процессами и гиперкоагуляцией [14, 15].
Важно отметить, что SARS-CoV-2 провоцирует длительный системный воспалительный ответ, в котором ключевую роль кроме хронической гипергликемии играют провоспалительные цитокины. Ряд авторов подчеркивают влияние интерлейкинов (ИЛ-6 и ИЛ-8) в патогенезе ХСН у пациентов после COVID-19, что согласуется с высокой предикторной значимостью ИЛ-8 в рамках представленного исследования [16]. Согласно литературным источникам, ИЛ-8 ассоциируется с тяжелым течением постко-видного синдрома, развитием одышки и эндотелиальной дисфункции [16]. Эксперименты in vitro, проведенные A. Sharma и соавт. [17] на кардиомиоцитах, выделенных из плюрипотентных стволовых клеток человека, продемонстрировали способность SARS-CoV-2 инфицировать клетки миокарда и вызывать их апоптоз. При этом было установлено, что прямое вирусное воздействие на кардиомиоциты сопровождается повышением экспрессии ряда белков, включая NT-proBNP, ИЛ-6, ИЛ-8 и ФНО [18]. ИЛ-8, как отмечают C. Schultheiß и соавт., выступает в качестве профиброзного фактора, оказывающего прямое влияние на кардиомиоциты. Повышенный уровень этого цитокина может свидетельствовать о продолжающемся повреждении тканей в постковидном периоде, играющем ключевую роль в формировании долгосрочных последствий COVID-19 [19].
Точные механизмы развития сердечно-сосудистой патологии, включая ХСН, в постковидном периоде остаются недостаточно изученными и требуют дальнейших масштабных исследований с длительным периодом наблюдения.
Выводы
Показатели HbA1c, ХС-ЛПНП, ИЛ-8, наряду с ИБС, имеют высокую прогностическую значимость в развитии ХСН у пациентов, перенесших поражение легких при COVID-19. Мониторинг показателей углеводного обмена, таких как HbA1c, ХС-ЛПНП, ИЛ-8, является важным аспектом в управлении сердечно-сосудистыми рисками у пациентов, перенесших COVID-19. Модель прогноза может быть использована в практическом здравоохранении, что, в свою очередь, позволит снизить тяжесть сердечно-сосудистых осложнений.


