Влияние адсорбции атомов и молекул кислорода на электронное строение графеновой наноленты
Автор: Шамина Елена Николаевна, Лебедев Николай Геннадьевич
Журнал: Математическая физика и компьютерное моделирование @mpcm-jvolsu
Рубрика: Физика
Статья в выпуске: 4 (41), 2017 года.
Бесплатный доступ
В работе представлены результаты квантово-химических полуэмпирических исследований процессов адсорбции атомов и молекул кислорода на поверхности графеновой наноленты. Расчеты выполнены на основе модели молекулярного кластера c граничными псевдоатомами с использованием полуэмпирических расчетных схем MNDO и PM3. Определены энергетические характеристики процессов адсорбции.
Модель молекулярного кластера, квантовая химия, энергия адсорбции
Короткий адрес: https://sciup.org/14969053
IDR: 14969053 | УДК: 541.138 | DOI: 10.15688/mpcm.jvolsu.2017.4.9
Текст научной статьи Влияние адсорбции атомов и молекул кислорода на электронное строение графеновой наноленты
DOI:
Графеновые наноленты (ГНЛ) рассматриваются в литературе в качестве перспективного материала для создания таких устройств, как полевые транзисторы, коммутационные устройства, сенсоры и др. Одним из преимуществ их использования является зависимость электронных свойств от характерных размеров наноленты и геометрии краев [7]. Электронные свойства ГНЛ могут быть модифицированы посредством внесения в структуру нанолент дефектов, таких как вакансий [6] или посредством адсорбции атомов или молекул [4; 5; 8].
Ранее в ряде работ был изучен вопрос о зависимости электронных свойств оксидированных углеродных наноструктур от их геометрии и положения адатома. В частности, в работах [2–3] на основе полуэмпирических исследований авторами была показана осциллирующая зависимость энергий адсорбции процессов оксидирования от диаметра и хиральности углеродной нанотрубки. Чередование минимальных и максимальных значений энергий с ростом диаметра трубок позволило определить оптимальные диаметры хиральных УНТ, на которых адсорбция атомарного и молекулярного кислорода реализуется наиболее эффективно в том смысле, что формируется энергетически более устойчивая система. В работе [9] авторами, в рамках теории функционала плотности, был изучен вопрос о зависимости электронных свойств молекулярно окидированного графена от положения адсорбированной молекулы кислорода относительно поверхности. Было показано, что конфигурация, в которой связь O-O параллельна поверхности, характеризуется наибольшим значением энергии адсорбции (особенно над центром шестиугольника), чем та, где связь O-O перпендикулярна поверхности.
В данной работе представлены результаты расчета энергетических характеристик процессов адсорбции атома кислорода и диссоциативной адсорбции молекулы кислорода на поверхности графеновых нанолент типа «arm-chair». Проведено исследование электронных свойств таких структур в зависимости от концентрации атомов на поверхности и их геометрического расположения.
Расчеты электронного строения данных структур выполнены в рамках модели молекулярного кластера с граничными псевдоатомами с использованием квантово-химических полуэмпиричес-ких методов MNDO и PM3 [1]. Модель молекулярного кластера позволяет сравнительно легко описывать структурные дефекты, функциональные группы на поверхности кристаллов и т. д. Это способствует широкому ее применению в большинстве хемосорбционных и каталитических задач.
Выбор модели
В качестве геометрических моделей изучаемых нанолент выбраны кластеры, содержащие 3 шестиатомных цикла (гексагона) по ширине и от 3 до 6 элементарных ячеек (ЭЯ) по длине. Граничные разорванные химические связи замыкались атомами водорода, которые выбирались в качестве граничных псевдоатомов.
В работе рассмотрено три варианта положения атомарного и молекулярного кислорода (рис. 1). Положение адатомов кислорода в одном случае выбрано над центром С–С-связи, так как он является двухвалентным при формировании ионно-ковалентных связей (рис. 1, а ), а в другом случае непосредственно над атомами углерода поверхности наноленты (рис. 1, в ). Положение адсорбирующейся молекулы кислорода выбрано параллельно С–С-связи (рис. 1, б ).
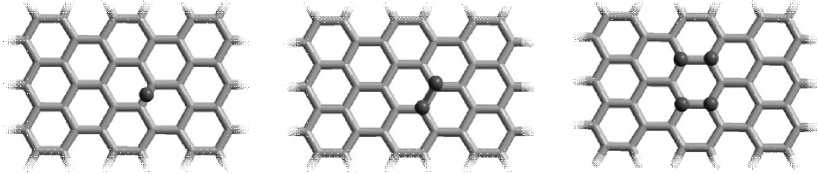
а б в
Рис. 1. Фрагменты структуры графеновой наноленты с указанием положения адсорбирующихся частиц: а – атом кислорода над центром С–С-связи; б – молекула кислорода параллельно С–С-связи;
в – атомы кислорода над атомами углерода
Кроме того, адсорбирующиеся частицы помещались в центральной части наноленты, чтобы уменьшить влияние граничных псевдоатомов.
Обсуждение результатов
Рассчитаны следующие основные электронно-энергетические характеристики: энергии граничных орбиталей Е ВЗМО и Е НВМО; энергия адсорбции Е ад и ширина запрещенной щели Е g и изменение ширины запрещенный зоны Δ Eg , обусловленное адсорбцией.
В результате адсорбции атом кислорода образует две химические связи с соседними атомами углерода, молекула кислорода диссоциирует на атомы, которые образуют по две химической связи с поверхностными активными центрами С, при этом происходит деформация поверхности наноленты так, что атомы углерода смещаются с положений равновесия наружу наноленты. В результате такой деформации связи С–С углеродных гексагонов, над которыми происходило присоединение О2, удлинились по сравнению с невозмущенными значениями в среднем на 9 %.
Анализ результатов показывает, что увеличение длины наноленты приводит к изменению энергетических характеристик процессов оксидирования углеродных нанолент. Величины энер- гий верхней занятой и нижней вакантной МО зависят от длины наноленты: ЕВЗМО монотонно уменьшается, а ЕНВМО – увеличивается (рис. 2). С увеличением длины наноленты разница между энергиями граничных орбиталей убывает, что свидетельствует об увеличении перекрывания между валентной зоной и зоной проводимости и увеличении реакционной способности системы. То есть адсорбированные на поверхности частицы увеличивают сродство ГНЛ к другим атомам или молекулам.
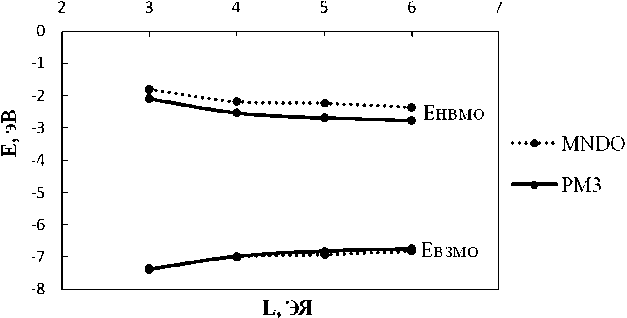
а
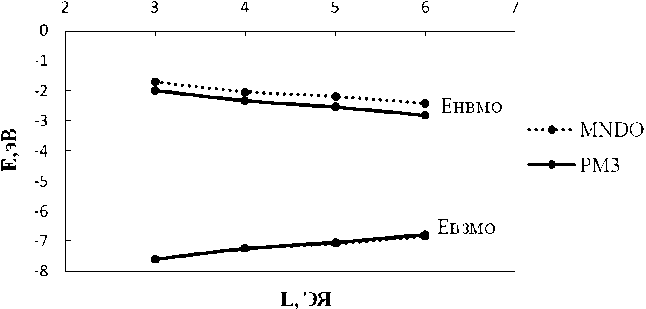
б
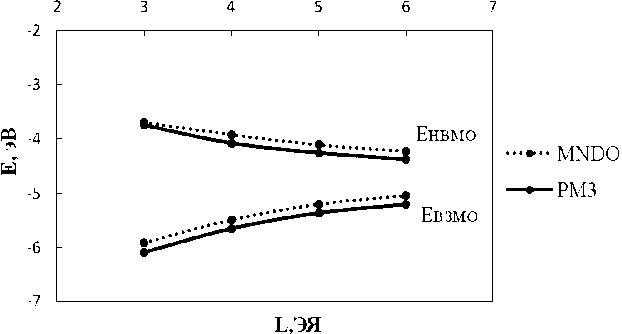
Рис. 2. Энергия граничных орбиталей ГНЛ с адсорбирующимися частицами как функция длины: а – один адатом кислорода; б – молекула кислорода; в – четыре адатома кислорода
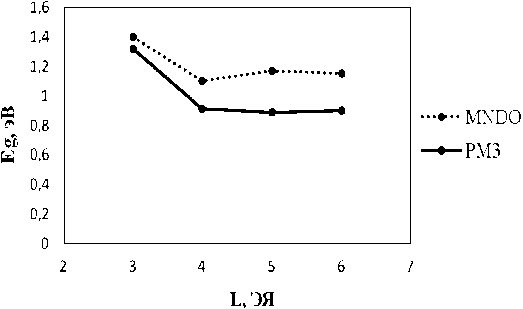
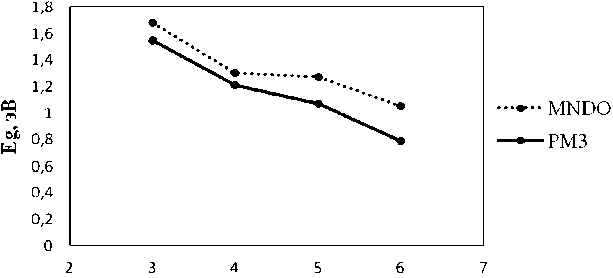
Адсорбированные частицы можно рассматривать как дефект структуры – квантовую точку, поляризующую поверхность ленты. Квантовая точка на поверхности создает дополнительные локализованные квантовые состояния электронов, которые могут заполняться электронами системы. Согласно расчетам величина энергии запрещенной щели Еg у ГНЛ с одним атомом кислорода возрастает в пределах ~1,1 ÷ 1,4 эВ (MNDO) и ~0,89 ÷ 1,32 эВ (PM3). При адсорбции молекулы кислорода и ее диссоциации значения величины энергии запрещенной зоны колеблются в пределах значений ~1,05 ÷ 1,68 эВ (MNDO) и ~0,79 ÷ 1,55 эВ (PM3). Величина энергии запрещенной щели Еg у ГНЛ с четырьмя атомами кислорода составляет ~1,21 ÷ 1,67 эВ (MNDO) и ~1,27 ÷ 1,61 эВ (PM3). Полученные данные свидетельствуют о полупроводниковых свойствах изучаемых нанолент.
а
ь,эя
б
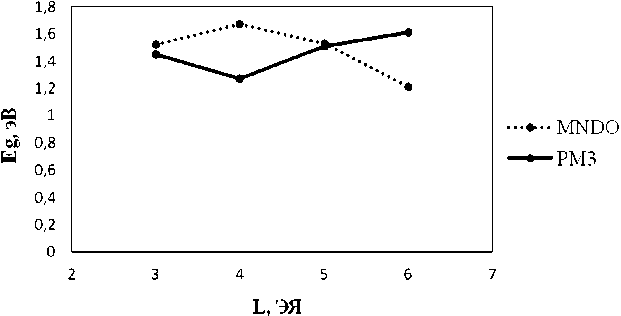
Рис. 3. Энергия запрещенной зоны оксида ГНЛ как функция длины: а – один адатом кислорода; б – молекула кислорода; в – четыре адатома кислорода
Следует заметить, что с увеличением длины наноленты энергия Eg уменьшается (см. рис. 3, а , б ). Это говорит об увеличении «металличности» изучаемой структуры, что соответствует экспериментальным данным: бесконечная графеновая поверхность обладает проводящими свойствами. Однако следует отметить, что при адсорбции четырех атомов кислорода наблюдается отсутствие корреляции численных результатов, полученных разными полуэмпирическими методами (рис. 3, в ). Данное расхождение, на наш взгляд, связано с параметризацией использованных полуэмпири-ческих методов. При этом метод PM3 использует модифицированную формулу для межатомного взаимодействия [1], что приводит к увеличению энергии взаимодействия между молекулами кислорода, адсорбированными на поверхности ГНЛ. Сильная корреляция между молекулами O2 влияет на энергию первого электронного перехода, которая сопоставляется с величиной Eg.
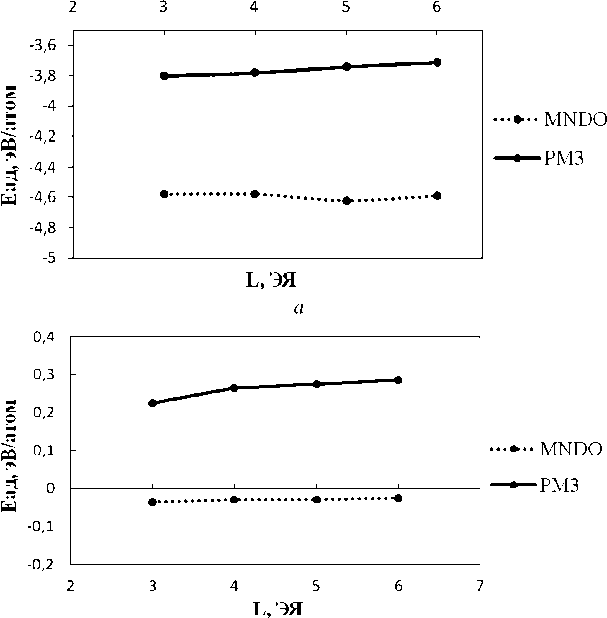
Зависимости энергии химической связи (энергии адсорбции) от длины наноленты пред . ставлены на рисунке 4. Для структуры, содержащей n адсорбированных атомов кислорода, энергия химической связи E ад( n ), приходящаяся на один адсорбированный атом, рассчитывалась следующим образом:
Eад(n) = (Etotal – EGNR – nEO) / n, где Etotal – энергия графеновой наноленты или ее фрагмента (с адсорбированными атомами кислорода на поверхности); EGNR – полная энергия чистой ГНЛ; EО – энергия изолированного атома кислорода.
Кривые на рисунке 4 наглядно демонстрируют, что энергия связывания атома кислорода колеблется около некоторого постоянного значения. При адсорбции одного атома кислорода энергия химической связи составляет в среднем -4,5 эВ в методе MNDO и -3,7 эВ в методе PM3. Отрицательные значения энергии адсорбции указывают на то, что система находится в устойчивом состоянии. При адсорбции четырех атомов кислорода энергия химической связи составляет в среднем -4,2 эВ в методе MNDO и -3,7 эВ в методе PM3.
б
Рис. 4. Энергия адсорбции кислорода как функция длины ГНЛ:
а – один адатом кислорода; б – молекула кислорода; в – четыре адатома кислорода (см. также с. 100)
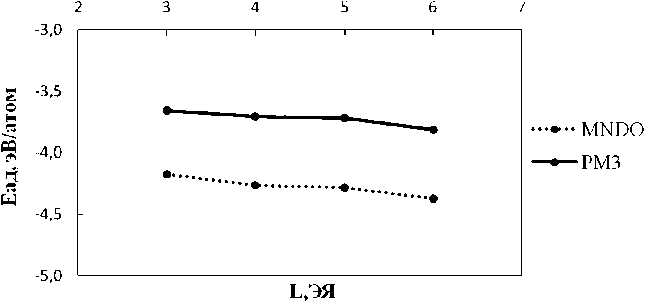
Рис. 4. Окончание
Но при этом наблюдается слабое монотонное убывание величины E ад (рис. 4, в ) с ростом длины ленты, что свидетельствует об увеличении устойчивости образованного оксида ГНЛ и уменьшении влияния границ ленты на процесс адсорбции. При адсорбции молекулы кислорода энергия химической связи составляет в среднем -0,03 эВ в методе MNDO и 0,25 эВ в методе PM3. То есть такое положение молекулы над поверхностью графеновой наноленты является энергетически менее выгодным. Данные результаты хорошо согласуются с аналогичными расчетами с помощью неэмпирических методов [9].
Заключение
На основе модели молекулярного кластера с использованием квантово-химических полу-эмпирических методов MNDO и PM3 изучены электронные свойства графеновых нанолент с адсорбированными атомами и молекулами кислорода. Показана зависимость энергетических характеристик процесса адсорбции от конфигурации адатома и концентрации адатомов. В частности, наибольшая эффективность адсорбции наблюдается в тех случаях, когда адатом кислорода располагается над центром С–С-связи. Поэтому адсорбированные на поверхности ГНЛ молекулы кислорода диссициируют на отдельные адатомы, которые адсорбируются над центрами С–С-связей.
Из анализа результатов расчета следует, что энергия адсорбции адатома кислорода и молекулы кислорода слабо зависит от длины наноленты, а двух молекул кислорода монотонно возрастает с увеличением длины ГНЛ.
Список литературы Влияние адсорбции атомов и молекул кислорода на электронное строение графеновой наноленты
- Степанов, Н. Ф. Квантовая механика и квантовая химия/Н. Ф. Степанов. -М.: Мир, 2001. -519 с.
- Шамина, Е. Н. Влияние хиральности углеродных нанотрубок на диссоциативную адсорбцию молекулярного кислорода на поверхности/Е. Н. Шамина, Н. Г. Лебедев//Журнал физической химии. -2015. -№ 5 (89). -С. 806-811.
- Шамина, Е. Н. Хиральный эффект адсорбции атомарного кислорода на поверхности углеродных нанотрубок/Е. Н. Шамина, Н. Г. Лебедев//Вестник Волгоградского государственного университета. Серия 1, Математика. Физика. -2013. -№ 1 (18). -С. 90-97.
- Electronic, structural, and transport properties of Ni-doped graphene nanoribbons/V. A. Rigo, T. B. Martins, J. R. Antonio da Silva //Phys. Rev. B. -2009. -Vol. 79. -Р. 075435.
- Enhanced half-metallicity in edge-oxidized zigzag graphene nanoribbons/O. Hod, V. Barone, J. Peralta //Nano Lett. -2007. -Vol. 7 (8). -Р. 2295-2299.
- Miller, M. Defect induced distortion of armchair and zigzag graphene and boron nitride nanoribbons/M. Miller, F. J. Owens//Chem. Phys. Lett. -2013. -Vol. 570. -P. 42-45.
- Son, Y. W. Energy Gaps in Graphene Nanoribbons/Y. W. Son, M. L. Cohen, S. G. Louie//Phys. Rev. Lett. -2006. -Vol. 9 (21). -P. 216803-216806.
- Wang, Z. Adsorption of transition metal atoms (Co and Ni) on zigzag graphene nanoribbon/Z. Wang, J. Xiao, M. Li//Appl. Phys. A. -2013. -Vol. 110 (1). -P. 235-239.
- Yu, S. S. Oxidation of Graphene Nanoribbon by Molecular Oxygen/S. S. Yu, W. T. Zheng, J. Qing//IEEE Trans. Nanotechnol. -2008. -Vol. 7 (5). -P. 628-635.


