Влияние активных форм кислорода на Cа2+-активируемую K+-проницаемость эритроцитов больных артериальной гипертензией в сочетании с сахарным диабетом 2-го типа
Автор: Трубачева О.А.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 1-1 т.26, 2011 года.
Бесплатный доступ
В настоящем исследовании методом регистрации мембранного потенциала по изменениям рН среды инкубации в присутствии протонофора изучено влияние супероксид-аниона и перекиси водорода на Са2+-зависимую калиевую проницаемость мембраны эритроцитов больных артериальной гипертензией в сочетании с сахарным диабетом 2-го типа и здоровых доноров. Продукты системы ксантин-ксантиноксидаза оказывают различное действие на Са2+-активируемые К+-каналы эритроцитов больных артериальной гипертензией в сочетании с сахарным диабетом 2-го типа и здоровых доноров. Супероксид-анион при его аппликации с наружной стороны мембраны не изменяет активность Са2+-активируемых К+-каналов как больных, так и здоровых доноров. Перекись водорода увеличивает Са2+-зависимую К+-проницаемость мембраны эритроцитов больных и снижает ее у здоровых доноров, но только при обработке эритроцитов ингибитором каталазы. Совместное действие перекиси водорода и агониста 1-адренэргических рецепторов L-фенилэфрина, либо ФМА и перекиси водорода значительно увеличивает Са2+-зависимую К+-проницаемость мембраны эритроцитов здоровых доноров, но не изменяет ее у больных артериальной гипертензией в сочетании с сахарным диабетом 2-го типа.
Артериальная гипертензия, сахарный диабет 2-го типа, эритроциты, ca2+-активируемые калиевые каналы, активные формы кислорода
Короткий адрес: https://sciup.org/14919356
IDR: 14919356 | УДК: 612.111.6:612.23:[612.12-008.331.1:616.379-008.64-098]
Текст научной статьи Влияние активных форм кислорода на Cа2+-активируемую K+-проницаемость эритроцитов больных артериальной гипертензией в сочетании с сахарным диабетом 2-го типа
При ряде заболеваний, сопровождающихся окислительным повреждением эритроцитов, в частности при ар- териальной гипертензии и сахарном диабете, наблюдаются типовые изменения со стороны клеток красной крови [3]: повышение внутриклеточной концентрации ионов кальция, снижение их деформируемости, сокращение продолжительности жизни [9–11]. Известно, что Са2+-ак-тивируемые К+-каналы – К+(Са2+)-каналы эритроцитов – играют важную роль в программируемой гибели клетки и их деформируемости [7].
Нельзя исключить, что в условиях повышенной продукции АФК, которая отмечается при артериальной гипертензии (АГ) и сахарном диабете (СД) 2-го типа, изменяется как функционирование самих К+(Са2+)-каналов, так и внутриклеточных сигнальных систем, участвующих в их регуляции. Однако данные об участии АФК в регуляции К+(Са2+)-каналов эритроцитов человека немногочисленны.
В связи с вышесказанным представляется весьма актуальным изучение роли АФК в регуляции К+(Са2+)-кана-лов эритроцитов как в норме, так и при патологическом процессе, сопровождающемся окислительным повреждением эритроцитов. Цель исследования: оценить вклад супероксид-аниона и перекиси водорода в регуляцию Са2+-зависимой калиевой проницаемости мембраны эритроцитов больных артериальной гипертензией в сочетании с сахарным диабетом 2-го типа.
Материал и методы
В работе использовалась кровь больных АГ в сочетании с СД 2-го типа (38 человек) и кровь практически здоровых доноров (27 человек). Клинический диагноз верифицировали с помощью клинико-лабораторных методов исследования на базе отделения атеросклероза и хронической ишемической болезни сердца НИИ кардиологии СО РАМН (руководитель – академик РАМН Р.С. Карпов). Группы исследуемых соответствовали по полу и возрасту. Кровь забиралась из локтевой вены утром натощак в пробирки с гепарином (25 ед./мл крови). После центрифугирования (1000g, 5 мин, 4 ° С) плазму и клетки белой крови удаляли, а эритроциты дважды промывали 3 частями изоосмотического раствора NaCl (150 мМ), содержащего 5 мМ Na-фосфатный буфер (рН 7,4) при тех же условиях центрифугирования.
Для исследования К+(Са2+)-каналов был применен метод регистрации мембранного потенциала в суспензии эритроцитов по изменениям рН среды инкубации в присутствии протонофора, основанный на том, что в этих условиях распределение протонов зависит от мембранного потенциала [4]. Эксперименты проводились по следующему плану: для получения гиперполяризационного ответа к 4,75 мл среды инкубации (среда N), содержащей 150 мМ NaCl, 1 мМ KCl, 1мM MgCl2, 10 мM глюкозы и 10 мкМ СаСl2, добавляли 0,25 мл упакованных эритроцитов. Через 5 мин инкубации при 37 ° С и постоянном перемешивании добавляли протонофор СlССР до конечной концентрации 20 мкМ и спустя 2 мин 0,5 мкМ Са2+-ионофо-ра А23187. Добавление кальциевого ионофора А23187 к суспензии клеток, содержащей хлорид кальция, приводило к выходу ионов калия и развитию гиперполяризационного ответа (ГО) мембраны эритроцитов, что находило свое отражение в изменении рН суспензии. Защелачивание среды инкубации соответствовало гиперполяризации мембраны, а восстановление рН – возвращению мембранного потенциала (МП) к исходному значению. Амплитуда ГО и скорость его развития характеризуют
Са2+-активируемые калиевые каналы, а скорость восстановления МП – активность Са2+-АТФазы [4].
Для получения супероксид-аниона и перекиси водорода использовалась система, включающая ксантин (10-4 М) и ксантиноксидазу (10 мU/мл). Продукцию супе-роксид-аниона оценивали спектрофотометрически по степени восстановления цитохрома С в бесклеточной среде при длине волны 550 нм. Измерения проводились против кюветы, содержащей среду N и цитохром С.
Спектрофотометрические исследования показали, что максимальная продукция супероксид-аниона наблюдалась при 10 минутах инкубации. Концентрация суперок-сид-аниона в среде инкубации в описанных условиях составила 9 мкМ. Другим продуктом реакции с участием ксантиноксидазы является перекись водорода, что находит свое отражение в снижении содержания супероксид-аниона. В ряде экспериментов среда инкубации клеток содержала 5∙10–8 М, 10–7 М и 10–6 М перекиси водорода (Н2О2), либо 0,026 М ингибитора каталазы аминотразола в присутствии соответствующих концентраций Н2О2. Стимуляцию α 1-адренэргических рецепторов эритроцитов проводили добавлением L-фенилэфрина гидрохлорида (10–8 М). Для активации протеинкиназы C был использован форболовый эфир (РМА – phorbol 12-myristate-13-acetate) в концентрации 10–7 М, который добавлялся в среду инкубации эритроцитов.
Анализ данных проводили при помощи программы Statistica 6.0 for Windows фирмы Statsoft. Фактические данные представлены в виде “среднее ± ошибка среднего” (X±m). Для определения характера распределения полученных данных использовали критерий нормальности Колмогорова–Смирнова. Сформированные выборки не подчинялись закону нормального распределения, поэтому для проверки статистических гипотез были использованы непараметрические критерии. Для проверки гипотезы об однородности двух независимых выборок использовался U-критерий Манна–Уитни (Mann–Whitney U-test). Для проверки однородности парных или зависимых выборок был использован Т-критерий Вилкоксона (Wilcoxon mached pairs test). Различия считали статистически значимыми при уровне значимости р<0,05.
Результаты и обсуждение
В первой серии экспериментов исследовали влияние системы ксантин (10 –4 М) и ксантиноксидаза (10 мU/мл) на параметры ГО эритроцитов больных АГ в сочетании с СД 2-го типа. Прединкубация эритроцитов с ксантином и ксантиноксидазой проходила в течение 10, 20 и 30 минут.
Амплитуда ГО эритроцитов больных АГ в сочетании с СД 2-го типа и здоровых доноров при 10 минутах инкубации достоверно не изменялась. Возможно, это связано с тем, что супероксид-анион не проникает через мембрану клеток, а его действие снаружи не оказывает воздействия на K+(Ca2+)-каналы.
Увеличение времени инкубации эритроцитов больных АГ в сочетании с СД 2-го типа и системы ксантин и ксантиноксидаза до 20 и 30 минут вызывало достоверное возрастание амплитуды ГО, тогда как этот параметр у здоровых доноров, напротив, снижался (рис. 1).
Скорость развития ГО и скорость восстановления МП у больных АГ в сочетании с СД 2-го типа достоверно не изменялись, тогда как у здоровых эти параметры снижались.
Возможно, обнаруженный эффект связан не с супер-оксид-анионом, а с другим продуктом ксантиноксидазной реакции перекисью водорода.
В следующей серии экспериментов изучено влияние перекиси водорода на K+(Ca2+)-каналы эритроцитов. Амплитуда ГО эритроцитов больных с АГ в сочетании с СД 2-го типа повышалась при всех выбранных концентрациях (рис. 2). Скорость развития ГО и скорость восстановления МП у больных АГ в сочетании с СД 2-го типа статистически значимо не изменялись.
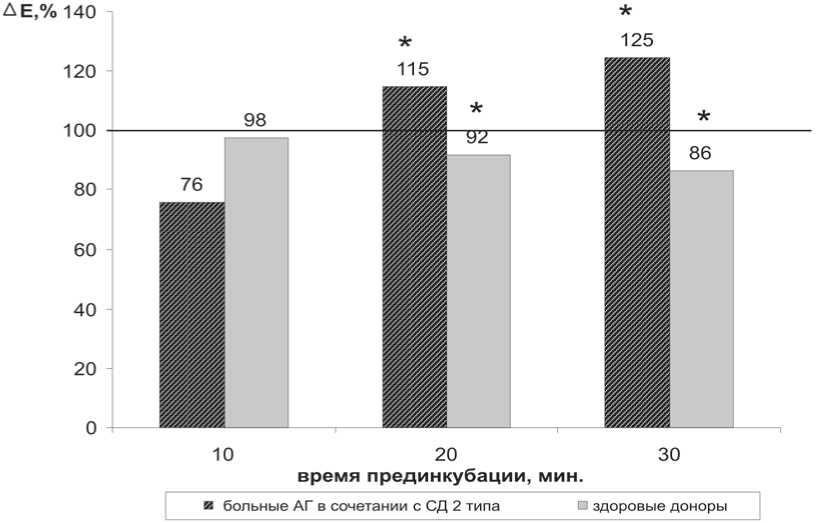
Рис. 1. Влияние времени инкубации с 10–4 М ксантином и 10 мU/мл ксантиноксидазой на амплитуду гиперполяризационного ответа эритроцитов больных АГ в сочетании с СД 2-го типа и здоровых доноров. За 100% приняты значения параметра в отсутствии ксантина и ксантиноксидазы; * – параметры, статистически значимо отличающиеся от контрольных значений, р<0,05
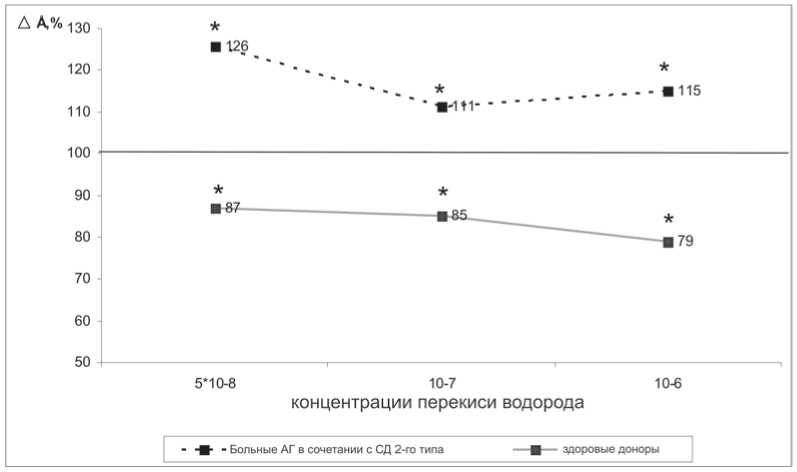
Рис. 2. Влияние перекиси водорода на амплитуду гиперполяризационного ответа эритроцитов больных АГ в сочетании с СД 2-го типа (без добавления аминотриазола) и здоровых доноров (обработанных аминотриазолом). За 100% приняты значения параметра в отсутствии агентов; * – параметры, статистически значимо отличающиеся от контрольных значений, р<0,05
В то же время у здоровых доноров амплитуда ГО статистически значимо не изменялась при всех выбранных концентрациях Н2О2 (рис. 2). Обработка эритроцитов здоровых доноров аминотриазолом – ингибитором каталазы в присутствии всех концентраций перекиси водорода вызывала снижение амплитуды и скорости развития ГО (рис. 2), но при этом увеличивалась скорость восстановления мембранного потенциала. Полученные данные свидетельствуют о снижении Са2+-зависимой калиевой проницаемости и, напротив, об увеличении ак-
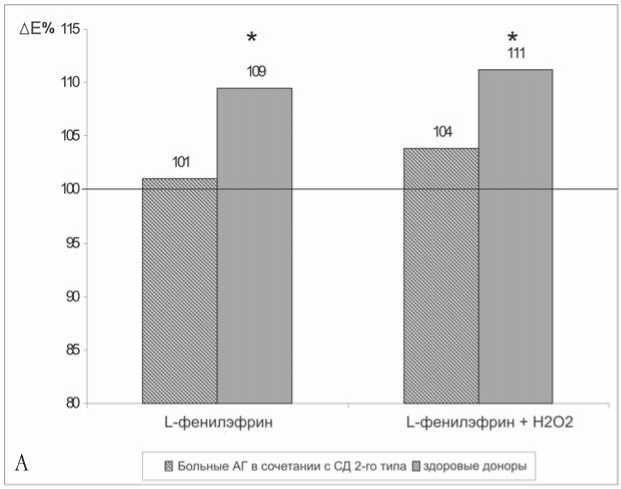
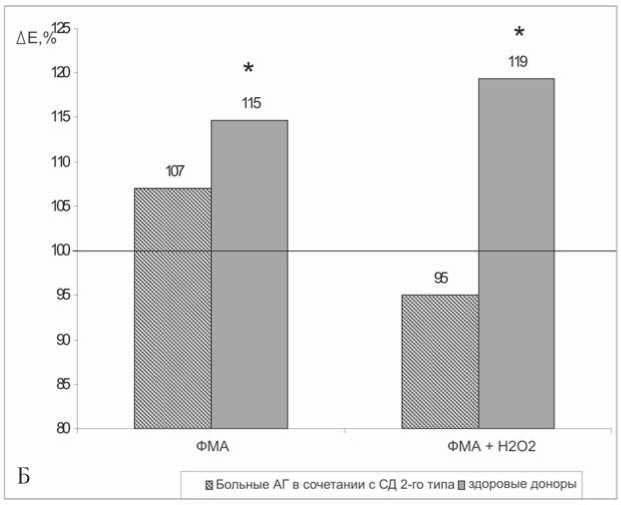
Рис. 3. Совместное влияние L-фенилэфрина (А), форбол-миристат-ацетата (Б) и перекиси водорода на амплитуду гиперполяризационного ответа мембраны эритроцитов больных АГ в сочетании с СД 2-го типа и здоровых доноров. За 100% приняты значения параметра в отсутствии агентов; * – параметры, статистически значимо отличающиеся от контрольных значений, р<0,05
тивности Са2+-насоса мембраны эритроцитов в условиях повышения внутриклеточной концентрации Н2О2. Ранее в работах показано [5], что в формировании Са2+-инду-цированного ГО эритроцитов участвуют не только К+(Са2+)-каналы, но и Са2+-АТФаза: увеличение ее активности снижает амплитуду ГО эритроцитов. Не исключено, что увеличение активности Са2+-АТФазы под действием Н2О2 приводило к описанному эффекту.
При инкубации эритроцитов больных АГ в сочетании с СД 2-го типа с Н2О2 и аминотриазолом параметры ГО достоверно не отличались от полученных в отсутствии ингибитора каталазы.
Результаты исследования позволяют заключить, что Н2О2оказывает существенное влияние на Ca2+-активируемую K+-проницаемость мембраны эритроцитов больных АГ в сочетании с СД 2-го типа. Причиной этого может быть дисбаланс про- и антиоксидантных систем эритроцитов [3], отмечаемый при данных патологиях.
В ряде работ показано участие внутриклеточных сигнальных систем в регуляции К+(Са2+)-каналов эритроцитов [3, 5]. Известно, что активность ряда ферментов, являющихся участниками внутриклеточных регуляторных каскадов, таких, как протеинкиназа С (ПК С), NO-синтаза, гу-анилатциклаза и др., модулируются АФК [12].
В следующей серии экспериментов изучалось совместное влияние Н2О2и агониста α 1-адренэргических рецепторов L-фенилэфрин гидрохлорида на Ca2+-ак-тивируемую K+-проницаемость мембраны эритроцитов. Инкубация эритроцитов больных АГ в сочетании с СД 2-го типа как в присутствии L-фенилэфрина, так и при совместном действии L-фенилэфрина и Н2О2 не приводила к изменению параметров ГО. У здоровых доноров только амплитуда ГО в этих условиях существенно возрастала (рис. 3А).
Одним из ключевых ферментов сигнального пути, опосредованного α 1-адре-нэргическими рецепторами, является протеинкиназа С (ПКС), представленная в эритроцитах изоформой альфа, которая активируется форболовыми эфирами.
В следующей серии экспериментов исследовалось влияние форбол-миристат-ацетата (ФМА) на параметры ГО эритроцитов больных и здоровых доноров. Амплитуда ГО эритроцитов больных АГ в сочетании с СД 2-го типа статистически значимо не изменялась в присутствии ФМА, либо ФМА и Н2О2, тогда как в эритроцитах здоровых доноров этот параметр статистически значимо увеличивался (рис. 3Б).
Известно, что в эритроцитах стимуляция ПК С вызывает увеличение входа ионов кальция, что ведет к активации K+(Ca2+)-каналов [6]. Возможно, в условиях повышения внутриклеточной концентрации Н2О2 увеличивается активность ПК С, стимулированной через α 1-адренэрги-ческие рецепторы, либо ФМА, что ведет к повышенному входу ионов Са2+ и, соответственно, к увеличению Са2+-зависимой К+-проницаемости мембраны эритроцитов, а также возрастанию активности Са2+-насоса. Однако такой эффект проявляется, видимо, только в эритроцитах здоровых доноров. Отсутствие влияния L-фенилэфрина и ФМА на фоне перекиси водорода на К+(Са2+)-каналы эритроцитов больных АГ в сочетании с СД 2-го типа может быть связано с тем, что у этой категории больных активность ПК С изначально увеличена [1]. Кроме того, в условиях повышенной внутриклеточной концентрации ионов кальция, что отмечается у исследованной категории больных [8], дополнительный вход Са2+ может и не приводить к приросту амплитуды ГО.
Таким образом, регуляция K+(Ca2+)-каналов АФК различается в эритроцитах больных АГ в сочетании с СД 2го типа и здоровых доноров, что можно объяснить дисбалансом про- и антиоксидантных систем эритроцитов [3], увеличением степени гликозилирования не только гемоглобина, но и белков мембранного каркаса [1, 2], отмечаемых у больных АГ в сочетании с СД 2-го типа.
Заключение
Таким образом, в настоящем исследовании установлено, что супероксид-анион при его аппликации с наружной стороны мембраны не изменяет активность Са2+-ак-тивиуемых К+-каналов эритроцитов как в группе больных артериальной гипертензией в сочетании с сахарным диабетом 2-го типа, так и у здоровых доноров. Перекись водорода увеличивает Са2+-зависимую К+-проницаемость мембраны эритроцитов больных и снижает ее у здоровых доноров, но только при обработке эритроцитов ингибитором каталазы. Совместное действие перекиси водорода и агониста α 1-адренэргических рецепторов L-фенилэфрина, либо форбол-миристат-ацетата и перекиси водорода значительно увеличивает Са2+-зависимую К+-проницаемость мембраны эритроцитов здоровых доноров, но не изменяет ее у больных артериальной гипертензией в сочетании с сахарным диабетом 2-го типа.
Список литературы Влияние активных форм кислорода на Cа2+-активируемую K+-проницаемость эритроцитов больных артериальной гипертензией в сочетании с сахарным диабетом 2-го типа
- Алекcандровский Я.А. Молекулярные механизмы развития диабетических осложнений//Биохимия. -1998. -Т. 63, Вып. 11. -С. 1470-1479.
- Максимов О.В., Солун М.Н. Особенности липидного состава эритроцитарных мембран у больных сахарным диабетом//Пробл. эндокринол. -1989. -Т. 35, № 2. -С. 14-18.
- Новицкий В.В., Рязанцева Н.В., Степовая Е.А. Физиология и патофизиология эритроцита. -Томск: Изд-во Том. ун-та, 2004. -202 c.
- Орлов С.Н., Петрова И.В., Покудин Н.И. и др. Са2+-активируемые калиевые каналы эритроцитов, исследованные методом регистрации Са2+-индуцированных изменений мембранного потенциала//Биол. мембраны. -1992. -Т. 9, № 9. -С. 885-903.
- Орлов С.Н., Покудин Н.И., Ряжский Г.Г. и др. О механизме регуляции транспорта ионов через плазматическую мембрану при изменении объема клетки//Биологические мембраны. -1988. -Т. 5, № 10. -С. 1030-1041.
- Andrews D.A., Yang L., Low P. S. Phorbol ester stimulates a protein kinase C-mediated agatoxin-TK-sensitive calcium permeability pathway in human red blood cells//Blood. -2002. -Vol. 100. -No. 9. -С. 392-399.
- Bor-Kucukatay M., Rosalinda B. et al. Effects of nitric oxide on red blood cell deformability//Amer. J. Physiol. -2005. -Vol. 284. -P. 1577-1584.
- Fujita J., Seno M., Obayashi H. et al. Elevated erythrocyte sodium-lithium countertransport activity correlates with increased intracellular sodium and free calciumion concentration in type 2 diabetes//Diabet Med. -2008. -No. 60. -P. 661-668.
- Fujita J., Tsuda K., Takeda T. et al. Nisoldipine improves the impaired erythrocyte deformability correlating with elevated intracellular free calciumion concentration and poor glycaemic control in NIDDM//Br. J. Clin. Pharmacol. -1999. -Vol. 47. -P. 499-506.
- McMillan D.E., Utterback N.G., La Puma J. Reduced erythrocyte deformability in diabetes//Diabetes. -1978. -No. 27(9). -P. 895-901.
- Effect of pravastatin on erythrocyte rheological and biochemical properties in poorly controlled Type 2 diabetic patients/P. Miossec, F. Zkhiri, J. Paries et al.//Diabet. Med. -1999. -No. 5. -P. 424-430.
- Rodrigues-Martinez M.A., Alonso M.J., Redonto J. et al. Role of lipid peroxidation and the glutathione&dependent antioxidant system in the impairment of endothelium&dependent relaxations with age//Br. J. Pharmacol. -1998. -Vol. 123. -P. 113-121.


