Влияние антацидных операций на концентрацию гастрина в плазме крови и риск развития злокачественных новообразований толстой кишки
Автор: Корсаков И.Н., Восканян С.Э., Найденов Е.В.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Хирургия
Статья в выпуске: 4 т.11, 2015 года.
Бесплатный доступ
Цель: выявление связи антацидных операций и злокачественных новообразований органов пищеварительной системы. Материал и методы. Исследование проведено на 72 крысах линии Wistar: изучалось влияние стволовой ваготомии, дистальной резекции 2/3 желудка и антрумэктомии на концентрацию гастрина в плазме крови, а также влияние внутрибрюшинного введения азоксиметана на частоту развития злокачественных новообразований толстой кишки. Результаты. Установлено повышение плазменной концентрации гастрина в послеоперационном периоде стволовой ваготомии, установлено некоторое снижение его концентрации после начального пика с дальнейшей стабилизацией. Выявлено снижение концентрации гастрина в результате дистальной резекции желудка до значений, близких к нулю, с последующим незначительным ее повышением и дальнейшей стабилизацией. Определено, что у животных, подвергнутых выполнению стволовой ваготомии в сочетании с индукцией опухолевого роста путем введения химического канцерогена азоксиметана, частота развития новообразований толстой кишки была статистически значимо выше, чем у животных, подвергнутых только введению азоксиметана. Частота развития опухолей у животных, подвергнутых резекции 2/3 желудка, отличалась статистически незначимо от этого параметра у животных контрольной группы. Заключение. Вагусная денервация брюшной полости вызывает значительное стойкое повышение концентрации гастрина в плазме крови. Резекция дистальных отделов желудка вызывает значительное снижение продукции гастрина, сменяющееся незначительным его ростом в отдаленном периоде. Стволовая ваготомия повышает риск развития новообразований брюшной полости у крыс.
Антацидные операции, ваготомия, гастрин, дистальная резекция желудка, злокачественные новообразования
Короткий адрес: https://sciup.org/14918217
IDR: 14918217
Текст научной статьи Влияние антацидных операций на концентрацию гастрина в плазме крови и риск развития злокачественных новообразований толстой кишки
Цель: выявление связи антацидных операций и злокачественных новообразований органов пищеварительной системы.
Животные были разбиты на три серии:
серия 1 — изучение влияния подавления желудочной секреции на концентрацию гастрина в плазме крови (29 животных);
группа 1.1 (контрольная) — изучение влияния «ложной» операции на концентрацию гастрина в плазме крови (5 животных);
группа 1.2 — изучение влияния стволовой ваготомии на концентрацию гастрина в плазме крови (8 животных);
серия 2 — адаптация экспериментального способа индукции опухолевого роста для нужд исследования (21 животное);
серия 3 — изучение влияния антацидных операций на выраженность злокачественного роста, индуцированного химическим канцерогеном (23 животных);
группа 3.2 — изучение влияния стволовой ваготомии на выраженность злокачественного роста, инду- цированного внутрибрюшинным введением азоксиметана (12 животных).
Все вмешательства выполнялись под общей анестезией золетилом, доступ к органам верхнего этажа брюшной полости во всех случаях обеспечивался срединной лапаротомией.
Стволовая ваготомия выполнялась путем иссечения участков переднего и заднего стволов блуждающего нерва у пищеводно-желудочного перехода.
Животные контрольной группы были подвергнуты только лапаротомии.
Концентрация гастрина определялась перед выполнением оперативного вмешательства, через 3, 4, 8, 10 и 15 недель после выполнения вмешательства.
Концентрация гастрина в плазме крови определялась методом ИФА с использованием готового набора (USCN Life Science Corp., США) в соответствии с инструкцией производителя набора.
Индукция злокачественных новообразований толстой кишки у животных серии 2 осуществлялась подкожным введением раствора азоксиметана (Sigma-Aldrich Co., США) в дозе 12мг/кг, 8 мг/кг, 6 мг/кг и 4 мг/кг двукратно с интервалом 2 недели или в дозе 10 мг/кг внутрибрюшинно трехкратно. Животные выводились из эксперимента через 16 или 30 недель после первого введения. Наличие новообразований в толстой кишке оценивалось после вскрытия просвета толстой кишки в продольном направлении с использованием пятикратного оптического увеличения.
В серии 3 экспериментов индукция опухолевого роста осуществлялась внутрибрюшинным введением азоксиметана в дозе 10 мг/кг трехкратно. Подавляющее желудочную секрецию вмешательство выполнялось на 7-й день после последнего введения препарата. Животные выводились из эксперимента через 16 недель после первого введения препарата.
Значимость различий между группами оценивалась по χ2 с поправкой Йетса, критерию Вилкоксона для зависимых групп и по U-критерию Манна — Уитни для независимых. Результаты представлены в виде медианы (межквартильный интервал).
Результаты. Лапаротомия в контрольной группе не приводила к значимому изменению плазменной концентрации гастрина.
Исходная концентрация гастрина в плазме крови животных, подвергнутых стволовой ваготомии, составила 155 (127-198) пг/мл. Стволовая ваготомия приводила к значимому (р<0,05 по сравнению с исходным уровнем и по сравнению с контролем) повышению плазменной концентрации гастрина через 4 (до 241 (214-329) пг/мл) и 6 (до 226 (195-312) пг/ мл) недель после выполнении вмешательства, к 10-й неделе исследования концентрация гормона снижалась до 191 (163-254) пг/мл, на 15-й неделе после вмешательства составляя 201 (143-247) пг/мл, не отличалась значимо от предыдущего зарегистрированного значения (рис. 1).
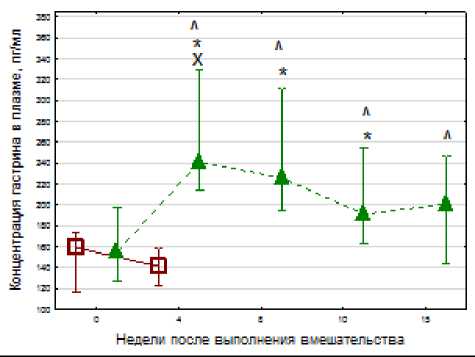
Рис. 1. Динамика концентрации гастрина в плазме крови у животных, подвергнутых стволовой ваготомии: □ — контроль; ▲ — стволовая ваготомия; маркер — медиана; I— межквартильный интервал; * — p< 0,05 по сравнению с предыдущим значением; ^ — p<0,05 по сравнению с исходным значением, критерий Вилкоксона; х — p<0,05 по сравнению с контролем, U-критерий Манна — Уитни
Стволовая ваготомия значимо повышала частоту развития новообразований толстого кишечника у животных, подвергнутых воздействию азоксиметана, по сравнению с группой животных, подвергнутых только введению канцерогена (таблица).
Не выявлено значимых различий в частоте развития новообразований между группами животных, подвергнутых введению азоксиметана и введению
Влияние антацидных операций на активность неопластического процесса, индуцированного химическими канцерогенами
Обсуждение. В исследовании установлено повышение плазменной концентрации гастрина в послеоперационном периоде стволовой ваготомии, выявлено некоторое снижение его концентрации после начального пика с дальнейшей стабилизацией.
Результаты настоящего исследования свидетельствуют о целесообразности проведения дальнейших исследований (когортных или случай — контроль), направленных на изучение влияния ваготомий на риск развития новообразований органов брюшной полости с целью определения целесообразности отнесения больных, перенесших подобные оперативные вмешательства, к соответствующей группе риска.
Результаты исследования позволяют пересмотреть существующее мнение о выполнении ваготомий как об относительно безопасных оперативных вмешательствах.
Выводы:
Список литературы Влияние антацидных операций на концентрацию гастрина в плазме крови и риск развития злокачественных новообразований толстой кишки
- Кузин H.M., Алимов A.H. Селективная проксимальная ваготомия с дуоденопластикой в лечении дуоденальных стенозов у больных язвенной болезнью двенадцатиперстной кишки. Хирургия 1997; (4): 38-43
- Гринберг А.А. Прободная язва. В кн.: Неотложная абдоминальная хирургия (справочное пособие для врачей). М.: Триада-Х, 2000; с. 227-247
- Graham DY, Genta RM. Long-term proton pump inhibitor use and gastrointestinal cancer. Curr Gastroenterol Rep 2008; 10 (6): 543-547
- Jensen RT. Involvement of cholecystokinin/gastrin-related peptides and their receptors in clinical gastrointestinal disorders. Pharmacol Toxicol 2002; 91 (6): 333-350
- Коротько Г.Ф. Желудочное пищеварение. Краснодар, 2007; 256 с.
- Waldum HL, SandvikAK, Brenna Е, Petersen Н. Review Gastrin-histamine sequence in the regulation of gastric acid secretion. Gut 1991; 32 (6): 698-701
- Johnson LR. Physiology of the gastrointestinal tract. : Academic press, 2006; 2004 p.
- Dockray G, Dimaline R, Varro A. Gastrin: old hormone, new functions. Pflugers Arch 2005; 449: 344-355
- Todisco A, Ramamoorthy S, Witham T, et al. Molecular mechanisms for the antiapoptotic action of gastrin. Am J Physiol Gastrointest Liver Physiol 2001; 280 (2): 298-307
- Noble PJ, Wilde G, White MR, et al. Stimulation of gastrin-CCKB receptor promotes migration of gastric AGS cells via multiple paracrine pathways. Am J Physiol Gastrointest Liver Physiol 2003; 284(1): 75-84
- Fourmy D, GigouxV, ReubiJC. Gastrin in gastrointestinal diseases. Gastroenterology 2011; 141 (3): 814-818.


