Влияние азитромицина на генотоксичность в Allium тесте
Автор: Концевая Ирина Ильинична, Ольшевский Артем Игоревич
Журнал: Бюллетень науки и практики @bulletennauki
Рубрика: Биологические науки
Статья в выпуске: 3 т.9, 2023 года.
Бесплатный доступ
Исследуется влияние азитромицина в концентрации 50,0-1000,0 мг/л на патологию митоза в Allium тесте в первой метафазе после обработки и после завершения восстановительного периода. Методы исследования: Allium тест, цитогенетический анализ, статистический анализ. Allium тест был выполнен на партии лука обыкновенного сорта Штутгартер, который характеризовался как генетически нестабильный по итогам микроядерного теста. Результаты анализа показали, что тестируемые концентрации азитромицина (50,0-1000,0 мг/л) в первом митозе не вызывают существенное повышение значений патологии митоза (ПМ) по сравнению с негативным контролем. Однако отмечено существенное возрастание (в 8 раз) числа клеток с ПМ в варианте «последействие, спустя 48 часов» для концентрации 300,0 мг/л азитромицина: с 4,1% до 32,3%. Следует отметить, что при действии всех тестируемых концентраций азитромицина наблюдается такая же тенденция как в контрольном варианте по сохранению спектра ПМ и по доминированию, во-первых, патологии «забегание/отставание хромосом», и во-вторых, патологии «асинхронное веретено деления». Процент упомянутых ПМ колеблется, соответственно, от 52 до 74, и от 7 до 22. Другие типы ПМ по своей встречаемости в опытных вариантах располагаются в следующей последовательности: к-митоз, рассеивание хромосом, выбросы хромосом, полиплоидность, липкость хромосом, хромосомные и хроматидные мосты, пикноз интерфазных ядер. При действии азитромицина, начиная с концентрации 100,0 мг/л до 1000,0 мг/л, в делящихся клетках наблюдали полиплоидные клетки, которые содержали тетраплоидный набор хромосом. В опытных вариантах в единичных клетках отмечали существенное увеличение размеров ядер интерфазных клеток и наличие ядерных почек, что рассматривается как маркеры полиплоидизации и амплификации генов. Восстановительный период (спустя 48 часов после действия антибиотика) для азитромицина не снижает количество клеток с ПМ, но изменяет их состав и спектр.
Лук, антибиотики, митоз
Короткий адрес: https://sciup.org/14126830
IDR: 14126830 | УДК: 577.18-049.8:575.224 | DOI: 10.33619/2414-2948/88/04
Текст научной статьи Влияние азитромицина на генотоксичность в Allium тесте
Бюллетень науки и практики / Bulletin of Science and Practice
УДК 577.18-049.8:575.224
В настоящее время при лечении нетяжелых инфекций одним из наиболее востребованных классов антибиотиков являются макролиды. Эти препараты, согласно отчетам Европейского общества антимикробной химиотерапии ( ESAC ), занимают 2-е место по объему потребления среди антибиотиков, применяющихся в амбулаторной практике, уступая только пенициллинам [1].
Представителем новой фармакологической группы макролидных антибиотиков — азалидов, является азитромицин. Препарат разработан фармацевтической компанией Pliva (Хорватия) и представлен под торговым названием сумамед [2].
Азитромицин является полусинтетическим антибиотиком, несколько отличающихся по структуре от классических макролидов. Обладает широким спектром антибактериального (бактериостатического) действия. Связываясь с 50S-субъединицей рибосом, угнетает пептидтранслоказу на стадии трансляции, подавляет синтез белка, замедляет рост и размножение бактерий, в высоких концентрациях оказывает бактерицидный эффект [3].
Азитромицин, благодаря своей уникальной фармакокинетике, которая выгодно отличает его от многих других антибиотиков, способен создавать максимальные и длительные концентрации в очаге поражения [1]. Азитромицина дигидрат — вещество пролонгированного действия, причем однократное применение средства, особенно в ударной дозе, сохраняет свое присутствие в организме до 6 дней . Характеризуется разнообразным фармакотерапевтическим применением, особенно при лечении бактериальных, респираторных, мочеполовых и энтерических инфекций [4].
Кроме антибактериального действия макролиды обладают умеренной противовоспалительной, иммуномодулирующей, мукорегулирующей и прокинетической активностью [2]. Использовался также при лечении COVID-19 [4]. Макролиды обладают высокой эффективностью и в то же время считаются одной из наиболее безопасных групп
Бюллетень науки и практики / Bulletin of Science and Practice Т. 9. №3. 2023 антибактериальных препаратов. Они не оказывают токсического влияния на органы и ткани макроорганизма [6] и реже, по сравнению с другими антибиотиками, вызывают аллергические реакции [1].
В то же время в литературе отсутствуют данные о влиянии азитромицина на клеточном уровне. В эксперименте в качестве модельного объекта был выбран лук обыкновенный ( Allium cepa L.) [6]. Широкое распространение тесты с A. cepa получили из-за того, что они являются более чувствительными и простыми по сравнению с биотестами животных [8, 9]. Несмотря на большие различия в организации и метаболизме между растительными и животными клетками, многими авторами сделан вывод о возможности экстраполировать полученные результаты A. cepa на животные организмы, включая человека [6, 7, 9]. При этом в настоящее время клетки лука используются для тестирования антибактериальных препаратов [10].
Цель исследования : тестирование азитромицина на выявление повреждений генетического аппарата в Allium тесте.
Материал и методы исследований
Луковицы, необходимые для постановки опыта, были приобретены в специализированном магазине, сорт лука обыкновенного Штутгартер. Постановку Allium -теста выполняли согласно [11]. Тестировали азитромицин (в виде азитромицина дигидрата) (РУП «Белмедпрепараты», Беларусь). Концентрации в мг/л указаны на Рисунке 1.
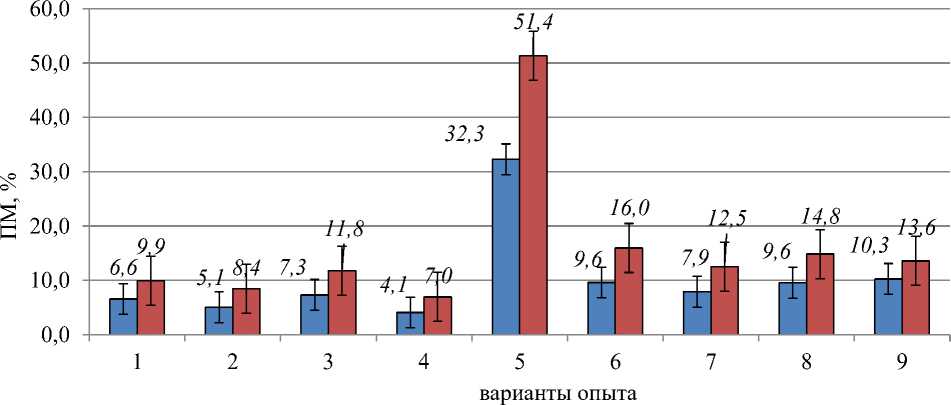
□ ПМ с учетом профазы □ ПМ без учета профазы
Рисунок 1. Влияние азитромицина на патологию митоза. Варианты опыта: 1 — контроль (вода дистиллированная); 2 — азитромицин, 50 мг/л; 3 — азитромицин, 100 мг/л; 4 — азитромицин, 300 мг/л; 5 — восстановительный период после варианта №4; 6 — азитромицин, 500 мг/л; 7 — восстановительный период после варианта №6; 8 — азитромицин, 1000 мг/л; 9 — восстановительный период после варианта №8
Возможность ингибирующего либо стимулирующего эффектов тестируемых концентраций азитромицина оценивали с использованием метафазного и ана-телофазного метода учета перестроек хромосом в клетках корневых меристем лука. Патологию митоза (ПМ) подсчитывали как отношение числа клеток с нарушениями митоза к общему числу делящихся клеток [12] и классифицировали отдельно для каждого корешка по И. А. Алову с незначительной модификацией [13]. Просмотр препаратов осуществляли на компьютеризированной кариологической станции, оснащенной световым микроскопом
(Olympus BX-40-увеличение-400×). По каждому варианту было просмотрено не менее 10 000 клеток.
Статистическую обработку полученных результатов исследований проводили на с помощью пакета прикладного программного обеспечения “Statsoft (USA) Statistica v.7.0”. с расчетом выборочной средней и стандартной ошибки среднего. Для данных, подчиняющихся нормальному закону распределения, использовали дисперсионный анализ (ANOVA) и t-критерий Стьюдента для попарных сравнений. Нулевую гипотезу отклоняли при уровне статистической значимости p <0,05 [14].
Результаты исследований и их обсуждение
Патологический митоз — один из способов возникновения мутаций и развития анеуплоидии [13]. Однако воздействие небольших доз обратимо для большинства форм патологий митоза, поскольку в течение нескольких часов через ряд механизмов с участием белков может восстановиться митотический аппарат и продолжиться митотическое деление [13]. С патологией митоза у человека связано развитие ряда заболеваний. Патологические митозы часто возникают при канцерогенезе, лучевой болезни и вирусной инфекции. Патология митоза может носить функциональный и органический характер. Функциональные нарушения деления клеток могут выражаться, например, в гипореактивности вступающих в митоз клеток .
В текущем эксперименте в контроле значение ПМ с учетом профазы составило 6,6%, что незначительно превышает нормальное значение уровня спонтанного мутирования: 2–5% [15]. Результаты анализа показали, что все тестируемые концентрации азитромицина в первом митозе не вызывают существенное повышение значений ПМ.
Однако для концентрации 300,0 мг/л азитромицина было отмечено, что в варианте «последействие, спустя 48 часов» (Рисунок 1: вариант 5), значение ПМ по сравнению с контрольной цифрой возросло существенно в 4,9 раза. Также если сравнивать варианты 4 и 5: когда фиксировали процесс деления клеток в первом митозе после действия антибиотика и вариант его последействия, то в этом случае установлено возрастание значения ПМ в 8,0 раз (Рисунок 1): с 4,1% до 32,3%. В то время как для более высоких концентраций антибиотика, равных 500,0 и 1000,0 мг/л, подобной картины не наблюдали. Следует напомнить, что азитромицина дигидрат — вещество пролонгированного действия [3]. Поэтому, чтобы корректно оценивать возможные патологические процессы в делящихся клетках образовательной ткани под влиянием разных концентраций тестируемого антибиотика: от 50,0 до 1000,0 мг/л, необходимо проанализировать состав и спектр патологий митоза, а также определить, каков характер повреждения в клетке каждая из концентраций вызывает.
В контрольном варианте из всех регистрируемых патологий митоза наблюдали в 68% патологию «забегание/отставание хромосом» и в 24% — патологию «асинхронное веретено деления» (Рисунок 2). Также в единичных клетках, что составляет 0,1–0,4%, отмечены рассеивание хромосом в анафазе, выброс хромосом, фрагменты. Мы акцентируем внимание на наличие микроядер в клетках контрольного варианта (Рисунок 3: 1б), подчеркивая, что такой признак рассматривается как морфологический пассивный маркер генетической нестабильности [16]. В то же время следует помнить, что, согласно [17], сами микроядра также могут являться источником возникновения дополнительной генетической нестабильности. В итоге все это приводит к появлению разнообразных повреждений ДНК и их множественному накоплению. Патология митоза «забегание/отставание хромосом» в метакинезе и при расхождении к полюсам возникает при повреждении хромосом в области кинетохора [18].
Однако снижение функциональной активности кинетохора может возникать не только в патологических, но и физиологических условиях [13].
Асинхронное веретено деления (экваториальное разделение хромосом в анафазе) вызвано аномальной ориентацией хромосом от полюса к полюсу в метафазе, является острым аберрантным состоянием, которое возникает в результате нерегулярных путей сборки веретена деления и его аномальной активности [19]. Данная патология напрямую не связана с клеточным циклом и собственно митозом. Встречается и в физиологически оптимальных условиях роста. Сигнальные механизмы, определяющие расположение группы хромосом (среднюю плоскость), особенно в асимметрично делящихся клетках, которые имеют решающее значение для определения судьбы клеток и дальнейшей дифференцировки тканей, остаются невыясненными [20].
Влияние азитромицина на типы патологий митоза представлено на Рисунке 2. Следует отметить, что при действии всех концентраций азитромицина: от 50,0 до 1000,0 мг/л наблюдается такая же тенденция как в контрольном варианте по сохранению спектра патологий митоза и по доминированию, во-первых, патологии «забегание/отставание хромосом», и во-вторых, патологии «асинхронное веретено деления» (Рисунок 3: 7а). Процент упомянутых патологий митоза колеблется, соответственно, от 52 до 74, и от 7 до 22 (Рисунок 2).
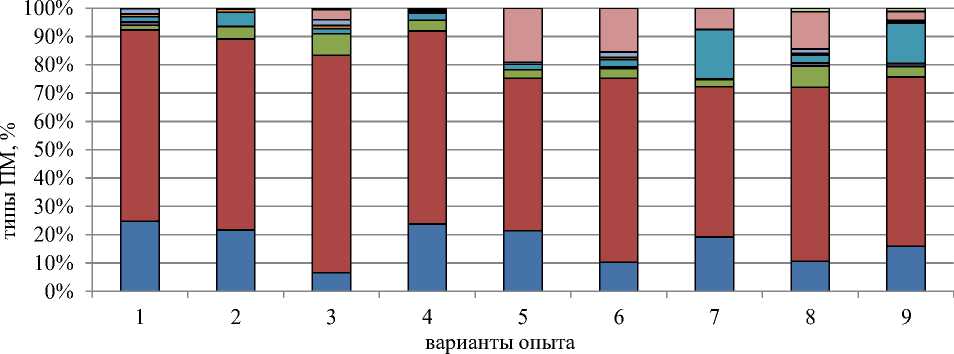
□ Ас Вер □ з/отст хр □ выбр хр □ мосты □ рассеив □ фрагмент □ слипание □ к-митоз □ разное
Рисунок 2. Влияние азитромицина на состав и спектр патологий митоза. Обозначения вариантов — те же, что для Рисунка 1
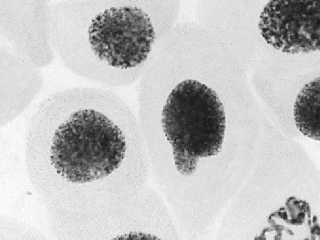
По своей встречаемости в опытных вариантах в меньшей степени определяемые патологии митоза располагаются в следующей последовательности: к-митоз (Рисунок 3: 2а, 3б, 6б, 7б), рассеивание хромосом (Рисунок 3: 2а, 3б, 4б, 6б, 7б), выбросы хромосом (Рисунок 3: 5а, 8б), полиплоидность (Рисунок 3: 2а, 6б, 7б), липкость хромосом (Рисунок 3: 5а, 8а), хромосомные и хроматидные мосты (Рисунок 3: 8а), пикноз интерфазных ядер (Рисунок 3: 1а, 4а, 4б, 6б, 7а, 8г). и вызваны дисфункцией ядерного веретена деления. Рассмотрение характеристик упомянутых патологий митоза подтверждает наше предположение.
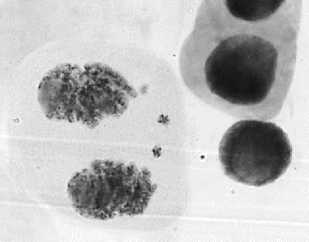
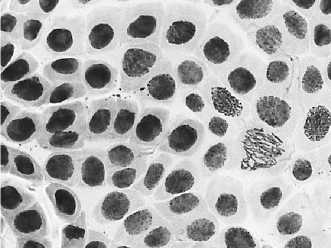
а
1 — азитромицин, 50 мг/л: а — микроядра на стадии телофазы + пикноз; б — ядерные почки
*•*•
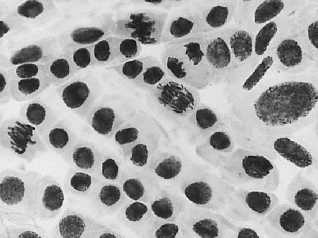
б
2 — азитромицин, 100 мг/л: а — митоз, ядра в норме; б — хромосомы в норме + большое ядро + слипание хромосом
а
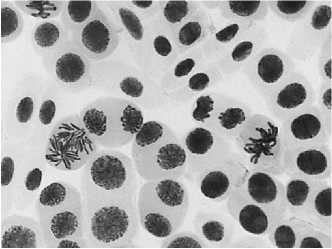
б
•Ш^ ' * , ^
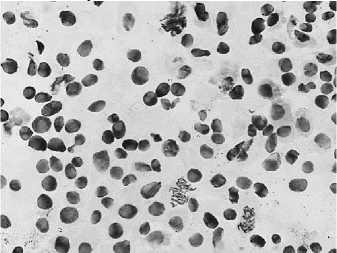
Ч #
4 — восстановительный период после варианта №3: а — пикноз; б — ядра в норме и пикноз ядер
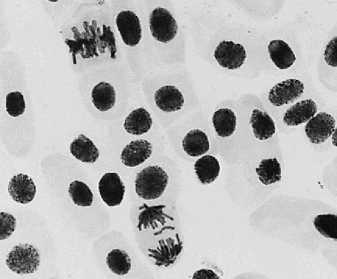
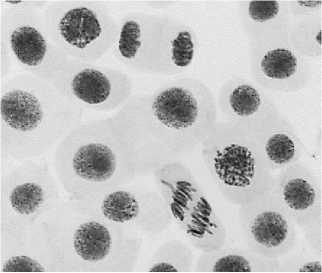
б
5 — азитромицин, 500 мг/л: а — выброс хромосомы в анафазе + вздутие хромосом; б — ядра в норме + забегание хромосом
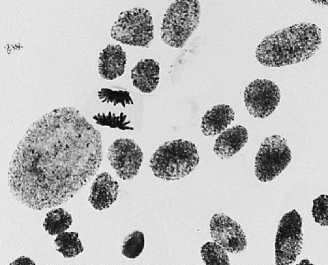
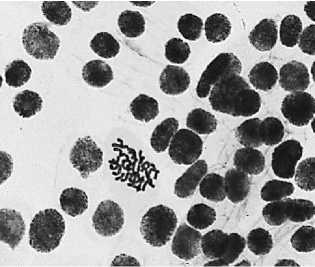
6 — восстановительный период после варианта №5: а — асинхронное веретено деления + большое ядро; б — полиплоидная клетка + ядерная почка
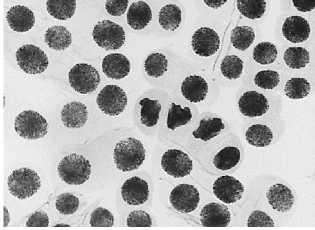
а
б
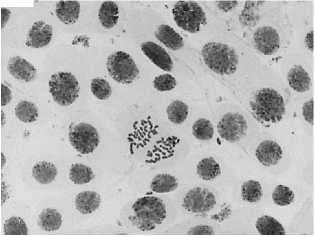
7 — азитромицин, 1000 мг/л: а — ядра в норме + пикноз; б — полиплоидная клетка
H
а
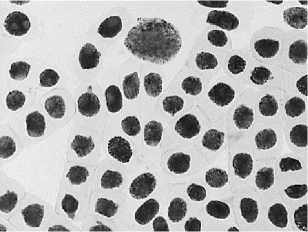
в
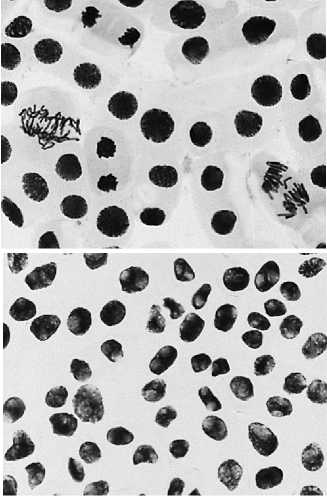
б
8 — восстановительный период после варианта №7: а — мосты хроматидные; б — выбросы хромосомы за веретено деления; в — ядерные почки + большое ядро; г — пикноз ядер
Рисунок 3. Влияние азитромицина на типы патологий митоза
К-митоз указывает на то, что многие химические вещества ингибируют образование веретена в соответствии с механизмом, сходным с действием колхицина, и индукция к-митоза обычно ассоциируется с ядами веретена, что указывает на анеугенный эффект [21]. Исход к-митоза зависит от дозы и времени воздействия статмокинетического яда на делящуюся клетку. При токсических дозах наблюдается пикноз ядра и гибель клетки. Воздействие небольших доз обратимо. В течение нескольких часов может восстановиться митотический аппарат и продолжиться митотическое деление [13]. Согласно [22], присутствие к-метафаз в клетках образовательной ткани может привести к изменению плоидности, в частности к
полиплоидизации, хотя наиболее частым результатом является индукция микроядер в результате фрагментации или отставания хромосом [13]. Полиплоидия отнесена к ингибированию полного нарушения веретенообразного механизма [19].
Рассеивание хромосом как на стадии метафазы, так и на стадии анафазы происходит в результате повреждения или полной дезорганизации митотического аппарата. Эту патологию митоза рассматривают как одно из проявлений к-митоза. Образование отстающих хромосом также обусловлено ингибированием полимеризации тубулина или белков цитоскелета [23].
В текущем эксперименте при действии азитромицина, начиная с концентрации 100,0 мг/л до 1000,0 мг/л, в делящихся клетках напрямую наблюдали полиплоидные клетки, которые содержали тетраплоидный набор хромосом (Рисунок 3: 2а, 6б, 7б). Неоднократно отмечали существенное увеличение размеров ядер интерфазных клеток (Рисунок 3: 2б, 6а, 8в) и это является свидетельством проявлением механизма адаптации и служит дополнительным защитным фактором [24]. Гигантские клетки могут быть полиплоидными клетками, которые произошли посредством эндорепликации или эндомитоза, что можно рассматривать как крайний случай онтогенетической амплификации генов [24].
Следует дополнить, что в единичных интерфазных клетках уже при действии 50,0 мг/л азитромицина отмечали наличие ядерных почек (рисунок е почки рассматриваются как маркеры полиплоидизации и амплификация генов, и их формирование приводит к изгнанию лишнего генетического материала из анеуплоидных клеток [25].
Хромосомная липкость отражает высокотоксичные эффекты на хроматин, обычно необратимого типа (представляет собой нерепарируемый эффект), которые могут привести к гибели клеток [26].
Пикноз ядерного аппарата, наблюдаемый в интерфазных клетках в единичных случаях при минимальной тестируемой концентрации азитромицина (50,0 мг/л), и в 100 % клетках, но только отдельных единичных корней, начиная с концентрации 300,0 мг/л (Рисунок 2, Рисунок 3: 1а, 4а, 7а, 8г), свидетельствует о смерти клеток, что приводит к некрозу тканей [27].
При микроскопическом исследовании были выявлены единичные клетки с сильно выраженным плазмолизом, также в зоне дифференциации многие клетки корешков лука имели плотную конденсированную цитоплазму. Такая морфологическая картина типична для процесса программируемой клеточной гибели у растений при действии ксенобиотиков.
Заключение
Результаты анализа показали, что все тестируемые концентрации азитромицина (50,0– 1000,0 мг/л) в первом митозе не вызывают существенное повышение значений патологии митоза (ПМ) по сравнению с негативным контролем. Однако отмечено существенное возрастание (в 8 раз) числа клеток с ПМ в варианте «последействие, спустя 48 часов» для концентрации 300,0 мг/л азитромицина: с 4,1% до 32,3%. В то время как для более высоких концентраций антибиотика, равных 500,0 и 1000,0 мг/л, подобной картины не наблюдали.
Следует отметить, что при действии всех тестируемых концентраций азитромицина наблюдается такая же тенденция как в контрольном варианте по сохранению спектра ПМ и по доминированию, соответственно, во-первых, патологии «забегание/отставание хромосом», и во-вторых, патологии «асинхронное веретено деления». Процент упомянутых ПМ колеблется, соответственно, от 52 до 74, и от 7 до 22.
По своей встречаемости в опытных вариантах иные типы ПМ располагаются в следующей последовательности: к-митоз, рассеивание хромосом, выбросы хромосом, полиплоидность, липкость хромосом, хромосомные и хроматидные мосты, пикноз интерфазных ядер.
Бюллетень науки и практики / Bulletin of Science and Practice Т. 9. №3. 2023
Восстановительный период (спустя 48 часов после действия антибиотика) для азитромицина не снижает количество клеток с ПМ, но изменяет их состав и спектр.


