Влияние бактериального липополисахарида на эластичность легочной ткани: модельные испытания
Автор: Фролов Дмитрий Михайлович
Рубрика: Естественные науки: новые проблемы и инновации
Статья в выпуске: 11, 2013 года.
Бесплатный доступ
С целью определения механических свойств легочной ткани в экспериментальной модели острого легочного повреждения в опытах на 17 белых крысах проводили однократные ингаляции липополисахарида E. coli О128 : B12 в виде микро- аэрозоля для лучшего проникновения в респираторный аппарат легких. Проанализировали динамику растяжимости легочной ткани в норме и после ингаляции водно-солевого носителя как апирогенного, так и с дисперсией ЛПС. Было установлено, что ингаляция ЛПС сопровождается снижением эластичности легочной ткани.
Липополисахарид, ингаляционное поступление, легкие, механотрансдукция
Короткий адрес: https://sciup.org/14967914
IDR: 14967914 | УДК: 591.121.1
Текст научной статьи Влияние бактериального липополисахарида на эластичность легочной ткани: модельные испытания
Бактериальные липополисахариды (далее – ЛПС), входящие в состав клеточной стенки грамотрицательных бактерий, обладают широким спектром биологических эффектов. Сенсибилизация иммунной системы и активация ее клеточного звена, в результате поступления ЛПС в организм, оказывает системный эффект на внутренние органы, в том числе и на легкие.
Эффекты неингаляционного поступления ЛПС в организм хорошо изучены, и ученые имеют достаточно полную картину о механизмах ЛПС-индуцированного ответа опосредованного цитокинами, хемокинами и гормонами [2; 3]. В литературе есть работы по созданию математической модели, описывающей события на системном уровне после такого поступления ЛПС в организм [1].
Последствия ингаляционного поступления ЛПС в организм изучены в наименьшей степени. Специфика повреждения легких обус- ловлена относительно большой площадью альвеолярной поверхности, их структурно-функциональными особенностями, значительными объемами транзита атмосферного воздуха и крови. При этом, некоторые представители клеточного ряда аэрогематического барьера имеют рецепторы к ЛПС (CD14, TLR4) и секретируют биологически активные вещества в ответ на контакт с ним [6; 14].
В последнее время исследователи все чаще обращают внимание на феномен повреждения легочной ткани ЛПС, способный образовывать микроаэрозольные дисперсии в воздушной среде. Такое ингаляционное повреждение может иметь острый характер, или становиться основой хронической легочной патологии [4; 6; 11].
Выявлена взаимосвязь между хронической ингаляцией бактериальных токсинов и развитием легочной патологии у работников определенных профессий, таких как заготовщики сена, работники мясокомбинатов, парнико- вых хозяйств и ряда подобных предприятий [9; 10]. Причем ингаляция ЛПС возможна не только за счет поступления его из атмосферы (включая нестерильные воздухоносные контуры), но и при массовой гибели микроорганизмов в верхних дыхательных путях или ротовой полости [9]. Особого внимания эта проблема заслуживает при искусственной вентиляции легких, когда возможно сочетание механического и инфекционного повреждения органа [8]. Эксперименты Робертсона (1989) показали, что ИВЛ создает избыточное давление, повреждающее бронхиальный и альвеолярный эпителий. И, в результате, повышается проницаемость их клеточной мембраны к белкам микроциркуляторного русла, инактивирующие сурфактант.
Ингаляция малых доз бактериального ЛПС приводит к повреждению легких по типу субхронического бронхоальвеолита, сопровождающимся слущиванием бронхиального эпителия и альвеолоцитов, реакцией альвеолярных и бронхиальных макрофагов, снижением воздушности легочной ткани при умеренно выраженной бронхиальной экссудации [4; 7; 12]. Лейкоциты и слущенный эпителий попадают и в альвеолярный экссудат, в связи с чем могут быть выявлены в бронхоальвеолярных смывах (БАС) [5].
В остром процессе доминирует цитокин-зависимое повреждение эндотелия и эпителиальной выстилки межальвеолярных перегородок, повышение сосудистой проницаемости и накопление экссудата, в том числе и полиморфно-ядерных лейкоцитов в альвеолярных пространствах [13].
Функция легких неразрывно связана с механическими свойствами ткани органа. Процесс дыхания представляет собой динамический цикл растяжения клеток и сурфактанта вместе с конвекцией жидкости из дыхательных путей в сосудистую сеть. И нарушения, связанные с сокращением гладкой мускулатуры дыхательных путей или со свойствами сурфактанта, изменяют респираторную механику и влияют на функцию легких в целом.
Острый воспалительный процесс сопровождается локальной инфильтрацией ткани и клеточными компонентами, что увеличивает ее жесткость и уменьшает растяжимость ткани. Кроме того, хорошо известно, что биологические модуляторы, такие как бактериальный ЛПС или цитокины, увеличивают жесткость легочной ткани, а у клеток, наоборот растяжимость, хотя роль макрофагов в определении функции легочной механики до конца не ясна.
Таким образом, изучение механических свойств легких представляет собой одну из главных задач в понимании легочной биологии и процесса дыхания в целом.
Цель работы – выявить изменения растяжимости легочной ткани в модели однократного ингаляционного поступления ультра-дисперсного аэрозоля ЛПС.
Материалы и методы
Эксперимент проводили на 17 белых крысах породы Вистар массой от 220 до 280 г в соответствии этическими нормами, изложенными в «Международном кодексе медицинской этики» (1994), Хельсинской декларации (2000) и Директивах Европейского сообщества 86/609EEC. Животных разделили на три группы: 12 животных вошли в опытную и контрольную группы, по 6 в каждой, и 5 – в интактную. Ингаляцию проводили в затравочной камере объемом 100 л в течение часа. Крысы в опытной группе дышали смесью воздуха с водно-солевым аэрозолем ЛПС Escherichia coli О128 : B12 (Sigma Chemical Co., St Louis, MO, USA). Микроаэрозольные капли со средним диаметром 4 мкм, содержащие ЛПС, получали с помощью компрессорного ингалятора CN-231 (A&D, Japan). Частицы такого размера способны свободно проникать не только в верхние дыхательные пути, но и в альвеолярный аппарат легких крысы в процессе спонтанного дыхания. Условия опыта были подобраны так, что за время нахождения в камере каждое животное инспирировало ЛПС в дозе порядка 1 мг/кг массы. Животных контрольной группы ингалировали 0,85 %-ным раствором NaCl без ЛПС. Животных вывели из эксперимента через 3 часа после ингаляции передозировкой Золетила (120 мг/кг массы). Крысы интактной группы находились в обычных условиях вивария без каких-либо воздействий и были выведены из эксперимента в тот же срок.
Механические свойства легких определяли с помощью экспериментальной установ- ки, состоящей из прямого ртутного манометра для определения давления, шприца объемом 20 мл, и зонда для закрепления легкого (рис. 1). Шприцом подавалась порция воздуха, при этом фиксировалось изменение давления в органе и вытесненный легкими объем 0,85 %-го раствора NaCl. Подачу воздуха осуществляли парциально, первая порция соответствовала значению давления при подаче 1 мл воздуха, вторая – 2 мл, третья – 3 мл и крайняя точка определялась значением подаваемого объема воздуха, при котором происходил разрыв легочной ткани. Далее строили общий график зависимости ДV/ДP по 24-м точкам. Для каждого графика строили функцию экстраполяции зависимости эластических свойств легочной ткани.
Результаты и их обсуждение
Эластические свойства легких обусловливаются преимущественно механическими возможностями паренхимы легкого. Растяжимость легочной ткани является величиной, противоположной упругости. Упругость легочной ткани EЛТ определяли с помощью установки, состоящей из поршня для подачи воздуха, прямого ртутного манометра для определения изменения давления в легком и градуированной емкости с 0,85%-ным раствором NaCl для определения вытесненного объема. Воздух подавался до предела разрыва легочной ткани. Упругость легочной ткани определялась как сопротивление к растяжению при приложенной силе и измеря- лась по существующим в физической механике закономерностям.
Формулу упругости легочной ткани вывели, исходя из формулы модуля Юнга:
F__ = д PV o елт Sx a v
Если значение упругости ткани легкого зависит от давления, то:
Z p
V o E ap
Таким образом, описание поведения функции E(ДP) дает возможность определить свойство ткани, на которую оказывается давление. Линейный характер функции отражает упругие свойства легочной ткани, а нелинейный говорит о снижении упругих и увеличении пластических свойств.
Аппроксимированная функция упругости легочной ткани интактных животных – квадратичная и имеет следующий вид:
E(ДP) = -0,0683х2+ 5,2412х - 45,901 (R2 = 0,96)
В интервале от 0 до 24–28 % распределение линейно, при дальнейшей подаче воздуха происходило изменение характера функции, и она демонстрировала уже нелинейную зависимость. Несомненно, это связано с переходом упругих свойств легочной ткани в пластические, так как при увеличении легких на 45–56 % от их начального объема происходил их разрыв.
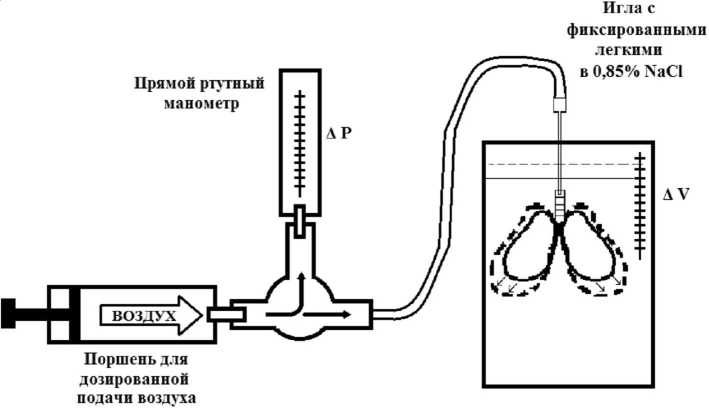
Рис. 1. Схема экспериментальной установки для определения механических свойств легких крысы.
Функция зависимости E(ДP) для контрольных животных схожа с таковой у животных интактной группы:
E(ДP) = -0,0986x2 + 6,7022x + 57,914 (R2 = 0,96)
Функция зависимости прироста объема от прироста давления в легких животных, ингалированных микроаэрозольной дисперсией ЛПС, также нелинейна:
E(ДP) = 0,0829x2 – 3,4174x + 33,443 (R2 = 0,96)
Таким образом, при однократной ингаляции ЛПС происходит изменение эластичности легочной ткани. Ингаляция ЛПС сопровождается снижением эластичности легочной ткани (снижение основного коэффициента в уравнении зависимости p-V с 6,71 до 3,41), так что прирост давления сопровождается менее значимым изменением объема легочной ткани.
Список литературы Влияние бактериального липополисахарида на эластичность легочной ткани: модельные испытания
- Горячев, А. Н. Математическое моделирование компонента тиреоидной дизрегуляции при хроническом эндотоксикозе/А. Н. Горяче//Вестник новых медицинских технологий. -2008. -Т. 15. -№3. -С. 167-168.
- Калашникова, С. А. Тиреоидная модуляция ФНО-зависимого апоптоза и формирование хронической патологии печени при эндогенной интоксикации у крыс/С. А. Калашникова//Бюллетень экспериментальной биологии и медицины. -2009. -Т. 147. -№2. -С. 201-206.
- Писарев, В. Б. Бактериальный эндотоксикоз: взгляд патолога. -Волгоград: Изд-во ВолГМУ, 2008. -320 с.
- Фролов, Д. М. Структурные изменения в легких при аэрозольном поступлении в организм липополисахарида, диспергированного в гидрофобной и водной фазе/Д. М. Фролов//Фундаментальные исследования. -2012. -№10 (2) -С. 345-348.
- Фролов, Д. М. Индикация повреждения межальвеолярных перегородок при аэрозольном поступлении в организм бактериального липополисахарида/Д. М. Фролов//Врач-аспирант. -2013. -№5.2 (60). -С. 327-332.
- Abate, W. Surfactant lipids regulate LPSinduced interleukin-8 production in A549 lung epithelial cells by inhibiting translocation of TLR4 into lipid raft domains/W. Abate//J. Lipid Res. -2010. -№ 51 (2). -Р. 334-344.
- Brass, D. M. Chronic LPS inhalation causes emphysema-like changes in mouse lung that are associated with apoptosis/D. M. Brass//Am. J. Respir Cell Mol. Biol. -2008. -№ 39 (5). -Р. 584-590.
- Dahlem, P. Mechanical ventilation affects alveolar fibrinolysis in LPS induced lung injury/P. Dahlem//Eur. Respir. J. -2006. -№ 28. -P. 992-998.
- Duquenne, P. Measurement of endotoxins in bioaerosols at workplace: a critical review of literature and a standardization issue/Р. Duquenne//Ann. Occup. Hyg. -2013. -№ 57 (2). -P. 137-172.
- Heldal, K. K. Pneumoproteins in sewage workers exposed to sewage dust//Int. Arch. Occup. Environ. Health. -2013. -№ 86 (1). -P. 65-70.
- Hernandez, M. L. Comparative airway inflammatory response of normal volunteers to ozone and lipopolysaccharide challenge/M. L. Hernandez//Inhal. Toxicol. -2010. -№ 22 (8). P. -648-656.
- Liebers, V. Health effects due to endotoxin inhalation/V. Liebers//Arch. Toxicol. 2008. -№ 82 (4). -P. 203-210.
- Mammoto, A. Control of lung vascular permeability and endotoxin-induced pulmonary oedema by changes in extracellular matrix mechanics/A. Mammoto//Nat. Commun. -2013. -Vol. 4. -e1759.
- Mller, W. Differential inflammatory response to inhaled lipopolysaccharide targeted either to the airways or the alveoli in man/W Mller, I. Heimbeck, T.P.J. Ho-fer et al.//PLOS One. -2012. -Vol. 7 (4). -e33505.


