Влияние биологически активных пептидных компонентов гемолимфы личинок Galleria mellonella на рост и ферментативную активность Escherichia coli
Автор: Костина Динара Александровна, Федоткина Олеся Сергеевна, Кленова Наталья Анатольевна, Пурыгин Петр Петрович, Буряк Алексей Константинович, Литвинова Елена Геннадьевна
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Проблемы прикладной экологии и биологии
Статья в выпуске: 3-1 т.15, 2013 года.
Бесплатный доступ
Проведено изучение биологически активных пептидных компонентов гемолимфы личинок Galleria mellonella в условиях их предварительной специфической и неспецифической иммунизации, экстрагирования этиловым спиртом, выделения и изучения методами высокоэффективной жидкостной хроматографии и МАЛДИ-анализа. Спиртовые экстракты личинок восковой моли не оказывают гемолитического действия на эритроциты человека и обладают защитным действием в условиях окислительного стресса in vitro. Изучение антибактериального действия спиртовых экстрактов показало наличие бактериостатического действия по отношению к E. сoli и Bacillus cereus. Проведенный МАЛДИ-анализ выявил наличие в гемолимфе пептидных соединений с молекулярной массой от 875 до 18000 Да. Среди них были идентифицированы как ранее обнаруживаемые, так и неизвестные пептиды. Часть из них обнаруживается также и в условиях неспецифической иммунизации личинок ацетон-1,1-диметилгидразоном. Пептидные компоненты гемолимфы личинок Galleria mellonella не только угнетают рост E. сoli, но и оказывают воздействие на скорость метаболических процессов, что выражается в изменении ферментативной активности клеток E. coli.
Антибактериальные пептиды, личинки
Короткий адрес: https://sciup.org/148205647
IDR: 148205647 | УДК: 579.8.017.73
Текст научной статьи Влияние биологически активных пептидных компонентов гемолимфы личинок Galleria mellonella на рост и ферментативную активность Escherichia coli
П риродные биологически активные соединения представляют значительный интерес как с точки зрения изучения фундаментальных механизмов их образования в качестве регуляторов и иммуномодуляторов, так и их практического применения в качестве лекарственных препаратов.
Насекомые являются перспективными источниками биологически активных пептидов, служащих у них важнейшими компонентами врожденного иммунитета из-за недостаточности адаптивной иммунной системы и регуляторами биохимических процессов [1].
В настоящее время известно, что экстракты личинок восковой моли проявляют высокую активность в отношении многих микроорганизмов: Mycobacterium tuberculosis, Corinebacterium difte-
Galleria mellonell a; личинки.
ria, Clostridium tetani, Yersinia pestis [2]. Подобные эффекты определяются наличием в гемолимфе личинок Galleria mellonella большого количества разнообразных биологически активных пептидов, спектр которых зависит от действия иммунизирующих факторов.
Нами проведен большой объем исследований по изучению биологически активных пептидных компонентов гемолимфы личинок Galleria mel-lonella в условиях предварительной специфической и неспецифической иммунизации их, экстрагирования этиловым спиртом, выделения и изучения методами электрофореза, ионообменной и высокоэффективной жидкостной хроматографии и МАЛДИ-анализа, а также определения гемолитической и антибактериальной активности.
В статье проведен анализ по изучению влияния данных по изучению влияния биологически активных компонентов гемолимфы.
МАТЕРИАЛЫ И МЕТОДЫ
Объект исследования. В работе использованы личинки восковой моли, выращенные в естественной среде (пасека в Самарской области), в лабораторных условиях на искусственной питательной среде (ИТЭБ РАН г. Пущино), а также в лаборатории СамГУ из отложенных яиц на восковых сотах (термостат, 30°С).
Пробоподготовка. 1. Получение экстрактов личинок восковой моли. Для получения экстракта
№ 1 проводили экстракцию биологически активных веществ (БАВ) из целых личинок без предварительной гомогенизации. При получении экстракта № 2 навеску личинок большой восковой моли предварительно растирали в фарфоровой ступке, из полученного гомогената экстрагировали БАВ. Экстракцию БАВ проводили 40% этанолом при комнатной температуре в темноте в течение 20 дней, по методу, применяемому в народной медицине и гомеопатии [3]. Полученные экстракты хранили в темноте при 4 °С. Экстракт № 3 представлял собой биологически активную пищевую добавку «Натуральный экстракт доктора Мухина», производимую на заводе «Диод» по технологии ИТЭБ РАН г. Пущино (Патент РФ № 2038086). Экстракт хранили в темноте при 4 °С. Полученные экстракты содержали этиловый спирт в концентрации 34%. С целью исследования повреждающего действия спиртовых экстрактов определяли гемолитическую активность и влияние их на скорость процессов ПОЛ [4].
-
2. Иммунизация личинок Galleria mellonella и получение гемолимфы . Личинки в стадии предшествующей окукливанию подвергали специфической иммунизации E. coli , смесью культур E. coli и Bacillus cereus , вводя в брюшную полость каждой особи по 0,5-1 мкл суспензии, содержащей 106 КОЕ/мл. Неспецифическую иммунизацию осуществляли ацетон-1,1-диметилгидразоном (ADMH) – производным несимметрического диметилгидразина (1,1-диметилгидразин, UDMH). При этом каждой личинке вкалывали микрошприцем 0,5 мкл 0,01% раствора ADMH [4]. После 24 часов при 28°С у живых особей личинок, предварительно охлажденных на льду пипеткой собирали гемолимфу в пробирку, содержащую кристаллы фенилтиомочевины, 20 мкл ингибитора протеаз (2 мг/мл). Затем в полученную гемолимфу добавляли в равном объеме антикоагулянт, содержащий 0,04 М цитратный буфер рН 4,5; 0,186 М хлорид натрия, 0,017 М ЭДТА. Клетки и дебрис осаждали центрифугированием при 100 g в течение 10 минут. Супернатант повторно центрифугировали 30 минут при 2300 g. Делипидизацию проводили добавлением равного объема гексана. После центрифугирования в режиме 100g 15 минут гексановую фракцию удаляли, добавляли равный объем ацетилацетата и после центрифугирования в том же режиме фракцию с этилацетатом удаляли. Для осаждения белков к полученному раствору добавляли 5 мл смеси метанол-ледяная уксусная кислота-вода (90:1:9, по объему) и центрифугировали при 20000 g в течение 20 минут. Супернатант наносили на колонку (0,7х7 см) с сефадексом G-10, уравновешенною дистиллированной водой. Собирали 10 мл элюата и лиофилизировали на установке Иней-3.1. Лиофилизат растворяли в 2 мл 0,1%-ной ТФУ, после чего добавляли 1 мл воды, центрифугировали 15 мин при 20000 g и 2 °С.
-
3. Разделение пептидных компонентов гемолимфы. Для разделения пептидных компонентов гемолимфы личинок Galleria mellonella использовали методы ионообменной, высокоэффективной жидкостной хроматографии [3, 5].
-
4. Определение антибактериальной активности. В качестве тестовых микроорганизмов использовались суточный инокулят E. coli штамма М-17, выращенный на среде LB и Bacillus cereus, выращенный на мясопептонном бульоне. Бумажные стерильные диски диаметром 6,0 мм (8 дисков для каждого образца) пропитывали анализируемыми фракциями гемолимфы и помещали во влажном состоянии на свежие посевы E. coli на чашках Петри со средой, уплотненной агаром. Выращивали в течение 2-х суток в термостате при 37 °С. Антибактериальная активность оценивалась по размерам зон ограниченного роста в условиях газонного роста при обычном посеве инокулята. В качестве сравнения использовали дис-
- ки, пропитанные фракциями гемолимфы неимму-низированных личинок, а также диски, пропитанные стерильной дистиллированной водой или элюирующим буфером.
-
5. Воздействие пептидных компонентов фракций ВЭЖХ на метоболические процессы изучали добавлением 100 мкл исследуемой фракции с содержанием пептидов в пределах 5-10 мкг/мл в 10 мл суточного инокулята E. coli. В контрольные пробы добавляли соответствующее количество 0,04 М цитратного буфера рН 4,5. Инкубировали 24 часа при 37 °С, после чего определяли ферментативную активность.
Супернатант наносили на картирдж Sep-Pak C18, предварительно уравновешенный с 0,05%-ной ТФУ. Для элюирования использовали 5 мл 10-,40-и 100%-ные растворы ацетонитрила в 0,05%-ной ТФУ. Полученные фракции лиофилизировали. Лиофилизаты растворяли в 400 мкл воды, и растворы подвергали разделению методом ВЭЖХ.
Оборудование. Использовали жидкостный хроматограф Agilent 1200 Series, диодноматричный детектор Agilent 1200 Series Diode Array and Multiple Wavelength (DAD) фирмы «Agilent Technologies» (США). Систему кондиционировали 30 мин. Детекцию проводили на длинах волн 210, 220, 224, 280 нм. Спектр регистрировали в диапазоне 190–400 нм. Колонка: Zorbax Eclipse XDB-C18 (150 × 4,6 мм, 5 мкм, 80 Å) фирмы «Agilent Technologies». Для проведения ВЭЖХ использовали следующие элюенты: А – 0,04% ТФУ (по объему), B – ацетонитрил (скорость потока 0,5 мл/мин, программа градиента: 020 мин. – 7-100% В, 20-30 мин. – 100% В, 30-35 мин. – 100-7% В, температура колонки 25 °С, объем вводимой пробы 50 мкл). Мертвое время колонки, измеренное в установленных условиях градиента ацетонитрила составило 1,8±0,5 мин. Также использовали MALDI-времяпролетный масс-спектрометр Ultraflex II Bruker (азотный лазер с длиной волны 337 нм и частотой импульса до 20 Гц) фирмы «Bruker Daltoniks». Образцы для MALDI готовили на мишенях Anchor Chip с размером лунок 600 мкм в тонком слое 2,5-дигидроксибензойной кислоты, используемой в качестве матрицы.
Идентификацию пептидов осуществляли при помощи программного пакета Maskot. Поиск проводили по данным MC/MC спектров в базе NCBI.
Для количественной оценки содержания пептидов во фракциях была проведена калибровка колонки антибактериальным пептидом низином (Nisin from Lactococcus lactis ).
Методы определения ферментативной активности E. coli. Общая дегидрогеназная активность [6] . Использовали методику определения общей дегидрогеназной активности с помощью 2,3,5-трифенилтетразолиум хлорида (3%-ный водный раствор), который, восстанавливаясь, окрашивает исследуемый раствор в розовый цвет. В 5 мл исходного инокулята добавляли анализируемые фракции по 0,2 мл и индикатор по 0,3 мл. Через 24 часа инкубации при 37 °С окраску экстрагировали 5 мл 96%-ным этиловым спиртом. Измерение оптической плотности проводили при длине волны 492/630 нм на ИФА STAT FAX 3100 (США). Выражали в единицах ОП×1000.
Подготовка гомогената бактерий для определения активностей сукцинатдегидрогеназы и каталазы. 3 мл инокулята E. сoli гомогенизировали в гомогенизаторе Поттера с добавлением 0,2 мл 0,2%-ного тритона Х-100 в течение 3-х минут. Оставляли на 2 часа при температуре 12 oС для экстрагирования ферментов. Центрифугировали в режиме 650 g, 10 минут при 0 oС для удаления фрагментов и неразрушенных клеток. В полученном гомогенате (надосадочная жидкость) определяли активность ферментов. Для пересчета в удельную активность проводили определение белка по методу Лоури.
Сукцинатдегидрогеназная активность [7] . Инкубационная смесь содержала 2,5 мл 100 мМ натрий-фосфатного буфера (рН=7,8), 0,2 мл 2 мМ феррицианида калия и 0,1 мл гомогената E. сoli. Реакцию запускали добавлением 0,2 мл 10 мМ сукцината натрия. Регистрировали изменение оптической плотности в течение 2 минут (λ 420, СФ-46, Россия).
Каталазная активность [8] . В 2 мл 0,03%-ного раствора перекиси водорода добавляли 0,1 мл гомогената бактерий. Пробы оставляли на 10 минут при комнатной температуре. Реакцию останавливали добавлением 1 мл 4%-ного молибдата аммония. В холостую пробу молибдат аммония добавляли сразу без инкубации. Интенсивность окраски измеряли при длине волны 410 нм против контроля на реактивы: 2,1 мл воды дист., 1 мл молибдата аммония.
Работа выполнена при финансовой поддержке федеральной программы «Научные и научно- педагогические кадры инновационной России» (проект № 02.740.11.0312)
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Спиртовые экстракты личинок восковой моли не оказывали существенного гемолитического действия на эритроциты человека, кроме того, обнаруживалось защитное действие в условиях окислительного стресса in vitro, так как добавление экстрактов сопровождалось нормализацией показателей мембранной проницаемости эритроцитов, деформируемости и скорости потребления глюкозы клеткой [4].
Изучение антибактериального действия спиртовых экстрактов неиммунизированных личинок восковой моли, изготовленных без предварительной гомогенизации (экстракт № 1), из гомогенизированных личинок (экстракт № 2), а также биологически активной пищевой добавки «Натуральный экстракт доктора Мухина» (экстракт № 3) показало, что экстракты № 2 и № 3, возможно, содержат в своем составе компоненты, обладающие бактериостатическим действием по отношению к E. coli . При выращивании E. coli на агари-зованной среде LB наблюдалось увеличение зон ограничения роста в среднем на 13% [3].
С целью стимуляции производства личинками компонентов, оказывающих бактерицидное действие, была использована их специфическая иммунизация смесью культур Escherichia coli и Bacillus cereus и неспецифическая иммунизация ацетон-1,1-диметилгидразоном (ADMH).
Гемолимфа, полученная из личинок после иммунизации смесью культур E.coli и Bacillus cereus была подвергнута обработке, позволяющей освободиться от липидных компонентов и основной массы высокомолекулярных белков. Очищенный таким образом супернатант разделяли на фракции с помощью ВЭЖХ (рис 1). Анализ сигналов трехмерных изображений позволил предположить наличие во фракциях пептидных составляющих и низкомолекулярных компонентов, имеющих максимумы поглощения 210-240 нм. Для оценки степени вклада составляющих растворов (цитрат-анионы, ЭДТА, тиомочевина) провели хроматографирование 5 мкл образца антикоагулянта. Можно предположить, что высокая оптическая плотность в данном диапазоне была обусловлена совокупностью факторов: присутствием составляющих антикоагулянта (время удерживания 1,8; 2,1); наличием низкомолекулярных компонентов и соединений пептидной природы, связанным с прохождением хроматографического процесса по эксклюзионному механизму на макропористом сорбенте с размером пор 80 Ǻ, что подтвержается сигналами соединений с временами удерживания, соответствующими элюированию неудерживаемых компонентов, а также характерным для белков и пептидов видом спектра. Сравнение трехмерных хроматограмм, получен- ных при разделении образцов гемолимфы, иммунизированных и неиммунизированных личинок, позволил выявить изменения состава компонентов, вызванное иммунным ответом, который выражается в возникновении сигналов новых ве- ществ пептидной природы или усилении лов, характерных для гемолимфы контрольной группы гусениц в диапазоне времени 5-11 мин. (рис. 2). Различия присутствуют также во временном диапазоне 1,7-5 мин, в котором элюируются слабоудерживаемые компоненты.
сигна-
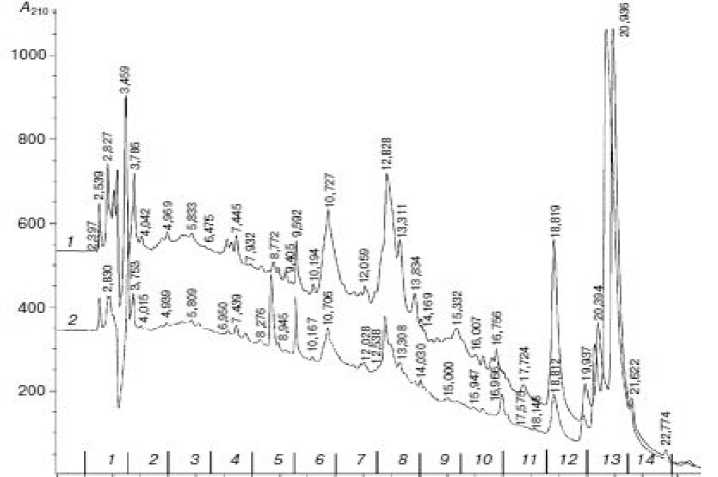
Рисунок 1. Профили элюции 40-% ацетонитрилом, ВЭЖХ. Верхняя кривая – личинки, иммунизированные суспензией смеси клеток Escherichia coli и Bacillus сereus . Нижняя кривая – неиммунизированные (контрольные) личинки
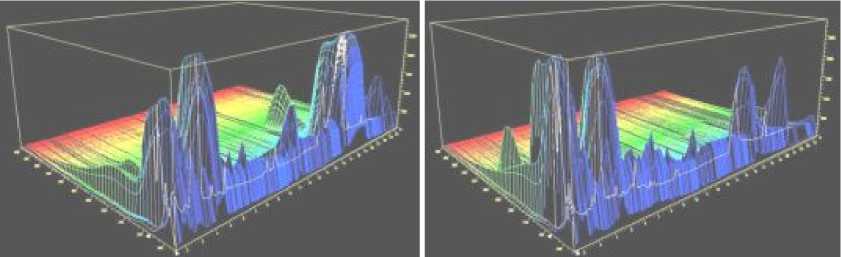
А Б
Рисунок 2. А) Трехмерная хроматограмма супернатанта гемолимфы контрольной группы личинок. Б) Трехмерная хроматограмма супернатанта гемолимфы группы личинок, иммунизированных смесью культур Escherichia coli и Bacillus сereus . Ось Х-время удерживания, мин; ось Y-длина волны, нм; ось Z- степень поглощения, mAU.
Было получено и проанализировано на наличие антибактериальных свойств 14 пептидных фракций ВЭЖХ гемолимфы личинок, иммунизированных смесью культур Escherichia coli и Bacillus cereus и неиммунизированных (контрольных) личинок. При использовании в качестве тестового микроорганизма Escherichia coli мы наблюдали достоверное увеличение зон ограничения роста по сравнению с контролем, при пропитывании дисков составом фракций № 1-4, № 5-6 иммунизированных личинок, а также № 2-3, № 5-6, № 7, № 10, № 13 неиммунизированных личинок (табл. 1). Компоненты фракций №10 иммунизирован- ных личинок, а также № 3, № 5, № 13 неиммуни-зированных (контрольных) личинок ограничивали рост Bacillus cereus (табл. 2). Таким образом, оказывалось, что личинки восковой моли способны генерировать пептидные соединения более эффективно тормозящие рост грам(-) бактерий, подобных Escherichia coli.
Проведение масс-спектрометрического анализа показало наличие как ранее известных Anionic antimicrobial peptide 2 AP2_GALME (6979 Да), Cecropin-D-Like peptide CECD_GALME (4255 Да), Lebocinlike anionic peptide 1 LEB1_GALME (4819 Да) [9, 10], так и неизвестных пептидов, которые также могли оказывать ингибирующее действие ставляло определенный интерес исследование на рост бактерий (табл. 1, 2). Возможно, что часть биологически активных компонентов гемолимфы пептидных соединений может вырабатываться восковой моли в условиях неспецифической им-как общий неспецифический ответ насекомого на мунизации.
повреждающее воздействие. В связи с этим пред-
Таблица 1. Значения зон задержки роста Eschеrichia coli на плотной среде вокруг дисков, пропитанных фракциями гемолимфы личинок, иммунизированных и неиммунизированных (контрольных) личинок
|
№ фракции |
Время, мин |
Неиммунизированная группа личинок |
Иммунизированная группа личинок |
||
|
Зона задержки роста E. сoli , мм |
Обнаруженные пептиды, Да |
Зона задержки роста E. сoli , мм |
Обнаруженные пептиды, Да |
||
|
1 |
2-3,5 |
6,0±0,0 |
875 |
10,0 ± 0,9 P<0,01 |
875, 1013 |
|
2 |
3,5-5 |
7,3±0,4 P<0,05 |
875, 1062 |
7,5 ± 0,6 P<0,05 |
1096, 1258, 6789 |
|
3 |
5-6,5 |
7,7±0,8 P<0,01 |
1480, 1979, 2183, 4820 |
7,8 ± 0,6 P<0,01 |
1064, 1226, 1682, 1845, 4820 |
|
4 |
6,5-8 |
6,8±0,4 P<0,05 |
988, 1100, 1355, 2744, 3166, 3481, 3664 |
8,8±0,4 P<0,001 |
813, 878, 988, 1355, 1451, 2744, 2891, 2985, 3139, 3166, 3481, 3664 |
|
5 |
8-9,5 |
10,3 ± 2,2 P<0,01 |
814, 1144, 1231, 1411, 1696 , 1798, 1856, 1983, 2397, 2435, 2933 |
6,8 ± 0,4 P<0,05 |
814, 1058, 1144, 1231,1495, 1696 , 1798, 1856, 1983, 2048, 2383, 2399, 2435, 2748, 2933, 4801, 6155 |
|
6 |
9,5-11 |
7,0±0,5 P<0,05 |
1695 , 2211, 5595, 6318, 6459, 8340, 9161 |
10,3±1,3 P<0,01 |
875, 1231, 1695 , 2211, 5595, 6318, 6459, 8340, 9161 |
|
10 |
15,5-17 |
9,3 ± 0,78 P<0,01 |
982, 2563, 2620, 2734, 2819, 2919, 3577, 4503, 4714 |
9,0 ± 0,8 P<0,01 |
982, 1129, 2494, 2563, 2620, 2733, 2819, 2919, 3577, 4585, 4714 , 5716, 6113, 12222 |
|
13 |
20-21,5 |
9,0 ± 0,6 P<0,01 |
2276, 3284, 4819, 4837, 5039, 9048, 18088 , 7036 |
6,0 ± 0,0 |
3146, 4255 , 4819 , 6979 |
|
Контроль |
Буфер |
6,0± 0,0 |
6,0± 0,0 |
||
Таблица 2. Значения зон задержки роста B. Сereus на плотной среде вокруг дисков, пропитанных фракциями гемолимфы личинок, иммунизированных и неиммунизированных (контрольных) личинок
|
№ фракции |
Время, мин |
Неиммунизированная группа личинок |
Иммунизированная группа личинок |
||
|
Зона задержки роста B. Сereus , мм |
Обнаруженные пептиды, Да |
Зона задержки роста B. Сereus , мм |
Обнаруженные пептиды, Да |
||
|
3 |
5-6,5 |
7,5 ± 0,9 P<0,05 |
1480, 1979, 2183, 4820 |
6,0±0,0 |
1064, 1226, 1682, 1845, 4820 |
|
5 |
8-9,5 |
6,8 ± 0,4 |
814, 1144, 1231, 1411, 1696 , 1798, 1856, 1983, 2397, 2435, 2933 |
8,3 ± 0,7 P<0,01 |
814, 1058, 1144, 1231, 1495, 1696 , 1798, 1856, 1983, 2048, 2383, 2399, 2435, 2748, 2933, 4801, 6155 |
|
10 |
15,5-17 |
6,0±0,0 |
982, 2563, 2620, 2734, 2819, 2919, 3577, 4503, 4714 |
7,3 ± 0,7 P<0,05 |
982, 1129, 2494, 2563, 2620, 2733, 2819, 2919, 3577, 4585, 4714 , 5716, 6113, 12222 |
|
13 |
20-21,5 |
6,0±0,0 |
2276, 3284, 4819, 4837, 5039, 9048, 18088 , 7036 |
6,0 ± 0,0 |
3146, 4255 , 4819 , 6979 |
|
14 |
21,5-23 |
6,0±0,0 |
3614, 4255, 4837, 5039, 9048, 18088 |
6,0±0,0 |
3283, 3647, 3973, 4130,4835, 5237, 5384 , 9043, 18088 |
|
Контроль |
Буфер |
6,0± 0,0 |
6,0± 0,0 |
||
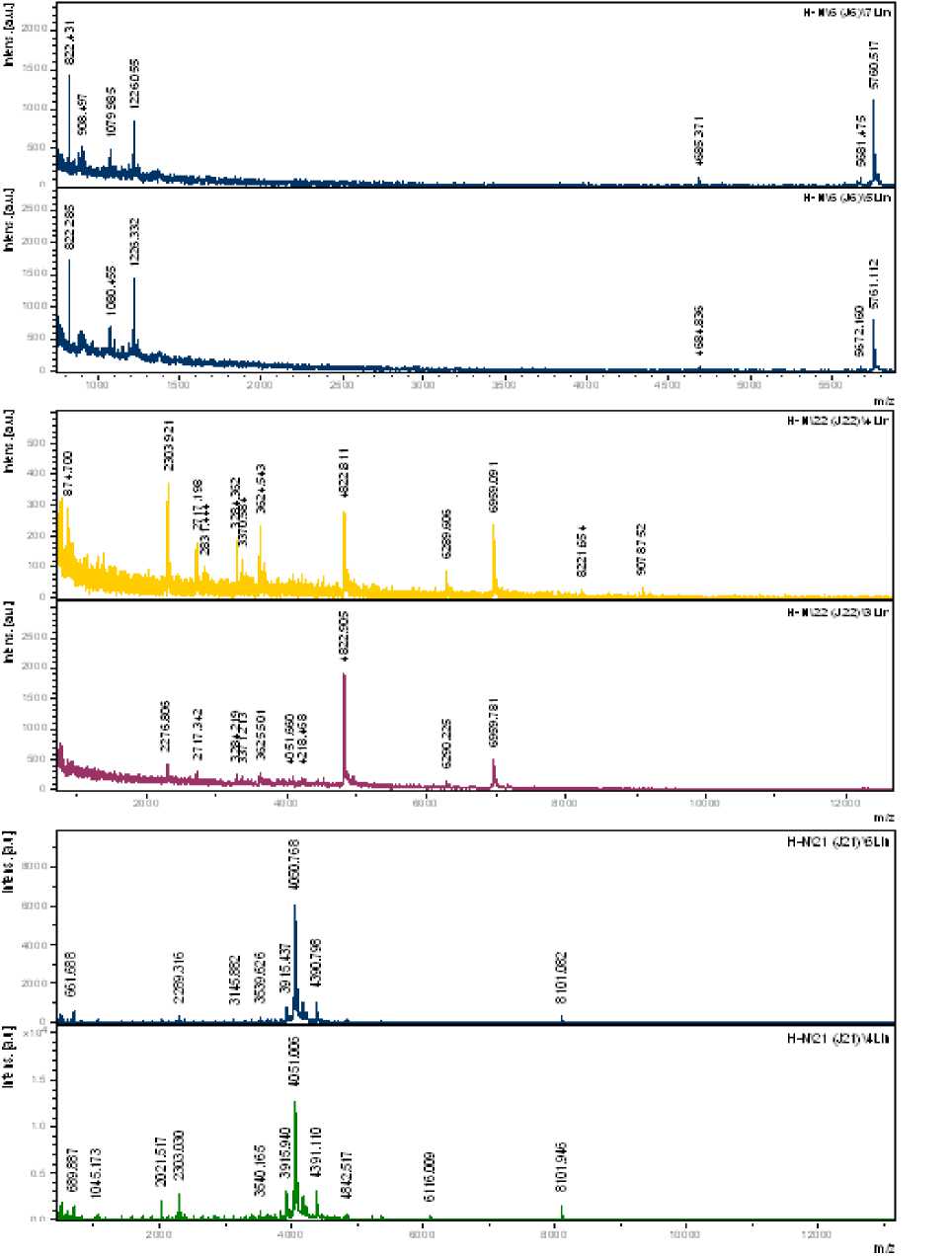
Рисунок 3. Спектры фракций гемолимфы Galleria mellonella larvae, иммунизированных производным гидразона (ADMH) № 2-6 № 24-26, № 30-32. По оси у – степень поглощения, au. По оси х – молярная масса, Да
В настоящее время в окружающую среду поступает значительное количество цитотоксических ксенобиотиков. Одним из таких является 1,1-диметилгидразин (гидразон), который применяется в качестве жидкого ракетного топлива [11]. Данное соединение в большом количестве поступает в окружающую среду, нарушая экологический баланс, так как подвергается трансформации, а также может вызывать неспецифическое повреждающее воздействие на живые организмы. В связи с этим нами осуществлена неспецифиче- ская иммунизация личинок восковой моли аце-тон-1,1-диметилгидразоном (ADMH).
Проведенная ВЭЖХ и МАЛДИ-анализ гемолимфы личинок, подвергнутых неспецифической иммунизации показало наличие фракций, оказывающих ингибирующее действие на рост Escherichia coli . Наибольшей антибактериальной активностью по сравнению с контролем обладали три фракции из полученных (№ 2-6, № 24-26, № 30-32), которые ограничивали рост кишечной палочки на 79, 71, 63 % соответственно (рис. 3).
При использовании в качестве тестового микроорганизма Bacillus cereus не наблюдается достоверного увеличения зон ограничения роста ни у одной из изученных фракций. Таким образом, неспецифический иммунитет личинок Galleria mellonella оказался не эффективным по отношению к грам(+) бактериям.
Фракции, обнаруживающие антибактериальное действие содержали в своем составе ранее невыделяемые пептидные компонеты с молеку- лярной массой от 820 до 9188 Да и известные антимикробные пептиды Prolin-rich antimicrobial peptide 2 с массой 1825 Да, Cecropin-D-like peptide c массой 2078 Да, Galleria defensin с массой 4930 Да, Prolin-rich antimicrobial peptide 2 [9, 10]. Подобные пептиды обнаруживались нами и при хроматографическом разделении гемолимфы личинок, иммунизированных смесью Escherichia coli и Bacillus cereus.
В составе фракций данные компоненты присутствовали в малых концентрациях (5-10 мкг/мл), однако известно, что антибактериальные пептиды оказывают бактерицидное действие только в достаточно высоких действующих дозах. Мы предположили, что часть пептидов способны проникать в цитоплазму и взаимодействовать с ее компонентами. Поэтому представляло интерес изучить возможное поступление фракций в клетки и их влияние на окислительный метаболизм Escherichia coli .
Таблица 3. Общая дегидрогеназная, сукцинатдегидрогеназная и каталазная активность E. coli при росте на жидкой среде с добавлением фракций гемолимфы личинок, обработанных гидразоном
Ферментативная активность
|
Фракции |
Дегидрогеназная активность, у.е. |
Каталазная активность, мкат |
Сукцинатдегидрогеназная активность, мМ/мин |
|
№ 2-6 |
348±3** |
0,279±0,029* |
0,170±0,027 |
|
№ 24-26 |
115±2* |
0,225±0,06 |
0,373±0,059* |
|
№ 30-32 |
45±1* |
0,225±0,044 |
0,163±0,015 |
|
контрольº |
132±4 |
0,217±0,023 |
0,237±0,0,048 |
ºАктивность в необработанных клетках;*Р<0,05 по отношению к контролю; **P<0,01 по отношению к контролю.
Действительно, в присутствии компонентов фракции № 2-6 наблюдалось повышение общей дегидрогеназной активности клеток E. coli и возрастала каталазная активность гомогенатов клеток по сравнению с контрольными пробами, инкубированными в обычных условиях (табл. 3). Увеличение общей дегидрогеназной активности свидетельствует о напряжении метаболических процессов, характерных для ответной реакции на стрессовое воздействие. Об усилении окислительных процессов свидетельствует и индуктивное повышение активности каталазы в клетках. В данной фракции, выходящей в начале элюирования, обнаруживались в основном пептиды с более низкой молекулярной массой, которые обычно проявляют высокую биологическую активность именно как ингибиторы и активаторы ферментативных процессов. Кроме того, здесь могут находиться и низкомолекулярные соединения непептидной природы, также проявляющие биологическую активность.
При воздействии аликвотой фракции № 24-26 наблюдается усиление скорости окисления сукцината на фоне снижения общей дегидрогеназной активности и неизменной концентрации каталазы (табл. 3). Вероятно, компоненты данной фракции способны оказывать более специфическое воз- действие, активируя сукцинат-фумаратную часть окислительной системы E. coli.
Компоненты фракции № 30-32 вызывают значительное снижение общей дегидрогеназной активности при выраженной тенденции к снижению сукцинатдегидрогеназной активности клеток бактерий (табл. 3). Дополнительной индукции каталазы не наблюдается.
ЗАКЛЮЧЕНИЕ
Проведенные нами исследования антибактериальных свойств пептидных компонентов гемолимфы личинок восковой моли показали, что они обусловлены белково-пептидными соединениями с различной молекулярной массой. Часть их эффективно экстрагируется 34%-ным этиловым спиртом, что обусловливает ингибирующее действие данных экстрактов на рост грам(-) бактерий. Разделение гемолимфы на отдельные фракции позволяет выявить большую активность некоторых фракций, в которых содержатся бактерицидные пептиды. Антибактериальные пептиды средней молекулярной массы и белки, вероятнее всего, действуют по общеизвестному механизму цекропин-подобных белков. Однако, более короткие пептиды, обнаруженные нами, могут проникать в клетки грам(-) бактерий, воздействуя на метаболические процессы [12]. Пептидные со- единения, проявляющие ингибирующие рост действие на E. coli, обнаруживаются как при специфической, так и в условиях неспецифической иммунизации личинок, хотя в первом случае их выделяется больше как по спектру, так и по концентрации.
Таким образом, как специфическая, так и неспецифическая иммунизация увеличивают содержание антибактериальных пептидов в гемолимфе личинок Galleria mellonella . Спектр генерируемых пептидов зависит от способа иммунизации.
Работа выполнена при финансовой поддержке федеральной программы «Научные и научнопедагогические кадры инновационной России» (проект № 02.740.11.0312)
Список литературы Влияние биологически активных пептидных компонентов гемолимфы личинок Galleria mellonella на рост и ферментативную активность Escherichia coli
- Bulet P., Stocklin R., Menin L. Antimicrobial peptides: from invertebrates to vertebrates//Immunol. Rev. 2004. V. 198. Р. 169-184.
- Spiridonow N.A., Kashparova E.V., Baskunov B.P. On chemical composition of a biologically active preparation from Galleria mellonella. Comp. Biochem. Physiol. 1992. C. 102-109.
- Пурыгин П.П., Кленова Н.А., Литвинова Е.Г., Срибная О.С., Никашина А.А. Обнаружение и выделение антибактериальных пептидов из экстрактов личинок Galleria mellonella//Вестник СмаГУ, Ест. науч. серия. 2006. Т. 6/1(46). С. 201-211.
- Катина Н.С., Кленова Н.А., Литвинова Е.Г. Влияние экстракта восковой моли Galleria mellonella на эритроциты в условиях окислительного стресса//Материалы конференции молодых ученых г. Пущино. 2005. С. 124.
- Sribnaya O.S., Purygin P.P., Klenova N.A., Buryak A.K., Litvinova E.G. Study of Peptide Fractions from Hemolymph of Galleria mellonella//Biochemistry (Moscow). 2010. V. 75 (9). Р. 1165-1172.
- Романенко В.И., Кузнецов С.И. Экология микроорганизмов пресных водоемов/Л.: Наука, 1974. С. 61.
- Методы общей бактериологии. Т. 2./под ред. Ф. Герхарда, М.: «Мир». 1984. С. 396-397.
- Королюк М.А., Иванова Л.И., Майорова И.Г. и др. Метод определения активности каталазы//Лаб. Дело, 1988. № 1. С. 16-19.
- Cytrynska M., Mak P., Zdybicka-Barabas A., Suder P., Jakubowicz T. Purification and characterization of eight peptides from Galleria mellonella immune hemolymph//Peptides Rev. 2007. V. 285. Р. 533-546.
- Mak P., Chmiel D., Gacek G. Antibacterial peptides of the moth Galleria mellonella//ScienceDirekt. 2007. V. 7. N. 28. P. 45 -56.
- Беклемишев А.Б., Лавриненко И.А., Рябченко А.В., Ткаченко В.И., Батырбекова С.Е., Лавриненко В.А., Бабина А.В. Исследование мутагенного и общетоксического воздействия 1,1-диметилгидразина и продуктов его трансформации на клетки биосенсорных штаммов E.coli и клетки эукариот//Бюлл. СО РАМН. 2010. Т. 30. № 2. С. 22.
- Otvos L. Antibacterial peptides isolated from insects.//J. Pept. Sci. 2000. V. 6 (10). Р. 497-511.


