Влияние блокады кисспептиновых рецепторов на показатели поведения крыс в стандартных тестах
Автор: Ткачева М.А., Инюшкина Е.М., Шарафутдинова А.Ю., Инюшкин А.Н.
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Физиология
Статья в выпуске: 1, 2019 года.
Бесплатный доступ
Регуляторный пептид кисспептин известен как стимулятор фертильности и регулятор репродукции. Его активность опосредована специфическим взаимодействием с рецепторами GPR54 (или KisslR). Существуют указания на связь кисспептиновой системы мозга с функцией циркадианного осциллятора - супрахиазматического ядра гипоталамуса, стимулирующего клетки кисспептиновой нейронной сети антеровентрального перивентрикулярного ядра гипоталамуса, что в свою очередь приводит к высвобождению гипоталамического гонадолиберина в период времени, непосредственно предшествующий началу суточной локомоторной активности. Также имеются данные о наличии волокон, содержащих кисспептин, и экспрессии кисспептиновых рецепторов в супрахиазматическом ядре, что указывает на функцию кисспептина как сигнала обратной связи от репродуктивной к циркадианной системе. Наряду с репродуктивной функцией кисспептина, появляются данные о его участии в регуляции поведения. Цель работы - изучить влияние интраназального введения специфического антагониста GPR54 рецепторов р-234 на поведение самцов крыс в стандартных тестах «Открытое поле» и «Темносветлая камера»...
Антагонист кисспептиновых рецепторов р-234, поведенческие тесты
Короткий адрес: https://sciup.org/14116350
IDR: 14116350 | УДК: 612.826.4 | DOI: 10.34014/2227-1848-2019-1-103-109
Текст научной статьи Влияние блокады кисспептиновых рецепторов на показатели поведения крыс в стандартных тестах
Введение.* Регуляторный пептид кис-спептин был открыт в качестве супрессора метастатической активности [1], однако позже была доказана его роль в процессах полового созревания и гаметогенеза. Функциональная активность кисспептина объясняется его специфическим взаимодействием с рецепторами GPR54 (или Kiss1R) [2]. Взаимодействие кисспептина с рецепторами GPR54
играет важную роль в инициации секреции гонадотропин-рилизинг-гормона (GnRH) в период полового созревания [3]. Нарушение передачи сигналов через GPR54-рецепторы вследствие их мутации приводит к аутосомному рецессивному гипогонадизму [4]. Существуют указания на связь кисспептиновой системы мозга с функцией циркадианного осциллятора – супрахиазматического ядра гипоталамуса [5]. В частности, в экспериментах на грызунах показано, что супрахиазма-тическое ядро ежесуточно в любой день эстрального цикла посылает стимулирующий сигнал, передатчиком которого является кис- спептин, в направлении гипоталамических клеток, продуцирующих гонадолиберин, в период циркадианного цикла, непосредственно предшествующий началу активной локомоторной фазы [6]. Таким образом, кис-спептин способен играть важную роль в сопряжении функций циркадианной и репродуктивной систем, а время суток может оказывать влияние на характер эффектов кис-спептина. В этом плане особый интерес представляют иммуногистохимические данные о наличии большого количества волокон, содержащих кисспептин, и экспрессии кис-спептиновых рецепторов в супрахиазматиче-ском ядре [7]. В нашем исследовании in vitro на срезах гипоталамуса крыс аппликации кисспептина вызывали рост спайковой активности нейронов супрахиазматического ядра и снижение степени нерегулярности межспайковых интервалов [8]. Эти данные свидетельствуют в пользу непосредственного действия репродуктивного регулятора кис-спептина на уровне нейронов циркадианного осциллятора по принципу обратной связи.
Наряду с репродуктивной функцией кис-спептина в последнее время отмечается его участие в регуляции поведения. В частности, у самцов мышей с нокаутом гена Kiss1R обнаружено изменение уровня тревожности и исследовательского поведения [9]. Подобные исследования определяют необходимость детального изучения поведенческой функции кисспептина и его рецепторов. В настоящей работе изучали влияние интраназального введения специфического антагониста GPR54 рецепторов р-234 на поведение самцов крыс в стандартных тестах «Открытое поле» и «Темно-светлая камера».
Цель исследования. Изучение процессов регуляции циркадианного осциллятора при помощи антагониста кисспептина (р-234).
Материалы и методы. Все экспериментальные протоколы были согласованы и одобрены комиссией по биологической этике Самарского национального исследовательского университета им. академика С.П. Королева. Исследовано 12 животных контрольной и экспериментальной групп. Для экспериментов были взяты крысы-самцы «Вистар» массой тела 240–270 г. Все животные содер- жались в виварии биологического факультета Самарского университета и получали пищу и питьевую воду без ограничений. Животных содержали в условиях режима освещения «свет/темнота» 12:12 ч. В начале эксперимента в течение 10 мин изучали поведение крыс в установках «Открытое поле» и «Тёмно-светлая камера» в первой половине циркадианного дня в ZT=2–6 (ZT=0 – момент включения освещения). Далее в то же время дня в течение трёх последовательных суток интраназально в объёме 10 мкл экспериментальным животным вводили антагонист кис-спептиновых рецепторов р-234 в концентрации 10-4 М. Крысам контрольной группы аналогично вводили воду для инъекций в объёме 10 мкл. Через 15 мин после интраназального введения крыс последовательно помещали в установки «Открытое поле» и «Тёмно-светлая камера» и в течение 10 мин производили видеорегистрацию поведенческой активности. Видеорегистрацию поведения животных осуществляли при помощи камеры Panasonic fullhd hc-x810, которая была установлена на штативе. При помощи программ ANY-maze 4.99 и SigmaPlot 12.5 осуществляли автоматическую регистрацию и статистическую обработку исследуемых параметров поведения. В тесте «Открытое поле» определяли количество посещенных квадратов, количество обследованных отверстий, время нахождения в центральных и периферических квадратах, характеристики груминга, седации (замирания), количество стоек с опорой на бортик, количество стоек без опоры на бортик. В тесте «Тёмно-светлая камера» определяли продолжительность нахождения в светлом и темном отсеках, количество выходов в светлый отсек, заглядывания из тёмного в светлый отсек, заглядывания из светлого в тёмный отсек.
Значения исследуемых показателей в ходе эксперимента сравнивали в контрольной и экспериментальной группах. В случае нормального распределения данных в выборках для сравнения использовали непарный t-тест, в остальных случаях – тест Манна–Уитни. Нормальность распределения проверяли с помощью теста Шапиро–Уилка, равенство дисперсий – с помощью теста Левена. Стати- стические данные о значениях параметров, соответствующих нормальному распределению, представляли как средние арифметические ± стандартные ошибки среднего. Изменения исследуемых параметров считали статистически значимыми при р<0,05.
Результаты. В исходном состоянии исследуемые показатели поведения у животных контрольной и экспериментальной групп не различались (р>0,05). После интраназального введения антагониста кисспептиновых рецепторов р-234 значение некоторых поведен- ческих показателей отличалось относительно соответствующих значений в контроле.
В установке «Открытое поле» не было обнаружено изменений количества посещённых квадратов, количества обследованных отверстий, времени нахождения в центральных и периферических квадратах, характеристик груминга (р>0,05). Однако, как показано на рис. 1, введение антагониста вызвало статистически значимое увеличение значения показателя «седация» (замирание) относительно контроля (р=0,046).
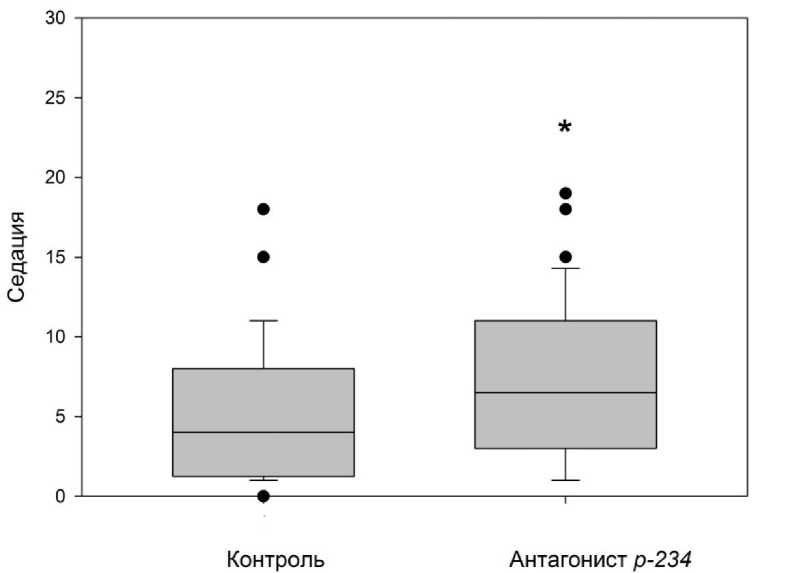
Рис. 1. Влияние интраназального введения антагониста кисспептиновых рецепторов р-234 на поведенческий параметр «седация».
Данные представлены как медианы (линия внутри боксов), квартили (верхняя и нижняя границы боксов), 10-й и 90-й перцентили (нижняя и верхняя границы усов), значения вариант за пределами этих перцентилей (точки).
* – статистически значимое различие между контрольной и экспериментальной группами (р<0,05) (на рис. 2, 3 обозначения аналогичные)
Исследование параметра «количество стоек с опорой на бортик» не выявило статистически значимых изменений (р=0,373). Вместе с тем введение антагониста привело к статистически значимому увеличению количества стоек без опоры на бортик (р=0,033; рис. 2).
Анализ параметров поведения в тесте «Темно-светлая камера» дал следующие ре- зультаты. Интраназальное введение антагониста кисспептиновых рецепторов р-234 не привело к изменению по сравнению с контролем продолжительности пребывания в темном и светлом отсеках (р>0,05). При этом у крыс, получавших антагонист кисспепти-новых рецепторов, обнаружилось увеличение количества выходов в светлый отсек по сравнению с контролем (р=0,017; рис. 3).
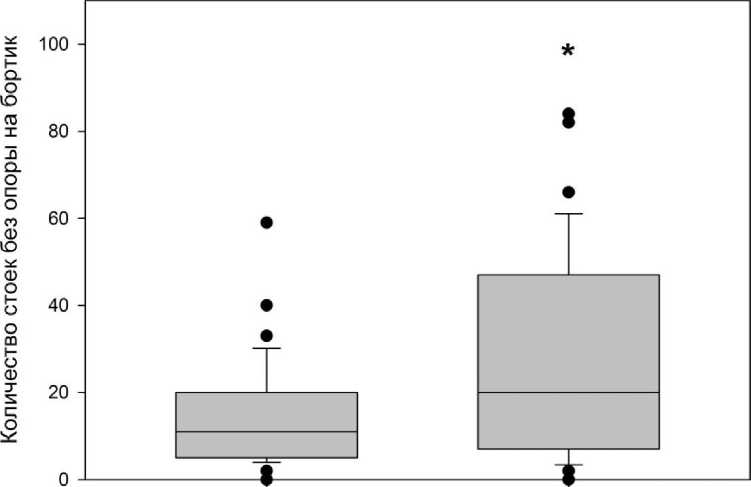
Контроль
Антагонист р-234
Рис. 2. Влияние интраназального введения антагониста кисспептиновых рецепторов р-234 на поведенческий параметр «количество стоек без опоры на бортик»
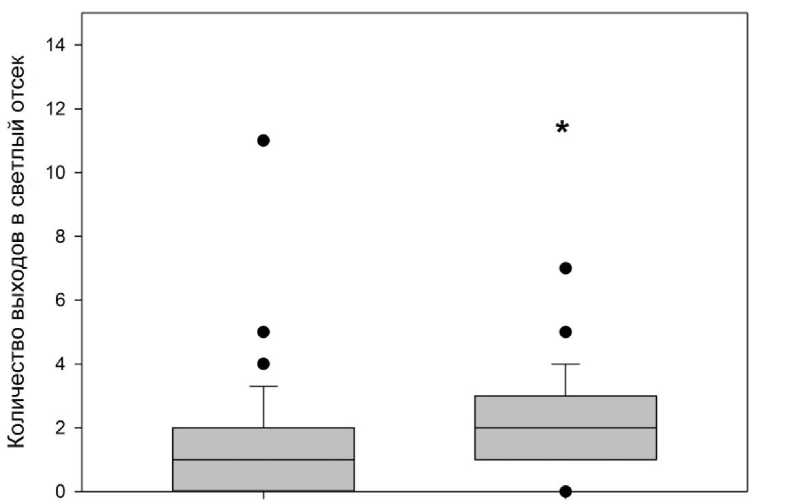
Контроль
Антагонист р-234
Рис. 3. Влияние интраназального введения антагониста кисспептиновых рецепторов р-234 на поведенческий параметр «количество выходов в светлый отсек»
Значения параметра «заглядывание из тёмного в светлый отсек» не различались в контрольной и экспериментальной группах
(p=0,146), так же как и значения параметра «заглядывание из светлого в тёмный отсек» (p=0,139).
Обсуждение. В ходе настоящей работы изучали влияние антагониста кисспептино-вых рецепторов р-234 на показатели поведения самцов крыс. При этом использовали ин-траназальное введение вещества. Данный способ введения становится все более популярным в экспериментальной практике, что объясняется целым рядом преимуществ. Вещества, вводимые интраназально, быстро проникают непосредственно в головной мозг в значительной концентрации вдоль обонятельных и тройничных нервов, минуя гематоэнцефалический барьер [10]. При этом вводимое вещество практически не попадет в кровоток [11], что дает возможность изучать центральные эффекты вещества изолированно от его периферических эффектов, возникающих при системном введении. Таким образом, в настоящей работе выявлены изменения поведенческой активности животных, возникающие в условиях блокады центральных кисспептиновых рецепторов.
Поскольку обнаружен циркадианный ритм стимуляции кисспептином структур репродуктивной оси [6], существенным является время введения вещества в суточном цикле. В нашем исследовании антагонист р-234 вводили в начале субъективного дня (ZT=2–6), когда кисспептиновые рецепторы практически не связаны с эндогенным кисспептином.
Основным результатом работы является изменение ряда поведенческих показателей в условиях блокады кисспептиновых рецепторов. В частности, в поведенческой установке «Открытое поле» обнаружено увеличение параметров «седация» и «стойка без опоры на бортик». В тесте «Темно-светлая камера» увеличилось количество выходов в светлый отсек. Такие изменения свидетельствуют о том, что введение антагониста кис-спептиновых рецепторов приводит к снижению уровня тревожности и к стимуляции исследовательского поведения. Полученные результаты хорошо согласуются с данными исследования на самцах мышей с нокаутом кисспептиновых рецепторов, у которых также было обнаружено снижение уровня тревожности и стимуляция исследовательского поведения в тесте «Приподнятый крестообразный лабиринт» [9]. Выявленные изменения поведения могут способствовать реализации уже известной функции кис-спептина как стимулятора репродукции либо выступать в качестве самостоятельного компонента в спектре физиологической активности кисспептиновой системы. Для ответа на этот вопрос необходимы дальнейшие исследования.
Заключение. Установлено, что антагонист кисспептиновых рецепторов р-234 при интраназальном введении самцам крыс вызывает снижение уровня тревожности и стимулирует исследовательское поведение.
Список литературы Влияние блокады кисспептиновых рецепторов на показатели поведения крыс в стандартных тестах
- Lee J.H., Miele M.E., Hicks D.J., Phillips K.K., Trent J.M., Weissman B.E., Welch D.R. KiSS-1, a novel human malignant melanoma metastasis-suppressor gene. J. Natl. Cancer. Inst. 1996; 88: 1731-1737.
- Ohtaki T., Shintani Y., Honda S., Matsumoto H., Hori A., Kanehashi K., Terao Y., Kumano S., Takat-su Y., Masuda Y., Ishibashi Y., Watanabe T., Asada M., Yamada T., Suenaga M., Kitada C., Usuki S., Kurokawa T., Onda H., Nishimura O., Fujino M. Metastasis suppressor gene KiSS-1 encodes peptide ligand of a G-protein-coupled receptor. Nature. 2001; 411 (6837): 613-617.
- Hrabovszky E., Ciofi P., Vida B., Horvath M.C., Keller T., Caraty F., Bloom S.R., Ghatei M.F., Dhillo W.S., Liposits Z., Kallo I. The kisspeptin system of the human hypothalamus: sexual dimorphism and relationship with gonadotropin-releasing hormone and neurokinin B neurons. Eur. J. Neurosci. 2010; 31: 1984-1998.
- Semple R.K., Achermann J.C., Ellery J., Farooqi I.S., Karet F.E., Stanhope R.G., O'Rahilly S., Apari-cio S.A. Two novel missense mutations in G protein-coupled receptor 54 in a patient with hypogonado-tropic hypogonadism. J. Clin. Endocrinol. Metab. 2005; 90: 1849-1855.
- Ткачева М.А., Инюшкина Е.М., Карян С.Д., Инюшкин А.Н. Роль аргинин-вазопрессина в регуляции активности нейронов циркадианных часов супрахиазматического ядра гипоталамуса. Ульяновский медико-биологический журнал. 2018; (1): 145-154.
- Kriegsfeld L.J. Circadian regulation of kisspeptin in female reproductive functioning. Adv. Exp. Med. Biol. 2013; 784: 385-410.
- Simonneaux V., Ancel C., Poirel V.J., Gauer F. Kisspeptins and RFRP-3 act in concert to synchronize rodent reproduction with seasons. Front. Neurosci. 2013; 7: 22.
- Ткачева М.А., Инюшкин А.Н. Электрофизиологические эффекты кисспептина на уровне нейронов биологических часов супрахиазматического ядра. Врач-аспирант. 2017; 80 (1): 86-92.
- Delmas S., Porteous R., Bergin D.H., Herbison A.E. Altered aspects of anxiety-related behavior in kisspeptin receptor-deleted male mice. Sci. Reports. 2018; 8: 2794.
- Frey W.H. Bypassing the blood-brain barrier to deliver therapeutic agents to the brain and spinal cord. Drug Deliv. Tech. 2002; 2: 46-49.
- Born J., Lange T., Kern W., McGregor G.P., Bickel U., Fehm H.L. Sniffing neuropeptides: a transnasal approach to the human brain. Nat. Neurosci. 2002; 5: 514-516.


